Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.4 Texcoco may./jun. 2008
Protección vegetal
Ocurrencia de hongos y etiología de la secadera de la fresa con diferentes sistemas de manejo agronómico
Fungi prevalence and etiology of strawberry dry wilt under different crop management systems
Luis F. Ceja–Torres1, Gustavo Mora–Aguilera2*, Daniel Téliz2, Antonio Mora–Aguilera2, Prometeo Sánchez–García3, Carlos Muñoz–Ruíz1, Bertha Tlapal–Bolaños4 y Rodolfo De La Torre–Almaraz5
1 CIIDIR–IPN–U–Michoacán. C.P. 59510. Jiquilpan, Michoacán. (lfceja@colpos.mx).
2 Fitopatología *Autor responsable:(morag@colpos.mx) y
3 Suelos. Colegio de Postgraduados. C.P. 56230. Montecillo, Estado de México.
4 Parasitología Agrícola. Universidad Autónoma Chapingo. C.P. 56230. Chapingo, Estado de México.
5 FES–IZTACALA, UNAM. C.P. 54090. Tlalnepantla, Estado de México.
Recibido: Junio, 2007.
Aprobado: Enero, 2008.
Resumen
En México, la secadera de la fresa (Fragaria x ananassa) se ha asociado con un complejo fungoso demostrándose únicamente la implicación de Fusarium oxysporum (Fox). Por tanto, en el presente estudio se determinó la asociación de hongos y pseudohongos con la enfermedad en diferentes sistemas de manejo agronómico y se verificó la patogenicidad. Dos muestreos se realizaron en el ciclo 2002/03 y tres en 2003/04 en 16 localidades del Valle de Zamora, Michoacán, México. Se sembraron 2640 secciones de raíces y 365 de coronas necróticas y 400 secciones de tejido asintomático en medio de cultivo papa–dextrosa–agar (PDA) y uno selectivo con antibióticos y fungicida PCNB (PARPH). Fox, F. solani (Fso), Cylindrocarpon sp. (Cyl), Pythium aphanidermatum (Pyt), Phytophthora sp. (Phy), Rhizoctonia fragariae (Rhi), Verticillium alboatrum (Ver) y Colletotrichum sp. (Col) se asociaron a la secadera. Fox fue la especie más frecuente (p<0.05) y la única que aumentó de floración a fructificación de 47 a 62% en raíz y 77 a 83% en corona. En plantaciones con acolchado plástico y riego por goteo (A+G), Fox disminuyó 18% respecto a suelo sin acolchado con riego por gravedad, mientras que Cyl aumentó 15% en A+G (p<0.05). El suelo arcilloso y franco arcilloso contrastó en la detección de Fox (46.8 y 12.4%) y Rhi (9.1 y 43.7%). Síntomas de marchitez con necrosis en raíz, corona y muerte general se reprodujeron con inoculaciones individuales de Fox (100%), Pyt (100%), Phy (100%), Rhi (60%) y combinaciones de Fox con Rhi (100%), Pyt (100%) y Cyl (100%). Este es el primer reporte que implica a Phytophthora sp., P. aphanidermatum y R. fragariae como patógenos causales de secadera en México. La identificación morfológica de Fox y Rhi se confirmó por secuenciación de la región intergénica del rADN.
Palabras clave: Fragaria, complejo fungoso, acolchado plástico.
Abstract
In México, strawberry dry wilt (Fragaria x ananassa) has been associated with a fungus complex in which only the implication of Fusarium oxysporum (Fox) is evident. Therefore, in the present study the association of fungi and pseudofungi with the disease was determined in different systems of agronomical management, and pathogenicity was verified. Two samplings were made in the 2002/03 season and three in 2003/04 in 16 localities of the Valley of Zamora, Michoacán, México, where 2640 sections of roots and 365 of necrotic crowns were sown, along with 400 sections of asymptomatic tissue in potato–dextrose–agar (PDA) culture medium and a selective medium with antibiotics and PCNB (PARPH) fungicide. Fox, F. solani (Fso), Cylindrocarpon sp. (Cyl), Pythium aphanidermatum (Pyt), Phytophthora sp. (Phy), Rhizoctonia fragariae (Rhi), Verticillium albo–atrum (Ver) and Colletotrichum sp. (Col) were associated with the dry wilt. Fox was the most frequent species (p=0.05) and the only one that showed an increase from flowering to fructification of 47 to 62% in root and 77 to 83% in crown. In plantations with plastic mulch and drip irrigation (A + G), Fox decreased by 18% with respect to unmulched soil with gravity irrigation, whereas Cyl increased by 15% in A + G (p=0.05). The clay and clay loam soil contrasted in the detection of Fox (46.8 and 12.4%) and Rhi (9.1 and 43.7%). Symptoms of wilting with necrosis in root and crown and general death were reproduced with individual inoculations of Fox (100%), Pyt (100%), Phy (100%), Rhi (60%) and combinations of Fox with Rhi (100%), Pyt (100%) and Cyl (100%). This is the first report that implies Phytophthora sp., P. aphanidermatum and R. fragariae as causal pathogens of dry wilt in México. The morphological identification of Fox and Rhi was confirmed by sequencing of the intergenic region of the rDNA.
Key words: Fragaria, fungal complex, plastic mulch.
INTRODUCCIÓN
En México, las enfermedades de la raíz causadas por hongos y pseudohongos son las principales limitantes fitosanitarias del cultivo de la fresa (Fragaria x ananassa Duch.) destacando la secadera la cual consiste en un marchitamiento y muerte gradual de la planta (Mendoza–Zamora y Romero–Cova, 1989; Castro y Dávalos, 1990; Quintero et al., 1998). La enfermedad se ha asociado con nueve organismos sobresaliendo cuatro especies de Fusarium, Verticillium dahliae, Rhizoctonia solani y Phytophthora sp. (Castro y Dávalos, 1990; Mendoza, 1992; Quintero et al., 1998). A la fecha, sólo se ha demostrado la patogenicidad de F. oxysporum (Martínez–Barrera y Castro–Mendoza, 1976; Castro y Dávalos, 1990), lo que es una limitante para el manejo efectivo de la secadera. Además, no hay estudios epidemiológicos que aporten una base racional para el control. Considerando la hipótesis de que la secadera es causada por un complejo de organismos que pueden tener una frecuencia y distribución diferencial en función al manejo del cultivo y textura del suelo, se desarrolló este trabajo con el objetivo de determinar la etiología de la secadera en la principal región fresera de Michoacán, México. La base fue un muestreo regional para medir el efecto inductivo del manejo agronómico y textura del suelo en la ocurrencia de la enfermedad para aportar criterios sólidos en un programa de manejo integrado del cultivo.
MATERIALES Y MÉTODOS
Muestreo regional
En 1414 ha de fresa se muestrearon 16 localidades del Valle de Zamora, Michoacán. Se recolectaron 500 plantas enfermas y 20 asintomáticas en cinco muestreos efectuados durante floración y fructificación en los ciclos de cultivo 2002/03 y 2003/04. El tamaño de muestra por cada muestreo fue 100 plantas con síntomas de secadera cantidad obtenida por ponderación con valores relativos de textura del suelo, superficie plantada, y manejo predominante (Cuadro 1). La textura se determinó en el laboratorio de Física de Suelos del Colegio de Postgraduados. Los cálculos se realizaron mediante la ecuación (Mora–Aguilera, 2000):

donde, ni= número de unidades (plantas) de muestreo por módulo de riego–i (tamaño de muestra), e i = 1.....4; N=número total de unidades, definido por la capacidad de procesado en laboratorio; Swi = ponderación por la superficie del módulo–i, y w=1,...,3; Twi = ponderación por la textura del suelo del módulo–i, y w=1,...,2; Mwi= ponderación por el manejo del módulo–i, y w=1,...,2.
Las localidades muestreadas en cada módulo de riego fueron: módulo I) Zamora, Tamándaro, Jacona, Romero de Torres y Estancia de Amézcua; módulo II) Aquiles Serdán, La Ladera, Ojo de Agua y Atacheo; módulo III) El Llano, Los Cerritos, Villafuerte y Ario de Rayón; módulo IV) La Sauceda, La Rinconada y Atecucario.
Caracterización cultural, morfológica y molecular
Los hongos y pseudohongos aislados se purificaron mediante cultivos monospóricos y por punta de hifa en agua–agar al 2 % seguido de una inducción reproductiva en PDA y jugo V8–agar a 28±2 °C. La identificación se hizo con las claves de Nelson et al. (1983), Sneh et al. (1991), Erwin y Ribeiro (1996) y Crous (2002). Por la frecuencia alta de F. oxysporum y la hipótesis de que R. fragariae (hongo no consignado previamente en México) participa en el complejo patogénico, la identificación de estos organismos se confirmó molecularmente por amplificación y secuenciación de la región intergenética transcripcional (ITS) del gene rADN 18S desde DNA micelial.
La extracción de ADN de cada aislamiento se hizo adaptando el protocolo de Delaporta et al. (1983). La PCR se hizo con los oligonucleotidos ITS4 (5'–TCC TCC GCT TAT TGA TAT GC–3') e ITS5 (5'–GGA AGT AAA AGT CGT AAC AAG G–3'. Se usó la mezcla de reacción descrita por White et al. (1990), con el siguiente programa de amplificación: 1 ciclo 95 °C, 1 min; 30 ciclos a 95 °C, 1 min; 57 °C, 1 min; 72 °C, 1 min; 1 ciclo a 72 °C, 12 min. Los productos de 700 pb fueron purificados por el método de Wizar (Promega, EE.UU.) y secuenciados en un Genetic Analyzer Modelo 3100 del Laboratorio de Bioquímica Molecular de la FES–IZTACALA–UNAM. Las secuencias obtenidas se compararon y alinearon con las disponibles en la base de datos del Banco de Genes del NCBI, EE.UU., usando BLAST y Clustal W de DNASTAR Ver. 3.1 (DNASTAR, Inc.).
Frecuencia de hongos y pseudohongos
Las plantas recolectadas se procesaron en laboratorio sembrándose 2640 fracciones de raíces y 365 secciones de coronas necróticas en PDA y PARPH (Quintero et al., 1998). De plantas asintomáticas se procesaron 200 fracciones de raíces y 200 de coronas. Mediante pruebas de t (p<0.05) se comparó la frecuencia de aislamientos por especie (SAS Institute, 1988).
Ensayos de patogenicidad
Se hicieron tres ensayos de patogenicidad con los organismos aislados e identificados F. oxysporum (Fox), F. solani (Fso), R. fragariae (Rhi), Cylindrocarpon sp (Cyl), V. alboatrum (Ver), Colletotrichum sp. (Col), Phytophthora sp. (Phy) y P. aphanidermatum (Pyt). Ensayo 1: Un disco de PDA (diámetro 1 cm) con micelio de Fox y Pyt de 8 d, se colocó sobre la corona de tres plántulas de fresa CP 96–3 in vitro; los testigos recibieron un disco de PDA sin micelio. Las plántulas se incubaron en laboratorio con luz y oscuridad natural y temperatura ambiente (22±2 °C). Ensayo 2: Plantas de fresa CP 96–3 de 8 a 12 hojas, producidas in vitro y trasplantadas en tierra estéril en macetas de 11 X 9 cm, fueron inoculadas como ya se indicó. Tres plantas (una por maceta) fueron inoculadas con Fox, Cyl y Pyt; y cinco con Phy, Rhi, Col, Ver y Fso. Para cada una de las siguientes combinaciones: Fox + Cyl, Fox + Pyt y Fox + Rhi se inocularon tres plantas. Ensayo 3: Cinco plantas en estado de amacollamiento de la variedad Camarosa, certificadas como sanas por el Departamento de Agricultura de EE.UU., se inocularon con 1 g de granos de sorgo (Sorghum bicolor) esterilizados y colonizados con F. oxysporum (Wang y Jeffers, 2000). Un mismo número de plantas testigo se inocularon con 1 g de granos de sorgo estéril sin micelio. En el segundo y tercer ensayo las plantas se mantuvieron en invernadero a capacidad de campo con temperaturas entre 15 °C y 35 °C. Los organismos que indujeron los síntomas de secadera fueron reaislados para verificar su identidad y cumplir con los postulados de Koch.
RESULTADOS Y DISCUSIÓN
Muestreo regional
En las 16 localidades muestreadas se detectó la secadera asociada con complejos fungosos, lo cual concordó con lo reportado para Guanajuato, Michoacán, Edo. de México y Sinaloa (Mendoza–Zamora y Romero–Cova, 1989; Castro y Dávalos, 1990; Quintero et al., 1998). La frecuencia promedio de cada tipo de aislamiento en raíz y corona fue similar en cada localidad, excepto en Fox y Cyl, los cuales se detectaron en mayor cantidad (p<0.05) en corona y raíz (Cuadro 2).
Caracterización cultural, morfológica y molecular
Del total de aislamientos de raíz (2640) y corona (365) se identificaron y caracterizaron ocho especies fungosas: 1) F. oxysporum Snyder y Hansen produjo colonias rosa púrpura que tornaron violeta, microconidios ovoides y hialinos producidos en fiálides cortas, macroconidios ligeramente curvados con 3 a 5 septos, 21 a 43 µm de longitud y 3 a 5 jum de ancho y clamidosporas terminales o intercalares. 2) F. solani Snyder y Hansen formó crecimientos miceliales blancos, microconidios de 6 a 16 µm, macroconidios de 28 a 36 jum y clamidosporas solas o apareadas. 3) R. fragariae Husain y McKeen exhibió colonias blancas, con ramificaciones desarrolladas en ángulo recto (90°) e hifas binucleadas con diámetro promedio de 8.4 µm (Figura 1A). 4) Cylindrocarpon sp. presentó colonias café oscuro, de crecimiento lento, conidióforos cortos y macroconidios cilíndricos, generalmente con 1 a 3 septos y 37 a 63 µm de longitud. 5) V. alboatrum Reinke y Berthier produjo colonias blanco amarillentas o cremosas, hifas ramificadas en verticilo y conidios unicelulares generalmente ovoides. No se observaron clamidosporas o microesclerocios que lo diferencian de V. dahliae (Maas, 1998). 6) Colletotrichum sp. formó colonias blanco rosadas y conidios unicelulares, ovoides o cilíndricos e incoloros o de color salmón cuando se observaron unidos en masas. 7) Phytophthora sp. exhibió colonias blancas; algunas cepas produjeron oogonios con anteridios paráginos y otras que no produjeron estructuras sexuales sólo formaron esporangios globosos sin papila o semipapilados. 8) Pythium aphanidermatum presentó micelio blanco, abundante y de crecimiento rápido; las oosporas fueron apleróticas en oogonios esféricos, con anteridios en forma de campana; los esporangios filamentosos e inflados tuvieron tamaño variable (Figura 1B).
Las secuencias de dos aislados de Fox, 100% homólogos entre sí (números de acceso: DQ979012 y DQ452072), tuvieron una homología de 99% y valor de similitud de 959 con la mayoría de las secuencias de Fusarium oxysporum, raza F–H 6.5, disponibles en el Genbank. Las secuencias de dos aislados de Rhi, 100% homólogos entre sí (números de acceso: DQ979011 y DQ452073), tuvieron una homología de 98 % y un valor de similitud de 1151 con la mayoría de las secuencias del teleomorfo de Rhizoctonia fragariae del grupo de anastomosis AG–A. Las secuencias fueron depositadas en el banco de genes del NCBI con los números de acceso referidos.
Para asociación con la secadera, sólo Fox se había reportado en Michoacán (Téliz et al., 1986; Mendoza, 1992). Por tanto, Fso, Rhi, Cyl, Ver y Pyt se suman a F. verticilioides, F. rigidiuscula, V. dahlie y R. solani reportados para ese Estado (Téliz et al., 1986; Mendoza, 1992). Otras especies, F. roseum, Phoma sp., Ascochyta sp. y Alternaria sp., reportadas para Guanajuato no se encontraron en este trabajo (Mendoza–Zamora y Romero–Cova, 1989; Castro y Dávalos, 1990; Quintero et al., 1998). Esta diversidad de organismos asociados a una enfermedad de la raíz es comprensible ya que pueden aislarse organismos saprobióticos del rizoplano, algunos de ellos no patogénicos (Quilambaqui–Jara et al., 2004). Además, la asociación de nuevas especies con la secadera se podría explicar por la importación de material vegetativo para siembra correspondiente a nuevas variedades de EE.UU. Este podría ser el caso de V. alboatrum reportado en ese país (Maas, 1998) y que figuró por primera vez en este estudio.
Frecuencia de hongos y pseudohongos
Los hongos más frecuentes fueron Fox, Cyl y Pyt con 182, 155 y 82% para el ciclo de cultivo 2002/03 y 656, 256 y 82% para el ciclo 2003/04 (Cuadro 3). Los menos frecuentes fueron Rhi, Fso, Col y Ver (2 a 49%). Con excepción de Fox, las frecuencias de los organismos decrecieron de floración a fructificación, probablemente debido a diferencias en la densidad de inóculo en cada estado fenológico (Castro y Dávalos, 1990) o debido a cambios en la susceptibilidad de la planta por efecto de la variedad, edad o competencia entre organismos con predominancia de Fox. En el ciclo 2003/04 fue evidente la mayor presencia de Fox en corona (67 a 83%) que en raíz (47 a 62%), mientras que Cyl fue más frecuente en esta última (22 a 52%) (p<0.05) (Cuadro 3). Fox y Cyl exhibieron crecimiento vigoroso en PARPH, por lo que es posible que hayan limitado el crecimiento adecuado de los pseudohongos. Aunque se esperaba una variabilidad marcada en la detección de microorganismos entre ciclos de producción debido a la selección de diferentes plantaciones y técnicas de laboreo del suelo, los resultados fueron consistentes entre ambos ciclos con excepción de Fso y Pyt. La frecuencia alta de Fox concordó con reportes para Irapuato (68%) y Zamora (70%) (Téliz et al., 1986; Mendoza–Zamora y Romero–Cova, 1989; Castro y Dávalos 1990). Similarmente, la frecuencia baja de Ver y Rhi coincidió con reportes de Téliz et al. (1986) para V. dahliae en el Valle de Zamora y de R. solani en Irapuato, Guanajuato (36%) y Zamora, Michoacán (24%) (Téliz et al., 1986; Mendoza–Zamora y Romero–Cova, 1989). De plantas asintomáticas se aislaron con valores totales a Fox (75%), Cyl (17%), Rhi(16%), Phy (9%), y Pyt (5%), lo cual sugiere la necesidad de un nivel alto de infección para la expresión de la enfermedad o que la detección ocurrió durante el proceso de incubación.
Los sistemas de manejo influyeron en la abundancia de los organismos asociados con mayor frecuencia a la secadera. Fox fue más predominante en suelo con acolchado y riego por goteo aunque Cyl fue el único significativamente diferente (p<0.05) (Figura 2).
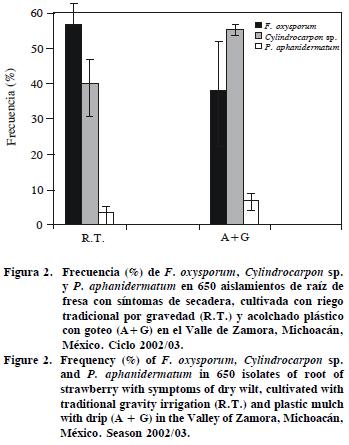
La temperatura puede determinar la frecuencia de las especies y suprimir diferencialmente sus poblaciones (Michereff et al., 2005). El acolchado puede contribuir a la inocuidad y certificación del cultivo bajo la modalidad de buenas prácticas agrícolas (BPA); sin embargo, modifica la humedad, temperatura y ventilación del suelo, por lo que su potencial inductivo o restrictivo al parasitismo debe estudiarse (Mbagwu, 1991). En suelos arcillosos (Cuadro 4), hubo también mayores poblaciones de Fox (46.8%) y Cyl (38.7%), posiblemente debido a la capacidad del suelo para retener más humedad, lo cual favorece el desarrollo de estos hongos (Michereff et al., 2005).
Otros factores que afectan la sobrevivencia del inóculo como la frecuencia de riego, compactación y contenido nutricional, no fueron evaluados. Rhi tuvo mayor abundancia en suelo con textura franco arcillosa (43.7%); este hongo es más agresivo en suelos moderadamente húmedos, condición común en suelos francos o arenosos (Michereff et al., 2005).
Ensayos de patogenicidad
En el primer ensayo, Fox y Pyt fueron patogénicos y causaron 100% de mortalidad a 6 d de la inoculación, aunque los síntomas de marchitez se expresaron desde el día 3. En el segundo ensayo, los síntomas típicos fueron inducidos en 100% de las plantas por Fox, Pyt, Phy, Fox + Pyt, Fox + Rhi y Fox + Cly, y en 60% en Rhi. Inicialmente se presentó necrosis en raíz y corona y la secadera se observó entre 5 a 8 d después de la inoculación. Ninguna de las inoculaciones combinadas con Fox modificó la expresión del daño, ya que el tipo, severidad y velocidad de síntomas fueron similares a los causados por cada patógeno inoculado por separado. En California, EE.UU., V. alboatrum causa la marchitez de la fresa y Cylindrocarpon sp. es considerado un patógeno poco agresivo al causar la pudrición negra de raíz en asociación con Pythium sp., R. fragariae e Idriella lunata (Hancock, 1999; Douglas, 2000). En estas pruebas Ver y Cyl, al igual que Col y Fso, no reprodujeron la enfermedad por lo que denotan actividad saprofítica. Este supuesto se ha demostrado para aislamientos de F. solani (Quilambaqui–Jara et al., 2004). Sin embargo, no se descarta que las condiciones experimentales como la densidad de inóculo y método de inoculación utilizados influyeran en estos resultados. Esta posibilidad es mayor para Cyl ya que su alta frecuencia en campo permite hipotetizar que este organismo, considerado poco agresivo (Hancock, 1999; Douglas, 2000), interactúe en la fase inicial de la enfermedad con Fox. Esto podría explicar su mayor presencia en raíz que en corona y que al final, en fructificación, no haya predominado (Cuadro 2 y 3).
En el tercer ensayo, 100% de la plantas del cultivar Camarosa iniciaron los síntomas a los 23 d y se marchitaron 30 d después de la inoculación con Fox. La corteza de la raíz mostró necrosis y la corona presentó lesiones café oscuro en tejido vascular. El periodo de incubación excedió aproximadamente 23 d respecto a los otros ensayos, lo cual puede atribuirse más al método de inoculación que al genotipo o edad de las plantas. Este periodo podría ser el más representativo en condiciones de campo. Si se considera que la mayor incidencia de secadera ocurre durante la segunda fase de fructificación, se podría sugerir que el período crítico de infección sucede aproximadamente un mes antes de este evento fenológico, lo cual es importante para determinar el inicio de un programa efectivo de control. En los tres ensayos, los hongos que causaron enfermedad fueron reaislados y comparados morfológicamente con los inoculados, cumpliéndose los postulados de Koch. Las plantas testigo no manifestaron síntomas.
CONCLUSIONES
La secadera de la fresa se encontró distribuida en todas las localidades muestreadas del Valle de Zamora, Michoacán.
Fso, Cyl, Ver, Col, Fox, Phy, Pyt y Rhi se asociaron con la secadera; sin embargo, únicamente Fox, Phy, Pyt y Rhi fueron patogénicos. P. aphanidermatum y R. fragariae se reportan por primera vez en fresa en México. Además, se confirmó la identidad taxonómica de los aislados de Fox Y Rhi por secuencia del gen rADN 18S. 4).
Considerando la frecuencia alta y distribución regional extensiva de F. oxysporium y que fue el único que aumentó su presencia al final de los dos ciclos de cultivo, se postula a este hongo como el de mayor aptitud parasítica pudiendo formar complejos con Phy, Pyt y Rhi.
El control debe considerar el monitoreo de Fox y el manejo del cultivo ya que el acolchado con riego por goteo indujo su menor frecuencia, mientras que el suelo arcilloso lo incrementó, indistintamente del tipo de riego.
LITERATURA CITADA
Castro, F. J., y P. Dávalos. 1990. Etiología de la secadera o pudrición de la raíz y corona de la fresa en Irapuato, Gto. Rev. Mex. Fitopatol. 8: 80–86. [ Links ]
Crous, P. W. 2002. Taxonomy and Pathology of Cylindrocladium (Calonectria) and Allied Genera. The American Phytopathological Society. St. Paul, Minnesota, USA. pp: 52–53. [ Links ]
Delaporta, S.L., J. Woods, and J.B. Hicks. 1983. A plant DNA minipreparation version II. Plant Mol. Biol. Reporter 1: 19–21. [ Links ]
Douglas, G. W. 2000. Manejo integral de enfermedades en la fresa. In: Memoria del Primer Simposium Internacional de la Fresa. Zamora, Michoacán. pp: 122–133. [ Links ]
Erwin, D. C., and O. K. Ribeiro. 1996. Phytophthora Diseases Worldwide. The American Phytopathological Society. St. Paul, Minnesota, USA. pp: 96–124. [ Links ]
Hancock, J. F. 1999. Strawberries. Michigan State University, USA. CABI Publishing. pp: 169–171. [ Links ]
Maas J. L. 1998. Compendium of Strawberry Diseases. The American Phytopathological Society. St. Paul, Minnesota, USA. Second Edition. pp: 44–57. [ Links ]
Martínez–Barrera, R., y R. Castro–Mendoza. 1976. Identificación del agente causal de la secadera de la fresa en Zamora, Michoacán. In: Memoria del VII Congreso Nacional de Fitopatología. México, D.F. pp: 43–44. [ Links ]
Mbagwu, J. S. C. 1991. Influence of different mulch materials on soil temperature, soil water content and yield of three Cassava cultivars. J. Sci. Food Agric. 4:569–577. [ Links ]
Mendoza Z., C. 1992. Enfermedades fungosas de hortalizas y fresa. In: Manejo fitosanitario de las hortalizas en México. Centro de Entomología y Acarología. Chapingo, México. pp: 273–288. [ Links ]
Mendoza–Zamora, C., y S. Romero–Cova. 1989. Enfermedades de la fresa Fragaria chiloensis var. ananassa en Villa Guerrero, Edo. de México. III: Identificación e incidencia de los hongos que atacan corona y raíz. Rev. Mex. Fitopatol. 7:140–146. [ Links ]
Michereff, S. J., L. A. M. Peruch, e D. E. G. T. Andrade. 2005. Manejo integrado de doencas radiculares. In: Ecología e Manejo de Patógenos Radiculares em Solos Tropicais. Michereff, S. J., D. E. G. T. Andrade, e M. Menezes (eds). Universidade Federal Rural de Pernambuco. Brasil. pp: 367–388. [ Links ]
Mora–Aguilera, G. 2000. El muestreo en la sanidad: Principios y aplicaciones. In: Principios de Salud Animal y Fitosanidad. Cibrian T., J. E., y S. Anaya R. (comps). Colegio de Postgraduados. Montecillo, Edo. de México. pp: 103–124. [ Links ]
Nelson, P. E., T. A. Toussoun, and W. F. O. Marasas. 1983. Fusarium Species: An Illustrated Manual for Identification. The Pennsylvania State University Press. University Park and London, pp: 142–150. [ Links ]
Quilambaqui–Jara, M., E. Zavaleta–Mejía, G. Mora–Aguilera, F. Delgadillo–Sánchez, y A. Marín–Jarillo. 2004. Patogenicidad de tres especies de Fusarium asociadas con el declinamiento del espárrago (Asparagus officinalis L.) en Guanajuato, México. Rev. Mex. Fitopatol. 22: 30–36. [ Links ]
Quintero, J. R., R. S. García, S. Montoya, y F. Estrada. 1998. Etiología de las enfermedades del cultivo de la fresa (Fragaria spp.) en Sinaloa. In: Memorias del XXV Congreso Nacional de Fitopatología. Guanajuato, Gto. 84 p. [ Links ]
SAS Institute. 1988. SAS User's Guide: Statistics. Release 6.03 Edition. SAS Institute, Inc. Cary, N.C. USA. 1028 p. [ Links ]
Sneh, B., L. Burpee, and A. Ogoshi. 1991. Identification of Rhizoctonia Species. The American Phytopathological Society. St. Paul, Minnesota, USA. pp: 39–42. [ Links ]
Téliz, D., A. Mendoza, y J. Sandoval. 1986. Enfermedades de la fresa en México. Rev. Mex. Fitopatol. 4:1–12. [ Links ]
Wang, B., and S.N. Jeffers. 2000. Fusarium root and crown rot: A disease of container–grown hosts. Plant Dis. 84:980–988. [ Links ]
White, T. J., T. Bruns, S. Lee, and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis, M. A., D. H. Gelfand, J. J. Sninsky, and T. J. White (eds). PCR Protocols: A Guide to Methods and Applications. Academic Press, San Diego, USA. pp: 315–322. [ Links ]














