Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.3 Texcoco abr./may. 2008
Protección vegetal
Susceptibilidad de especies de eucalipto a Gonipterus scutellatus y perfiles electroforéticos de proteínas marcadoras del adulto
Susceptibility of eucalyptus species to Gonipterus scutellatus and electrophoretic profiles of adult marker proteins
Amanda Huerta–Fuentes1, Italo Chiffelle–Gómez2, Maryi Serrano–Garzón1, Tatiana Vázquez–Silva1 y Jaime Araya–Clericus3
1 Departamento de Silvicultura, Facultad de Ciencias Forestales, Universidad de Chile, Casilla 9206, Santiago, Chile. (ahuerta@uchile.cl), (ahuertaf@gmail.com)
2 Departamento de Agroindustria y Enología,
3 Departamento de Sanidad Vegetal Facultad de Ciencias Agronómicas. Universidad de Chile. Casilla 1004. Santiago, Chile.
Recibido: Abril, 2007.
Aprobado: Marzo 2008.
Resumen
En Chile, el gorgojo australiano Gonipterus scutellatus Gyllenhal (Coleoptera: Curculionidae), específico del eucalipto y detectado por primera vez en 1998, se ha distribuido en las regiones IV a IX, y podría afectar a más de 525 mil ha de Eucalyptus. El insecto se alimenta del follaje nuevo y causa pérdidas de crecimiento. Los objetivos de este estudio fueron evaluar la susceptibilidad de las especies de eucalipto más importantes en Chile al daño por G. scutellatus, caracterizar el peso molecular (kDa) de las proteínas de gorgojos adultos alimentados en ellas, y buscar proteínas marcadoras en los insectos asociadas a la especie de eucalipto de la que se alimentan. La susceptibilidad de Eucalyptus camaldulensis Dehnh., E. globulus ssp. globulus Labill. y E. robusta Smith a insectos adultos se midió por la pérdida de área foliar. Las proteínas de los adultos se analizaron por electroforesis, comparando el tamaño e intensidad de las bandas de geles. E. camaldulensis fue más susceptible (p<0.05; 12.93% pérdida de área foliar) que E. robusta (6.36%) y E. globulus (5.46%). Los adultos alimentados con E. robusta presentaron el mayor número de proteínas (22). Aquellos alimentados con cada una de las tres especies de eucalipto por separado tuvieron 15 proteínas comunes, y nueve exhibieron variaciones (proteínas marcadoras): los adultos alimentados con E. robusta tuvieron siete proteínas marcadoras; E. camaldulensis y E. globulus tres proteínas cada uno. Los gorgojos alimentados con E. robusta tuvieron tres proteínas marcadoras exclusivas (9, 31 y 38 kDa); los alimentados con E. camaldulensis y E. globulus sólo tuvieron una cada uno (35 y 47 kDa). Así, los gorgojos alimentados con los tres eucaliptos tuvieron tres perfiles distintos de proteínas.
Palabras clave: Eucalyptus camaldulensis, E. globulus, E. robusta, gorgojo del eucalipto, proteínas marcadoras.
Abstract
In Chile, the Australian weevil Gonipterus scutellatus Gyllenhal (Coleoptera: Curculionidae), specific to eucalyptus, was first detected in 1998. It has spread trough the IV to IX Regions and could affect more than 525 thousand ha of Eucalyptus. The insect feeds on new foliage and causes losses in growth. The objectives of this study were to evaluate the susceptibility of Chile's most important eucalyptus species to damage by G. scutellatus, to characterize the molecular weight (kDa) of proteins of adult weevils that feed on the trees, and to identify marker proteins of the insects associated with the species of eucalyptus on which they feed. Susceptibility of Eucalyptus camaldulensis Dehnh., E. globulus sp. globulus Labill. and E. robusta Smith to adult insects was measured by leaf area loss. The proteins of the adults were analyzed by electrophoresis, comparing size and intensity of the bands of gels. E. camaldulensis was more susceptible (p<0.05; 12.93% leaf area loss) than E. robusta (6.36%) or E. globulus (5.46%). Adults fed with E. robusta had the highest number of proteins (22). Those fed with each one of the three eucalyptus species separately had 15 proteins in common, and nine exhibited variations (marker proteins). Adult weevils fed E. robusta had seven marker proteins; E. camaldulensis and E. globulus had three marker proteins each. Weevils fed E. robusta had three marker proteins exclusive to these insects (9, 31 and 38 kDa), while those fed with E. camaldulensis and E. globulus had only one each (35 and 47 kDa). Thus, the three groups of weevils fed with different eucalyptus species had different protein profiles.
Key words: Eucalyptus camaldulensis, E. globulus, E. robusta, eucalyptus weevil, marker proteins.
INTRODUCCIÓN
El gorgojo del eucalipto, Gonipterus scutellatus Gyllenhal, es un Curculionidae australiano específico de Eucalyptus spp. (Withers, 2001), y se le considera una de las plagas más severas en su lugar de origen. Esta especie se ha encontrado en plantaciones de eucalipto en África, Europa (Mansilla, 1992; Cordero et al., 1999), California (Cowles y Downer 1995; Hanks et al. 2000), y Nueva Zelanda (Withers, 2001). En Sudamérica se describió en Argentina en 1926 (Rosado–Neto, 1993), en Uruguay en 1943, en Brasil en 1955 y en Chile en 1998 (Rosado–Neto, 1993; Beéche, 1999).
Las larvas y los adultos de G. scutellatus se alimentan del follaje de eucalipto en crecimiento. El crecimiento de las poblaciones del gorgojo en pocos años se favorece con la abundancia de hospedantes preferidos, condiciones de clima templado, especialmente temperatura y precipitaciones, y ausencia de enemigos naturales (Tooke, 1953). En la V Región de Chile (San Felipe), G. scutellatus tiene 3 a 4 generaciones por año (Estay et al., 2002). El alto potencial reproductivo del insecto, junto con su capacidad de defoliación intensa puede causar pérdidas de crecimiento o deformaciones (Santolamazza y Cordero, 1998); incluso los árboles pueden morir debido a infestaciones continuas (Elliott y De Little, 1985).
G. scutellatus tiene marcada preferencia por algunas especies de Eucalyptus (Cordero y Santolamazza, 2000). En Chile, la especie más afectada es E. globulus ssp. globulus, seguida de E. camaldulensis Den. y E. viminalis Labill (Lanfranco y Dungey, 2001).
Las primeras infestaciones de G. scutellatus en Chile se encontraron en las regiones V y Metropolitana (Beéche, 1999), lo que ha generado preocupación por el futuro de las 525 057 ha plantadas con Eucalyptus spp. (INFOR, 2006). Esta plaga se ha desplazado entre las regiones IV a IX (SAG, 2006). Según Klein y Waterhouse (2000) su importancia como plaga del eucalipto es superada únicamente por Phoracantha semipunctata F. (Coleoptera: Cerambycidae).
Los compuestos secundarios de las plantas se consideran medios de defensa química contra los insectos (Dajoz, 2001). Estos compuestos reducen el poder digestivo de los insectos o bien reaccionan como antiapetitivos. En las plantas leñosas la concentración de estos compuestos es elevada, especialmente de taninos (polifenoles), terpenos y ligninas.
Hay variación en la susceptibilidad de Eucalyptus spp., y se consideran sensibles a G. scutellatus: E. globulus, E. camaldulensis, E. viminalis, E. robusta, E. punctata, E. maideni y E. smithi; y resistente E. saligna, e inmune E. citriodora (Romanyk y Cadahia, 2002). Según Floyd y Foley (2001), la resistencia de especies de eucalipto a plagas puede basarse en la composición química de las hojas. En E. melliodora A. Cunn. ex Schauer, E. sideroxylon A. Cunn. ex Woolls y E. camaldulensis, se ha observado una relación inversa entre la concentración de 1,8–cineol (un monoterpeno) o bien sideroxilonal, que se encuentran en los aceites esenciales de las hojas, y la susceptibilidad a fitófagos.
Aunque todas las células de los insectos comparten el mismo genoma, pueden tener distintos genes en actividad y, por tanto, elaborar proteínas diferentes (Ezzel, 2002). Los insectos desarrollan estrategias para eludir las defensas de las plantas; por ejemplo, aumentan su actividad proteolítica o inducen la generación de proteínas resistentes a proteasas de las plantas. La expresión de las proteínas depende del ambiente al cual se somete el insecto. Es decir, dependiendo de su alimentación, el insecto expresa algunas proteínas exclusivas (Vivanco et al., 2005).
Los objetivos de este estudio fueron evaluar la susceptibilidad de varias especies de eucalipto al daño por G. scutellatus, caracterizar el peso molecular de las proteínas de adultos del insecto alimentados con esas especies de eucalipto, y buscar proteínas exclusivas (marcadoras) asociadas al alimento recibido.
MATERIALES Y MÉTODOS
Evaluación de la pérdida de área
Los adultos de G. scutellatus se recolectaron a fines de verano en un rodal joven de E. globulus muy infestado (60 a 80% de los brotes apicales dañados) en la Provincia de San Felipe (V Región en Chile central), y se trasladaron en bolsas de tela en cajas térmicas al Laboratorio de Entomología Forestal de la Facultad de Ciencias Forestales de la Universidad de Chile, en Santiago. Allí se mantuvieron en cajas plásticas de 5 L y se alimentaron con hojas frescas de E. globulus (Santolamazza y Cordero, 1998).
Se usaron plantas de un año (1 m altura aproximada) de E. camaldulensis, E. globulus y E. robusta Smith en macetas plásticas (19 cm diámetro) con una mezcla de suelo, arena y turba tratada con captan 2 g L–1 y urea. Estas plantas se pusieron en jaulas (1.8x1.5x1.8 m) rodeadas con tul para prevenir el escape de los insectos, en condiciones de campo bajo clima mediterráneo e irrigación periódica. En cada planta tratada se pusieron dos adultos (una hembra y un macho), que se alimentaron por un mes. Dado que la recolección se hizo a fines de verano (marzo), la edad de los adultos fluctuó entre uno y dos meses (Estay et al., 2002). Se usó como testigo plantas sin insectos. En cada planta se midió el área foliar (cm2) al inicio y al término del experimento, con una cuadrícula de 0.5 cm para obtener la variación de área. Se usó la razón del área foliar, correspondiente al cociente entre las mediciones final e inicial por planta. Los resultados tuvieron un buen ajuste a la distribución normal y se expresaron como promedios ± D.E. El diseño fue completamente al azar con un arreglo factorial de tratamientos (2 x 3) (Canavos, 1988): el primer factor fue la presencia o ausencia de adultos y el segundo la especie de eucalipto. Cada tratamiento tuvo cinco repeticiones. Los adultos que morían se sustituyeron por otros de desarrollo similar para mantener el consumo, lo cual ocurrió una sola vez. Se usaron pruebas t de Student (Taucher, 1999) para determinar si la presencia del insecto influía en la pérdida de área foliar en las especies de eucalipto evaluadas.
Electroforesis de perfiles de proteínas
Después de un mes de alimentación, se analizaron por electroforesis los perfiles de proteínas de tres muestras (repeticiones) compuestas de dos adultos de cada especie de eucalipto. Los adultos se colocaron 24 h en placas Petri sin alimento (para limpiar su tubo digestivo) y homogeneizaron a 4 °C en amortiguador (TRIS–HCl 50 mM, pH 8.5, EDTA 5 mM, SDS 0.07%, con inhibidores de proteasa 0.1 mM; Sigma), forzándolos a través de un espacio estrecho entre un vástago de teflón y un contenedor de vidrio (Fleischer et al., 1979). Las muestras se centrifugaron 10 min a 1.250 G, se congelaron y almacenaron a –20 °C. La concentración de las proteínas de los extractos de cada muestra se determinó por el método de Bradford (1976). Los perfiles electroforéticos de los extractos se determinaron en geles de poliacrilamida en condiciones desnaturantes (PAGE–SDS) unidimensionales (Laemmli, 1970; Bollag et al., 1996). La electroforesis se hizo en minigeles (6 cm x 8 cm X 0.75 mm). El gel de concentración fue T=5% y C = 2.7% y el gel de separación T=12.5% y C = 2.7%. Para correr el gel se usó un aparato de electroforesis vertical (mini–protein, Bio–Rad) en un amortiguador de corrida (Tris 25 mM, glicina 192 mM, pH 8.8) con voltaje constante (120) y azul de bromofenol como indicador. Los estándares de peso molecular (PM) fluctuaron entre 20 y 220 kDa (LMW BioChile). Los geles obtenidos se tiñeron con 1.5% de azul brillante de Coomassie en 50% v/v de metanol y destiñeron en ácido acético/ metanol/ agua (1:1:8).
El área de las proteínas se determinó con un programa de densitometría (BioCaptMW software, Microsoft, Redmond, USA). Se usaron pruebas de ji–cuadrada (Taucher, 1999) para determinar diferencias significativas en el tamaño e intensidad de la banda en los geles de las proteínas marcadoras en los extractos.
RESULTADOS Y DISCUSIÓN
Susceptibilidad de eucalipto al daño de adultos de G. scutellatus
Todas las plantas testigo aumentaron su área foliar promedio en 22.3 cm2, equivalente a 5.5%. El área foliar de las plantas con adultos de las tres especies evaluadas decreció: E. globulus tuvo la menor reducción del área foliar, seguida de E. robusta, y E. camaldulensis. En esta última especie los insectos causaron el daño mayor y redujeron su área foliar en 12.93%; E. robusta y E. globulus tuvieron pérdidas de área foliar de 6.36 y 5.46% (Cuadro 1), lo que indica que E. camaldulensis es más vulnerable a la infestación de adultos.
Los adultos de G. scutellatus redujeron significativamente (p<0.05) el área foliar sólo en E. camaldulensis y E. globulus (Cuadro 1). Esta reducción del área foliar se produjo en un mes; una exposición mayor puede causar efectos mayores en el crecimiento y en la supervivencia de las plantas (Floyd y Foley, 2001). El daño sería mayor si se considera que en esta área el insecto tiene hasta cuatro generaciones y el adulto está presente todo el año (Estay et al., 2002).
Algunas plantas de E. robusta con G. scutellatus tuvieron una mayor variación del área foliar. Plantas de un mismo género y aún de la misma especie presentaron grandes variaciones en la susceptibilidad al daño por insectos, debido a sus características genéticas (Farrow et al., 1994).
Las bajas tasas de reducción del área foliar de las especies estudiadas pueden estar relacionadas con la necesidad de los adultos de comer y crecer únicamente en el árbol donde emergieron. Específicamente, los adultos pudieron no adaptarse completamente al tipo de follaje debido a que la composición química de las hojas adultas de E. globulus donde se recolectaron los insectos y las plantas jóvenes del ensayo fue distinta (Floyd et al., 2001).
Algunas plantas de E. globulus y E. robusta expuestas a G. scutellatus crecieron, lo que puede ser una estrategia para reducir el riesgo de daño. Se ha documentado que la tolerancia y el crecimiento rápido son mecanismos de resistencia a plagas en eucaliptos (Floyd y Foley, 2001).
Proteínas marcadoras de adultos de G. scutellatus según tipo de alimentación
En la Figura 1 se presenta un gel representativo de las proteínas de adultos de G. scutellatus. Los insectos alimentados con E. robusta presentaron 22 proteínas; los alimentados con E. camaldulensis y E. globulus, 18.
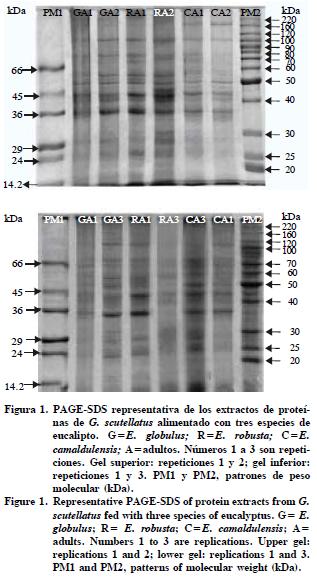
Quince proteínas fueron comunes en los adultos de G. scutellatus, mientras que nueve presentaron variaciones (proteínas marcadoras con PM inferiores a 60kDa) de acuerdo al tipo de follaje consumido. Las nueve proteínas que tuvieron variaciones en los extractos (Figura 2) son las proteínas marcadoras que indican cambios en el metabolismo de los adultos debido al alimento recibido. En un estudio con larvas de este insecto se encontraron 11 proteínas marcadoras distintas a las del adulto (Huerta et al., 2007).

De las proteínas que variaron, tres se encontraron sólo en los adultos alimentados con E. robusta (proteínas 24, 20 y 16, asociadas con PM aproximados de 9, 31 y 38 kDa). Sólo una ocurrió en los adultos alimentados con E. camaldulensis (proteína 18, de 35 kDa), y una fue exclusiva de aquellos alimentados con E. globulus (proteína 12, 47 kDa). Así, la mayor variación en las proteínas se presentó en los adultos alimentados con E. robusta (Figura 2).
Una explicación del mayor número de proteínas en adultos alimentados con E. robusta es que durante la electroforesis una proteína podría haberse fraccionado debido a un error en el proceso y aparecer en el gel como si fueran dos proteínas más pequeñas. Esta hipótesis se descartó al compararse las repeticiones de los geles, pues las proteínas marcadoras tuvieron el mismo comportamiento en todos los extractos de los adultos alimentados con esta especie de eucalipto.
Las diferencias en las proteínas de los extractos de los adultos alimentados con E. robusta o E. camaldulensis se relacionaron con las proteínas 10, 16, 20, 21 y 24, las cuales estuvieron ausentes en los adultos alimentados con E. camaldulensis; además, con la proteína 18, la cual sólo apareció en los adultos alimentados con E. camaldulensis. Las otras dos proteínas (13 y 19) fueron comunes para estas dos especies. Las diferencias entre los extractos de los adultos alimentados con E. globulus respecto a los que recibieron E. robusta y E. camaldulensis corresponden a la ausencia de las proteínas 13 y 19 en los adultos alimentados con E. globulus, combinada con la exclusividad de la proteína 12. Los adultos alimentados con E. globulus y E. camaldulensis no tuvieron proteínas marcadoras en común (Figura 2).
La presencia o ausencia de proteínas marcadoras en los adultos de G. scutellatus puede deberse a la influencia de la composición química de las hojas que consumieron durante el experimento. La composición de los aceites esenciales de las hojas de los eucaliptos puede causar diferencias en susceptibilidad al daño por insectos (Floyd y Foley, 2001; Dungey y Potts, 2003). La función de los metabolitos secundarios de las plantas es actuar específicamente contra la infestación de insectos para reducir el daño (Kessler y Baldwin, 2002; Vivanco et al., 2005). Según un estudio de la composición química de las hojas de tres especies de eucalipto (E. melliodora, E. sideroxylon y E. polyanthemos Schauer), en las concentraciones de sideroxylonal y 1,8–cineol existe variación inter e intraespecífica, donde una parte se debe a diferencias genéticas y ambientales (Floyd y Foley, 2001).
Las pruebas de ji–cuadrada (X2 = 14.24; p<0.05) no indicaron diferencias significativas entre las proteínas marcadoras (tamaño e intensidad) de los adultos de G. scutellatus alimentados con E. globulus respecto a los alimentados con E. camaldulensis. Sólo los adultos alimentados con E. robusta tuvieron diferencias significativas en sus proteínas marcadoras.
CONCLUSIONES
Los adultos del gorgojo (Gonipterus scutellatus) causaron pérdidas variables de área foliar en las tres especies de eucalipto, lo que indica que estas especies tienen niveles distintos de resistencia o susceptibilidad a esta plaga. E. camaldulensis fue la especie más susceptible a la infestación por adultos de G. scutellatus en comparación con E. globulus y E. robusta.
La aparición de proteínas marcadoras en los adultos de G. scutellatus refleja un cambio en el insecto que responde al tipo de alimento consumido. Aquellos alimentados con E. robusta tuvieron tres proteínas marcadoras exclusivas, en tanto que los alimentados con E. globulus y con E. camaldulensis presentaron sólo una cada uno.
AGRADECIMIENTOS
Estudio financiado por el Proyecto de Investigación DID I–02/6–2 "Determinación de la resistencia de diferentes especies de Eucalyptus al daño por el gorgojo del eucalipto, Gonipterus scutellatus Gyllenhal (Col., Curculionidae)", de la Dirección de Investigación de la Universidad de Chile.
LITERATURA CITADA
Beéche, M. 1999. Programa de detección y control del gorgojo del eucalipto, Gonipterus scutellatus (Gyll.) (Coleoptera: Curculionidae). In: Libro de Actas, XXI Congreso Nacional de Entomología. 3–5 noviembre. Arica, Chile. pp: 33–34. [ Links ]
Bollag, D., M. Rozycky, and S. Edelstein. 1996. Protein Methods. 2nd Edition. Wiley–Liss, New York. 416 p. [ Links ]
Bradford, M.M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein–dye binding. Analytical Biochem. 72: 248–254. [ Links ]
Canavos, G.C. 1988. Probabilidad y Estadística, Aplicaciones y Métodos. Mc Graw–Hill/Interamericana de México S.A. de C.V., México. 651 p. [ Links ]
Cordero, A., and S. Santolamazza. 2000. The effects of three species of eucalyptus on growth and fecundity of the eucalypt snout beetle (Gonipterus scutellatus). Forestry 73: 21–29. [ Links ]
Cordero, A.,S. Santolamazza, and J.A. Andrés. 1999. Life cycle and biological control of the Eucalyptus snout beetle (Coleoptera, Curculionidae) by Anaphes nitens (Hymenoptera, Mymaridae) in north–west Spain. Agric. For. Entomol. 1: 103–109. [ Links ]
Cowles, R.S., and J.A. Downer. 1995. Eucalyptus snout beetle detected in California. California Agric. 49: 38–40. [ Links ]
Dajoz, R. 2001. Entomología Forestal:Los Insectos y el Bosque. Ediciones Mundi Prensa, Madrid. 548 p. [ Links ]
Dungey, H.S., and B.M. Potts. 2003. Eucalypt hybrid susceptibility to Gonipterus scutellatus (Coleoptera: Curculionidae). Austral Ecol. 28: 70–74. [ Links ]
Elliott, H.J., and D.W. De Little. 1985. Insect pests of trees and timber in Tasmania. Forestry Commission, Tasmania, Hobart. 90 p. [ Links ]
Estay, S., J. Araya, y M.A. Guerrero. 2002. Biología de Gonipterus scutellatus Gyllenhal (Coleoptera: Curculionidae) en San Felipe, Chile. Boletín de Sanidad Vegetal, Plagas 28: 391–397. [ Links ]
Ezzel, C. 2002. Proteins rule. Scientific Am. 286 (4): 40–47. [ Links ]
Farrow, R.A., R.B. Floyd, and F.G. Neumann. 1994. Inter–provenance variation in resistance of E. globulus juvenile foliage to insect feeding. Austr. For. 57: 65–68. [ Links ]
Fleischer, S., J. O. McIntyre, and J. C. Vital. 1979. Large–scale preparation of rat liver mitochondria in high yield. Methods Enzymol. 55: 32–39. [ Links ]
Floyd, R.B., and W.J. Foley. 2001. Identifying Pest Resistant Eucalyptus using Near–infrared Spectroscopy. RIRDC Publication 01/112, Canberra, Australia. 110 p. [ Links ]
Floyd, R.B., R.A. Farrow, and M. Matsuky. 2001. Within species variation in insect damage and growth in Eucalyptus globulus. In: Floyd, R.B., and W.J. Foley. 2001. Identifying Pest Resistant Eucalyptus using Near–infrared Spectroscopy. RIRDC Publication 01/112, Canberra, Australia. pp: 2–12. [ Links ]
Hanks, L.M., J.G. Millar, T.D. Paine, and C. D. Campbell. 2000. Classical biological control of the Australian weevil Gonipterus scutellatus (Coleoptera: Curculionidae) in California. Environ. Entomol. 29: 369–375. [ Links ]
Huerta, A., I. Chiffelle, M. Serrano, T. Vásquez, and J.E. Araya. 2007. Protein profiles of Gonipterus scutellatus (Coleoptera: Curculionidae) larvae fed from leaves from three Eucalyptus species. New Zealand J. Crop Horticultural Sci. 35: 357–363. [ Links ]
INFOR (Instituto Forestal). 2006. Estadísticas Forestales 2005. Boletín Estadístico N° 111. Santiago, Chile. 165 p. [ Links ]
Kessler, A., and I.T. Baldwin. 2002. Plant responses to insect herbivory: The emerging molecular analysis. Ann. Rev. Plant Biol. 53: 299–328. [ Links ]
Klein, K.C., and D.F. Waterhouse. 2000. The Distribution and Importance of Arthropods Associated with Agriculture and Forestry in Chile. ACIAR Monograph 68, Santiago, Chile. 231 p. [ Links ]
Laemmli, U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680–685. [ Links ]
Lanfranco, D., and H.S. Dungey. 2001. Insect damage in Eucalyptus: A review of plantations in Chile. Austral Ecol. 26: 477–481. [ Links ]
Mansilla, J.P. 1992. Presencia sobre Eucalyptus globulus Labill de Gonipterus scutellatus Gyll. (Col, Curculionidae) en Galicia. Boletín de Sanidad Vegetal, Plagas 18: 547–554. [ Links ]
Romanyk, N., y D. Cadahia. 2002. Plagas de insectos en las masas forestales. Ediciones Mundi Prensa, Madrid. 336 p. [ Links ]
Rosado–Neto, G.H. 1993. Gonipterinae dos eucaliptos: Primeiro registro de Gonipterus scutellatus para o Estado de Sao Paulo, Brasil e algumas consideraçoes sobre G. gibberus (Coleoptera, Curculionidae). Rev. Bra. Zool. 13: 77–90. [ Links ]
SAG (Servicio Agrícola y Ganadero). 2006. Informativo Fitosanitario Forestal N°2 (3). Unidad de Vigilancia y Control de Plagas Forestales y Exóticas Invasoras. Ministerio de Agricultura, Santiago, Chile. 4 p. [ Links ]
Santolamazza, S., and A. Cordero. 1998. Sperm competition, cryptic female choice and prolonged mating in the eucalyptus snoutbeetle, Gonipterus scutellatus (Coleoptera, Curculionidae). Etiologia 6: 33–40. [ Links ]
Taucher, E. 1999. Bioestadística. Editorial Universitaria, Santiago de Chile. 310 p. [ Links ]
Tooke, F.G.C. 1953. The eucalyptus snout beetle, Gonipterus scutellatus Gyll. A study of its ecology and control by biological means. Entomology Memoirs, Department of Agriculture, Union of South Africa 3: 1–282. [ Links ]
Vivanco, J.M., E. Cosio, V.M. Loyola–Vargas, y H.E. Flores. 2005. Mecanismos químicos de defensa en las plantas. Investigación y Ciencia 341 (2): 68–75. [ Links ]
Withers, T.M. 2001. Colonization of eucalypts in New Zealand by Australian insects. Austral Ecol. 26: 467–476. [ Links ]














