Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.1 Texcoco ene./feb. 2008
Protección vegetal
Caracterización morfológica y molecular de aislados de Monilinia spp. y pruebas de patogenicidad sobre manzana
Morphological and molecular characterization of Monilinia sp. isolates and pathogenicity on apple
Zaida Muñoz, Assumpció Moret y Joan Bech
Universitat de Barcelona, Departamento de BiologÍa Vegetal, Facultad de Biología. Avgda. Diagonal 645, 08028 Barcelona (mmoret@ub.edu)
Recibido: Diciembre, 2006.
Aprobado: Octubre, 2007.
Resumen
La podredumbre morena o momificado de los frutos producida por Monilinia spp. ocasiona importantes pérdidas de producción en especies de rosáceas. Se han identificado tres especies de Monilinia muy relacionadas entre sí: M. laxa y M. fructigena de origen europeo, y M. fructicola de origen americano. En 2006 la Organización Nacional de Protección de las Plantas de España confirmó la presencia de M. fructicola en dos localidades de Cataluña. Para determinar la posible expansión de esta especie de cuarentena en nuestro país se han caracterizado morfológica y molecularmente 28 aislamientos de Monilinia spp. procedentes de diversas localidades catalanas y del resto de España. La caracterización morfológica se hizo mediante cultivo de los aislados en medio patata dextrosa agar y determinación de ciertos caracteres a los 4 y 7 d de incubación. Las variables fueron la coloración de la colonia, la forma de los márgenes y la presencia de masas estromáticas; además se caracterizaron molecularmente mediante PCR múltiplex con iniciadores específicos para las tres especies. Para estudiar la patogenicidad de aislados de dichas especies se infectaron artificialmente manzanas de la variedad Golden Delicious y a las 72 h y 96 h se determinó el diámetro de las lesiones y se evaluó la presencia de esporulación. Un 20% de los aislados se caracterizaron como M. fructigena y 80% como M. laxa. Los aislados de M. fructigena fueron significativamente más agresivos que los de M. laxa 96 h después de la inoculación. Se concluye que los focos de infección de M. fructicola en España han sido puntuales y limitados y no se observa una expansión de la enfermedad en las localidades estudiadas.
Palabras clave: Monilinia fructicola, Monilinia fructigena, Monilinia laxa, Pyrus malus, patogenicidad, PCR múltiplex.
Abstract
Brown rot, or mummified fruit disease produced by Monilinia sp., causes major losses in production of species of the Rosaceae family. Three closely related species of Monilinia have been identified: M. laxa and M. fuctigena, of European origin, and M. fructicola, of American origin. In 2006 the Organización Nacional de Protección de las Plantas of Spain confirmed the presence of M. fructicola in two locations of Catalonia. To determine the possible spread of this species, which is subject to quarantine in Spain, 28 isolates of Monilinia sp. from different locations of Catalonia and the rest of the country were characterized morphologically and molecularly. Morphological characterization was performed by culturing the isolates in a potato dextrose agar medium, and given traits were determined after 4 and 7 d of incubation. The variables were coloring of the colony, shape of the edges and presence of stromatic masses. Isolates were also characterized molecularly using multiplex PCR with specific primers for the three species. To study pathogenicity of the isolates of both species, Golden Delicious apples were infected artificially; 72 and 96 h later diameter of the lesions was measured and sporulation was assessed. Of the isolates, 20% were identified as M. fructigena and 80% were M. laxa. The isolates of M. fructigena were significantly more aggressive than those of M. laxa 96 h after inoculation. It is concluded that centers of infection of M. fructicola in Spain have been pin–pointed and confined, and spread of brown rot is not observed in the locations studied.
Key words: Monilinia fructicola, Monilina fructigena, Monilinia laxa, Pyrus malus, pathogenicity, multiplex PCR.
INTRODUCCIÓN
La podredumbre morena o momificado de los frutos producida por Monilinia spp. ocasiona importantes pérdidas de producción en especies de rosáceas (Prunus spp., manzano [Pyrus malus L.] y peral [Pyrus communis L.]). Se han identificado tres especies de Monilinia muy relacionadas entre sí: M. laxa (Aderhold & Ruhland) Honey, M. fructigena (Aderhold & Ruhland) Honey y M. fructicola (Winter) Honey y un anamorfo de Monilinia, Monilia polystroma van Leeuwen. En 2006 la Organización Nacional de Protección de las Plantas (NPPO) de España confirmó la presencia de M. fructicola en dos localidades de Cataluña. Los principales hospederos de M. fructicola son melocotón (Prunus persica [L.] Batsch), nectarina (Prunus persica var. nectarina [Aiton] Maxim.), alba–ricoque (Prunus armeniaca L.) y ciruela (Prunus domestica L.); M. fructigena es más frecuente en manzanas (Pyrus malus L.), peras (Pyrus communis L.) y cerezas (Prunus avium L.) (Batra, 1991); M. laxa prefiere albaricoques, almendros (Prunus dulcis [Mill.] D.A. Webb) y cerezos; y M. polystroma infecta manzano, peral y membrillo (Cydonia oblonga Mill.). M. laxa afecta preferentemente flores y ramillas mientras que M. fructigena tiene mayor incidencia en frutos (Byrde y Willetts, 1977). M. fructicola es un patógeno de frutales de hueso capaz de atacar flores, frutos y ramillas (Ogawa y English, 1960).
Es difícil identificar dichas especies con base en las características morfológicas de los aislamientos en medios de cultivo y en la tasa de crecimiento miceliar, porque su aspecto morfológico puede variar entre los aislados de una misma especie. Los métodos de biología molecular son la principal herramienta para identificar dichas especies (Hughes et al., 2000). Se ha utilizado RAPD (Welsh y McClelland, 1990; Williams et al., 1990), AFLP (Majer et al., 1996), amplificación de la región ITS y digestión posterior con enzimas de restricción (Snyder y Jones, 1999; Förster y Adaskaveg, 2000) y otros tipos de marcadores moleculares. Basándose en pequeñas variaciones intraespecíficas y un bajo polimorfismo interespecífico en la región ITS, Ioos y Frey (2000) desarrollaron parejas de iniciadores específicos para cada especie. Se diseñaron iniciadores específicos para M. fructicola (Fulton y Brown, 1997; Förster y Adaskaveg, 2000; Boehm et al., 2001) que permiten amplificar aislamientos de esta especie aunque no los de M. fructigena y M. laxa. Fulton y Brown (1997) identificaron un intrón del grupo–I en la SSU del rDNA de M. fructicola el cual no está presente en M. fructigena y M. laxa. Sin embargo, Côté et al. (2004a) observaron que el producto de la PCR que contiene el intrón no se amplifica en algunos aislados de M. fructicola, lo cual indica variabilidad genética entre los aislados de dicha especie. Se han desarrollado iniciadores que permiten la diferenciación inequívoca de M. laxa, M. fructigena y M. fructicola en una única reacción de PCR (Malvárez et al., 2001; Côté et al., 2004b), lo cual agiliza la detección de estas especies.
Los objetivos del presente trabajo fueron caracterizar morfológica y molecularmente mediante PCR múltiplex con iniciadores específicos aislamientos de Monilinia spp. obtenidos de frutos de melocotón, cereza, manzana y membrillo, y determinar su agresividad mediante la inoculación in vitro de manzanas de la variedad Golden Delicious.
MATERIALES Y MÉTODOS
Aislados
Los aislados de Monilinia spp. se hicieron con frutos infectados procedentes de nueve localidades catalanas y cuatro del resto de España (Cuadro 1). El medio de cultivo usado para los primeros aislamientos fue agar glucosado con cloranfenicol (Saboraud Dextrose Agar CAF 500 [45 g L–1], Biolife). Luego se resembraron discos (5 mm diámetro) obtenidos del margen de las colonias sobre patata dextrosa agar (PDA [39 g L–1], Sigma, Aldrich) y las placas se incubaron a 23 ±1 °C con 12 h de oscuridad y 12 h de iluminación con luz fluorescente. A los 4 y 7 d de crecimiento en PDA se calculó el crecimiento de cada colonia con la media de tres diámetros trazados en el reverso de las cápsulas. A los 15 d de incubación se determinaron características morfológicas: coloración de la colonia, forma de los márgenes, presencia de estromas, y formación de anillos de crecimiento. Los aislados se conservaron a –20 °C.
Extracción del ADN
Se usó el kit de aislamiento de ácidos nucleicos E.Z.N.A.® Fungal DNA Kit (Omega–Bio–Tek). El ADN de cada muestra se mantuvo congelado a –20 °C hasta su utilización.
Amplificación del ADN mediante PCR múltiplex
Para determinar la especie responsable de la infección se hizo una PCR múltiplex, según el protocolo de Malvárez et al. (2001), usando iniciadores específicos para M. fructigena (M0368–8R), M. fructicola (M0368–10R) y M. laxa combinados con un iniciador común a las tres especies (M0368–5). El iniciador específico para M. fructigena también permite amplificar M. polystroma (Côté et al., 2004b) (Cuadro 2).
Pruebas de patogenicidad de Monilinia spp. sobre manzana
Para la inoculación artificial de frutos sanos de manzana (Golden Delicious) se hizo una desinfección superficial sumergiéndolos 5 min en una solución de hipoclorito sódico al 1 % (vol: vol) y dos lavados consecutivos con agua destilada estéril. Se hizo uno o dos orificios (5 mm diámetro; 4 mm profundidad) en cada manzana donde se introdujo el inóculo procedente de un cultivo puro de Monilinia spp. de 6 d de crecimiento. Se escogieron 10 aislamientos para las inoculaciones: siete de M. laxa (M07, M10, M17, M18, M23, M25, M27) y tres de M. fructigena (M01, M05 y M20); se inocularon cuatro frutos por aislamiento y cuatro como testigo. Los frutos testigo recibieron sólo un disco de PDA estéril y las pruebas de patogenicidad se repitieron dos veces.
El material inoculado se incubó en cámara húmeda a 22 °C y con el régimen de luz citado. A las 72 y 96 h siguientes a la inoculación se calculó el diámetro de las lesiones y se observaron los síntomas de las áreas afectadas, así como la formación de micelio y el desarrollo de masas estromáticas. De los frutos inoculados se hicieron aislamientos que se incubaron a 23 °C para confirmar los Postulados de Koch (Schiffman et al., 1985).
Estadística
La diferencia entre los diámetros medios de las colonias de los aislados de Monilinia spp. se evaluó mediante análisis de la varianza a los 4 y 7 d de incubación. La prueba de la DMS (p<0.05) se usó para comparar las medias entre los diámetros. La patogenicidad de los aislados seleccionados sobre manzanas se evaluó comparando los diámetros a las 72 y 96 h con un análisis de varianza; las medias entre los diámetros se compararon con la prueba de Tukey (p<0.05).
RESULTADOS
Diámetro de crecimiento de las colonias y características morfológicas de los aislamientos
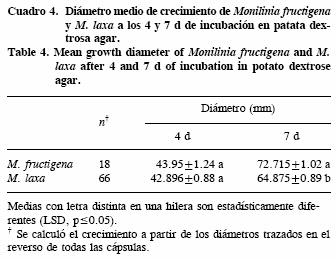
La media del crecimiento de las colonias calculada usando la media de tres diámetros a los 4 y 7 d de incubación se presenta en el Cuadro 3. El diámetro de crecimiento de las colonias de los aislados de M. fructigena varió de 41.98±0.40 mm a 46.21±0.85 mm a los 4 d de incubación, mientras que a los 7 d el crecimiento osciló entre 68.60±0.70 mm y 78.33± 0.78 mm. M. laxa tuvo un crecimiento ligeramente inferior a M. fructigena. A los 4 d de incubación los diámetros mínimo y máximo fueron 17.67±0.41 mm y 59.0±0.71 mm, y 47.0±3.08 mm y 78.67±1.08 mm a los 7 d.
La caracterización morfológica de las colonias obtenidas de las resiembras en PDA, a los 15 d de incubación, permitió diferenciar dos tipos de desarrollo miceliar: 1) colonias de color marrón grisáceo, poco prominentes, con márgenes ondulados y anillos de crecimiento más oscuros, que según los estudios moleculares correspondieron a M. laxa; 2) colonias de color crema, crecimiento uniforme y continuo, márgenes de la colonia no lobulados y abundante micelio aéreo en correspondencia con las zonas de mayor esporulación que pertenecian a M. fructigena, aunque algunos de los aislados de esta especie se asemejaban a M. laxa por su aspecto en forma de roseta y la presencia de círculos de crecimiento. La formación de abundantes masas estromáticas en M. fructigena sólo se observó en un aislamiento de M. laxa.
No hubo diferencias significativas de crecimiento (p>0.05) entre los aislados de M. fructigena y los de M. laxa a los 4 d de incubación. Sin embargo, a los 7 d el diámetro medio de los aislados de M. fructigena fue significativamente mayor(p<0.05) que el de los aislados de M. laxa (Cuadro 4).
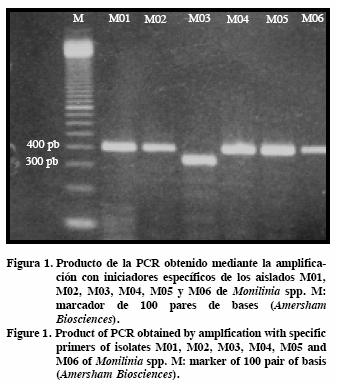
Determinación molecular de la especie mediante PCR múltiplex
Los resultados del producto de la PCR múltiplex con iniciadores específicos permitieron diferenciar dos especies de Monilinia con base en el tamaño de la banda: 1) seis de los 28 aislamientos tenían un tamaño de banda de 402 pb (Figura 1) que corresponde a M. fructigena; 2) en 22 aislamientos el tamaño de la banda fue 333 pb, correspondiente a M. laxa (Cuadro 1).
Pruebas de patogenicidad sobre manzana (Pyrus malus)
Todos los aislamientos estudiados fueron patogénicos dado que los frutos artificialmente infectados manifestaron síntomas típicos de podredumbre marrón que se observaron 24 h después de la inoculación. Se formaron lesiones pardas de tipo concéntrico alrededor de la zona inoculada que aumentaron sus dimensiones y determinaron una pudrición generalizada de la mayoría de los frutos al final del ensayo. No hubo diferencias de crecimiento entre los aislados después de 72 h de incubación (p >0.05): el diámetro de la lesión en M20 (M. fructigena) fue 3.65±0.10 cm y en M23 (M. laxa) fue 1.99±0.23 cm.
A las 96 h de la inoculación el diámetro de la zona afectada de los aislados de M. fructigena fue significativamente mayor que los de M. laxa (p<0.05). De los aislamientos estudiados el más agresivo fue M05 (Cuadro 5). Todos los frutos testigo permanecieron sanos y no se observó ningún síntoma asociado con la pudrición marrón ocasionada por las especies de Monilinia. En 70% de los frutos se desarrolló un micelio de color blanco grisáceo que empezaba en torno de la zona inoculada y se extendía gradualmente al progresar la pudrición del fruto. A las 72 h los frutos inoculados con M. fructigena desarrollaron masas compactas de micelio y conidios distribuidas por toda la superficie de la lesión (Figura 2), mientras que en los frutos inoculados con M. laxa la esporulación se desarrolló a las 96 h (Cuadro 5) y quedó limitada en torno a la zona de inoculación.

El reaislamiento del hongo usado en la inoculación permitió demostrar el cumplimiento de los Postulados de Koch, indicando que Monilinia spp. es el agente causal de la podredumbre morena.
DISCUSIÓN
La identificación de las tres especies de Monilinia y M. polystroma con base en las características morfológicas y culturales presenta dificultades dado que pueden existir diferencias cualitativas y cuantitativas de las colonias entre los aislados de una misma especie. Según Lane (2002), no hay un carácter morfológico específico que permita separar las distintas especies. En el presente estudio algunos de los aislados de M. fructigena se asemejaban a M. laxa por el aspecto de la colonia característico de esta última especie.
La tasa de crecimiento de las colonias en medios de cultivo se usa para la separación de especies. Batra (1979) estableció que M. laxa podía diferenciarse de M. fructigena y de M. fructicola por su menor tasa de crecimiento: M. fructigena tenía un crecimiento de 8 cm a los 7 d de incubación, pero el de M. laxa era sólo 4 cm a los 6 d de crecimiento. Según Sonoda et al. (1982) y Van Leeuwen y Kesteren (1998), el diámetro medio de las colonias de M. laxa era parecido al de M. fructigena a los 5 d de incubación. En el presente estudio no hubo diferencias significativas de crecimiento (p>0.05) entre los aislados de M. fructigena y los de M. laxa a los 4 d. Sin embargo a los 7 d de incubación el diámetro de los aislados de M. fructigena fue significativamente mayor que el de los de M. laxa (p<0.05).
Dado que los métodos de identificación basados en las características morfológicas y culturales no son concluyentes, es necesario usar los métodos de biología molecular. Al comparar, en el presente estudio, las características de cada aislamiento identificado por su morfología con los resultados obtenidos en la caracterización molecular, sólo 72% de los aislados inicial–mente identificados con base en la morfología y medias de crecimiento de las colonias se correspondía con los resultados obtenidos mediante la PCR con iniciadores específicos. La identificación de las especies de Monilinia usando iniciadores específicos (Malvárez et al., 2001) es una técnica útil, rápida y fiable que ha permitido determinar específicamente los aislados a partir de una única reacción de PCR. El tamaño de banda obtenido para cada aislamiento concuerda con los resultados de Côté et al. (2004b).
Las especies M. laxa y M. fructigena, de origen europeo, presentan distribución mundial, pero M. fructicola, de origen americano y frecuente en América (Malvárez et al., 2004), Japón, China (Zhu et al., 2005) y Australia, fue introducida por primera vez en Europa (Francia) en 2002 (OEPP/EPPO). Se identificó en Hungría en octubre de 2005 en frutos de melocotón importados de Italia y España (Petróczy y Palkovics, 2006). En 2006, la NPPO de España confirmó la presencia de M. fructicola en las localidades de Ivars de Noguera (Lleida, Cataluña) y de Castillonroy (Huesca, Aragón). Durante la primavera del mismo año se delimitó la zona afectada y se aplicaron las medidas fitosanitarias oportunas para erradicar dichos focos. En el presente estudio, a pesar de haberse recogido muestras de localidades relativamente próximas a las zonas afectadas (ocho muestras de la provincia de Huesca y nueve de Cataluña) no se detectó la presencia de M. fructicola. Por tanto, se considera que las medidas aplicadas lograron controlar la dispersión de la enfermedad.
CONCLUSIONES
Las dos especies de Monilinia más frecuentes en España son M. fructigena y M. laxa. Los aislados fueron caracterizados como M. fructigena (20%) y M. laxa (80%). Hubo mayor agresividad de los aislados de M. fructigena frente a los de M. laxa. Dada la reciente identificación de M. fructicola en España, específicamente en Cataluña, y al no recuperar a M. fructicola en las muestras analizadas (aunque el número de muestras fue limitado), es posible afirmar que los focos de infección de esta especie fueron puntuales y limitados y no se observa una expansión de dicha enfermedad de cuarentena.
LITERATURA CITADA
Batra, L.R. 1979. First authenticated North American record of Monilinia fructigena, with notes on related species. Mycotaxon 8: 476–484. [ Links ]
Batra, L.R. 1991. World species of Monilinia (fungi): Their ecology, biosystematics and control. Mycologia Mem. 16: 1–246. [ Links ]
Boehm, E.W.A., Z. Ma, and T.J. Michailides. 2001. Species–specific detection of Monilinia fructicola from California stone fruits and flowers. Phytopathology 91: 428–439. [ Links ]
Byrde, R. J. W., and H. J. Willetts. 1977. The Brown Rot Fungi of Fruit. Their Biology and Control. Pergamon Press. Oxford. 171 p. [ Links ]
Còté, M. J., M. Prud'homme, A. J. Meldrum, and M. C. Tardif. 2004a. Variations in sequence and ocurrence of SSU rDNA group I introns in Monilinia fructicola isolates. Mycologia 96 (2): 240–248. [ Links ]
Còté, M. J., M. C. Tardif, and A. J. Meldrum. 2004b. Identification of Monilinia fructigena, M. fructicola, M. laxa, and Monilia polystroma on inoculated and naturally infected fruit using Multiplex PCR. Plant Dis. 88: 1219–1225. [ Links ]
Förster, H., and J.E. Adaskaveg. 2000. Early brown rot infections in sweet cherry fruit are detected by Monilinia–specific DNA primers. Phytopathology 90: 171–178. [ Links ]
Fulton, C. E., and A. E. Brown. 1997. Use of SSU rDNA group–I intron to distinguish Monilinia fructicola from M. laxa and M. fructigena. FEMS Microbiol. Letters 157: 307–312. [ Links ]
Hughes, K. J. D., C. E. Fulton, D. McReynold, and C. R. Lane. 2000. Development of new PCR primers for idenfication of Monilia species. Bull. OEPP/EPPO 30: 507–511. [ Links ]
Ioos, R., and P. Frey 2000. Genomic variation within Monilinia laxa, M. fructigena and M. fructicola, and application to species identification by PCR. Eur. J. Plant Pathol. 106: 373–378. [ Links ]
Lane, C.R. 2002. A synoptic key for differentiation of Monilinia fructicola, M. fructigena and M. laxa, based on examination of cultural characters. Bull. OEPP/EPPO 32: 489–493. [ Links ]
Majer, D., R. Mithen, B. G. Lewis, P. Vos, and R. P. Oliver. 1996. The use of AFLP fingerprinting for the detection of genetic variation in fungi. Mycol. Res. 100: 1107–1111. [ Links ]
Malvárez, G., A. Rodríguez, C. Aguilar, E. Silvera, y P. Mondino. 2001. Identificación de especies de Monilinia spp en aislamientos obtenidos de Prunus spp por PCR con primers específicos. Agrociencia V(1): 48–53. [ Links ]
Malvárez, G., A. Rodríguez, C. Aguilar, A.C. Silveira, E. Silvera, J. Bargueño, y P. Mondino, 2004. Monilinia fructicola, única especie presente ocasionando la podredumbre morena del duraznero (Prunus persica) en Uruguay. Fitopatología 39 (3): 126–132. [ Links ]
Petróczy, M., and L. Palkovics, 2006. First report of brown rot caused by Monilia fructicola on imported peach in Hungary. Plant Dis. 90: 375. [ Links ]
Ogawa, J. M. and W. H. English. 1960. Relative pathogenicity of two brown rot fungi, Sclerotinia laxa and Sclerotinia fructicola, on twigs and blossoms. Phytopathology 50: 550–558. [ Links ]
Schiffman, N. M., H. Michaely, G. Zauberman, and I. Chet. 1985. Physiological changues ocurring in picket climateric fruit with different pathogenic fungi. J. Phytopathol. 113: 227–284. [ Links ]
Snyder, C. L., and A. L. Jones. 1999. Genetic variation between strains of Monilinia fructicola and Monilinia laxa isolated from cherries in Michigan. Can. J. Plant Pathol. 21: 70–77. [ Links ]
Sonoda, R. M., J. M. Ogawa, and B. T. Manji. 1982. Use of interactions of cultures to distinguish Monilinia laxa from M. fructicola. Plant Dis. 66: 325–326. [ Links ]
Van Leeuwen, G. C. M., and H.A. Kesteren. 1998. Delineation of the three brown rot fungi of fruit crops (Monilinia spp.) on the basis of quantitative characteristics. Can. J. Bot. 76 (12): 2042– 2050. [ Links ]
Welsh, J., and M. McClelland. 1990. Fingers–printing genomes using PCR with arbitrary primers. Nucleic Acids Res. 18: 7213–7218. [ Links ]
Williams, J. G. K., A. R. Kubelik, K. J. Livak, J. A. Rafalski, and S. V. Tingey. 1990. DNA polymorphims amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Res. 18: 6531–6535. [ Links ]
Zhu, X. Q., X. Y. Chen, Y. Luo, and L. Y. Guo. 2005. First report of Monilinia fructicola on peach and nectarine in China. Plant Pathol. 54: 575. [ Links ]














