Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.1 Texcoco ene./feb. 2008
Agua–suelo–clima
Materia orgánica en tepetate bajo cultivo de higuera y pasto, acondicionado con estiércol y fertilizante
Organic matter in tepetate cultivated with fig tree and grass, amendmented with manure and fertilizer
Alma S. Velázquez–Rodríguez1, David Flores–Román2, Jorge D. Etchevers–Barra3 y Norma E. García–Calderón4
1 Universidad Autónoma del Estado de México. Instituto Literario 100. Colonia Centro. 50 000. Toluca, Estado de México. México. (almaver22@hotmail.com).
2 Instituto de Geología. Universidad Nacional Autónoma de México. Ciudad Universitaria. 04510. Coyoacán, México, D.F. (davidf@servidor.unam.mx).
3 Edafología. Campus Montecillo. Colegio de Postgraduados. 56230. Montecillo, Estado de México. (jetchev@colpos.mx).
4 Facultad de Ciencias. Universidad Nacional Autónoma de México. Ciudad Universitaria. 04510. Coyoacán, México, D.F. (negc@hp.fciencias.unam.mx)
Recibido: Octubre, 2006.
Aprobado: Noviembre, 2007.
Resumen
Las plantas y enmiendas aumentan la calidad de los tepetates una vez que se han roturado estas capas duras, abundantes en el Eje Neovolcánico Mexicano. En el tepetate, que posee estructura masiva y carece de reservas orgánicas, la adición de materia orgánica (MO) ha mostrado un efecto significativo en la fertilidad al aportar N y P, esenciales para el desarrollo de biota, al tiempo que favorece una estructuración estable. Aunque se sabe que la calidad del suelo se relaciona con la naturaleza de los compuestos orgánicos, son escasos los estudios acerca de los componentes básicos de la MO, una vez que se ha incorporado a capas duras como el tepetate. El objetivo del presente estudio fue cuantificar el carbono orgánico total, polisacáridos, ácidos húmicos y ácidos fúlvicos, aportados al tepetate por cultivo de higuera (Ficus carica L.) y pasto Rhodes (Chloris gayana Kunth), con adición de estiércol bovino y fertilizante, por dos años. El experimento se realizó en invernadero, con tepetate tipo duripán. Se aplicó el equivalente a 72 Mg ha–1 de bovino por unidad experimental y dosis de fertilización de 80–80–20 para higuera y 250–200–00 para pasto. El estiércol duplicó el contenido de carbono orgánico del tepetate desde los primeros meses de aplicación. El fertilizante influyó en la producción de polisacáridos. Las plantas, con y sin enmiendas, propiciaron un aumento de hasta 100% de carbono orgánico y polisacáridos. Los ácidos húmicos y fúlvicos no se modificaron por los tratamientos. El mayor contenido de carbono y polisacáridos fue a los 12 meses.
Palabras clave: Carbono orgánico, humus, polisacáridos, tepetates
Abstract
Plants and amendments increase quality of the tepetates once these hard layers, abundant in the Mexican Volcanic Belt, have been rototilled. In tepetate, which has a mass structure and lacks organic reserves, the addition of organic matter (OM) has proven to have a significant effect on fertility by supplying N and P, essential for the development of biota, and which promotes a stable structurization. Although it is known that soil quality is related to the nature of the organic compounds, there are few studies referring to the basic compounds of OM, once it has been incorporated into hard layers such as tepetate. The objective of the present study was to quantify the total organic carbon, polysaccharides, humic acids and fulvic acids, supplied to the tepetate by cultivation of fig (Ficus carica L.) and Rhodes grass (Chloris gayana Kunth), with the addition of bovine manure and fertilizer, for two years. The experiment was conducted in the greenhouse with duripán tepetate. The equivalent of 72 Mg ha–1 of manure was applied per experimental unit and fertilization dose of 80–80–20 for fig and 250–200–00 for grass. The manure doubled the organic carbon content of the tepetate from the first months of application. The fertilizer influenced the production of polysaccharides. The plants, with and without amendments, provided an increase of as much as 100% of organic carbon and polysaccharides. The humic and fulvic acids were not modified by the treatments. The highest content of carbon and polysaccharides was at 12 months.
Key words: Organic carbon, humus, polysaccharides, tepetates
INTRODUCCIÓN
El carbono orgánico es indispensable para el crecimiento de plantas y el establecimiento de biota, ya que interviene en todos los procesos estructurales y metabólicos de los seres vivos (McCarthey et al., 1997). Los polisacáridos aumentan la fertilidad por ser compuestos fácilmente asimilables por las plantas y la biota; además, participan activamente en la agregación al formar enlaces transitorios con la fracción mineral (Guggenberger y Zech, 1994; Brimecombe et al., 2001). La fracción húmica es un importante reservorio de nutrientes dado que consiste de coloides con carga superficial y establece enlaces permanentes con las partículas minerales, formando agregados altamente estables (Crowley, 2001; Varanini y Pinton, 2001).
Los tepetates, capas duras de origen piroclástico que ocupan 30 700 km2 en el Eje Neovolcánico Mexicano, presentan baja porosidad efectiva (menor al 40%) por su estructura masiva y bajo contenido de materia orgánica, nitrógeno y fósforo. Lo anterior se debe a que son horizontes subsuperficiales que quedan expuestos al perderse la capa fértil que los cubre (Quantin et al., 1992; Zebrowski, 1992; Etchevers et al., 2004).
Como resultado de la casi nula reserva de compuestos orgánicos del tepetate, la actividad biológica, el establecimiento de especies vegetales, el crecimiento radical y la dinámica de los ciclos biogeoquímicos es limitada. La roturación y la compensación de las carencias nutrimentales del tepetate permiten establecer plantas de importancia económica o ecológica en estas capas y, a mediano plazo, propicia la formación de suelo.
La roturación aumenta la macro porosidad (Prat et al., 1997), lo que favorece la infiltración, el intercambio gaseoso y el desarrollo de raíces. Los fertilizantes suplen la deficiencia de P y N y se usan para complementar la aplicación de abonos orgánicos (Etchevers et al., 1992; Pérez et al., 2000), pero se lixivian rápidamente y pueden afectar negativamente las propiedades químicas del tepetate. Al respecto, Acevedo et al. (2001) y Velázquez et al. (2001) observaron una ligera acidificación del tepetate, como resultado del uso de fertilizantes. En contraste, los estiércoles y abonos verdes, liberan suficientes nutrimentos para mantener un cultivo, favorecen la estructuración, la estabilidad de los agregados y la dinámica de la biota (Pérez et al., 2000; Acevedo et al., 2001; Flores et al., 2004).
Además las plantas tienen una influencia significativa sobre las características del tepetate: disgregan y agregan el material, y aportan compuestos orgánicos al sustrato susceptibles de ser usados por la biota o en procesos de estructuración (Velázquez et al., 2001). Sin embargo, hay pocos estudios sobre los componentes básicos de la materia orgánica, una vez que se ha incorporado al tepetate. Su conocimiento permitiría anticipar su efecto en las características físicas, químicas y biológicas de estas capas y mejorar las técnicas de manejo.
El objetivo de la presente investigación fue evaluar la cantidad de carbono, polisacáridos, ácidos húmicos y ácidos fúlvicos, aportados al tepetate por el cultivo de higuera (Ficus carica L.) y pasto Rhodes (Chloris gayana Kunt), con adición de estiércol bovino y fertilizante inorgánico, durante dos años.
MATERIALES Y MÉTODOS
La investigación se realizó en el invernadero del Instituto de Geología de la UNAM, con tepetate tipo duripán, recolectado en Tetela del Volcán, Estado de Morelos, México (18°51' 34.3" N y 98° 44' 16.6" O), a una altitud de 2127 m. En esta zona existen amplias superficies donde afloran tepetates tipo duripán cuya habilitación sería de gran beneficio para los productores agrícolas.
El tepetate se caracterizó como un duripán color pardo amarillento en seco (10YR6/4) y pardo amarillento oscuro en húmedo (10YR4/4), densidad real 2.3 Mg nr3, densidad aparente 1.7 Mg nr3, dureza 24 kg cm–2 y clase textural franca (50, 27 y 23% de arena, limo y arcilla). El pH fue 7.1, la materia orgánica 0.3%, la capacidad de intercambio catiónico 22.7 cmol+kg–1, las bases intercambiables para Ca2+, Mg2+, Na+ y K+ fueron 11.5, 7.2, 1.3 y 1.0 cmol+ kg–1 y la saturación de bases 92.5%. El contenido de carbono, ácidos húmicos y fúlvicos fue 1.9, 0.55 y 1.0 g kg"1 de suelo y el de polisacáridos 0.45% de glucosa.
El tepetate se roturó y tamizó, seleccionándose la fracción de 2 a 20 mm de diámetro que son un tamaño adecuado para el manejo del tepetate (Velázquez et al., 2001; Etchevers et al., 2004; Flores et al., 2004); los fragmentos se colocaron en macetas de plástico sin perforaciones (5 kg por maceta). Las plantas usadas fueron higuera (Ficus carica L), que es un frutal de interés en la zona de estudio, y pasto Rhodes (Chloris gayana Kunt) por el efecto de las gramíneas en la recuperación y habilitación de capas duras (Márquez et al., 1992; Acevedo et al., 2001; Flores et al., 2004). Las plantas de higuera (1 año edad) fueron proporcionadas por el Vivero Nezahualcoyotl, de la Ciudad de México. Para el pasto, se establecieron almácigos en el invernadero.
Se seleccionó estiércol bovino como enmienda orgánica debido a su fácil obtención y bajo costo en la zona de estudio. Se aplicó en una dosis equivalente a 72 Mg ha–1, tomando como base la dosis (40 Mg ha–1) usada en tepetates tipo fragipán cuyo contenido de MO es casi el doble del de el duripán del presente estudio (Acevedo et al., 2001; Flores et al., 2004). Como enmienda inorgánica se usó sulfato de amonio, superfosfato de calcio simple y cloruro de potasio, en cantidades equivalentes a 80–80–20 para higuera y 250–200–00 para pasto, de acuerdo con las dosis usadas para higuera en la zona de estudio y considerando las recomendadas para pastos (Bogdan, 1977).
El trasplante de las especies vegetales a las macetas con tepetate acondicionado con las enmiendas, se hizo a raíz desnuda. La unidad experimental para higuera fue una planta por maceta, y, para pasto, tres macollos. Se colocó una serie de unidades experimentales para el estudio a 12 meses y otra para el estudio a 24 meses.Al término de cada periodo de observación se cortó la parte aérea de la planta desde la base y se sacó el tepetate de la maceta; cuidadosamente se retiraron las raíces y el sustrato se secó al aire. Para los análisis se tomó una muestra representativa de cada maceta, molida y tamizada a malla 100.
El carbono orgánico se midió por el método de oxidación con dicromato de potasio (Nelson y Sommers, 1996); los polisacáridos totales por la técnica del ácido–fenol–sulfúrico (Ivarson y Sowden, 1962; Whistler y Wolfrom, 1962). La fracción húmica total se extrajo con una solución de NaOH y Na4P2O7 1M (Kononova, 1982); los ácidos húmicos se separaron de los fúlvicos por precipitación con ácido sulfúrico 1:1 hasta pH 1.5. Las dos fracciones se evaluaron mediante espectroscopía visible–UV.
El diseño experimental fue completamente al azar con un arreglo factorial de tratamientos y cuatro repeticiones. La unidad experimental fue una planta de higuera por maceta y tres de pasto. El experimento duró dos años divididos en etapas de 12 meses (E2, E3), más una etapa representativa del tiempo cero (E1). Se establecieron 12 tratamientos y un testigo, constituido sólo por fragmentos de tepetate (Cuadro 1). Se hicieron análisis de varianza y pruebas de comparación de medias de Tukey (p<0.05) con el paquete JMP.
RESULTADOS Y DISCUSIÓN
Las plantas tuvieron una influencia significativa (p<0.05) en el contenido de carbono orgánico (CO) del tepetate y su interacción con las enmiendas modificó el de ácidos fúlvicos. Los demás factores y sus interacciones tuvieron un efecto altamente significativo (p<0.01)en las diferentes fracciones orgánicas.
El CO del tepetate aumentó en una unidad (p<0.01) por la simple aplicación de estiércol (E2 y E3) y estiércol con fertilizante (E3). Para los tratamientos con planta, el aporte de CO fue significativamente mayor en ambas especies cuando el sustrato se acondicionó con estiércol, manteniéndose constante el incremento hasta E3 (Figura 1). El fertilizante en combinación con el estiércol, provocó un incipiente aumento de carbono en E2, pero una disminución en E3.

El contenido de polisacáridos aumentó en tres unidades cuando se acondicionó el tepetate con las dos enmiendas. Con las plantas se triplicó el porcentaje de polisacáridos en los tratamientos con estiércol y estiércol con fertilizante. Dicho incremento se presentó de E1 a E2 y de E2 a E3 con HEF y PEF, pero hubo una disminución de E2 a E3 en HE y PE (Figura 2).
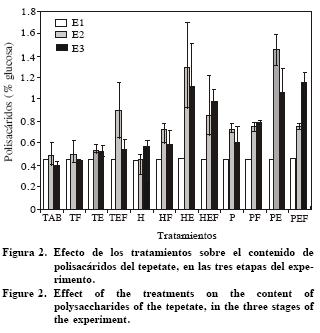
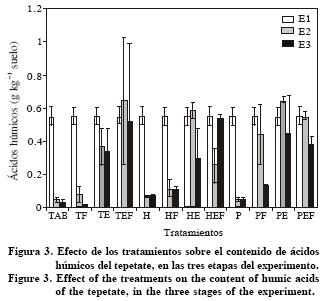
Los ácidos húmicos y fúlvicos disminuyeron durante los dos periodos y con los distintos tratamientos (p<0.01), excepto aquellos con estiércol y estiércol con fertilizante donde el contenido no fue estadísticamente diferente al inicial. El fertilizante y las plantas no influyeron en esta fracción (Figuras 3 y 4).

De acuerdo con los resultados, las enmiendas y plantas provocaron un aumento de carbono orgánico y polisacáridos en el tepetate, sin afectar la fracción húmica. En el presente estudio aumentó el CO en 150% en dos años, debido a la adición de estiércol. El porcentaje de CO fue mayor al reportado por Pérez et al. (2000) y Báez et al. (2002), para tepetates tipo fragipán acondicionados con estiércol en invernadero o con labranza cero y diferentes cultivos. De acuerdo con esos autores, condiciones controladas de humedad y temperatura, así como el poco movimiento del sustrato, favorecen la acumulación de CO, lo que explica su acumulación en el tepetate.
Sin embargo, es importante considerar que el tepetate usado en el presente estudio fue tipo duripán, por lo que su dureza es mayor y menor la porosidad efectiva, lo que debió limitar considerablemente la alteración del estiércol. La acumulación de CO superior a la esperada sugiere que no hubo interrupción en los procesos de transformación, lo que presumiblemente se debió al tamaño de los fragmentos. De acuerdo con Acevedo et al. (2001), Velázquez et al. (2001) y Flores et al. (2004), los fragmentos de 2 a 5 mm, que predominaban en las macetas, favorecen la existencia de espacios de tamaño óptimo para el movimiento de agua y el aire, así como para el establecimiento de biota, factores esenciales en la transformación de la materia orgánica.
Respecto a los polisacáridos el estiércol sólo modificó su contenido en TEF, lo cual pudo deberse a que menos del 25% de los productos de su descomposición, corresponde a azúcares simples y hemicelulosa (Guggenberger y Zech 1994). El cambio significativo se presentó con el estiércol, pero en asociación con las especies vegetales.
Las plantas, sin enmiendas, aumentaron el CO (50%) y los polisacáridos (75%); con adición de estiércol y estiércol con fertilizante, el incremento fue superior al 100% en ambos casos. Cuando el tepetate se acondicionó, una parte del CO y de los polisacáridos presumiblemente se originaron de la descomposición del estiércol, como ya se explicó. Sin embargo, el incremento en los tratamientos sin enmiendas apunta a que las plantas, por sí mismas, aportaron compuestos orgánicos al sustrato. En la interfase suelo–planta, la fuente principal de polisacáridos al suelo son los compuestos de rizo deposición de las plantas, que son azúcares y gomas poliurónicas de bajo peso molecular (Varanini y Pinton, 2001).
Tanto el CO como los polisacáridos aumentaron con el tiempo en HEF y PEF, pero disminuyeron en HE y PE durante el segundo año. Esto se explica porque durante la etapa de crecimiento activo el metabolismo vegetal es máximo, así como la rizo deposición (Brimecombe et al., 2001). En el segundo año ocurrió la floración y fructificación de las plantas, procesos que requieren mayor energía, por lo que la liberación de compuestos radicales presumiblemente disminuyó. Además, el aporte nutrimental de los residuos orgánicos a los tepetates es insuficiente para cubrir la demanda nutrimental de los cultivos (Pérez et al., 2000). Por tanto, si no hay un aporte constante de materia orgánica, la acumulación disminuye significativamente.
Contrario a lo esperado, no hubo diferencias entre plantas. En otros estudios en suelo y algunos en tepetate (Neumann y Römheld, 2001; Báez et al., 2002; Flores et al., 2004) se observó que la tasa de rizo deposición depende de la morfología de la raíz. Sin embargo, los resultados del presente estudio sugieren que más que la morfología radical, la acumulación de CO y polisacáridos estuvo determinada por la permanencia de la materia orgánica en el sustrato, ya que, no obstante la baja durabilidad de los polisacáridos en el suelo (Guggenberger y Zech 1994), su acumulación en el tepetate fue significativa.
La permanencia de los polisacáridos probablemente fue favorecida por la arcilla (23%) y amorfos de sílice (4.5% SiO2 como óxidos libres) del tepetate que, como se ha observado en algunos suelos (Guggenberger y Zech, 1994), pueden tener un efecto protector. Aunque es sólo un supuesto es interesante considerarlo, porque los amorfos son componentes que pueden influir en las características del tepetate si cambios de pH, temperatura, humedad o la alteración biológica, favorecen su disolución.
El contenido de ácidos húmicos y fúlvicos del tepetate no aumentó por efecto de los tratamientos debido probablemente a su baja tasa de síntesis, ya que sólo 5 a 10% del CO de un suelo llega a formar parte del humus (Stevenson, 1982; Labrador, 1998). Además, la formación de ácidos húmicos y fúlvicos es un proceso lento porque ocurre a partir de la fracción más recalcitrante de la materia orgánica (Brimecombe et al., 2001; Neumann y Römheld, 2001). La disminución observada de E1 a E2 puede atribuirse a que la roturación deja expuesto el humus asociado a la fracción mineral, poniéndolo a disposición de la biota (Ferrera et al., 1997). Estos resultados coinciden con lo observado en otros tepetates (Báez et al., 2002; Pérez et al., 2000). Sin embargo, difieren de éstos porque en el presente estudio el contenido inicial se mantuvo constante en HE, HEF, PE y PEF, lo que sugiere que el tepetate tipo duripán, tendría características que favorecen la acumulación de materia orgánica.
El fertilizante no influyó en la fracción orgánica del tepetate. Sin embargo, al aplicarse junto con el estiércol, propició un aumento de CO y polisacáridos. Lo anterior puede explicarse si se considera que el fertilizante es una fuente directa de nutrimentos que satisface los requerimientos de plantas y biota, evitando el consumo inmediato de la fracción orgánica, con lo que se favorece su permanencia en el sustrato.
CONCLUSIONES
El cultivo de higuera y pasto Rhodes, así como la adición de estiércol bovino, favorecieron un incremento de 150% en el contenido de carbono orgánico del tepetate y de 100% en el de polisacáridos. El contenido de ácidos húmicos y fúlvicos no fue diferente al inicial cuando se adicionaron estiércol y fertilizante; sin embargo, disminuyó en más de 80% cuando se mantuvo sin enmiendas. El fertilizante favoreció la acumulación de CO al satisfacer las necesidades nutrimentales de plantas y biota, retrasando el consumo de los compuestos orgánicos y permitiendo su acumulación en el tepetate.
AGRADECIMIENTOS
A la Dirección General de Asuntos del Personal Académico (DGAPA) de la UNAM, por el apoyo económico brindado, a través del Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), para la realización de la investigación.
LITERATURA CITADA
Acevedo, S. O. A., A. S. Velázquez R., y D. Flores R. 2001. Agregación por especies vegetales y abonos orgánicos en tepetates fracturados bajo condiciones de invernadero. TERRA Latinoamericana 19 (4):363–373. [ Links ]
Báez, P. A., J. D. Etchevers B., C. Hidalgo M., C. Prat, V. Ordaz Ch., y E. Núñez R. 2002. C Orgánico y P Olsen en tepetates cultivados de México. Agrociencia 36 (6):643–653. [ Links ]
Bogdan, A. V. 1977. Tropical Pasture and Fodder Plants (Grasses and Legumes). Longman. London, U. K. 475 p. [ Links ]
Brimecombe, M. J., F. A. De Leij, and J. M. Lynch. 2001. The effect of root exudates on rhizosphere microbial populations. In: Pinton R., Z. Varanini, and P. Nannipieri (eds). The Rhizosphere. Biochemistry and Organic Substances at the Soil–Plant Interface. Marcel Dekker Inc. New York, USA. pp: 95–140. [ Links ]
Crowley, D. 2001. Function of siderophores in the plant rhizosphere. In: Pinton R., Z. Varanini, and P. Nannipieri (eds). The Rhizosphere. Biochemistry and Organic Substances at the Soil–Plant Interface. Marcel Dekker Inc. New York, USA. pp: 223–261. [ Links ]
Etchevers, J., C. Zebrowzki, C. Hidalgo, y P. Quantin. 1992. Fertilidad de los tepetates: II. Situación del fósforo y el potasio en tepetates de México y Tlaxcala. TERRA Latinoamericana 10:386–391. [ Links ]
Etchevers, J., C. Hidalgo, C. Prat, y P. Quantin. 2004. Enciclopedia of Soil Science. DOI: 10 1081/E–ESS–120017323. Marcel Dekker Inc. N.Y., New York. pp: 1745–1749. [ Links ]
Ferrera, C. R., A. Ortiz, J. Delgadillo, y S. Santamaria. 1997. Uso de la materia orgánica en la recuperación de tepetates y su influencia en los microorganismos. In: Suelos Volcánicos Endurecidos. Zebrowski C., P. Quantin y G. Trujillo (eds.). Quito, Ecuador. pp: 225–227. [ Links ]
Flores, S. D., M. A. Pérez O., y H. Navarro G. 2004. Rehabilitación agroecológica de suelos volcánicos endurecidos, experiencias en el Valle de México. LEISA. Rev. Agroecol. (19): 24–27. [ Links ]
Guggenberger, G., and W. Zech. 1994. Composition and dynamics of dissolved carbohydrates and lignin–degradation products in two coniferous forests N. E. Bavaria, Germany. Soil Biol. Biochem. 26 (1):19–27. [ Links ]
Ivarson, K. C., and F. J. Sowden. 1962. Methods for the analysis of carbohydrate material in soil. I. Colorimetric determination of uronic acids, hexoses and pentoses. Soil Sci. 94:245–250. [ Links ]
Kononova, M. N. 1982. Materia Orgánica del Suelo. Su Naturaleza, Propiedades y Métodos de Investigación. OIKOS–TAU. Barcelona, España. 365 p. [ Links ]
Labrador, M. J. 1998. La Materia Orgánica en los Agrosistemas. Ministerio de Agricultura, Pesca y Alimentación. Mundi–Prensa. Madrid, España. 174 p. [ Links ]
McCarthey, D. A., B. R. Stinner, and P. J. Bohlen. 1997. Organic matter dynamics in maize agroecosystems as affected by earthworm manipulations and fertility source. Soil Biol. Biochem. 29 (3/4):397–400. [ Links ]
Nelson, D. W., and L. E. Sommers. 1996. Total carbon, organic carbon and organic matter. In: Sparks, D. L. (ed.). Methods of Soil Analysis. Part 3. Chemical Methods. American Society of Agronomy and Soil Science Society of America. Book Series: 5. Madison, Wisconsin, USA. 1390 p. [ Links ]
Neumann, G., and V. Römheld. 2001. The release root exudates as affected by the plant's physiological status. In: Pinton R., Z. Varanini, and P. Nannipieri (eds). The Rhizosphere. Biochemistry and Organic Substances at the Soil–Plant Interface. Marcel Dekker Inc. New York, USA. pp: 41–94. [ Links ]
Pérez, O. M. A., J. D. Etchevers, H. Navarro G., y R. Núñez E. 2000. Aporte de los residuos del cultivo anterior al reservorio de nitrógeno en tepetates. Agrociencia 34:115–125. [ Links ]
Prat, C., A. Báez, y A. Márquez. 1997. Erosión y escurrimiento en parcelas de tepetate t3 en Texcoco, México. In: Zebrowski C., P. Quantin, y G. Trujillo (eds). Suelos Volcánicos Endurecidos. Quito, Ecuador. pp: 371–383. [ Links ]
Quantin, P., C. Zebrowski, y C. Hidalgo. 1992. El material original de los tepetates t2 y t3 de la región de Texcoco (México): ¿loess o cineritas? TERRA Latinoamericana 10: 178–182. [ Links ]
Stevenson, F. J. 1982. Humus Chemistry. Genesis, Composition, Reactions. John Wiley and Sons, Inc. New York, U.S.A. 440 p. [ Links ]
Varanini, Z., and R. Pinton. 2001. Direct versus indirect effects of soil humic substances on plant growth and nutrition. In: Pinton R., Z. Varanini, and P. Nannipieri (eds). The Rhizosphere. Biochemistry and Organic Substances at the Soil–Plant Interface. Marcel Dekker Inc. New York, USA. pp: 141–158. [ Links ]
Velázquez, R. A. S., D. Flores R., y O. A. Acevedo S. 2001. Formación de agregados en tepetate por influencia de especies vegetales. Agrociencia 35 (3):311–320. [ Links ]
Whistler, R. L., and M. L. Wolfrom. 1962. Methods in Carbohydrate Chemistry. Vol. I. Academic Press. London. 390 p. [ Links ]
Zebrowski, C. 1992. Los suelos volcánicos endurecidos en América Latina. TERRA Latinoamericana 10: 15–23. [ Links ]














