Introducción
Frutas, vegetales y plantas son fuentes ricas en compuestos químicos con el potencial de prevenir enfermedades crónicas, el valor medicinal de las plantas y frutas radica en las sustancias químicas contenidas en ellas, que producen una determinada acción fisiológica en el cuerpo humano (Al-matani, Said Al-Wahaibi & Amzad-Hossain, 2015). La hipertensión es uno de los mayores factores de riesgo asociados con la mortalidad en todo el mundo, que representa más de la mitad de todos los casos de las enfermedades cardiovasculares (Bhagani, Kapil & Lobo, 2018). La inhibición de la enzima convertidora de angiotensina (ECA) es un importante enfoque terapéutico empleado en el tratamiento de la presión arterial alta. Esta enzima es una metalopeptidasa dependiente de zinc que convierte la angiotensina I en angiotensina II (octapéptido vasoconstrictor), por lo que aumenta la presión arterial. La ECA también promueve la degradación de la bradicinina que funciona como un vasodilatador y regula el estrés oxidativo (Chakraborty & Roy, 2021). Los fitoquímicos con potencial antioxidante contenidos en frutas, como los compuestos fenólicos, brindan efectos protectores a la salud, ya que tienen la capacidad de reducir las consecuencias del estrés oxidativo, que originan el desarrollo de enfermedades como la hipertensión y el proceso de envejecimiento (Álvarez-Suarez et al., 2014; Rocha da Costaet al., 2023). El membrillo (Cydonia oblonga Miller) es una fuente importante de compuestos con efectos positivos a la salud, debido a sus propiedades antioxidantes, antimicrobianas, anticarcinogénicas y antiulcerosas (Stojanovic et al., 2017). Los frutos de membrillo no son muy apreciados plenamente como productos frescos debido a su dureza, lo fibroso de la pulpa, amargor y sobre todo por su astringencia, pero una vez maduros son muy demandados para la elaboración de mermeladas, jaleas y licores (Szychowski, et al., 2018). En México su producción supera las cinco mil 100 toneladas, siendo Durango, Jalisco, y Zacatecas los líderes productores, en conjunto concentran el 77 por ciento del total nacional (SIAP, 2021). Por lo tanto el objetivo fue cuantificar e identificar el contenido de compuestos fenólicos del membrillo cultivado en Zacatecas y analizar su potencial hipertensivo, ya que no se ha realizado anteriormente, esto proporcionara datos para su posible uso industrial, empleándolo como harina funcional, es importante identificar frutas que podrían ser una fuente importante de metabolitos para el desarrollo de fármacos (antioxidante y antihipertensivos) o alimentos nutracéuticos y así cumplir los deseos del consumidor a través de frutas con beneficios para la salud
Materiales y métodos
Frutos maduros de membrillo (Cydonia oblonga Miller) de un productor local fueron colectados en el municipio de Rio Grande, Zacatecas, México (23° 49′ 2″ N 103° 02′ 10″ O) en el mes de septiembre 2020. Las condiciones climáticas son semiárido cálido, con una temperatura media anual de 17.1 °C, con una altura de 1857 m. s. n. m., el material vegetal se cortó en rodajas y se deshidrató en un horno de aire forzado hasta alcanzar una humedad del 15% (Precision DN Instruments, Model -43) a 35°C por 48 h, la humedad se determinó de acuerdo al método 925.098, de la AOAC (1999). Los frutos secos fueron molidos (UD Cyclone Sample Mill, UD Corp., Boulder, CO) hasta pasar por una malla 80-US (0.180 mm), y empacados en bolsas de plástico. La harina resultante contenía todas las partes anatómicas del fruto, pulpa y cáscara con excepción de las semillas. La harina obtenida fue almacenada en bolsas de polietileno con sello hermético a −20 °C y en oscuridad para evitar la degradación de fitoquímicos.
Extracción de fitoquímicos
La fracción libre que no está unida a la pared celular de fitoquímicos en membrillo fue extraída de acuerdo con Adom & Liu (2002). Se pesaron 0.5 g de harina y se mezclaron con 10 mL de metanol al 80% (80:20, v/v); esta suspensión se homogenizó en un agitador rotatorio (OVAN noria R, EUA, 2010) por 10 min, y fue centrifugada a 3000 x g a 10 °C durante 10 min. El sobrenadante se colocó en tubo nuevo y se concentró al vacío a 35 °C (Speed Vac Concentrator, Thermo Electron Corporation) hasta alcanzar un volumen final de 2 mL.
Determinación de flavonoides
En una placa de 96 celdas, se agregaron 20 µL del extracto, se agregaron 80 µL de agua destilada y 6 µL de NaNO2 al 5% (p/v) y se dejó reposar por 5 minutos. Posteriormente fueron adicionados 12 μL de AlCl3 al 10% (p/v), 10 μL de NaOH 1M y 20 µL de agua destilada. Después de 30 min de reposo la absorbancia fue determinada a 510 nm (Synergy TM HI, Multi-Detection, Biotek, Inc., Winooski, VT, EUA), se empleó catequina (25 ppm a 300 ppm) como estándar (99%, Sigma Chemical Co.) y el contenido de flavonoides fue expresado como mg equivalentes de catequina (mg EC)/100 g de muestra en base seca (bs), esto al restar la humedad de la harina, las determinaciones se realizaron por triplicado (Adom & Liu, 2002).
Determinación de taninos condensados
Debido a su estructura polimérica y para su mejor extracción, ya que se tienen que separar de la pared celular y fraccionar la molécula polimérica, esto se aclara en el apartado de discusión, no se emplearon los extractos de fitoquímicos obtenidos anteriormente. 1 g de harina de membrillo se mezcló con 10 ml de acetona (80:20, v/v). A 20 μL de este extracto, se adicionaron 1200 μL de una solución de vainillina al 4% (p/v) en metanol (99.5%) y 600 μL de HCl concentrado, se dejaron en reposo durante 15 min a temperatura ambiente. Se empleó catequina (50 μg/ml a 1000 μg/ml). como estándar (99%, Sigma Chemical Co.) y se midió la absorbancia a 500 nm (Synergy TM HI, Multi-Detection, Biotek, Inc., Winooski, VT, EUA). Los resultados se calcularon y expresaron como mg equivalentes de catequina (mg EC)/100 g (bs). Las determinaciones se realizaron por triplicado (Xu & Chang, 2007).
Determinación de Cumarinas
Las cumarinas son un compuesto sólido y cristalino con una temperatura de fusión de 69 a 73 °C, por lo que es importante no emplear altas temperaturas, en su extracción y sobre todo cuando se fabrican harinas de los frutos de donde se obtienen (Santos & Silva, 2008), en nuestro caso la temperatura empleada para la elaboración de la harina de membrillo fueron 35 °C. Para determinar el contenido de cumarinas, en las harinas de membrillo, se mezclaron 24 mg de harina en 50 mL de una solución metanol/agua (80:20). Una segunda dilución se realizó tomando una alícuota de 8 mL de la solución stock en 25 mL de la solución metanol/agua (80:20), obteniendo una concentración final teórica de 153.6 μg/mL. Las lecturas se realizaron en un espectrofotómetro (Synergy HT, Biotek Instrument), a una longitud de onda de 275 nm. Se preparó una curva de calibración tomando como estándar de cumarina, la 2H-1-benzopirano-2-ona de Fluka (Sigma-Aldrich) y los resultados fueron expresados como mg equivalentes de cumarina (mg ECU)/100 g (bs), las mediciones se realizaron por triplicado (Soares e Silva et al., 2012).
Determinación de compuestos fenólicos totales
En una placa de 96 celdas, se agregaron 20 µL del extracto. Se mezclaron con 180 µL del reactivo de Folin Ciocalteu (Sigma-Aldrich, St. Louis, MO), la reacción se neutralizó con 50 µL Na2CO3 al 7% y posteriormente se dejó reposar por 90 min. Se empleó ácido gálico como estándar (Sigma Chemical Co.) y se midió la absorbancia a 750 nm (Synergy TM HI, Multi-Detection, Biotek, Inc., Winooski, VT, EUA), el contenido de fenólicos totales fue expresado como mg equivalentes de ácido gálico (mg EAG)/100 g (bs), las determinaciones se realizaron por triplicado (Singleton, Orthofer, & Lamuela-Raventós, 1999).
Determinación del perfil de compuestos fenólicos
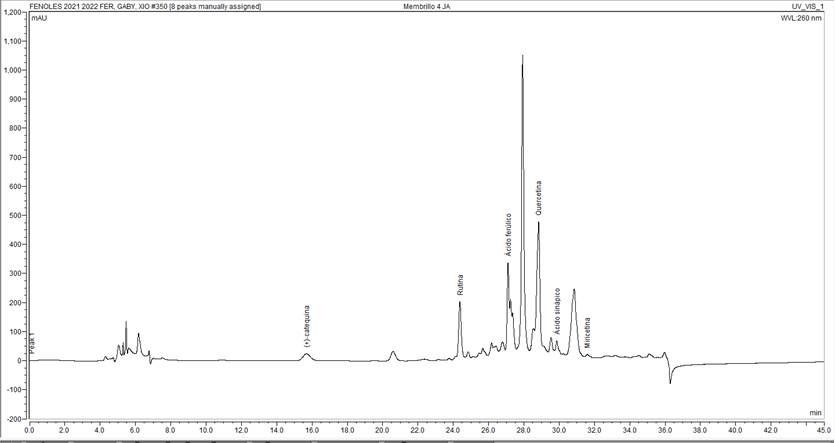
La determinación del perfil de compuestos fenólicos en el extracto metanólico fue realizada con un cromatógrafo de líquidos de alta resolución Dionex UltiMate 3000 acoplado a un detector de arreglo de fotodiodos DAD3000(RS) (Thermo Scientific) (HPLC-DAD), equipado con una bomba cuaternaria de titanio (LPG-3400AB), un muestreador automático (WPS3000TBPL) y un horno para columna (Thermo Scientific). La separación fue realizada empleando una columna analítica Acclaim 120 A (C18, 5 μm, 120 Å, 4.6 × 250 mm), de Dionex (Thermo Fisher Scientific), a temperatura ambiente. La elución de los ácidos fenólicos y flavonoides fue realizada con el siguiente gradiente: agua acidificada con ácido acético (pH 2.8) (A) y acetonitrilo (B). El gradiente inicia con 95% A, de 0 a 8 min; 6 a 12% B, de 8 a 14 min; 12 a 20% B, de 14 a 18 min; 20 a 35% B, de 18 a 24 min; 35 a 95% B, de 24 a 27 min; 95 a 60% B, de 27 a 31 min; 60 a 40% B, de 31 a 34 min; 40 a 20% B, de 34 a 38 min; and, 20 a 5% B, de 38 a 45 min. Las longitudes de onda establecidas fueron 260, 270, 275, 280, 285, 290, 295, y 300 nm, se emplearon estándares certificados de cada uno de los compuestos fenólicos identificados (Sigma-Aldrich, Steinheim, Germany) (Valdez Morales, et al., 2014).
Evaluación de la actividad antioxidante
Se empleó el método de 2,2-difenil-1-picrilhidrazilo (DPPH), adaptado para celdas. Se mezclaron 20 µL del extracto con 200 µL de la solución de DPPH (Sigma Chemical Co.) en una placa de 96 celdas. Se incubó por 30 minutos. La absorbancia fue determinada a 540 nm (Synergy TM HI, Multi-Detection, Biotek, Inc., Winooski, VT, EUA). La actividad antirradical fue expresada como µmol equivalentes de Trolox (Sigma Chemical Co.) (µmol ET)/100 g (bs). Las determinaciones se realizaron por triplicado (Cardador-Martínez , Loarca-Piña, & Ooman, 2002). La actividad antirradical ABTS (ácido 2,2´-azino-bis(3-etilbenzotiazolin)-6-sulfónico) se llevó a cabo de acuerdo con Re, Pellegrini, Proteggente, Yang, & Rice-Evans (1999). A 1980 µL de la dilución (3.5 mM, pH 7) del radical ABTS•+ (Sigma Chemical Co.) se le añadieron 20 µL de extracto de fitoquímicos y se incubaron 15 min en oscuridad para posteriormente medir la absorbancia a 735 nm (Synergy TM HI, Multi-Detection, Biotek, Inc., Winooski, VT, EUA). Para ambos métodos se construyó una curva estándar de Trolox (0-125 μM) y la actividad antirradical fue expresada como µmol equivalentes de Trolox (ET)/100 g (bs) y las determinaciones se realizaron por triplicado.
Actividad inhibitoria de la enzima convertidora de angiotensina
Se midió la actividad de 0.05 mL (0.025 U/mL) de la enzima convertidora de angiotensina (ECA) frente a su sustrato, Hipuril-L-Histidil-L-Leucina (Sigma Chemical Co.) a una concentración de 0.3% (p/v). Bajo las mismas condiciones se realizó la medición de la actividad de la ECA adicionando enalaprilo, a una concentración de 0.4% (p/v) como control positivo, para inhibir la actividad de la ECA. Para evaluar la propiedad inhibitoria de membrillo se utilizó una concentración de los extractos de 0.2% (p/v) en un buffer de fosfatos PBS (400 mM. pH 8.5). Durante el procedimiento se realizó una incubación de la enzima con su sustrato a 37 °C por 30 minutos y según era el caso, con los inhibidores (enalaprilo o extracto de membrillo); Hubo modificación a la técnica original, donde la reacción fue detenida con 0.25 ml de HCl 1M. Posteriormente se realizó una extracción del producto de la actividad enzimática, el ácido hipúrico, con 1.0 mL de acetato de etilo, seguido de la evaporación del exceso de acetato de etilo; este producto se disolvió en 1.5 mL de agua destilada y se determinó su absorbancia a una longitud de onda de 228 nm (Wang, Saito, Tatsumi, & LI, 2003). La actividad de inhibición de la ECA se expresó cómo % inhibición de la ECA y se calcula como sigue:
Resultados
Compuestos fenólicos en los extractos de membrillo
En el presente estudio el contenido de flavonoides determinado en membrillo fue de 422(4 mg EC/100 g (bs) y taninos de 250(8 mg EC/100 g (bs). El contenido total de fenólicos obtenidos en membrillo fue de 122(10 mg EAG/100 g (bs) y de cumarinas de 46(2 mg ECU/100 g (bs). Por HPLC-DAD se detectaron 4 tipos de flavonoides catequina (534.02 μg/g), rutina (4,811.11 μg/g), quercetina (924.20 μg/g) y miricetina (35.51 μg/g) y 2 tipos de ácidos fenólicos diferentes, ferúlico (610.32 μg/g) y sinápico (653.92 μg/g), siendo la rutina el compuesto fenólico que se encontró en mayor cantidad.
Discusión
En el caso de pulpa y en cáscara de membrillo se han reportado contenidos de flavonoides en un rango de 17.28 a 44.65 y de 41.23 a 63.41 mg EC/100 g, respectivamente. Y en mezclas de cáscara y pulpa como en esta investigación en un rango de 119.8 a 211.5 mg EC/100 g, es importante tener en cuenta que los flavonoides representan un porcentaje considerable, en el contenido total de compuestos fenólicos presentes en membrillo, con un intervalo del 24% al 33% (Karadenz, Burdurlu, Koca & Soyer, 2005; Stojanovic et al., 2017). Los valores reportados en este estudio son mayores, que lo reportado por otros investigadores, estas diferencias podrían ser atribuidas por el área de cultivo, el tiempo de cosecha, las condiciones climáticas, además de la variedad y al estado de maduración. Conforme avanza la maduración, la cantidad de los flavonoides disminuye, esto puede ser atribuido a la condensación de diferentes ácidos fenólicos en los últimos estados de maduración, formando algunos complejos fenólicos con taninos y la lignina (Ben Ahmed, Ben Rouina, Sensoy & Boukhriss, 2009).
Los flavonoles están acumulados en la capa externa del tejido de la cutícula, debido a la luz se estimula su biosíntesis. En este trabajo se identificaron tres flavonoles, el glucósido rutina>quercetina>miricetina. Una importante diferencia en su concentración existe entre los diferentes tipos de frutas, dependiendo del grado de exposición a la luz del sol (Stojanovic et al., 2017). Este efecto es benéfico para la salud humana, ya que la quercetina tiene una fuerte actividad antioxidante y puede proteger el organismo de radicales libres dañinos (Szychowski et al., 2018).
Los polifenoles presentes en membrillo incluyen a los flavan-3-oles como la catequina que también se identificó, que junto con la miricetina fueron los compuestos fenólicos que se encontraron en menor cantidad en el extracto, Se ha tenido especial interés en los flavonoles, ya que son los responsables del color del fruto y en los taninos, debido a su fuerte actividad antioxidante (Wojdyło, Oszmian´ ski & Bielicki, 2013). Los taninos son definidos usualmente como compuestos fenólicos con un alto grado de polimerización y se encuentran normalmente tanto en la pulpa como en la cáscara.
Las procianidinas poliméricas, ácidos hidroxicinámicos y flavonoles representan el 63%, 36% y 1% del total de compuestos fenólicos en membrillo, sin embargo, sus contenidos, son fuertemente dependientes del tipo de cultivo (Wojdyło, Teleszko & Oszmianski, 2014). No existen reportes del contenido total de taninos en membrillo, por métodos espectrofotométricos, pero se han reportado valores del contenido de procianidinas poliméricas, determinadas por HPLC en otras variedades de membrillo, obteniendo datos de 4900 a 5600 mg/100 g, de este compuesto (Teleszko & Wojdyło, 2015).
En otras frutas como kiwi, arándanos y durazno se han reportado valores de taninos de 240 a 597 mg EC/100 g (bs) (McDougall, Kulkarni & Stewart, 2009; Park et al., 2011; Belhadj et al., 2016; Aguayo-Rojas, Mora-Rochín, Tovar-Jiménez, Rochín-Medina, & Navarro-Cortez, 2022). La alta concentración de taninos en membrillo, tanto en su pulpa, como en los jugos obtenidos de él, puede explicar su astringencia y amargor característico. El amargor y la astringencia dependerán del contenido de flavonoles, ya que estos son las unidades estructurales, que conforman a este tipo de polímero fenólico, así como su grado de polimerización y de la pectina residual unida a él (Vidal et al., 2004).
El grado de polimerización de los taninos afecta las propiedades fisicoquímicas de las procianidinas (Le Bourvellec, Picot, & Renard, 2006). Este grado de polimerización, en la fruta puede ser de 8 a 11 unidades (Wojdylo et al., 2013), pero en el caso de los jugos de 2 hasta 13 unidades, en este tipo de productos es importante considerar el grado de polimerización, debido a que los taninos son responsables de generar turbidez, por eso entre menor grado presenten, los jugos serán más claros y estables (Oszmian´ ski, Wojdyło & Kolniak, 2009). También se ha demostrado que, durante el procesamiento, los taninos son transferidos de las vacuolas del fruto, hacia el jugo o al producto procesado (Le Bourvellec et al., 2004), esto es importante para conocer el posible uso industrial del membrillo y su efecto durante su procesamiento.
Como se mencionó anteriormente los taninos se unen principalmente a las pectinas, en lugar de otros componentes de la pared celular y pueden formar puentes entre las pectinas altamente solubles y las protopectinas insolubles (Arranz, Saura-Calixto, Shaha & Kroon, 2009). Las cumarinas son una de las 8000 estructuras de compuestos fenólicos reportados, que están presentes en los vegetales, las cumarinas están ampliamente distribuidas en diferentes partes anatómicas de las plantas, son conocidas por su agradable olor a vainilla y se encuentran en altas concentraciones en frutas como el membrillo de Bengala (Aegle marmeleos), así como en semillas, raíces, cortezas y hojas (Borges-Bubols et al., 2013; Davis, Maresca & Supuran, 2013).
Su estructura básica consta de un anillo bencénico, unido a un anillo α-pirona con un átomo de oxígeno en la posición α, y un grupo cetona en el carbono 2 (C2), además, pueden tener diferentes actividades bioactivas, como antibacterianas, antioxidante, antiinflamatorias, anticuagulantes y sobre todo anicarcinogénicas (Zhang et al., 2014; Kubrak, Podgórski & Stompor, 2017).
Existen pocos reportes sobre el contenido de cumarinas en frutas, pero se han reportado hasta 15 diferentes tipos de cumarinas en frutos como el membrillo de bengala (Aegle marmelos), también se ha reportado su presencia en pomelo (Citrus maxim) un fruto cítrico, en los frutos de plantas como la Cullen corylifolium y la Angelica officinalis L. siendo cuatro, las principales cumarinas identificadas por HPLC, imperatorina, isoimperatorina, xantotoxina y bergapteno (Sezer Senol et al., 2011; Zhang et al., 2018). Como se indicó anteriormente, no existen reportes del contenido de cumarinas en membrillo, pero Soares e Silva et al. (2012) desarrollaron el método utilizado en la presente investigación, y reportaron valores de 4.7 a 5.0 g ECU/100 g en harinas de hojas de guaco (Mikania glomerata), una planta trepadora de Brasil, que es empleada en la medicina tradicional, para el tratamiento del asma, tos y bronquitis, esta planta es conocida por sus altos contenidos de cumarinas, por lo que, se puede considerar una presencia significativa de este compuesto en nuestra muestra.
Hoy en día las cumarinas continúan recibiendo atención debido a sus diversas bioactividades, algunas han sido usadas en el tratamiento de diversas enfermedades, un ejemplo es la 4-hidroxicumarina empleada junto con la aspirina y heparina como anticoagulantes (Mueller, 2004).
Los compuestos fenólicos tienen un rol diverso como antioxidantes, adicionalmente, presentan un papel importante en los atributos sensoriales del fruto (astringencia y amargor), el membrillo es considerado una buena fuente de estos compuestos y esto se puede probar, por su alta intensidad de amargor y astringencia que presenta, incluso en su máxima etapa de maduración (Wojdyło et al., 2013). La distribución y composición de los compuestos fenólicos en frutas son afectados por la madurez, tipo de cultivar, prácticas horticulturales, origen geográfico, estación de crecimiento, condiciones de almacenamiento en poscosecha y las condiciones de procesamiento (Kim, Jeong & Lee, 2003).
Estudios previos realizados por diversos investigadores, con membrillo de varios países, como España, Turquía, Portugal, Irán, Serbia y Túnez han reportado, valores de fenólicos totales en un rango de 71 a 159 mg EAG/100 g en pulpa y de 327 a 710 mg EAG/100 g en la cáscara, se puede observar claramente, que la mayor cantidad de estos compuestos, se encuentran principalmente en la cáscara, esto puede atribuirse, a que estos compuestos sirven como mecanismo de defensa contra parásitos, además de una serie de reacciones químicas y enzimáticas, que ocurren durante la maduración, originando un aumento en el contenido de compuestos fenólicos, al ser liberados de la pared celular por acción de enzimas pectinolíticas (Wojdyło et al., 2014).
En la presente investigación, no se separó la cáscara de la pulpa y los resultados fueron obtenidos de una mezcla de ellas, también hay que señalar que en este estudio, solo se cuantificó la fracción libre de los compuestos fenólicos, por lo que la cantidad total de fenólicos totales podría ser mayor, sin embargo, los resultados son muy parecidos a lo reportado por otros investigadores en pulpa (Silva, Andrade, Martins, Seabra & Ferreira, 2006; Fattouch et al., 2007; Legua et al., 2013; Szychowskia et al., 2014). Es bien conocido que el contenido de estos fitoquímicos está determinado por la locación, variedad, madurez, pero también por las condiciones de crecimiento. Factores como luz solar, temperatura y nutrientes del suelo pueden tener una sustancial influencia sobre la composición de la fruta (Stojanovic et al., 2017).
Para la evaluación de la actividad antioxidante en frutas, la especificidad y sensibilidad de un solo método no indica la completa exanimación de los fitoquímicos en el extracto, de esta forma, la combinación de varios métodos puede proveer una evaluación más confiable del perfil de antioxidantes en las frutas. Dos ensayos fueron empleados para evaluar las propiedades antioxidantes en los extractos crudos de membrillo, cada ensayo tiene su propia ventaja y limitación, de esta forma los datos obtenidos por los dos métodos aumentan la confianza del potencial antioxidante del membrillo.
La determinación de la capacidad antioxidante es una reacción dependiente del mecanismo. En el presente estudio se emplearon análisis de antioxidantes basados en reacciones químicas (DPPH y ABTS). La actividad antioxidante está fuertemente relacionada con el contenido de compuestos fenólicos, ya que son los principales responsables de la misma (Szychowski et al., 2018). Otros investigadores han reportado una mayor actividad antioxidante en la cáscara, que en la pulpa en el membrillo, esto es atribuido a la mayor concentración de compuestos fenólicos en la piel, esto es importante destacar, ya que si los productos alimenticios elaborados de este fruto (jugos, mermeladas, ates etc.), requieren tener altos niveles de capacidad antioxidante, es necesario procesarlos, incluyendo la cáscara.
También se ha reportado una mayor capacidad antioxidante hidrofílica, que la lipofílica, esto debido a la mayor concentración de compuestos bioactivos polares o hidrofílicos en membrillo, como lo son los flavonoides, ácidos fenólicos y taninos, con respecto a los lipofílicos, como los carotenoides (Zaouay, Mena, Garcia-Viguera, & Mars, 2012; Szychowski, Munera-Picazo, Szumny, Carbonell-Barrachinaa & Hernandez, Szychowski, 2014: Teleszko & Wojdyło., 2015).
La actividad antioxidante en los extractos metanólicos de membrillo, determinada por el método ABTS, fue mayor a la obtenida por el método de DPPH, esto puede ser atribuido a la menor estabilidad del radical catión ABTS, aunque ambos valores fueron calculados como equivalentes de trolox. Se han reportado valores de capacidad antioxidante en membrillo de 1,500 a 7,850 µmol ET/ 100 g por ABTS y en DPPH, también se ha determinado la actividad antioxidante en membrillo por este método, pero los datos se han reportado principalmente por el porcentaje de inhibición de este radical, por lo que no lo pudimos comparar, pero en otras frutas como ciruela, guayaba y durazno, se han reportado valores por DPPH de 2010 a 3858 µmol ET/ 100 g (Arion et al., 2014; Teleszko & Wojdyło., 2015; Mokrani & Madani, 2016; Szychowski et al., 2018; Aguayo-Rojas et al., 2022).
Por lo que los datos obtenidos en este estudio son superiores a lo reportado por ABTS en otras variedades de membrillo y en otras frutas. El consumo de antioxidantes en la dieta es importante, ya que estos son capaces de neutralizar radicales libres y de reducir el riesgo de contraer enfermedades crónico-degenerativas. Por lo tanto, es muy importante determinar la actividad antioxidante en las frutas. Hoy en día la capacidad antioxidante en frutas se ha tomado como un indicador de sus beneficios a la salud humana (Prior & Wu, 2013).
Los extractos de pulpa y piel de membrillo presentan una mayor actividad antioxidante que la suma de los compuestos fenólicos evaluados en su forma individual, demostrando el efecto sinergístico de los antioxidantes individuales, además, se ha mostrado que los compuestos fenólicos del membrillo tienen una actividad antioxidante in vivo, ya que estos aumentan la capacidad antioxidante en la sangre después de la administración oral en ratas (Hamauzu, Inno, Kume, Irie, & Hiramatsu, 2006; Fattouch et al., 2007). No existen reportes de la inhibición de la ECA en membrillo, pero con otras frutas con sus respectivos valores neutralizadores, se ha reportado en plátano, granada, litchi un 50% de inhibición de la ECA (Fernández & Labra, 2013; Kessy, Wang, Zhao, Zhou, & Hu, 2018), fresa 38% (Cheplick, Kwon, Bhowmik, & Shetty, 2010) y durazno (Aguayo-Rojas et al., 2022).
Como control positivo empleado, el enalaprilo es uno de las medicamentos más usados para el control de la hipertensión, ya que tienen la capacidad de unirse a iones metálicos como el zinc, este presentó una inhibición de la enzima del 99±1%, No obstante, estas ventajas de los medicamentos inhibidores de la ECA pueden resultar inefectivas en el momento que produzcan efectos adversos tales como erupciones o sarpullidos en la piel, trastornos alimenticios y tos entre otros, que obligan a interrumpir el tratamiento (Laurent, 2017). Debido a los efectos secundarios de los inhibidores mencionados anteriormente, existe la necesidad de inhibidores con pocos o ningún efecto secundario. En este sentido, los informes han demostrado el uso efectivo de diferentes plantas y frutas, como terpenoides y compuestos fenólicos, incluyendo a los flavonoides y taninos, así como algunos derivados del ácido cafeíco. La mayoría de los estudios han demostrado que los extractos de plantas y frutas son efectivos contra la inhibición de la ECA, por lo que es importante conocer cuáles son los que tienen un mayor potencial (Ojeda et al., 2010; Atanasov et al., 2015).
Entre los grupos de metabolitos secundarios encontrados en membrillo y que presentan un efecto inhibidor de la actividad de la ECA, los taninos podrían ser uno de los compuestos fenólicos principales responsables en alterar tal actividad enzimática, puesto que los taninos altamente glucosilados contenidos en los frutos pueden formar puentes de hidrogeno con el zinc, cofactor de la enzima ECA y con otros sitios activos de la proteína, tal como actúan los fármacos empleados para el control de la hipertensión, pero con la ventaja de que estos fitoquímicos son de origen natural y los efectos secundarios provocados por los medicamentos se pudieran evitar (Lacaille, Franck, & Wagner, 2001). Adicionalmente los grupos hidroxilo (OH-) de los flavanoles pueden tener un efecto positivo en inhibir la enzima al interactuar con las proteínas, resultando en la formación de un enlace fuerte entre las catequinas y la ECA (Fernández & Labra, 2013).
Los polifenoles inhiben la actividad enzimática compitiendo con el sustrato por los sitios activos. Además, los flavonoides están directamente relacionados con su capacidad para unirse con el ion zinc en el sitio activo de ECA (Larson, Symons & Jalili, 2010). Estos compuestos también mostraron competencia inhibición enzimática, en la que la presencia de grupos hidroxilo y el anillo B desempeña un papel importante en la actividad inhibidora (Balasuriya & Rupasinghe, 2012). Por lo tanto, futuros estudios serán necesarios para identificar el mecanismo de inhibición de estas muestras.
Conclusiones
Los resultados de esta investigación indican los primeros estudios sobre el contenido y perfil de compuestos fenólicos, así como el potencial nutraceútico de membrillo cultivado en Zacatecas. Estos resultados comprueban la considerable cantidad de compuestos fenólicos, con potencial nutracéutico que pueden ser considerados como una buena fuente para aplicaciones médicas y alimentarias. Los fitoquímicos contenidos en la harina de membrillo pueden ser usados como una fuente natural de antioxidantes, además de inhibir la actividad ECA, por lo que podría considerarse al membrillo como una de las frutas con potencial antihipertensivo, aunque son necesarios estudios in vivo.











 nueva página del texto (beta)
nueva página del texto (beta)