Introducción
La especia vainilla se obtiene de los frutos beneficiados de diversas especies del género Vanilla, una de estas es V. planifolia Andrews, que representa cerca del 95% de los frutos comercializados (Bory et al., 2008; Azofeifa-Bolaños et al., 2014). La especie es originaria de las selvas tropicales del sureste de México y América Central (Bello-Bello et al., 2015), siendo considerado México como su centro de origen y domesticación (Rodríguez-Deméneghi et al., 2023). Sin embargo, su polinización y germinación en ambientes naturales es baja. Aunado a ésto, las poblaciones naturales han sido diezmadas por la recolecta excesiva e ilegal, provocando que se encuentre en vía de extinción en su hábitat natural, razón por la que es considerada en la Norma Oficial Mexicana,2010 NOM-059-SEMARNAT-2010 “Sujeta a Protección Especial (Pr)” (Norma Oficial Mexicana NOM-059-SEMARNAT-2010; Bello-Bello et al., 2015; Bonilla et al., 2015; Lozano-Rodríguez et al., 2015).
Con base a lo anterior, es necesario el desarrollo de estrategias para la conservación de esta especie. Actualmente, la conservación ex situ es considerada como la mejor opción, debido al deterioro del hábitat por la tala inmoderada y el cambio de uso de suelo (Menchaca & Lozano, 2018), además de ser una opción para preservar algunas especies vegetales (Reed et al., 2011; Coelho et al., 2020). Los bancos de germoplasma son un método tradicional de conservación ex situ, sin embargo, no son una buena opción de conservación para todas las especies (Engelmann, 2011; Coelho et al., 2020). Mientras que el método de colecciones de campo tiene como limitante el de requerir un considerable espacio físico y un alto costo para el mantenimiento, control de plagas y enfermedades (Bello-Bello et al., 2014; Coelho et al., 2020). Por lo tanto, los métodos biotecnológicos como la conservación in vitro a corto (crecimiento activo), mediano (crecimiento lento) y largo plazo (crioconservación) pueden considerarse mejores alternativas (Coelho et al., 2020).
Respecto al método a mediano plazo como es el de crecimiento lento, los explantes permanecen por 6 meses o hasta por 12 meses en cultivo in vitro (Rayas et al., 2002; Sánchez-Chiang & Jiménez, 2010). Este método se basa en la disminución de la división celular y el metabolismo de la planta, con la finalidad de incrementar el plazo de tiempo entre subcultivos, para disminuir los riesgos de contaminación por el subcultivo constante, sin que se produzcan cambios genéticos y se logre mantener la diversidad genética de una especie bajo condiciones estériles sin poner en peligro la estabilidad de la planta (Shibli et al., 2006).
A nivel mundial se han empleado ciertas sustancias relacionadas en el crecimiento vegetal, entre ellas, el cloruro de clormequat (CCC), que ha sido empleado como inhibidor del crecimiento vegetal en diversas especies en invernadero como es el caso de plántulas de lechuga (Bermúdez, 2018), además, han reportado trabajos sobre desarrollo y rendimiento del girasol (Silva-Garza et al., 2001), microtuberización in vitro de papa (Solanum tuberosum L.) variedad Cardinal y Diarnant (Hussain et al., 2006; Zakaria et al., 2008), sobre aclimatación y crecimiento in vitro de Tibouchina urvilleana (DC). Cogn. (Kozak, 2006), micropropagación de Eclipta alba (L.) Hassk (Ray & Bhattacharya, 2008), regeneración in vitro de cuerpos protocórmicos (PLBs) de Phalaenopsis ‘Fmk02010’ (Mehraj et al., 2017), entre otros; pero no han reportado su empleo para la conservación in vitro a mediano plazo en cultivos como la vainilla; así también los trabajos dedicados a su conservación in vitro mediante el empleo de ácido abscísico (ABA) son escasos (Bello-Bello et al., 2015; Pastelín, 2018; Bautista-Aguilar et al., 2021).
Tomando en consideración lo anterior, el empleo de ABA y CCC puede considerarse como una estrategia de conservación in vitro a mediano plazo, para aumentar los intervalos entre subcultivos, suministro constante de plantas libres de patógenos y disminución en el empleo de mano de obra, a comparación del método de conservación a corto plazo, el cual implica un crecimiento a tasas normales, conllevando a un mantenimiento constante, mayor mano de obra (remunerado) y mayor cantidad de reactivos, debido a que los subcultivos se realizan cada 30 a 60 días (Sánchez-Chiang & Jiménez, 2010; Pérez et al., 2012; Bello-Bello et al., 2015; Bonilla et al., 2015; Alcántara et al., 2017).
Por lo tanto, el presente estudio tuvo como objetivo evaluar el efecto de la interacción de diferentes concentraciones de los inhibidores de ABA y CCC en la inhibición de la morfogénesis de microestacas de V. planifolia cultivadas in vitro como una alternativa de conservación a mediano plazo.
Materiales y métodos
La investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales del Instituto de Ciencias Biológicas de la UNICACH, ubicado en Ciudad Universitaria, Libramiento Norte Poniente 1150, Colonia Lajas Maciel Tuxtla Gutiérrez, Chiapas.
Material vegetal
La colecta del material biológico utilizado fue autorizada por la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) bajo la licencia de colecta científica SGPA/DGVS/11157/19. Derivado de lo anterior, se obtuvieron mediante cultivo in vitro plántulas de vainilla (V. planifolia) y posteriormente microestacas (explantes) de 1.5 cm. Todo el material empleado se cultivó in vitro en medio Murashige y Skoog al 50%, incubados a 25 ± 2 ºC, con un ciclo de fotoperiodo de 16/8 h y una intensidad lumínica de 2000 lux.
Preparación de medio
Se preparó medio Murashige y Skoog al 75% (MS 75%), con 30 g L-1 de sacarosa, adicionado con ABA a 0, 1.5 y 3 mg L-1, CCC a 0, 1, 2, 4 y 6 mg L-1 o su combinación (ABA/CCC) (Tabla 1). Se ajustó el pH a 5.6 con NaOH y HCl al 1 N, se agregó 2.5 mg L-1 de Phytagel Sigma®, se vació 20 ml de medio MS 75%, en cada uno de los frascos de vidrio de 125 ml con tapa, por último, se esterilizaron en autoclave a 121 ºC a una presión de 15 psi-1, durante 15 minutos.
Tabla 1 Combinaciones de inhibidores de crecimiento, ABA y CCC, utilizados en la conservación in vitro de Vanilla planifoliaTable 1. Combinations of growth inhibitors, ABA and CCC, used in the in vitro conservation of Vanilla planifolia.
| Tratamientos | mg L-1 | |
|---|---|---|
| Control | 0.0: 0.0 | |
| CCC | T 01 | 1 |
| T 02 | 2 | |
| T 03 | 4 | |
| T 04 | 6 | |
| ABA | T 05 | 1.5 |
| T 10 | 3 | |
| ABA/CCC | T 06 | 1.5: 1.0 |
| T 07 | 1.5: 2.0 | |
| T 08 | 1.5: 4.0 | |
| T 09 | 1.5: 6.0 | |
| T 11 | 3.0: 1.0 | |
| T 12 | 3.0: 2.0 | |
| T 13 | 3.0: 4.0 | |
| T 14 | 3.0: 6.0 | |
Conservación in vitro a mediano plazo
Posteriormente las microestacas fueron transferidas asépticamente a los frascos de vidrio (una microestaca por frasco) con medio de cultivo modificado (ABA, CCC o ambos) estéril. Los tratamientos experimentales y el control se incubaron durante 200 días bajo las mismas condiciones de iluminación y temperatura de la etapa de cultivo previa a la obtención de las microestacas.
Evaluación de las variables
Al cumplir el periodo de incubación se midió la longitud total de las plántulas obtenidas a partir de la yema de las microestacas, con un vernier digital Stainless Hardened®. Al finalizar el experimento Se contabilizó el número de brotes, número de hojas, número de raíces y porcentaje de supervivencia.
Análisis estadístico
Se empleó un diseño completamente al azar para 14 tratamientos experimentales y un control, cada tratamiento constó de 25 unidades experimentales, cada una conformada por una microestaca creciendo en un frasco con 25 ml de medio de cultivo con su respectivo tratamiento, empleándose un total de 375 unidades experimentales. Los datos obtenidos fueron sometidos a una prueba Shapiro Wilk y Levene, para analizar la normalidad y homogeneidad de las varianzas, al no superarse los supuestos se optó por realizar una prueba de Kruskal-Wallis (p < 0.05), y posteriormente una prueba de Dunn, para determinar diferencias intragrupos. Los análisis se realizaron utilizando el software estadístico R versión (4.1.1).
Resultados y discusión
Después de 200 días de cultivo in vitro se observó una reducción en la longitud de los explantes, la mayoría de ellos vigorosos. Así mismo, se observa que el tratamiento Control pese a presentar una mayor longitud, las hojas viejas inferiores presentaron una clorosis general avanzada, verde pálido a amarillo desde las hojas viejas hasta las jóvenes y nuevo crecimiento, además de un desarrollo débil, así como la pérdida y secado de hojas viejas (Figura 1a). Mientras que, en los tratamientos experimentales, únicamente se observan síntomas de déficit nutrimental en el tratamiento T 03 (4 mg L1 de CCC) (Figura 1c).

Figura 1 Efecto de concentraciones de dos inhibidores de crecimiento, sobre la conservación in vitro de Vanilla planifolia Andrews. Concentraciones de izquierda a derecha: a) Control, b) ácido abscísico (ABA) a 1.5 y 3 mg L-1, c) cloruro de clormequat (CCC) a 1, 2, 4 y 6 mg L-1 y d) combinación (ABA/CCC) a 1.5: 1.0, 1.5: 2.0, 1.5: 4.0, 1.5: 6.0, 3.0: 1.0, 3.0: 2.0, 3.0: 4.0 y 3.0: 6.0 mg L-1 a 200 días de cultivo.
Para el caso de V. planifoliaBello-Bello et al. (2015), reportan la ausencia de anomalías fenotípicas en las plántulas de vainilla, cultivadas in vitro con 1, 2 y 3 mg L-1 de ABA con MS al 100%, de manera similar, Barrueto & Carvalho (2008) reportan una completa dormancia de yemas, sin afectar su desarrollo y posterior conversión en plántulas de yemas axilares nodales de yuca (Manihot esculenta Grantz) conservadas en 5.29 y 7.92 mg L-1 de ABA. De igual forma Yun-peng et al. (2012), refieren la ausencia de afectaciones morfológicas en el cultivo de dos especies de lirios (Lilium davidii Duch. ex Elwes y Lilium longiflorum Thunb.) en medio adicionado con 3 mg L-1 de ABA durante 15 meses.
Respecto a la longitud total, existe una relación entre el tamaño decreciente de los explantes y el incremento en las concentraciones de CCC y ABA, observándose diferencias estadísticamente significativas (p = 2.2e-16, Kruskal Wallis), siendo el tratamiento T 14 (3.0: 6.0 mg L-1 de ABA/CCC) el que presentó el promedio más bajo con 1.80 cm, seguido por los tratamientos T 13 (3.0: 4.0 mg L-1 de ABA/CCC) y T 12 (3.0: 2.0 mg L-1 de ABA/CCC) con 1.85 y 1.90 cm respectivamente, éstos conforman un grupo que se diferencia estadísticamente del resto de tratamientos (Tabla 2, Figura 2a). Lo anterior concuerda con lo reportado por Bello-Bello et al. (2015); Pastelín (2018); Bautista-Aguilar et al. (2021), quienes refieren que el empleo de ABA tiene una relación entre la disminución de la longitud total del explante de vainilla y el incremento de la dosis empleada, siendo los tratamientos con mayor contenido del regulador (3 y 5 mg L-1 ABA) en medio MS al 100%, los que presentaron las medias más bajas 1.3, 1.42 y 0.71 cm respectivamente, resultado semejante al obtenido en el tratamiento T 10 (3.0 mg L-1 de ABA) el cual presentó una longitud de 1.23 cm. Es importante mencionar que los experimentos realizados por Bello-Bello et al. (2015), Pastelín (2018) y Bautista-Aguilar et al. (2021), tuvieron una duración de 180, 186 y 120 días respectivamente, mientras que el presente experimento fue de 200 días en medio MS al 75%, por lo que la interacción entre el ABA y el CCC generó una disminución significativa en la longitud de los explantes (p = 2.2e-16, Kruskal Wallis).
Tabla 2 Efecto de la interacción de diferentes concentraciones de ABA y CCC en la morfogénesis de V. planifolia.Table 2. Effect of the interaction of different concentrations of ABA and CCC on the morphogenesis of V. planifolia.
| Tratamientos | mg L-1 | Longitud total (cm) | Brotes | Hojas | Raíces | |
|---|---|---|---|---|---|---|
| Media | Media | Media | Media | |||
| Control | 0.0: 0.0 | 4.94 ± 1.38 a | 3.67 ± 0.57 a | 5.52 ± 2.77 a | 5.24 ± 1.37 a | |
| CCC | T 01 | 1 | 4.77 ± 1.62 a | 2.74 ± 0.44 b | 5.43 ± 1.20 a | 4.13 ± 1.60 b |
| T 02 | 2 | 4.68 ± 1.68 a | 2.0 ± 0.72 c | 5.35 ± 2.11 a | 4.10 ± 1.74 b | |
| T 03 | 4 | 3.81 ± 1.27 b | 1.26 ± 0.44 d | 4.22 ± 1.91 b | 3.35 ± 1.07 c | |
| T 04 | 6 | 2.90 ± 0.60 c | 1.14 ± 0.66 d | 3.36 ± 1.01 c | 2.50 ± 0.85 d | |
| ABA | T 05 | 1.5 | 3.94 ± 0.81 b | 1.96 ± 0.73 c | 3.24 ± 0.97 c | 2.52 ± 0.77 d |
| T 10 | 3 | 2.73 ± 0.74 c | 1.13 ± 0.75 d | 2.13 ± 0.92 d | 1.74 ± 1.05 e | |
| ABA/CCC | T 06 | 1.5: 1.0 | 3.80 ± 0.72 b | 1.30 ± 1.02 d | 3.17 ± 1.85 c | 2.78 ± 1.51 d |
| T 07 | 1.5: 2.0 | 3.73 ± 0.74 b | 1.27 ± 0.76 d | 3.14 ± 0.94 c | 2.73 ± 1.45 d | |
| T 08 | 1.5: 4.0 | 2.88 ± 0.45 c | 1.20 ± 0.76 d | 3.0 ± 2.32 c | 2.55 ± 0.94 d | |
| T 09 | 1.5: 6.0 | 2.82 ± 0.62 c | 1.08 ± 0.70 d | 2.20 ± 0.86 d | 2.44 ± 0.87 d | |
| T 11 | 3.0: 1.0 | 2.68 ± 0.52 c | 1.12 ± 0.79 d | 2.08 ± 0.92 d | 1.67 ± 1.09 e | |
| T 12 | 3.0: 2.0 | 1.90 ± 0.38 d | 0.44 ± 0.71 e | 1.88 ± 0.78 d | 1.64 ± 0.81 e | |
| T 13 | 3.0: 4.0 | 1.85 ± 0.46 d | 0.28 ± 0.46 e | 1.86 ± 0.72 d | 1.57 ± 0.81 e | |
| T 14 | 3.0: 6.0 | 1.80 ± 0.34 d | 0.27 ± 0.46 e | 1.83 ± 0.61 d | 1.50 ± 0.78 e | |
Datos obtenidos a 200 días de cultivo. Las medias con letras diferentes en cada columna indican diferencias estadísticas significativas (p < 0.05, prueba de Dunn) entre tratamientos (n = 375 microestacas).
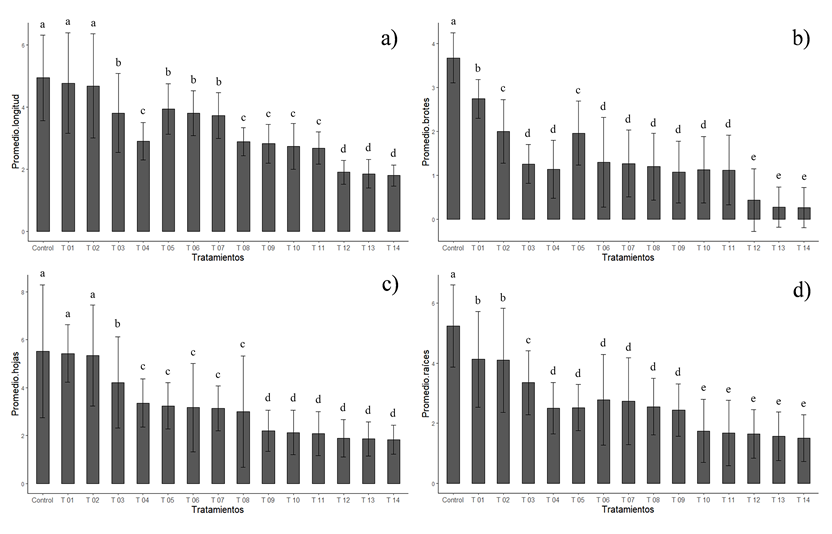
Figura 2 Efecto de la interacción de diferentes tratamientos: ABA/CCC mg L-1, en la morfogénesis de V. planifolia, a 200 días de cultivo: a) Longitud total (cm), b) Número de brotes, c) Número de hojas y d) Número de raíces. Las medias con letras diferentes en cada barra indican diferencias estadísticas significativas (p < 0.05, prueba de Dunn) entre tratamientos (n = 375 microestacas).
En lo referente al número de brotes, se observó una diferencia estadísticamente significativa entre los tratamientos (p = 2.2e-16, Kruskal Wallis), se tiene que a mayor concentración de reguladores, se obtuvo una menor formación de brotes, una menor media en el tratamiento T 14 con 0.27 brotes, seguido de los tratamientos T 12 y T 13 una media de 0.44 y 0.28, mismos que son semejantes entre sí y se diferencian del resto de tratamientos, estos resultados contrastan con los 3.67 brotes obtenidos en el tratamiento Control (Tabla 2, Figura 2b), por lo que, la interacción de ambos retardantes, permitió una inhibición eficaz, presentando un efecto sinérgico libre de efectos indeseados o deficiencias nutrimentales como la presentada en el tratamiento T 03 adicionado únicamente con CCC. Lo anterior, coincide con lo referido por Da Silva & Scherwinski-Pereira (2011), quienes observaron diferencias significativas en la longitud de los brotes y número de yemas por brote de pimienta (Piper aduncum L.), al usar 1, 2 y 3 mg L-1 de ABA. En el caso de la pimienta larga (Piper hispidinervum Kunth.), al usar 3 mg L-1 de ABA, obtuvieron el promedio más bajo de 8.8 cm de longitud y 6.8 yemas por brotes.
En cuanto al número de hojas, se encontraron diferencias significativas entre los tratamientos (p < 0.05, Kruskal Wallis), se tuvo una menor formación de hojas en el tratamiento T 14 con una media de 1.83 hojas, seguido por los tratamientos 12 y 13 con medias de 1.88 y 1.86 hojas respectivamente (Tabla 2, Figura 2c), estos resultados son similares a lo reportado por Bautista-Aguilar et al. (2021) quienes al conservar vainilla en MS (100 %) suplementado con 3 mg L-1 de ABA, obtuvieron una media de 1 hoja, por su parte, Bello-Bello et al. (2014), al conservar caña de azúcar, encontraron una menor formación de hojas obteniendo un promedio de 2.5 hojas, en el tratamiento de mayor concentración con 3 mg L-1 de ABA.
En lo referente al número de raíces, la prueba de Kruskal Wallis evidencia diferencias significativas entre los tratamientos (p < 0.05), manteniéndose la tendencia observada con anterioridad, presentando la media más baja en el T 14 con una media de 1.50 raíces por explante (Tabla 2, Figura 2d).
Respecto a lo anterior, Páez & González (2001), refieren que el empleo de 1.5 mg L-1 de ABA y 1.5 mg L-1 de CCC, permitieron la obtención del promedio de desarrollo de raíces más bajo en la conservación in vitro de papa (Solanum tuberosum L.) (1.15), mientras que Rivera-Calderón et al. (2008), señalan que la adición de 10:500 mg L-1 de BAP/CCC al medio de cultivo (MS al 100%), es capaz de inducir la más alta producción de microtubérculos de papa, con un promedio de 9.08. Hussain et al. (2006), reportaron además que el empleo de medio de cultivo Murashige y Skoog, adicionado con 200 mg L-1 de CCC es capaz de inducir la máxima formación de tubérculos en papa (16.5 tubérculos/frasco).
En lo referente a la supervivencia de los explantes, se observó que los tratamientos T 05 (1.5 mg L-1 de ABA), T 09 (1.5: 6.0 mg L-1) y T 12 (3.0: 2.0 mg L-1) de ABA/CCC, reflejaron los porcentajes más altos con 100% para todos los casos, seguidos por el tratamiento T 11 (3.0: 1.0 mg L-1/ ABA: CCC) con un 96%, mientras que, en el tratamiento T 04 (6.0 mg L-1 de CCC), obtuvo el porcentaje de supervivencia más bajo con un 56% (Figura 3).
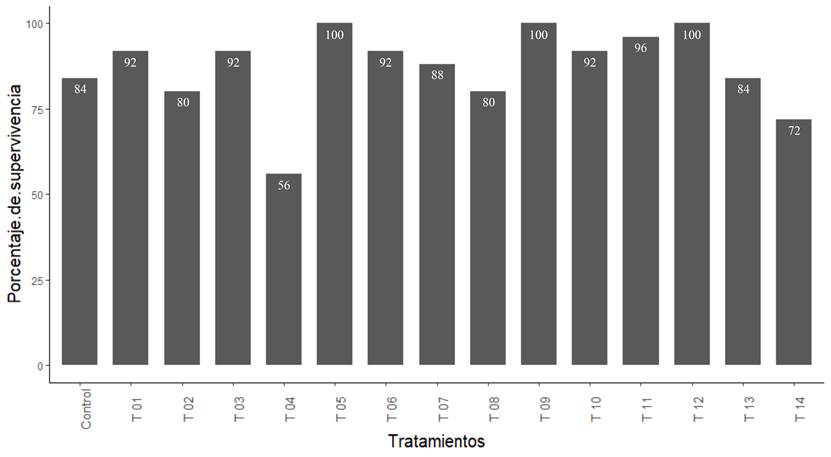
Figura 3 Porcentaje de supervivencia de plántulas de vainilla (V. planifolia) con los diferentes tratamientos a 200 días de cultivo.
Los resultados obtenidos, coinciden con lo reportado por Bello-Bello et al. (2015), en el estudio sobre la conservación in vitro de vainilla, refieren que con 1, 2 y 3 mg L-1 de ABA obtuvieron un porcentaje de supervivencia del 100, 90 y 90%, respectivamente, mientras que Bautista-Aguilar et al. (2021), obtuvieron un 93.3% de supervivencia en explantes de V. planifolia conservados en medio MS al 100% adicionado con 3 mg L-1 de ABA e incubado a 22 °C. Además de ser similar a lo reportado por Da Silva & Scherwinski-Pereira (2011), quienes obtuvieron una supervivencia del 100% en P. aduncum, en medio MS adicionado con 0.5 y 1.0 mg L-1 de ABA y un 100% en brotes de P. hispidinervum, en medio adicionado con 1 y 2 mg L-1 de ABA, para el caso del CCC no se encuentran reportes de sus efectos en la tasa de supervivencia de los explantes.
Conclusión
El mejor tratamiento para la conservación in vitro a mediano plazo de V. planifolia es el tratamiento T 12 (3.0: 2.0 mg L-1/ ABA: CCC, MS al 75%), debido a que presentó una supervivencia del 100% de los explantes y una menor longitud total en un periodo de 200 días, sin síntomas de deficiencias nutrimentales y anomalías en su desarrollo, por lo tanto, puede considerarse como una estrategia para salvaguardar este material vegetal mediante el establecimiento de bancos de germoplasma in vitro, para futuros proyectos de reubicación o intercambios con otros bancos de germoplasmas; con menor mano de obra, en comparación con la técnica de conservación a corto plazo.











 nueva página del texto (beta)
nueva página del texto (beta)



