Introducción
Los hongos son reconocidos como un grupo muy exitoso desde la perspectiva ecológica. La variedad de roles que desempeñan resulta fundamental para el adecuado funcionamiento de los ecosistemas, ya que su participación contribuye de manera significativa a la resiliencia y salud general de los mismos (Caiafa et al., 2017; Niego et al., 2023). Esa diversidad de funciones toma mayor relevancia si se considera que son el segundo grupo más diverso de eucariotas en el planeta (Purvis & Hector, 2000), y de acuerdo con las estimaciones más aceptadas, su número oscila entre los 2.2 a 3.8 millones de especies (Hawksworth & Lücking, 2017).
Para subsistir y desarrollarse, los hongos obtienen sus nutrientes a través de tres vías distintas las cuales se denominan hábitos eco-nutricionales o formas de vida (Aiartzagueña et al., 2016). Los simbiontes mutualistas, en especial las especies que forman ectomicorrizas, son comúnmente consideradas como organismos edáficos, ya que es en el suelo donde interactúan con las raíces de las plantas para obtener nutrientes y contribuir al crecimiento y salud de muchas especies arbóreas. Las especies que son parásitas tienen requerimientos nutricionales muy diversos; las formas patógenas infectan animales regulando sus poblaciones, o parasitando plantas lo cual afecta de forma negativa su desarrollo. En las especies saprobias los requerimientos nutricionales son más complejos pues el sustrato puede ser de origen animal o vegetal, por ejemplo, hojarasca, detritos disueltos en el suelo y madera, llamados respectivamente, humícolas, terrícolas y lignícolas; en estos últimos, incluyendo los que se nutren de celulosa (lignocelulósicos) (Montoya et al., 2010). Este gremio se encarga de degradar la materia orgánica muerta, jugando un rol fundamental en el reciclado de nutrientes y en la formación de suelos.
Los macromicetos son muy sensibles a las condiciones ambientales y su diversidad, abundancia y distribución dentro de un ecosistema determinado esta influenciada por diversos factores. Parámetros como la pendiente del terreno, la exposición a la luz solar, la disponibilidad de recursos y la altitud impactan de manera directa. Más aún, la interacción compleja de esos factores crea un mosaico de microambientes que, a su vez, moldea las comunidades fúngicas (Hu et al., 2022; Mazzola et al., 2008; Pinna et al., 2010).
En el estado de Oaxaca se han realizado algunos estudios sobre la distribución de macromicetos en respuesta a ciertos parámetros ecológicos (Rodríguez-Gutiérrez et al., 2020; Vázquez-Mendoza, 2008, 2012), permitiendo comprender un poco más la dinámica de los hongos (Díaz-Moreno et al., 2005); no obstante, para la costa de Oaxaca, ese tipo de estudios son nulos y los pocos trabajos que existen están enfocados a cuantificar la diversidad de especies. Como resultado de esos trabajos se sabe que a la fecha se han registrado 198 especies de hongos macroscópicos (Raymundo et al., 2022; Villarruel-Ordaz et al., 2021). Uno de los principales tipos de vegetación que se presenta en la región costa de Oaxaca es el Bosque Tropical Caducifolia (BTC), el cual se caracteriza por un estrato arbóreo que tira sus hojas durante una marcada temporada seca (Challenger & Soberón, 2008); sin embargo, el conocimiento que existe sobre la diversidad de macromicetos asociados a este tipo de vegetación en la costa de Oaxaca es escaso, y la limitada comprensión que poseemos sobre los hongos tropicales en general resalta la necesidad de llevar a cabo investigaciones que contribuyan a establecer patrones de distribución, y de este modo enriquecer nuestra percepción de su función ecológica. Los hongos requieren de condiciones precisas para desarrollarse; la diversidad y distribución de especies depende de la combinación de ciertos factores, por consiguiente, para comprender un poco más dicho fenómeno se planteó analizar la riqueza de especies de macromicetos en un BTC de la costa de Oaxaca, considerando el sustrato y los hábitos eco-nutricionales, así como la respuesta a la combinación de factores topográficos como la altitud, exposición a la luz solar y la pendiente del terreno.
Área de estudio
La zona de estudio fue la Unidad de Manejo Ambiental para la Conservación de Vida Silvestre “Jardín Botánico Puerto Escondido” (UMA-JBPE) de la Universidad del Mar; la cual se encuentra ubicada en el kilómetro 239 de la Carretera Federal 131 Sola de Vega-Puerto Escondido, en el municipio de San Pedro Mixtepec, Distrito de Juquila, Oaxaca. Se sitúa entre las coordenadas N 15°54'14.75", 15°55'1.06" y O 97°04'52.93", 97°04'29.21", a una altitud entre 80 y 145 m s. n. m (Figura 1a).
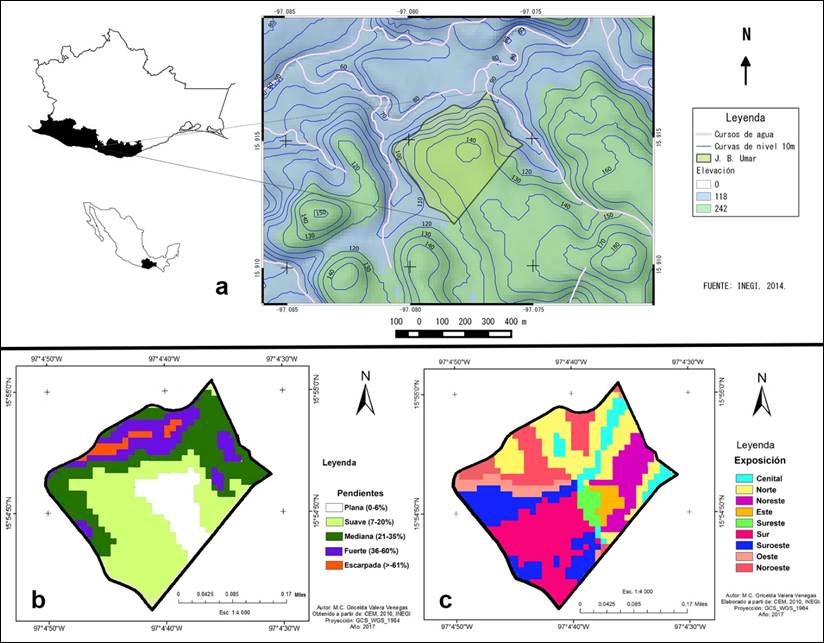
Figura 1 Ubicación geográfica de la UMA-JBPE. a: mapa de relieve y altitud; b: pendientes del terreno; c: orientación de la superficie.
Su relieve está constituido por lomeríos suaves a pronunciados y pequeñas cañadas con pendientes fuertes a muy escarpadas, pero predominan las áreas planas a muy onduladas. Los tipos de suelos que se reportan son feozems, leptosoles y regosoles eútricos. Se presenta un clima cálido subhúmedo (Aw) con lluvias en verano de cuatro meses y sequía por el resto del año con temperatura promedio de 27 °C. El tipo de vegetación que existe es el BTC en donde destacan especies de las familias Anacardiaceae, Asteraceae, Burseraceae, Cactaceae, Fabaceae, Malpighiaceae y Rubiaceae, entre otras (INEGI, 2004, 2007, 2013a).
Recopilación de datos y mapeo
Se trabajó con un total de 251 muestras de macromicetos, los cuales fueron recolectados por el primer autor realizando recorridos aleatorios dentro de la zona de estudio durante la temporada de lluvias de los años 2007 al 2020. Los ejemplares están registrados en una base de datos de campo y depositados en el Laboratorio de Colecciones Biológicas de la Universidad del Mar, campus Puerto Escondido (LCB-UMAR). A partir de la revisión de la base de datos se obtuvo información de los especímenes sobre el sustrato de preferencia, así como las coordenadas geográficas de donde fue recolectado, las cuales fueron determinadas en su momento con un geoposicionador Garmin eTrex Vista HCX a una resolución de ± 5 m.
Se elaboraron mapas de altitud, pendiente y exposición solar a partir de un análisis espacial del área en Quantum GIS Wien versión 2.8.1. de código libre. Se utilizó una porción del Continuo de Elevaciones 3.0 (CEM 3.0 resolución 15 m), y datos de referencia como vías terrestres y causes de ríos y arroyos, así como cartografía temática de uso del suelo y vegetación escala 1:250 000 serie V (INEGI, 2013b, 2013a) (Figura 1a-c). Las características topográficas de los sitios donde fueron recolectados los ejemplares de estudio se determinaron posicionando las coordenadas geográficas de cada espécimen registradas en la base de datos en los mapas topográficos previamente elaborados.
Toda la información recopilada de la base de datos de campo y del mapeo de las coordenadas geográficas de los especímenes se encuentra disponible en el Anexo 1.
Análisis de datos
Se generó una matriz de datos considerando el número de especies registradas por preferencia de sustrato (humícolas, lignícolas, terrícolas, entomopatógenos) y el número de especies presentes en cada una de las variables topográficas (pendiente, orientación y altitud). Se realizó un análisis de correlación entre las variables con la función COEF.DE.CORREL (PEARSON) de la paquetería de Excel (Microsoft Office Profesional Plus 2016).
Resultados
Riqueza específica
La revisión de la base de datos de los especímenes depositados en el LCB-UMAR permitió conocer la existencia de 169 morfoespecies, incluidas cinco con la connotación de “afinis” y cuatro más identificadas a nivel de familia. Solo el 42% de las especies están determinadas taxonómicamente por sus características morfológicas, 14 de ellas complementadas con una identificación molecular (Villarruel-Ordaz et al., 2021). Las especies identificadas se distribuyen en dos divisiones diferentes, 14 especies pertenecen a la división Ascomycota y 155 a Basidiomycota. Se reconocen cinco clases con 18 órdenes, siendo los mejor representados los Agaricales con 43 géneros y 102 especies, Polyporales con 19 géneros y 25 especies y Xylariales con cuatro géneros y 11 especies. Sobresalen los géneros Agaricus, Geastrum, Lepiota, Leucoagaricus, Leucocoprinus, Marasmius, Psatyrella y Xylaria, todos ellos con más de cinco especies (Anexo 1).
Hábitos eco-nutricionales y preferencias de sustrato
De acuerdo a la preferencia de sustrato registrada en la base de datos de los especímenes estudiados, 20.5% de las especies se desarrollaron sobre la hojarasca (humícolas), 32.3% en madera (lignícolas), 45.8% crecieron en el suelo (terrícolas) y solo 1.1% sobre larvas de insectos (entomopatógenos). La forma de vida que predominó en la zona de estudio fue el saprotrofismo con 93.5% de las especies, le siguieron las micorrícicas, las cuales representaron 4.1%, y por último las parásitas con 2.3% (Figura 2).
Variables topográficas
Sobre el mapa de la superficie de la UMA-JBPE se determinaron cinco categorías de pendientes: escarpadas (> de 51%), fuertes (36-50%), medianas (21-35%), suaves (7-20%) y planas (0-6%); las tres últimas, son las más representativas en la zona de estudio (Figura 1b). Alrededor del 73% de las especies registradas se distribuyeron en las pendientes medianas y suaves, y representan el 42.5% y 30.6% respectivamente. Le siguieron las pendientes planas con 13.8%, mientras que las pendientes fuertes presentaron la menor cantidad con solo 12.9% de los registros. Con base en la preferencia de sustrato, las especies terrícolas constituyeron el grupo predominante con el 48.7% de los registros, seguidas por las lignícolas con 30.1%. Se observó la presencia de especies humícolas, con el 20.1% de los registros, y un último grupo más especializado que representa 1% de las especies sobre larvas de insectos (Figura 3).
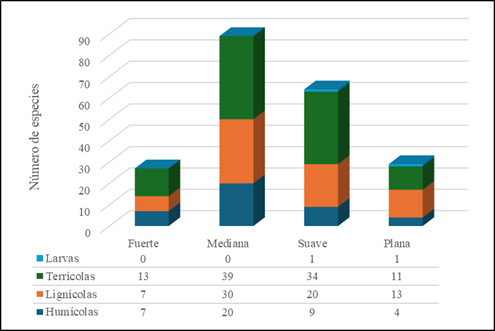
Figura 3 Distribución de especies de acuerdo a las preferencias nutricionales en relación a las diferentes pendientes observadas en la UMA-JBPE.
En cuanto a la orientación de los sitios de recolecta, se determinaron nueve tipos en la superficie de la UMA-JBPE: cenital, norte, sur, este, oeste, noreste, noroeste, sureste y suroeste (Figura 1c), siendo las áreas en dirección norte, noreste y noroeste, las que acumularon alrededor del 70% de los registros; mientras que las áreas con una orientación sur, suroeste y sureste, tuvieron una cantidad menor, con solo 2.7% del total de especies. Se observó una mayor proporción de especies con preferencia por sustratos terrícolas (46.3%) en comparación con las especies lignícolas (32.4%) y humícolas (20.2%). Esta tendencia es la misma en todas las condiciones de orientación analizadas, con la excepción de la parte del terreno con orientación sur y sureste, donde se registró una cantidad igual o incluso mayor de especies lignícolas. Cabe destacar que, en estas dos orientaciones, el porcentaje de especies es bastante reducido (Figura 4).

C: zenith, E: East, NE: northeast, NW: northwest, N: north, W: west, S: south, SE: southeast, SW: southwest.
Figura 4 Distribución del número de especies por preferencias nutricionales en relación a la exposición solar.
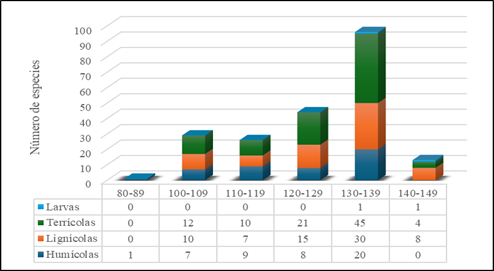
Con relación a la altitud, la riqueza de especies aumentó a medida que se asciende. El intervalo altitudinal de 130 a 140 m sobresalió por contener 45.9% del total de registros. Se observó un descenso gradual en la concentración de especies a medida que disminuye la altitud, en donde el intervalo de 120 a 130 m presentó alrededor del 21% de las especies. Posteriormente, los intervalos altitudinales de 110 a 120 m y de 100 a 110 m registraron el 12.4% y 13.8% de las especies, respectivamente. De manera consistente con las tendencias observadas en las pendiente y orientación del terreno, se mostró preferencia por el sustrato terrícola con un predominio a lo largo de todo el intervalo altitudinal, representando el 44.0% del total de especies, seguida por las lignícolas con 33.4%, y posteriormente las humícolas con 21.5%. En último lugar se encontraron las especies entomopatógenas, con una presencia mínima del 0.9% (Figura 5).
Coeficientes de correlación
Para establecer la relación entre los elementos topográficos evaluados, se llevó a cabo un análisis que involucró el número de especies registradas en las cuatro categorías de preferencias de sustrato: terrícolas, lignícolas, humícolas y entomopatógenas. Este análisis se realizó en función de las variables de estudio, que incluyeron la pendiente, orientación y altitud.
Los coeficientes obtenidos en este análisis revelan una correlación positiva entre estas variables.
Los valores más altos de correlación se observaron en los siguientes casos:
Entre pendientes medianas a suaves y orientación norte, con coeficientes de 0.987 y 0.983 respectivamente.
Entre pendiente mediana y un intervalo de altitud de 120 a 140 m, con coeficientes de 0.991 y 0.989 respectivamente.
Finalmente, entre orientación norte y un intervalo de altitud de 120 a 140 m, con coeficientes de 1.00 y 0.992 de manera respectiva.
Discusión
Diversidad de especies
Uno de los retos que enfrentan los estudios relacionados con los hongos en su entorno natural, radica en la dificultad asociada a la identificación certera de las especies. En numerosos casos, resulta imprescindible lograr una determinación precisa. Algunos estudios preliminares han revelado que aproximadamente el 70% de las especies encontradas en bosques tropicales pueden ser clasificadas en morfoespecies basadas solo en sus características macroscópicas (Braga-Neto et al., 2008), no obstante, el bajo porcentaje de determinación taxonómica a nivel de especie observada en este trabajo (42% de las morfoespecies reconocidas), refleja la falta de investigaciones sistemáticas sobre la funga macroscópica tropical; la cual pudiera servir de referencia (Guzmán, 1998; Villarruel-Ordaz et al., 2021). Los trabajos sobre diversidad de hongos indican que los trópicos concentran una enorme variedad de especies (O’Brien et al., 2005; Tedersoo et al., 2014), por lo que se sugiere poner mayor énfasis en el desarrollo de este tipo de estudios que ayuden a revertir el escaso conocimiento que se tiene de la diversidad fúngica en general. Los estudios sobre la diversidad a través del inventario de especies, son fundamentales para comprender la dinámica de los ecosistemas ya que proporcionan información vital para identificar patrones de distribución, como han señalado diversos autores (Braga-Neto et al., 2008; Cannon & Kirk, 2007; Cifuentes & Guzmán, 1981; Guzmán & Piepenbring, 2011; Lodge, 2001; Sunum et al., 2015; Viña, 2014), quienes han observado que géneros como Xylaria, Agaricus, Lepiota, Psathyrella, Marasmius y Marasmiellus, entre otros, tienden a ser muy representativos en regiones tropicales, una tendencia que también se observó en nuestra área de estudio (Anexo 1).
Formas de vida y preferencias de sustrato
El hábito eco-nutricional que predominante en la UMA-JBPE es el saprotrofismo, con 159 especies registradas (Figura 2). Este resultado concuerda con investigaciones previas llevadas a cabo en zonas tropicales, las cuales han indicado que la diversidad de especies saprobias es más amplia en ecosistemas tropicales que en regiones templadas (Caiafa et al., 2017; Hu et al., 2022; Lodge & Cantrell, 1995; Tedersoo et al., 2014; Viña, 2014). Es necesario considerar cuáles son las preferencias de sustrato que exhiben los macromicetos saprobios. Montoya et al., (2010) llevaron a cabo un análisis de la diversidad de especies saprobias en una región tropical de Colombia, en el cual consideraron seis categorías de sustratos, siendo las especies que se desarrollan sobre madera muerta (lignícolas) las que presentaron una mayor diversidad. Es evidente que ese patrón está muy relacionado con la disponibilidad de recursos presentes en el entorno, y ésta a su vez, influenciada por la estructura del dosel, ya que las plantas son quienes aportan la mayor cantidad de materia orgánica. En ese sentido, el BTC se caracteriza por el desprendimiento de sus hojas a lo largo de un período de 5 a 7 meses (Pennington & Sarukhán, 2005), lo que constituye una enorme fuente de biomasa en forma de hojarasca y pequeñas ramas. Esto podría suponerse que el sustrato preferencial para las especies saprobias es el humícola, sin embargo, las condiciones climáticas influyen de manera significativa, dando como resultado una velocidad de descomposición de la materia orgánica cuatro veces mayor que en áreas de climas templados (Álvarez-Sánchez, 2001; Guariguata & Kattan, 2002).
En este trabajo se adoptaron tres categorías de preferencia nutricional para las especies saprobias: humícolas, lignícolas y terrícolas. Se determino que en la zona de estudio 71 especies mostraron preferencia hacia los nutrientes disueltos en el suelo, seguidas por aquellas que se alimentan de material lignocelulósico (lignícolas) y por último las que degradan la hojarasca (Figura 2). Estos datos soportan la idea de que la descomposición veloz de la hojarasca resulta en una disponibilidad limitada de este tipo de sustrato para muchas especies de macromicetos, lo cual estaría impulsando la necesidad de recurrir a otras fuentes de nutrientes, como el suelo para las especies edáficas o los restos de madera para las especies lignícolas.
La presencia de especies humícolas está condicionada por la composición de la comunidad de plantas, lo cual se debe a la selectividad de ciertos grupos taxonómicos. Por ejemplo, los géneros Marasmius y Marasmiellus presentan correspondencia con la distribución de algunas plantas fanerógamas (Readhead, 1989), y aunque se han identificado ciertos patrones de asociación entre los hongos saprobios y el sustrato de hojas proveniente de diferentes familias de plantas, la información cualitativa en torno a este tema es limitada (Braga-Neto et al., 2008). En la zona de estudio, aproximadamente una quinta parte de las especies humícolas registradas pertenecen a esos dos géneros, y es muy probable que sigan algún patrón de asociación con las especies vegetales de mayor presencia en la UMA-JBPE, como son: Vachellia farneciana (L.) Wight Arn., Ceiba pentandra (L.) Gaertn., Heliocarpus pallidus Rose, Comocladia mollissima Kunth, Cochlospermum vitifolium (Willd.) Spreng, Bursera simaruba (L.) Sarg., Spondias purpurea L., entre muchas otras más propias de la vegetación secundaria de la selva baja caducifolia.
El análisis de los hongos lignícolas presenta una complejidad notable debido a la diversidad de nichos que ocupan. Algunas especies presentes en el área de estudio como Daldinia eschscholtzii (Ehrenb.) Rehm, Schizophyllum commune Fr., Fabisporus sanguineus (L.) Zmitr. y otras tantas de la familia Polyporaceae con cuerpos reproductores grandes y perennes, se han adaptado a sobrevivir en restos leñosos expuestos al sol y en ambientes secos (Bässler et al., 2010), mientras que otras muestran preferencia por áreas sombrías y húmedas. Además, factores como el tamaño del material leñoso, su grado de descomposición y la presencia de otros hongos, influyen en su microhábitat (Aiartzagueña et al., 2016; Lodge & Cantrell, 1995). La combinación de características afecta la disponibilidad de nutrientes y da como resultado una variación en la comunidad de hongos que coloniza dicho entorno. De cualquier modo, evaluar la actividad fisiológica y cuantificar la abundancia de especies en sustratos como hojarasca, suelo o restos leñosos, es una tarea compleja como lo señalan Baldrian et al. (2013).
Otro grupo eco-nutricional registrado para la UMA-JBPE es el de las especies micorrícicas, con tan solo siete especies (Figura 2). Es importante destacar que en este trabajo se limitó a la información registrada en la base de datos consultada sobre los hongos macroscópicos epigeos que forman ectomicorrizas. Esta restricción podría subestimar la proporción real de hongos con esa forma de vida en el ecosistema. La proporción de hongos que forman ectomicorrizas podría ser más elevada de lo que se sugiere en este estudio si se considera que, en bosques saludables, el número de hongos micorrícicos podría igualar o incluso superar a las especies saprobias en términos de riqueza específica (Hu et al., 2022; Montoya et al., 2010). Es importante mencionar que la mayoría de la información que se tiene sobre las micorrizas se basa en estudios realizados en regiones templadas, donde se encuentra una mayor proporción de hongos ectomicorrícicos como lo señala Tedersoo et al. (2014). No se descarta la posibilidad de que muchas de las especies que fueron registradas como saprobias con preferencia por sustratos edáficos, en realidad estuvieron estableciendo relaciones mutualistas con plantas. Algunas especies de géneros como Sebacina, Trechispora, Naucoria, Clavulina y Geastrum han sido citadas como hongos ectomicorrícicos (Pérez-Moreno & Read, 2004; Rinaldi et al., 2008), sin embargo, en el presente estudio algunas especies de esos géneros fueron registradas como saprobias. Resulta imperativo explorar alternativas metodológicas para determinar de manera más precisa la forma de vida de las especies fúngicas (Álvarez-Manjarrez et al., 2021; Garibay-Orijel et al., 2013; Smith et al., 2011).
El gremio menos representado en la UMA-JBPE es el de los hongos parásitos de plantas e insectos, los cuales tienen preferencia por sustratos vivos (Figura 2). En el área de estudio se registró a Ophiocordyceps sobolifera (Hill ex Watson) G.H. Sung, J.M. Sung, Hywel-Jones & Spatafora, y a una especie aun no identificada de Cordyceps sp., creciendo sobre larvas de insectos. Las diferentes especies de Cordyceps muestran una alta especificidad hacia ciertos grupos de insectos, la cual puede deberse a las características físicas y bioquímicas del hospedante, así como a las adaptaciones evolutivas del hongo (Benjamin et al., 2004; Del Valle & Robledo, 2019; Viña, 2014).
En el caso de los hongos parásitos de plantas, es esencial resaltar que diversas especies catalogadas como saprobias han demostrado tener la capacidad de actuar como parásitos facultativos durante ciertas etapas de su ciclo vital. Dentro de los órdenes Hymenochaetales y Polyporales, se ha observado que numerosas especies crecen de manera parasitaria en árboles vivos; y una vez que el árbol fallece, los hongos muestran la capacidad de adoptar un comportamiento saprobio (Cooke & Whipps, 1980; Stokland et al., 2012; Valenzuela et al., 2004). En la zona de estudio Earliella scabrosa (Pers.) Gilb. & Ryvarden y Fabisporus sanguineus (L.) Zmitr. mostraron ese comportamiento, lo cual corrobora lo reportado por Gilbert et al. (2008). Es probable que ese fenómeno sea más común de lo que se ha documentado hasta ahora.
Variables topográficas
Tanto la inclinación como la orientación de las laderas desempeñan un papel fundamental como factores determinantes de las condiciones microclimáticas, lo que a su vez afecta el desarrollo de las poblaciones fúngicas (Caiafa et al., 2017; Chen et al., 2018; Hu et al., 2022). Estos factores desempeñan un papel fundamental en la comprensión de las variaciones en el movimiento superficial e interno del escurrimiento y la humedad del suelo, lo cual es crítico para el desarrollo de los hongos, como lo han demostrado varios estudios (Aiartzagueña et al., 2016; Mazzola et al., 2008; Pinna et al., 2010; Serrada, 2011; Viña, 2014). En la UMA-JBPE, las pendientes demostraron ser una variable significativa en la distribución de especies. La mayor riqueza de especies se observó en las pendientes medianas, seguida de las suaves, con un total de 89 y 64 especies (Figura 3). En estas pendientes, los géneros mejor representados fueron Lepiota y Marasmius, con 12 y 10 especies, respectivamente (Anexo 1).
En terrenos con pendientes pronunciadas, el agua tiende a moverse más rápido hacia las partes bajas lo que ocasiona un aumento en la escorrentía superficial, esto significa que el agua fluye sobre la superficie en lugar de infiltrarse en el suelo (Reyna et al., 2010; Shaxson & Barber, 2005). Esta condición genera que la concentración de humedad y disponibilidad de agua sea menor en las partes más altas de las laderas, de manera particular aquellas con pendientes fuertes y escarpadas, lo cual explicaría el por qué en el área de estudio la diversidad de especies es menor en ese tipo de pendientes, ya que la capacidad de retención de agua condiciona la fructificación de los hongos; además, en los terrenos con pendientes muy pronunciadas, los riesgos de erosión son más elevados y por lo tanto una menor capacidad de retención de nutrientes. En el otro extremo, las porciones del terreno con pendientes planas acumulan una mayor cantidad de agua en el suelo lo cual puede tener un efecto limitante sobre la fructificación de las especies como lo han demostrado Pinna et al. (2010). Esto explicaría la baja diversidad de especies que se observó en las pendientes planas en la UMA-JBPE.
La orientación del terreno también tiene un efecto limitante en la distribución de la macrofunga. Este parámetro ecológico es complejo y puede estar influenciado por otros factores como el tiempo de exposición al sol, el viento, y otros factores climáticos. En el hemisferio norte, las laderas con exposición sur reciben mayor cantidad de radiación solar y tienden a ser más cálidas y secas; mientras que las laderas con orientación norte están menos expuestas a la insolación y suelen ser más frescas y húmedas (López-Gómez et al., 2012). En la zona de estudio las laderas que tienen orientación hacia el norte presentaron una mayor riqueza de especies (Figura 4), lo cual sugiere que la luz solar es un factor que influye en la temperatura y la humedad del suelo, lo que a su vez afecta las condiciones para el crecimiento y la reproducción de las especies fúngicas.
La altitud constituye un factor ligado al relieve del terreno, lo que conlleva a la necesidad de tener en cuenta esta interacción al tratar de identificar patrones relacionados con dicho parámetro. A pesar del limitado intervalo altitudinal que se presenta en la UMA-JBPE, 80 m en la parte más baja y 145 m la parte más alta, es especialmente notable el intervalo de 130 a 140 m s.n.m. donde se registró la mayor cantidad de especies (Figura 5). Existen diversos estudios que han resaltado patrones específicos de distribución en función de la altitud (Gómez-Hernández et al., 2012, 2016; Martínez, 2021; Vásquez Díaz & Esquivel Vásquez, 2021; Vázquez Mendoza, 2008; Villarruel-Ordaz & Cifuentes, 2007). En esos trabajos se hace mención de otros factores igualmente influyentes, tales como el tipo de vegetación, el tipo de suelo presente, la pendiente del terreno y la temperatura ambiental, entre otros. El patrón observado en la zona de estudio confirma la persistente pauta decreciente en términos de diversidad a medida que disminuye la altitud.
Correlación entre las variables
El análisis de los coeficientes de correlación entre la altitud, la pendiente, la orientación del terreno y las preferencias nutricionales en términos de la riqueza de especies, reveló una relación positiva entre la pendiente y la orientación como lo han señalado otros autores (Aiartzagueña et al., 2016; Mazzola et al., 2008; Pinna et al., 2010; Serrada, 2011; Viña, 2014). Los valores más altos de correlación se observaron en las pendientes medianas y suaves con una orientación norte. Esta combinación de factores ejerció una influencia significativa en la riqueza de especies. Además, se encontró una correlación positiva entre la orientación y la altitud. Las laderas con orientación norte y un intervalo de altitud de 120 a 140 m presentaron una mayor diversidad de especies, mientras que, las laderas con pendientes medianas y un intervalo de altitud de 120 a 140 m. condicionaron la presencia de 63 especies de macromicetos. Los resultados demostraron que la relación entre la altitud, la pendiente y la orientación del terreno influye de manera directa en la riqueza y las preferencias nutricionales de las especies estudiadas, con implicaciones importantes para la comprensión de la biodiversidad en la zona. La correlación de las variables consideradas en el presente estudio determinó que, de las 169 especies analizadas, 94 especies se distribuyen en un intervalo de altitud de los 120 a 140 m, principalmente en laderas que tienen una pendiente mediana y suave y con una exposición a la luz solar determinada por la orientación norte, noreste y noroeste. La forma de vida que predomina es el saprotrofismo, igual que lo reportado en otros bosques tropicales (Caiafa et al., 2017; Hu et al., 2022; Lodge & Cantrell, 1995; Tedersoo et al., 2014; Viña, 2014). En estas condiciones la mayoría de las especies tiene preferencia por un sustrato edáfico, seguido por las lignícolas y por último las humícolas.
Conclusiones
El saprotrofismo es el hábito predominante en la zona de estudio, el cual está estrechamente relacionado con la abundante materia orgánica presente en el Bosque Tropical Caducifolio (BTC) y las condiciones climáticas que lo caracterizan. Las especies saprobias terrícolas fueron las más representativas, seguidas por las saprobias lignocelulósicas y por último las humícolas.
Las pendientes medianas y suaves con orientación norte y a un intervalo de altitud de 120-140 m son los sitios donde se presenta la mayor riqueza de especies. Estos datos tienen implicaciones significativas en la comprensión de la biodiversidad de macromicetos en la UMA-JBPE ya que son relevantes para las estrategias de manejo y conservación de los recursos naturales.
En general, los resultados del estudio sugieren que la Unidad de Manejo Ambiental para la Conservación de Vida Silvestre “Jardín Botánico Puerto Escondido” es un ecosistema con una importante diversidad de macromicetos. La combinación de factores ambientales, como el clima, el tipo de vegetación y el relieve, juegan un papel fundamental en la distribución y preferencias nutricionales de las especies registradas.
Se recomienda realizar estudios más detallados sobre la influencia de los factores ambientales en la diversidad de macromicetos, incluyendo variables como la temperatura, la humedad, el pH del suelo y la composición de la vegetación, así como promover la conservación de los bosques tropicales, ya que son ecosistemas que albergan una gran diversidad biológica.











 nueva página del texto (beta)
nueva página del texto (beta)