Introducción
El término cáncer comprende un conjunto de enfermedades que presentan un crecimiento celular descontrolado, así como la diseminación de células anormales hacia diversos tejidos del cuerpo (Siegel et al., 2022; Thummadi et al., 2022). Actualmente es un importante problema de salud pública, ya que se ha convertido en la segunda causa de muerte en el mundo (Kargozar et al., 2022; Siegel et al., 2022).
En 2021 los tumores malignos representaron el 8% de las defunciones en México y se ha registrado un aumento constante en la tasa de defunciones de 6.09 por cada 10 mil personas en 2010 a 7.06 en 2021 (INEGI, 2021). Respecto a la incidencia, el cáncer de mama y el cérvico uterino fueron los de mayor morbilidad en mujeres, en tanto que el cáncer de próstata, colón y pulmón afectaron principalmente a los hombres (GLOBOCAN, 2020).
Aunado a lo anterior el cáncer presenta una gran mortalidad, esto debido a que es un proceso multifactorial que obedece tanto a agentes exógenos como endógenos (Thummadi et al., 2022). Dentro de los elementos más comúnmente asociados con el desarrollo de un proceso carcinogénico se encuentran el estrés oxidativo y el proceso inflamatorio crónico (Nitin Singh et al., 2019).
El estrés oxidativo se refiere al desequilibrio entre la producción de agentes oxidantes, por medio del metabolismo celular, y su eliminación mediante antioxidantes (Crespo et al., 2020). Este desequilibrio conlleva al daño de biomoléculas y células del organismo, ocasionando inestabilidad cromosómica, mutación genética y/o modulación de vías de señalización (Aggarwal et al., 2019). Los principales agentes oxidantes son las especies reactivas de oxígeno (EROs); sin embargo, el organismo también produce óxido nítrico (NO), el cual a su vez produce especies reactivas de nitrógeno (ERNs), mismas que poseen la capacidad de aumentar el riesgo de mutagénesis (Korde Choudhari et al., 2013). Un ambiente constante de estrés causa que las especies reactivas se produzcan durante un gran periodo de tiempo y que, a su vez, se genere un daño fisiológico en las células y tejido circundante que estimule un proceso de inflamación prolongado, el cual promueve el crecimiento, proliferación, supervivencia y metástasis de las células cancerosas (Todoric & Karin, 2019). De manera que para prevenir y resolver un proceso canceroso se requieren de terapias que no solo tengan actividad anticancerígena, sino que también exhiban propiedades antioxidantes y antiinflamatorias.
A causa de que las terapias convencionales contra el cáncer no son suficientes, suelen provocar toxicidad y numerosos efectos secundarios, se lleva a cabo una búsqueda continua de agentes quimioterapéuticos. Y en este esfuerzo han sido las plantas las que más han despertado el interés como fuente potencial de moléculas o fitofármacos bioactivos usando como principal herramienta de bioprospección la información de la etnofarmacopea (Kargozar et al., 2022; Ochatt et al., 2022; Purwianingsih et al., 2016).
En los estados de Baja California y Sonora se distribuye Acalypha californica Bentham. Esta planta es un arbusto semileñoso y perenne, utilizado ampliamente por los grupos étnicos para tratar el cáncer, por lo que se conoce comúnmente como "hierba del cáncer". En un estudio previo se demostró que el extracto metanólico de A. californica y sus fracciones de solventes poseían actividad antiproliferativa media en las líneas celulares murinas M12.Ak.C3.F6, RAW 264.7 y L929, así como en la línea celular cancerosa humana HeLa y que dicho efecto era debido a la activación de la apoptosis; adicionalmente se realizó un perfil químico de las sustancias contenidas en las fracciones con mayor actividad encontrando principalmente proantocianidinas y algunos ácidos fenólicos. Aunque dicho estudio fue el primero en brindar información sobre las actividades biológicas y la composición química de la planta, con excepción de la línea HeLa, no fue evaluada la actividad en otras líneas celulares cancerosas humanas (Rascón-Valenzuela et al., 2015).
Debido a la recolección aleatoria por parte del herbolario local y a la destrucción de su hábitat por la actividad antropogénica, es necesario tomar medidas encaminadas a la permanencia de A. californica, entre las que se propone la búsqueda de métodos de propagación y técnicas de cultivo comercial para esta planta medicinal (Khan et al., 2021; Pimentel et al., 2010; Sampayo-Maldonado, 2018).
El cultivo in vitro es una técnica que explota la totipotencilidad de las células para inducir la división celular, morfogénesis y desarrollo de la planta a partir de un cultivo aséptico de diferentes tipos de explantes en un medio de cultivo, esto con la finalidad de obtener callos. El callo es una masa de células indiferenciadas, que se desarrolla en respuesta a agentes químicos o lesiones físicas (Babich et al., 2021). Para obtenerlos se debe optimizar el medio de cultivo, realizando variaciones en la concentración de nutrientes, minerales, sustancias orgánicas y reguladores de crecimiento de las plantas (Alcántara et al., 2019). Los reguladores de crecimiento son sustancias que inducen respuestas fisiológicas tales como el desarrollo de raíces, la inducción de callos o el brotamiento. Entre los reguladores de crecimiento más utilizados en el cultivo in vitro de plantas se encuentran la auxina ácido indolbutírico (AIB), hormona que regula el crecimiento de la planta, la citocinina 6-bencilaminopurina (BAP) que promueve la división y la diferenciación y la cinetina (CIN) que promueve la división celular. Dichos reguladores de crecimiento pueden actuar diferencialmente dependiendo de la especie de planta, las dosis usadas y las combinaciones de estas (De-Souza et al., 2022; Ríos-Ramírez et al., 2017).
Tomando en cuenta que A. californica es una planta utilizada ampliamente por las personas para el tratamiento empírico del cáncer lo cual la hace blanco de la recolección desregulada de biomasa silvestre, que no han sido probadas las actividades biológicas relacionadas con la carcinogénesis tales como la actividad antioxidante y antiinflamatoria, y que existe información limitada sobre su composición, el objetivo del presente estudio fue encontrar las condiciones de formación de callos para el cultivo in vitro de A. californica; así como también medir las actividades antioxidante, antiinflamatoria y antiproliferativa en líneas celulares cancerosas humanas y determinar su perfil químico. Todo lo anterior como un primer esfuerzo para caracterizar química y biológicamente las etapas del desarrollo de la planta in vitro y encontrar las condiciones en las cuales se produzcan las sustancias bioactivas que validen su uso etnofarmacológico.
Materiales y métodos
Material vegetal
Las partes aéreas de A. californica fueron recoletadas en septiembre del 2018 en el Cerro del Bachoco, en la ciudad de Hermosillo, Sonora, México (29º8’51.3’’ N, 110º57’0’’O, matorral semidesértico, temperatura promedio 32°C, humedad relativa media 56%). La planta fue identificada en el herbario de la Universidad de Sonora y se le asignó el número de registro 026567.
Inducción de callos
Para la inducción de los callos fueron elegidos tallos juveniles de A. californica obtenidos en la colecta, los cuales fueron lavados con agua corriente durante veinte minutos, luego con detergente mediante agitación manual por tres minutos. Para la asepsia las muestras fueron colocadas en alcohol al 70% (v/v) durante 60 segundos, seguido de un lavado en solución de hipoclorito de sodio al 12% con una gota de Tween 20 durante 15 minutos. Finalmente, los tallos fueron enjuagados con agua destilada estéril en tres ocasiones. Los explantes seleccionados para el estudio fueron hojas, pecíolos, yemas y segmentos nodales, mismos que fueron cortados en trozos de 0.5 - 1.0 cm con un bisturí estéril.
Para realizar el cultivo in vitro fue utilizado el medio para plantas leñosas Woody Plant Medium (WPM) suplementado con diversas concentraciones (0,0.5,1.0,1.5,2.0 mg/L) de ácido indolbutírico (AIB), 6-bencilaminopurina (BAP) o cinetina (CIN), siguiendo la metodología empleada por (Majumder & Rahman, 2016). El pH del medio de cultivo se ajustó a 5.7 antes de adicionar el agar y la sacarosa, después se vertieron 25 mL de medio en frascos de vidrio, todo en condiciones de esterilidad.
Posteriormente, el medio que se encontraba en los frascos fue inoculado con los diversos explantes y se mantuvieron con un fotoperíodo de 16 horas luz a 27±1 °C de temperatura. El subcultivo se realizó en un medio de igual composición al que permitió la callogénesis. El medio sin reguladores de crecimiento vegetal fue utilizado como control.
Porcentaje de inducción de callos y morfología
Los datos sobre la inducción de callos (%) se registraron con la ayuda de la siguiente fórmula: Porcentaje de inducción de callos = (Nº de explantes que produjeron callos/Nº de explantes) ×100. En la inducción completa del callo para cada tratamiento se examinaron visualmente la textura y el color.
Preparación del extracto etanólico de callos de A. californica
El extracto etanólico fue obtenido mediante maceración de los callos liofilizados (6 semanas de crecimiento, crecidos en WPM+1.5 mg/L de AIB) con etanol al 70% en proporción 1:10 durante diez días con agitación intermitente a temperatura ambiente. El solvente fue removido mediante evaporación bajo presión reducida a 40 °C en un evaporador rotatorio (IKA, RV 10 digital, Wilmington, NC, USA). El extracto concentrado fue guardado a 4 °C, protegido de la luz, para su uso en ensayos posteriores.
Cultivo celular
Para los ensayos de actividad antiproliferativa se utilizaron como modelos las líneas celulares cancerígenas humanas A549 (carcinoma pulmonar) (ATCC CRM-CCL-185), HeLa (adenocarcinoma cervicouterino) (ATCC: CCL-2), MCF-7 (adenocarcinoma mamario) (ATCC: HTB-22) y ARPE-19 (no cancerosa, epitelio pigmentado de la retina) (ATCC:CRL2302). En tanto que para el ensayo de actividad antiinflamatoria mediante la medición de óxido nítrico se utilizó como modelo la línea murina RAW 264.7 (macrófagos transformados por el virus de la leucemia de Abelson) (ATCC: TIB-71). Todas las líneas celulares fueron adquiridas de la American Type Culture Collection (ATCC, Rockville, MD, EUA). Cada línea se mantuvo en el medio de cultivo DMEM alto en glucosa suplementado con 1% (v/v) de solución de penicilina-estreptomicina (10000 unidades de penicilina y 10 mg de estreptomicina/mL), 0.75% (v/v) de solución de L-glutamina 200 mM, 1% (v/v) de solución de piruvato de sodio 100 mM y 5% de suero fetal bovino. Las células fueron cultivadas en frascos de cultivo celular de 25 cm2 y fueron mantenidas a 37 °C en una incubadora con una atmósfera humidificada y con 5% de CO2. Las células se utilizaron para los ensayos una vez que se obtuvo el 80% de confluencia. Para despegar las células del fondo del frasco se utilizó una solución de tripsina-EDTA (Rascón Valenzuela, 2015).
Actividad antiproliferativa
La actividad antiproliferativa se evaluó mediante el ensayo de reducción de MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolio] Mossman, 1983, con algunas modificaciones. Las células (1 × 104 por pozo, 50 μL) fueron colocadas en cada pozo de una placa de 96 pozos y se incubaron durante 24 h a 37 °C en una atmósfera del 5% de CO2. Después se añadieron alícuotas de 50 µL de medio (DMEM 5% FBS) con un intervalo 6.25 a 200 μg/mL del extracto disuelto previamente en DMSO (concentración máxima de DMSO 0.5%) y las células estimuladas fueron incubadas durante 48 h. En las últimas 4 horas del período de incubación, el medio de cada pozo fue retirado y se realizó un enjuague con PBS 1X, posteriormente 100 µL de medio fresco fueron añadidos a cada pocillo, así como 10 µL de solución de MTT (5 mg/mL). El fármaco de amplio espectro doxorrubicina fue utilizado como control y con fines de comparación. La viabilidad celular se evaluó por la capacidad de las células metabólicamente activas para reducir la sal de tetrazolio a cristales de formazán, mismos que fueron disueltos con 100 µL de alcohol isopropílico ácido. La absorbancia de las muestras se midió con un lector de microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA), utilizando una longitud de onda de prueba de 570 nm y una longitud de onda de referencia de 630 nm. La absorbancia de las células tratadas únicamente con DMSO fue considerada como el 100% de proliferación. La actividad antiproliferativa del extracto fue reportada como valores de IC50 o en % de proliferación cuando no se haya podido inhibir el crecimiento del 50% de las células.
Contenido de fenoles totales (TPC)
El contenido fenólico total del extracto etanólico de los callos de A. californica se determinó utilizando el método de Folin-Ciocalteu adaptado a microplaca de 96 pozos (Sánchez-Rangel et al., 2013). Brevemente, se pesaron 10 mg del extracto seco y se disolvieron en 1 mL de metanol. Posteriormente 30 µL de la solución de extracto se mezclaron con 30 µL del reactivo de Folin-Ciocalteu al 10%. Las mezclas fueron incubadas por dos minutos a 40 °C. Seguidamente fueron adicionados a cada pozo 240 µL de Na2CO3 7% (p/v) y las mezclas fueron incubadas por 20 minutos a 40 °C. La absorbancia de cada pozo fue medida a una longitud de onda de 760 nm utilizando un espectrofotómetro de microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA). El contenido fenólico total de las muestras se calculó a partir de la curva de calibración de ácido gálico (0-58 mM). Los resultados fueron expresados como mmoles de equivalentes de ácido gálico (GAE) por gramo de extracto.
Contenido de flavonoides totales (TFC)
Para determinar el contenido total de flavonoides se evaluó la formación de complejos con aluminio (Shraim et al., 2021). En una microplaca de 96 pozos se colocaron 100 µL de agua desionizada, 10 µL de NaNO2 5 % (p/v) y 25 µL de extracto etanólico de A. californica previamente disuelto en metanol (10 µg/mL). La microplaca con las soluciones se incubó a temperatura ambiente, en oscuridad durante cinco minutos. Posteriormente, fueron añadidos 15 μl de solución de AlCl3 al 10% (p/v) a cada uno de los pozos y seguidamente se incubaron a temperatura ambiente durante seis minutos; finalmente fueron adicionados 50 µL de solución de NaOH 1 M y 50 µL de agua desionizada. La absorbancia de las muestras fue medida a 510 nm en un espectrofotómetro UV-Visible para microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA). El contenido total de flavonoides de las muestras se calculó a partir de la curva de calibración de quercetina (0-3.3 mM). Los resultados se expresan como mmoles de equivalentes de quercetina (QE) por gramo de extracto.
Estabilización del radical DPPH
La actividad antioxidante por estabilización del radical DPPH (1,1- difenil- 2- picrilhidrazilo, 2,2- difenil- 1- (2,4,6- trinitrofenil) hidrazilo) se determinó según Molyneux 2004 con algunas modificaciones. Primero fueron disueltos 2.5 mg del radical en 100 mL de metanol, ajustándose la absorbancia a 0.700 ± 0.01. En una microplaca de 96 pocillos se añadieron 200 µL del radical, y alícuotas de 20 µL de diferentes concentraciones del extracto (concentración final de 50-1000 µg/mL). Finalmente, las mezclas fueron incubadas por 30 minutos protegidas de la luz. La absorbancia fue medida en un espectrofotómetro UV-Visible para microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA) empleando una longitud de onda de 515 nm. Se empleó un blanco reactivo y el flavonol quercetina como control positivo. Los porcentajes de inhibición fueron determinados mediante la siguiente ecuación:
Poder Antioxidante Reductor Férrico (FRAP)
Para evaluar la actividad antioxidante mediante el ensayo FRAP, inicialmente se prepararon varias soluciones: buffer de acetatos 300 mM (pH 3.6), ácido clorhídrico 40 mM, solución TPTZ (2,4,6-Tris (2-piridil)-S-triazina) 10 mM (en HCl 40 mM) y una solución de cloruro férrico 20 mM. La solución FRAP se obtuvo mediante la adición de buffer de acetatos, solución TPTZ y solución de cloruro férrico con una relación 10:1:1, respectivamente. Posteriormente se colocaron 270 µL del reactivo FRAP en una microplaca de 96 pocillos y se le añadieron alícuotas de 20 µL con diferentes concentraciones del extracto (100, 500 y 1000 µg/mL). A continuación, se incubó la microplaca protegida de la luz durante 30 minutos. La absorbancia fue medida a una longitud de onda de 593 nm en un espectrofotómetro UV-Vis para microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA). Los resultados se expresaron como mmoles de Fe2+/g de muestra mismos que fueron obtenidos mediante una curva de calibración de Fe2SO4 con un intervalo de concentraciones de 7.82 a 250 µmoles de Fe2+.
Actividad antiinflamatoria
La medición de la actividad antiinflamatoria se llevó a cabo según (Schmölz et al., 2017). Los macrófagos RAW 264.7 se cultivaron a una densidad de 500 × 103 células/mL de medio en una placa de 24 pozos, en una atmósfera con 5% CO2 y 37 °C. Pasadas 24 horas, los cultivos fueron estimulados con concentraciones de 25-200 µg/mL del extracto por dos horas (valores cercanos a la IC10), luego se agregó 1μg/mL de LPS a cada pozo, y las células estimuladas fueron incubadas por 24 horas. Posteriormente 50 μL de cada sobrenadante de los pozos fueron colocados en otra placa de 96 pozos y a cada uno se le adicionaron 50 μL de reactivo de Griess, la mezcla se dejó reaccionar por 10 minutos y la absorbancia fue medida a 540 nm, utilizando un espectrómetro UV-Vis para microplacas (Thermo Fisher Scientific Inc. Multiskan GO, Waltham, MA, USA). Como control de activación se tomó la absorbancia de las células estimuladas con LPS (100% de producción de óxido nítrico) y como control de no activación la absorbancia de aquellas que no se estimularon con LPS (línea base de producción de óxido nítrico). El fármaco de amplio espectro dexametasona fue utilizado como control negativo y con fines de comparación.
Identificación de Compuestos Fenólicos por ESI-IT-MS-MS
La identificación de compuestos fenólicos presentes en el extracto etanólico de callos de A. californica se realizó introduciendo los extractos (10 µg/mL p/v) mediante inyección directa a un espectrómetro de masas Varian 500-MS (Walnut Creek, CA, EE. UU.) equipado con una fuente de ionización por electrospray y un analizador de masas de trampa de iones, que fueron controlados por MS WorkStation software v.16 (Agilent Technologies, Santa Clara, CA, EE. UU.). El espectrómetro de masas fue operado en modo negativo. Se utilizó nitrógeno como gas nebulizador y helio como gas de colisión para medición de masa precisa a un flujo de 1 mL/min. El equipo se operó a un voltaje −17 KV, y temperatura capilar de 350 °C. Los espectros de masas se adquirieron en modo de escaneo completo en el rango de 100-2000 m/z. La manipulación del extracto se llevó a cabo con protección de la luz. La identificación de los metabolitos se realizó por fragmentación de segundo orden (MS/MS). La confirmación se realizó comparando los iones fragmentados con los reportados en la literatura utilizando y bases de datos como el Mass Spectrometry Data Center (https://chemdata.nist.gov/) y el MassBank (https://massbank.eu/MassBank/).
Análisis estadístico
Para el cálculo de los valores de IC50 o EC50 se analizaron los porcentajes de proliferación o de inhibición de al menos tres experimentos, por triplicado, y fueron sometidos a un análisis de regresión lineal o no lineal dependiendo del comportamiento de los datos. Para el cálculo de la regresión no lineal los datos fueron log transformados, normalizados y analizados para generar una curva dosis-respuesta y calcular los valores correspondientes (IC50 o EC50).
En todos los ensayos biológicos los resultados se presentan como la media de triplicados de tres experimentos paralelos ± desviación estándar. Las diferencias significativas entre medias se evaluaron por análisis de varianza de una vía (ANOVA), después de comprobar que los datos eran normales (prueba de Shapiro-Wilk) y homocedásticos, seguido por una prueba de Tukey. Las diferencias se consideraron significativas cuando p < 0.05. Los resultados se analizaron por medio del programa estadístico JMP, versión para Windows 11.0.0 y Graphad prism versión 8.0.
Resultados
Inducción de callos
Para establecer el cultivo in vitro de una planta la inducción de callos es un paso vital, esto se puede realizar a partir de un explante con un grado de diferenciación variable de sus tejidos, debido a un proceso de desdiferenciación y división celular, modulado por el tipo de explante, medio de cultivo, tipo y concentración de regulador de crecimiento entre otros factores (Prakasha & Umesha, 2018).
Con la finalidad de encontrar las mejores condiciones y el mejor explante para el cultivo de los callos de A. californica, pecíolos, yemas, hojas y segmentos nodales fueron inoculados en el medio Woody Plant Medium (WPM) especial para plantas leñosas, así como diferentes concentraciones de los reguladores de crecimiento vegetal 6-bencilaminopurina (BAP), cinetina (CIN) o ácido indol butírico (AIB) (Tabla 1).
Tabla 1 Efecto de diferentes concentraciones (mg/L) de AIB, BAP o CIN en el porcentaje de inducción de callo y el crecimiento promedio (cm) en hojas, pecíolos, yemas y segmentos nodales que produjeron callos, durante seis semanas de incubación*.
| Tratamientos | Hojas | Pecíolos | Yemas | Segmentos nodales | ||||
|---|---|---|---|---|---|---|---|---|
| % I | CP (cm) | % I | CP (cm) | % I | CP (cm) | % I | CP (cm) | |
| Control | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| AIB | ||||||||
| 0.5 | 22.20 bc | 0.55 ± 0.10 b | 33.30 ab | 0.56±0.30 b | 16.30 c | 0.50±0.01 b | 15.60 c | 0.56±0.10 b |
| 1.0 | 9.00 c | 0.58 ±0.20 b | 34.10 ab | 0.50±0.30 b | 29.10 bc | 0.53±0.10 b | 14.90 c | 0.55±0.10 b |
| 1.5 | 33.30 a | 1.90 ± 0.15 a | 51.90 a | 2.96±0.20 a | 55.60 a | 0.56±0.10 b | 39.00 a | 1.85±0.40 a |
| 2.0 | 12.30 c | 0.58 ± 0.20 b | 18.50 bc | 0.60±0.10 a | 37.00 b | 0.90±0.45 b | 14.90 c | 0.58±0.20 b |
| BAP | ||||||||
| 0.5 | 10.30 c | 0.50 ± 0.23 b | 8.30 c | 0.50±0.16 b | 33.30 b | 0.51±0.10 b | 23.30 b | 0.65±0.10 b |
| 1.0 | 29.60 a | 3.20 ± 0.41 a | 44.60 a | 0.86±0.20 b | 49.90 a | 2.00±0.20 a | 44.30 a | 0.80±0.30 b |
| 1.5 | 13.30 c | 0.60 ± 0.27 b | 15.30 bc | 0.64±0.10 b | 20.70 c | 0.80±0.10 b | 12.90 c | 0.57±0.10 b |
| 2.0 | 14.90 c | 0.56 ± 0.10 b | 16.90 bc | 0.59±0.20 b | 18.50 c | 0.50±0.01 b | 10.00 c | 0.50±0.16 b |
| CIN | ||||||||
| 0.5 | 11.10 c | 0.55± 0.30 b | 7.00 c | 0.50±0.13 b | 5.00c | 0.57±0.10 b | 6.00 c | 0.80±0.13 b |
| 1.0 | 8.60 c | 0.60±0.13 b | 9.00 c | 0.56±0.20 b | 7.30 c | 0.50±0.05 b | 11.30 c | 0.50±0.12 b |
| 1.5 | 10.30 c | 0.53±0.20 b | 5.60 c | 0.51±0.10 b | 10.00 a | 0.56±0.10 b | 8.00 c | 0.73±0.20 b |
| 2.0 | 14.90 c | 0.48±0.10 b | 7.30 c | 0.54±0.30 b | 6.00 c | 0.52±0.20 b | 10.30 c | 0.51±0.04 b |
*Los valores corresponden a la media de tres réplicas con tres explantes por réplica. %I=Porcentaje de inducción, CP=Crecimiento promedio. a-c Medias de grupos con letras iguales no difieren significativamente entre sí de acuerdo a la prueba de Tukey (p˂0.05).
Como se muestra en la Tabla 1 los mayores porcentajes de inducción de callos se obtuvieron empleando 1.0 mg/L de BAP y 1.5 mg/L de AIB. Adicionalmente se puede observar que el explante más callogénico fue la yema a la concentración de 1.5 mg/L de AIB con un 55.60 % de inducción. Por otro lado, el mayor crecimiento promedio de callos se observó en hojas con un valor promedio de 3.20 cm en la concentración de 1.0 mg/L de BAP (Fig. 1).

Fig. 1 Desarrollo de callo de A. californica a partir de un explante de hoja después de cuatro semanas de incubación en medio WPM+1 mg/L de BAP.
El tratamiento control que consistía solo en medio WPM sin suplementación de los reguladores de crecimiento no presentó desarrollo de callo, lo que indica que es necesaria la aplicación de fitorreguladores en el cultivo de tejidos de A. californica, resultados similares reportaron Sagharyan et al., (2020). Sin embargo, resalta el hecho de que CIN no mostró un buen desempeño en la callogénesis, ya que a la concentración más alta (2 mg/L), tan solo se obtuvo un 14% en la inducción de callos a partir de hojas.
Con la finalidad de evaluar si los callos obtenidos podían generar organogénesis indirecta una parte de los callos provenientes de los diferentes explantes y suplementados en un inicio con AIB (1.5 mg/L) o BAP (1 mg/L) fueron subcultivados utilizando WPM+1.5 mg/L de AIB y su diferenciación fue monitorizada durante seis semanas. En la Figura 2 se puede observar que los callos de todos los explantes fueron capaces de generar brotes; sin embargo, aquellos provenientes del medio inicial suplementado con AIB a 1.5 mg/L tuvieron un mayor crecimiento, destacando por su tamaño los obtenidos de pecíolos; adicionalmente pudo evidenciarse que únicamente los callos obtenidos de los pecíolos mostraron rizogénesis.
Evaluación de la proliferación celular
Una vez que se determinó que la mejor condición de callogénesis era el cultivo de los explantes en WPM+1.5 mg/L de AIB, los callos con seis semanas de crecimiento fueron liofilizados. Con la finalidad de caracterizar las actividades biológicas relacionadas con el efecto anticancerígeno que le atribuyen las etnias a A. californica, se generó un extracto hidroalcohólico por medio de maceración, tomando en cuenta que en un estudio previo las sustancias polares del extracto fueron las responsables de sus propiedades bioactivas (Rascón et al., 2015).
La primera de las actividades biológicas evaluadas fue la antiproliferativa, la cual se midió mediante el ensayo de reducción del MTT utilizando un intervalo de concentraciones de 6.25 - 200 μg/mL del extracto etanólico de los callos de A. californica como tratamiento en las líneas celulares cancerosas humanas A549, HeLa y MCF-7 (Tabla 2).
Tabla 2 Actividad antiproliferativa del extracto etanólico de los callos de A. californica en líneas celulares humanas.
| Tratamiento | Líneas celulares (IC50*) | ||
|---|---|---|---|
| A549 | HeLa | MCF-7 | |
| Extracto etanólico de callos de A. californica | ND | ND | ND |
| Doxorrubicina | 0.977±0.009a | 0.788±0.007b | 0.870±0.010a |
Valores de IC50 (μg/mL; media ± desviación estándar, n>3). Los valores en las filas con superíndice distinto (a-c) son significativamente diferentes (p<0.05).* Concentración inhibitoria del 50%. ND: No determinado, IC50 > 200 μg/mL
Como se observa en la Tabla 2 los valores de IC50 del extracto etanólico de los callos de A. californica no pudieron ser determinados para ninguna de las líneas celulares, debido a que a la concentración más alta empleada en el presente estudio el extracto no posee la capacidad de inhibir el 50% del crecimiento de las células con respecto a aquellas tratadas únicamente con DMSO (100% de proliferación).
La línea celular A549 resultó ser la más susceptible al efecto del extracto con una proliferación del 66.05% a la concentración de 200 µg/mL, en tanto que la línea MCF-7 mostró ser la más resistente. Los efectos del extracto etanólico de los callos de A. californica exhibieron un efecto dosis dependiente en las concentraciones de 50-200 µg/mL, en tanto que en las concentraciones de 6.25-25 µg/mL el crecimiento de las células tratadas fue similar a la del control por lo que estas últimas no se mostraron en la Tabla 3.
Tabla 3 Porcentaje de proliferación celular posterior a la aplicación de extracto etanólico de los callos
| Concentración (µg/mL)* | A549 | HeLa | MCF-7 |
|---|---|---|---|
| 200 | 66.05± 10.34a | 89.21 ± 5.57c | 94.26 ± 2.04c |
| 100 | 78.42±5.48b | 99.46±3.81c | 102.24±2.75c |
| 50 | 91.10±6.15c | 101.65±1.17c | 99.56±7.4c |
| 25 | 99.45±4.38c | 100.49±3.74c | 101.16±2.39c |
*Las concentraciones incluidas en los ensayos comprendieron el intervalo de 6.25 a 200 µg/mL; sin embargo, a partir de 25 µg/mL no se encontraron diferencias con las células sin tratamiento. Los valores en las filas con superíndice distinto (a-c) son significativamente diferentes (p<0.05)
Actividad antioxidante
Con la finalidad de determinar la actividad antioxidante del extracto etanólico de los callos de A. californica se emplearon cuatro metodologías complementarias, la medición del contenido de fenoles totales (TCP), la concentración de flavonoides totales (TFC), la estabilización del radical DPPH (DPPH) y el poder de reducción del hierro férrico a ferroso (FRAP).
El contenido total de flavonoides y contenido de fenoles totales se ve relacionado con la actividad antioxidante de los extractos debido a que los grupos hidróxilos y los anillos aromáticos que forman parte de la estructura de los mencionados compuestos facilitan la estabilización de los radicales libres y reducción de especies oxidantes. Los compuestos fenólicos y flavonoides presentan estructuras complejas y variadas de manera tal que se debe de establecer una metodología que permita comparar los efectos de los diversos compuestos con uno de referencia, así que para el TPC se utilizó el estándar de ácido gálico y para TFC se empleó el estándar de quercetina. Un valor más alto obtenido en estos ensayos representa una mayor abundancia de compuestos con capacidad antioxidante.
En la Tabla 4 se observa como el extracto etanólico de los callos de A. californica posee un alto contenido de fenoles totales con un valor de 2.6±0.25 µmol de GAE/g de extracto seco, esto de acuerdo con la clasificación propuesta por (Subedi et al., 2014) quienes establecen que un valor igual o superior a 0.6 mmol GAE/g de extracto representa una alta concentración de compuestos fenólicos. Por otra parte, el contenido de flavonoides totales determinado para el extracto también puede ser considerado muy alto ya que presentó 1.56±0.25 mmol QE/g de extracto, cuando el valor de corte para extractos con alto contenido se encuentra en 0.33 mmol QE/g de extracto (Subedi et al., 2014).
Tabla 4 Contenido de fenoles y flavonoides totales en el extracto etanólico de callos de A.californica.
| Muestra | TPCa | TFCb | DPPH•c | FRAPd |
|---|---|---|---|---|
| Extracto etanólico de callos de A. californica |
2.6 ± 0.25 | 1.56 ± 0.25 | 44.85 ± 1.22 | 1.58 ± 0.15 |
| Quercetina | 1.71±0.14 | 33.27±0.82 |
ammol de equivalentes de ácido gálico, representado como la media ± SE; bmmol de equivalentes de quercetina, representado como la media ± SE; cEC50, representado como la media ± SE en µg/mL, dmmol de Fe2+, representado como la media ± SE
Para evaluar el potencial antirradicalario del extracto se empleó el ensayo de estabilización de radical DPPH. Una mayor cantidad de antioxidantes en un extracto es responsable de la disminución de la absorbancia de la solución de DPPH, para comparar la actividad de eliminación de radicales por los extractos etanólicos se utilizaron los valores de EC50 (Concentración Eficaz media), y cuanto menor sea su valor, mayor es la capacidad de estabilizar los radicales libres. Un estándar del flavonol, quercetina, se utilizó como control positivo con un valor de EC50 de 1.71 ± 0.40 μg/mL. Para determinar si los valores de EC50 obtenidos son significativos, se tomó como base la clasificación propuesta por (Bi et al., 2016), quien propone los siguientes valores de corte: Actividad antioxidante fuerte con EC50 < 100 µg/mL, intermedia EC50 100-500 µg/Ml y débil EC50 > 500 µg/mL. De manera tal que el extracto etanólico de los callos de A. californica exhibió una actividad antirradicalaria muy fuerte con un valor de EC50 de 44.85±1.22 µg/mL (Tabla 4).
Debido a que existen diversos mecanismos oxidativos, el ensayo FRAP fue incluido con la finalidad de evaluar la capacidad del extracto de callos de A. californica para reducir el ion férrico a ferroso. Mediante un cribado de más de 20 extractos de plantas con actividad antioxidante Gohari et al. (2011) determinaron que valores de 0.16 mmol de Fe2+/g de extracto representan una fuerte actividad reductora en el ensayo FRAP por lo que el poder reductor del hierro férrico para el extracto etanólico de los callos de A. californica puede ser considerado fuerte ya en los experimentos realizados en el presente estudio se obtuvo un valor de 1.58±0.15 mmol de Fe2+/g de extracto (Tabla 4).
Actividad antiinflamatoria
En general, se reconoce que el efecto inhibidor de la producción de óxido nítrico (NO) es un índice importante para evaluar la eficacia de los agentes antiinflamatorios. Así que con la finalidad de determinar dicha actividad del extracto etanólico de los callos de A. californica se utilizó un sistema basado en células RAW 264.7 activadas con LPS para la producción del NO. Los macrófagos activados fueron tratados con un intervalo de concentraciones del extracto etanólico de los callos de A. californica de 25-200 µg/mL, el cual no disminuye la proliferación de las células RAW264.7. En la Figura 3 se muestra como todas las concentraciones probadas causaron disminuciones estadísticamente significativas en la producción de NO, siendo la concentración de 50 µg/mL la que mostró una mayor efectividad reduciendo aproximadamente un 23% del NO producido con respecto al control de células sin tratamiento.
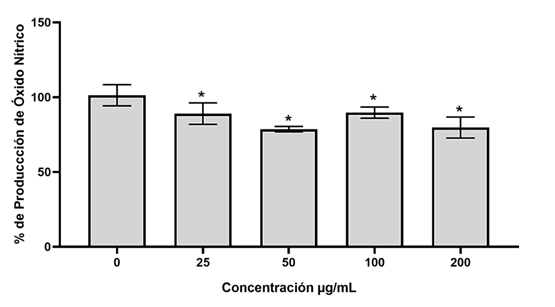
Fig. 3 Efecto en la producción de NO: Efectos del extracto etanólico de callos de A. californica sobre la producción de óxido nítrico (NO) en células RAW 264.7 estimuladas con LPS 1 μg/ml, en un intervalo de concentraciones de 25 a 200 µg/mL, *Significancia estadística en comparación con las células control (DMSO), p<0.05 (Prueba de Tukey).
Identificación de Compuestos Fenólicos por ESI-IT-MS-MS
Con la finalidad de elucidar los compuestos presentes en el extracto etanólico de los callos de A. californica se utilizó espectrometría de masas en modo de ionización negativo, el cual es el método más pertinente para la identificación de compuestos fenólicos. De esta manera el análisis de los espectros de masas denotó la presencia de 15 compuestos fenólicos, de los cuales 10 son pertenecientes a los ácidos fenólicos y cinco son flavonoides (Tabla 4). Dentro del grupo de los flavonoides se identificó una isoflavona, la genisteína; un flavonol, el kaempferol; un flavano, la [epi]catequina; un flavanonol, la taxifolina; y una flavona, la miricetina-3-O-pentósido.
Tabla 5 Identificación de compuestos presentes en el extracto etanólico de callos de A. californica mediante
| Sustancia | Ion precursor [M-H] (m/z) | Iones productos ESI-MSn (m/z) |
|---|---|---|
| Aldehído protocatéquico | 137 | 109 (100) |
| Ácido protocatéquico | 153 | 109 (100), 137 (29) |
| Ácido cumárico | 163 | 109 (24), 135 (100) |
| Ácido gálico | 169 | 125 (100) |
| Ácido cafeico | 179 | 135 (73), 161 (62) |
| Ácido quínico | 191 | 83 (18), 93 (63), 109 (33), 111 (26), 127 (100), 137 (14), 171 (67) |
| Genisteína | 269 | 183 (72), 243 (32) |
| Kaempferol | 285 | 113 (36), 159 (39), 227 (41), 266 (100) |
| [Epi]catequina | 289 | 205 (13), 227 (91), 245 (81), 271 (100) |
| Ácido carboxílico de la brevifolina | 291 | 203 (34), 247 (69) |
| Ácido elágico | 301 | 185 (22), 229 (35), 257 (41) |
| Taxifolina | 303 | 153 (12), 234 (92), 275 (58) |
| Ácido metil-elágico | 315 | 185 (30), 273 (15), 300 (90) |
| Ácido elágico-pentosa | 433 | 300 (100), 301 (86) |
| Miricetina 3-O-pentosa | 449 | 279 (100), 317 (72) |
Discusión
Las plantas han sido por miles de años una fuente valiosa de compuestos bioactivos, tanto es así que el 80% de la población utiliza algún tipo de planta medicinal para el cuidado de su salud (Ávila, 2017). Al respecto Acalypha californica es una de las hierbas más utilizadas empíricamente para el tratamiento del cáncer en el Noroeste de México; sin embargo, es una planta que no es cultivada, de manera tal que la especie crece en hábitats expuestos a las actividades antropogénicas y la colecta indiscriminada, resultando en la disminución significativa de las poblaciones silvestres. Bajo esta premisa el presente estudio tuvo como primer objetivo encontrar las mejores condiciones de cultivo in vitro para generar callos de A. californica con la finalidad de disminuir la presión de las poblaciones silvestres y dar un primer paso en el desarrollo de fuentes de compuestos bioactivos para la obtención de materias primas utilizadas en la elaboración de fitofármacos.
Las principales variables estudiadas en la generación de los callos fueron los diferentes explantes, los cuales podían provenir de hojas, pecíolos, yemas y segmentos nodales; así como la concentración (0.5-2 mg/L) y tipos de reguladores de crecimiento (AIB, BAP y CIN). Resultando que el explante más callogénico fueron las yemas y las concentraciones más efectivas fueron 1.0 mg/L (49.9% de inducción) de BAP y 1.5 mg/L de AIB (55% de inducción); en cambio la suplementación con CIN produjo una pobre callogénesis (14% el valor más alto).
El hecho de que las yemas en combinación con los reguladores utilizados hayan sido el explante más callógenico se debe a las características genéticas propias de A. californica y el mecanismo de acción de los fitorreguladores. Algunos autores atribuyen las diferencias en la respuesta de distintos explantes a las características anatómicas y las variaciones en el contenido hormonal endógeno de los mismos pues es justo a nivel de factores de transcripción que actúan las auxinas y citocininas, de manera que en algunas plantas las hojas y los segmentos nodales pueden resultar más callogénicos (Espinosa et al., 2012).
Como se mostró en la Tabla 1 la concentración de auxinas y citocininas no siempre tienen un efecto dosis dependiente, ya que podemos observar los mejores porcentajes de inducción de callos de A. californica son obtenidos por concentraciones intermedias de AIB o BAP. Al respecto, ha sido evidenciado que una concentración intermedia de auxina y citocininas promueve la inducción de callos, en tanto que una alta concentración de los mismos es propicia para el desarrollo de raíces; sin embargo, el mecanismo molecular del proceso aún no se encuentra claro. Algunos autores plantean que, dependiendo de la planta y sus características genéticas, las auxinas y citocininas pueden causar cambios a nivel de factores de transcripción (vía ARF para las auxinas y vía ARR para las citocininas) que juegan un papel central en la reentrada de las células al ciclo celular (Ikeuchi et al., 2013; Patel et al., 2022).
Contrario a lo presentado en esta investigación CIN sirve para propiciar la callogénesis en especies tales como Medicago sativa (alfalfa) y Azadirachta indica (Neem) (Farjaminezhad &Garoosi, 2019; Wan et al., 1988). Aunque, a diferencia del presente estudio, en dichas investigaciones CIN siempre fue combinada con una auxina, lo que puede explicar el hecho de que por sí sola no logró una inducción y crecimiento de los callos de A. californica. Lo anterior puede deberse a que la auxina AIB regula el crecimiento de la planta y desdiferenciación, la citocinina BAP promueve tanto la división, como diferenciación de las células; en tanto la cinetina CIN solo promueve la división celular. Estos resultados concuerdan con los de (Majumder & Rahman, 2016), quienes encontraron que el mayor porcentaje de inducción de callo en A. indica se obtenía en presencia de una combinación de auxinas y citocininas, siendo AIB el más efectivo.
Una vez obtenidos los callos y con la finalidad de continuar con la búsqueda de las mejores condiciones para callos eficientes de A. californica, una parte de los callos previamente cultivados en medio suplementado con 1.5 mg/L de AIB o 1.0 mg/L de BAP (los más callogénicos) fueron subcultivados en WPM +1.5 mg/L de AIB y su crecimiento y diferenciación se registró durante seis semanas de incubación. Como se puede apreciar en la Figura 2 los callos obtenidos previamente en la concentración de 1.0 mg/L de BAP no desarrollaron raíces y sus brotes fueron de menor tamaño. Numerosas investigaciones en las cuales se estudió la diferenciación de plantas medicinales, como Ugni molinae, Salvia officinalis L, Mentha piperita L. han comprobado que AIB es un regulador de crecimiento que estimula la formación de raíces en plantas leñosas, por lo que el hecho de que no hayan sido generadas raíces y que se obtuvieron brotes más pequeños a partir de los callos inicialmente obtenidos por la suplementación con BAP nos permitió concluir que las mejores condiciones para el crecimiento de callos de A. californica es a partir de un explante de yemas inoculado en medio WPM suplementado con 1.5 mg/L de AIB. (Islam & Alam, 2018; Jafari et al., 2017; Rodríguez Beraud et al., 2014).
A. californica es una planta a la cual los grupos étnicos de Sonora y Baja California le atribuyen actividad anticancerígena, dicha propiedad fue evidenciada en un estudio realizado por Rascón et al. (2015) en donde la fracción polar del extracto metanólico de A. californica mostró actividad antiproliferativa moderada en las líneas celulares cancerosas murinas M12.Ak.C3.F6 (IC50=59.90±1.05 µg/mL) y RAW 264.7 (IC50=58.93±1.26 µg/mL), así como en la línea celular cancerosa humana HeLa (IC50=50.11±1.13 µg/mL); adicionalmente el extracto exhibió actividad diferencial al afectar en menor medida a las células no cancerosas murinas L929 (IC50=100.00±1.09 µg/mL), dicho efecto fue atribuido al contenido de proantocianidinas; sin embargo el estudio mostró ciertas limitaciones ya que solo se evaluó una línea celular humana y actividades relacionadas con el proceso de carcinogénesis no fueron evaluadas. Así que como un primer esfuerzo para caracterizar tanto química como biológicamente las etapas de desarrollo de A. californica en cultivo in vitro, las actividades antiproliferativas en líneas cancerosas humanas, la actividad antioxidante in vitro y la actividad antiinflamatoria en células del extracto etanólico de los callos de A. californica fueron evaluadas; así mismo un perfil químico del mencionado extracto fue realizado utilizando espectrometría de masas.
Para evaluar la actividad antiproliferativa del extracto etanólico de los callos de A. californica fueron utilizadas las líneas celulares cancerosas humanas A549, HeLa y MCF-7 utilizando un intervalo de concentraciones de 6.25 a 200 µg/mL. Como se puede apreciar la mayor disminución para la proliferación celular (34%) fue obtenida para la línea A549 a una dosis de 200 µg/mL; sin embargo, dicho efecto no se considera activo ya que de acuerdo con el NCI para que un extracto sea considerado con propiedad antiproliferativa debe de tener un valor de IC50 menor que 30µg/mL. Que el extracto etanólico de los callos no haya tenido un efecto significativo puede deberse a que los compuestos responsables de la actividad antiproliferativa son metabolitos secundarios específicamente proantocianidinas, los cuales poseen una función ecológica en el organismo, en cambio los callos son una masa de células no diferenciadas las cuales aún no producen este tipo de compuestos. La biosíntesis de metabolitos secundarios en el cultivo de tejidos vegetales suele ser baja en los estadios tempranos de desarrollo de la planta, por lo que generalmente la adición de moléculas precursoras al medio de cultivo aumenta la formación del compuesto de interés. Por este motivo, se recomienda realizar dos medios, uno que permita un buen crecimiento celular para permitir el desarrollo de la planta y otro que optimice la producción de metabolitos secundarios una vez formada (Efferth, 2019).
El cáncer es un proceso multifactorial el cual posee una asociación significativa con los procesos oxidantes e inflamatorios. Lo anterior debido a que las especies oxidantes generan mutaciones y daños a las células y tejidos, mismos que disparan un proceso de inflamación crónico que a su vez promueve la diferenciación de células iniciadas a células cancerosas (Moloney & Cotter, 2018). Por esta razón las terapias contra el cáncer deben de considerar múltiples aristas entre ellas la actividad antioxidante y antiinflamatoria de las mismas.
La actividad antioxidante del extracto etanólico de los callos de A. californica fue evaluada utilizando cuatro metodologías complementarias. Primeramente, el contenido de compuestos fenólicos totales y de flavonoides fue evaluado utilizando como sustancias de referencia el ácido gálico y el flavanol quercetina, respectivamente. El extracto etanólico de los callos de A. californica mostró un alto contenido de fenoles totales (2.6 ± 0.25 GAE/g de extracto) y también de flavonoides totales (1.56 ± 0.25 QE/g de extracto), de acuerdo con las escalas establecidas por (Subedi et al., 2014) y (Bi et al., 2016). Tomando en cuenta que los compuestos fenólicos y uno de sus grupos, los flavonoides, son considerados metabolitos secundarios, sorprenden los altos niveles obtenidos en los extractos de callos, incluso algunos autores sugieren que la formación de tejidos especializados es un requisito previo para la producción de metabolitos secundarios, especialmente compuestos fenólicos (de Queiroz Braga et al., 2015). Sin embargo, la producción de compuestos fenólicos y flavonoides ya ha sido reportado. En un estudio donde se generaron callos de Ageratina pichichensis se demostró que estos poseían TCP y TFC muy parecidos a los de las plantas silvestres, esto debido a que a partir de los 20 días los callos empiezan a inducir estrés en el cultivo a causa del consumo de compuestos del sustrato, provocando una síntesis de metabolitos secundarios (Motolinia-Alcántara et al., 2023).
El extracto de callos de A. californica presentó una actividad antioxidante especialmente fuerte mediante el ensayo DPPH, según Yuniarti et al., 2020, logrando estabilizar la mitad de la concentración del radical DPPH con una concentración de 44.85 µg/mL. Dicha actividad antirradicalaria puede ser explicada debido al alto contenido de compuestos fenólicos y flavonoides del extracto de los callos, ya que la estructura química de estos compuestos los capacitan para estabilizar y desactivar radicales libres antes de que ataquen a las biomoléculas de la célula. En sistemas vivos la actividad antirradicalaria se encuentra asociada a la prevención de múltiples desordenes crónicos tales como la diabetes, arteroesclerosis, envejecimiento y cáncer (Santamaría-Gómez et al., 2018; Zhang et al., 2022).
Los procesos oxidativos no se encuentran asociados únicamente con la actividad de los radicales libres, sino que también se pueden ejercer efectos oxidantes por medio de la oxidación de moléculas por los metales de transición presentes en el cuerpo. Razón por la cual al evaluar la actividad antioxidante de los callos de A. californica resultó importante medirla por medio del método FRAP, el cual se fundamenta en la capacidad que tienen los extractos para reducir el hierro en estado férrico (Fe3+) a su estado ferroso (Fe2+); al respecto, de acuerdo con los valores establecidos en la literatura, el extracto de los callos mostró un fuerte poder reductor del hierro con 1.58 ± 0.15 mmol de Fe2+/g de extracto. Dicha actividad se ve relacionada estrechamente con el contenido de compuestos fenólicos del extracto (Vega-Ruiz et al., 2021).
En este contexto, vale la pena reconocer que las enfermedades relacionadas con el estrés oxidativo se tratan tradicionalmente con miembros del género Acalypha tales como A. wilkesiana var. macafeana, A. indica Linn. y A. fruticosa (Din et al., 2013; Mullick et al., 2013; Rajkumar et al., 2010).
Como se muestra en la Figura 3, la producción de NO, disminuyó ligeramente en los macrófagos RAW 264.7 estimulados con LPS tratados con la concentración de 50 µg/mL de extracto etanólico de los callos (24%), en tanto que a concentraciones mayores el efecto inhibitorio fue menor. Este comportamiento puede deberse a la clase de compuestos fenólicos contenidos en los callos, ya que solo ciertos tipos de compuestos fenólicos tales como los flavonoides se ven asociados a la actividad antiinflamatoria; además ha sido documentado que, si bien los compuestos fenólicos pueden tener efectos antiinflamatorios en ciertas concentraciones, a concentraciones mayores pueden presentar un efecto pro-oxidante y pro-inflamatorio (Rahman et al., 2022).
En el estudio biodirigido realizado por (Rascón-Valenzuela et al., 2015) sobre la actividad antiproliferativa del extracto metanólico de A. californica se estudió la composición de la fracción residual de dicho extracto por espectrometría de masas, encontrando que la mayoría de los compuestos eran pertenecientes a la familia de las proantocianidinas. Contrariamente al generar el perfil químico del extracto etanólico de los callos de A. californica mediante espectrometría de masas fueron encontradas estructuras de ácidos fenólicos y flavonoides principalmente.
Lo anterior puede deberse a que si bien en los callos se genera estrés por los nutrientes propiciando las condiciones para la síntesis de compuestos fenólicos tales como los ácidos fenólicos y flavonoides, dicho estrés no provoca la síntesis de las proantocianidinas encontradas en los extractos de las plantas silvestres ya que estas se ven mayormente favorecidas por el enfrentamiento contra patógenos, la presencia de metales pesados y altas radiaciones UV, es decir, condiciones propias de un organismo en un ecosistema (Yu et al., 2022).
En tanto los ácidos fenólicos y los flavonoides de los callos pueden obedecer mayormente a atender procesos de oxidación metabólica dentro de las células en crecimiento (Liu et al., 2015). A su vez, la presencia de los ácidos fenólicos y los flavonoides en el extracto etanólico de los callos fundamenta la actividad antioxidante y antiinflamatoria encontrada en el presente estudio.
Conclusiones
La realización de la presente investigación permitió establecer las mejores condiciones para la generación de callos de A. californica, siendo estas la utilización de yemas para los explantes y el medio WPM suplementado con 1.5 mg/L de AIB. Aunado a lo anterior se puede concluir que los callos generados son capaces de producir ácidos fenólicos y flavonoides los cuales son responsables de la alta actividad antioxidante y anti-inflamatoria exhibida por el extracto etanólico de los callos. En este nivel de desarrollo, los callos no poseen actividad antiproliferativa significativa en líneas celulares cancerosas; sin embargo, el hecho de que presente actividad antiinflamatoria y antioxidante puede ayudar a prevenir el desarrollo de los procesos cancerosos, ya que tanto la inflamación como la oxidación juegan un fuerte papel en la generación de estos. De manera que la información generada representa un primer paso en el desarrollo de cultivos in vitro de A. californica, así como un soporte científico a las propiedades atribuidas por las etnias.











 nova página do texto(beta)
nova página do texto(beta)




