Introducción
Los helechos son plantas que presentan en su gran mayoría raíces, tallos, hojas y ciclo de vida diplofásico, con dos generaciones libres e independientes, la esporofítica diploide y la gametofítica haploide que requiere del agua para su reproducción (Ballesteros-Montiel, Arreguín-Sánchez, Fernández-Nava, & Quiroz-García, 2019, pág. 2). Los estudios de ciclos de vida y su desarrollo morfogénico permiten obtener datos para el manejo de los helechos relacionados con el cultivo comercial, preservación de los taxones, además de aportar referencias de interés taxonómico y ecológico debido a que las esporas al ser liberadas de los esporangios se dispersan a diferentes sitios, lo que hace factible que cuando lleguen a lugares que cumplan con condiciones ambientales específicas de luz, humedad, temperatura y tipo de sustrato, pueda establecerse el esporófito y esta es una de las formas de ir colonizando nuevas regiones (Salazar-Aguilar, Arreguín-Sánchez, & Tejero-Díez, 2015, pág. 22).
Las Aspleniaceae es una de las familias más ricas dentro de los helechos leptosporangiados con aproximadamente 700 especies donde se han incluido a géneros como Asplenium L., Schaffneria Fée ex T. Moore y Phyllitis Hill (Moran, 1995, pág. 290). También se han reconocido a otros géneros como Asplenium, Loxoscaphe T. Moore, Holodictyum Maxon y Schaffneria Fée ex T. Moore (Mickel & Smith, 2004, pág. 6). En trabajos más recientes se reconocen dos géneros: Asplenium e Hymenasplenium Hayata (Christenhusz, X. Chun, & Schneider, 2011, pág. 15; Giudice, Luna, & Ganem, 2013, pág.; PGI, 2016, pág. 582; Xu, y otros, 2020, pág. 22).
Para el género Asplenium se tienen diferentes tratamientos taxonómicos, por ejemplo, se ha segregado al género en secciones como Asplenidictyum, Ceterachopsis, Hymenasplenium y Thamnopteris (Tryon & Tryon, 1982, pág. 630). En otras investigaciones se han reconocido agrupaciones de especies como el grupo de Asplenium salicifolium L. (Maxon, 1908); grupo de Asplenium trichomanes L. (Maxon, 1913) y grupo de Asplenium fragile C. Presl (Weatherby, 1931) y en este último se analizó el complejo de poliploides e híbridos que se presentan en este conjunto de especies.
Se han realizado estudios de biología molecular como los de Murakami & Schaal, (1994) y Murakami (1995), en ambas investigaciones se estudió la filogenia de la sección Hymenasplenium. En el estudio de Murakami, Nogami, Watanabe & Iwatsuki, (1999) se aborda la filogenia de Aspleniaceae. Gastony & Johnson (2001) proponen la filogenia de Loxoscaphe y Schneider et al., (2004) proponen la filogenia de las asplenoides basada en la secuencia del cloroplasto rbcL y trnL-Fspacer y sus implicaciones para la biogeografía. A través de estudios morfológicos y moleculares actualmente se considera que la familia Aspleniaceae incluye dos géneros: Asplenium e Hymenasplenium (Christenhusz, Chun y Schneider, 2011; Regalado & Prada, 2011; Giudice, Luna y Ganem 2013 y PPGI 2016).
La circunscripción del género Asplenium incluye a plantas terrestres, rupícolas o epífitas; rizoma rastrero, ascendente o erecto con escamas presentes dispuestas desde la base del peciolo y que se extienden a toda la lámina, a veces pequeñas escamas filiformes, generalmente clatradas, monomorfas o diplomorfas, así como tricomas que pueden o no ser glandulares; peciolos cilíndricos o alados, brillantes u opacos con dos haces vasculares en forma de “C” uniéndose distalmente en forma de “X”; lámina simple o dividida, equiláteras o no, coriáceas a membranosas; raquis y costas a veces alados, escamosos, glabros o pilosos, a veces con yemas prolíferas en las pinnas terminales, venas libres o bifurcadas, con o sin hidátodos evidentes, márgenes enteros o profundamente serrados; soros superficiales o lineares, indusio entero, subentero o eroso, raramente ciliado o glanduloso, esporangios globosos sin parafisos; esporas bilaterales con perisporio reticulado, crestado, a veces equinado o liso. Algunas especies del género se les confunde con Diplazium Sw. (Athyriaceae), la diferencia entre ambas entidades taxonómicas es que Asplenium presenta un soro linear a lo largo de las venas, mientras que Diplazium tiene soros en pares que se unen dorso con dorso (Moran, 1995, p. 290-291). En México se encuentran unos 86 taxones y es un género que con frecuencia forma híbridos en zonas tropicales y templadas (Mickel y Smith, 2004, p. 73).
Los esporófitos de Asplenium blepharophorum (Fig. 1) de los cuales se tomaron las esporas presenta las siguientes características: planta terrestre a veces epifita con rizoma erecto de 10 a 15 mm de diámetro, cubierto por escamas de 10 a 14 mm de largo por 1.5 a 3 mm de ancho, lanceoladas, de inserción basal, densas con el margen entero a ligeramente dentado, base cordada, ápice filiforme; frondes uniformes de 30 a 60 cm de largo, peciolo 1/3 a 1/6 más corto que la longitud de la lámina, cubierto por escamas de 5 a 11 mm de largo por 0.1 a 0.3 mm de ancho, linear a linear-lanceoladas, de inserción basal, densas margen irregularmente fimbriado, base cordada, ápice filiforme, castaño claras, raquis también escamoso, ligeramente alado, escamas parecidas a las del peciolo, lamina de contorno ovado- deltoideo a ovado-lanceoladas de 25 a 35 cm de largo bipinnada a bipinnada-pinnatífida, ápice pinnatífido con o sin yema prolifera subterminal, pinnas de 15 a 30 pares, de 5 a 15 cm de largo por 0.5 a 2 cm de ancho, de contorno lanceolar, peciólulo de 1 mm de largo, segmentos ovados de 0.7 a 1.2 cm de largo por 0.4 a 0.8 mm de ancho con base decurrente y margen lobado, glabros en el haz, levemente escamoso el envés, venación libre; soros 2 a 3 por segmento, alargados ubicados en la porción media de las nervaduras secundarias y cubiertos por un indusio alargado o bien curveado adquiriendo la forma semilunar; esporas monoletes, vista proximal de 48 a 76 µm de largo por 41 a 53 µm de ancho, vista lateral de 49 a 66 µm de largo por 37 a 47 µm de profundidad, sexina equinada, perina de 4 a 7 µm formando una red con proyecciones equinadas (Arreguín-Sánchez, Fernández-Nava, & Quiroz-García, 2004, págs. 188-190).
Al no encontrar datos del desarrollo morfogénico del taxón en estudio, se incluyen referencias de otras especies que corresponden a diferentes secciones y grupos taxonómicos del género Asplenium como los de Raghavan (1965, 1969) y Raghavan & Tung (1967) que tratan diversos aspectos del desarrollo en gametófitos de Asplenium nidus (L.) J. Sm. Morlang (1967), estudió la hibridazión y poliploidía en gametófitos de Asplenium platyneuron (L.) Britton, Sterns & Poggenb., A. rhizophyllum L. y A. montanum Willd. Herrero et al. (1993) describen gametófitos en cuatro subespecies de Asplenium trichomanes L. Mucciflora & Gori (1995) observaron prótalos de Asplenium trichomanes L. var. trichomanes. Prada et al. (1995) investigaron los gametófitos del complejo Asplenium adiantum-nigrum. Aragón y Pangua (2004) observaron la germinación de las esporas de A. adiantum-nigrum L. var. adiantum-nigrum, A. adiantum.nigrum L. var. silesiacum (Milde) Viane & Reichst., A. septentrionale (L.) Hoffm. subsp. septentrionale y A. ruta-muraria L. subsp. ruta-muraria. Lavalle & Prada (2007) estudiaron el esporófito y gametófito de Asplenium dareoides Desv. Sánchez-Montiel, Arreguín-Sánchez y Fernández-Nava (2008) describen el desarrollo de los gametófitos y esporófitos de Asplenium monanthes L. Testo y Watkins (2013) indagaron el desarrollo de los gametófitos del complejo Asplenium scolopendrium L. y Estrelles & Ibars, (2017) describen la germinación y gametófitos de Asplenium majoricum Litard.
Se incluyen antecedentes de estudios relacionados con nuevos híbridos y algunas formas de detectarlos a través de la morfología de los ejemplares, debido a que Asplenium es un género que con frecuencia se presenta este evento. Gastony (1970) describe el híbrido Asplenium pinnatifidum X trichomanes y Pangua, Prada, Pajarón, y Salvo (1992) describen un nuevo híbrido para España relacionado con Asplenium majoricum.
Los trabajos relacionados con estudios de cariotipo se citan como una forma de detectar hibridaciones y poliploidías, así como, una manera para dilucidar las relaciones entre grupos de especies como los de Morzeti (1966) que aclaran la posición de taxones del complejo Asplenium heterochroum-resiliens. Dong (2011) se apoyó en estudios citológicos para separar los taxones de Asplenium sect. Thamnopteris. Hunt, Ansell, Russell, Schneider, & Vogel (2011) establecen que Asplenium majoricum es un alotetraploide. De la Fuente, Gabriel y Galán, Molino, Sessa y Quintanilla (2020) describen la expresión del carácter, barreras reproductivas y origen del híbrido Asplenium X aran-tohanum.
El propósito de este trabajo es describir y comparar el desarrollo morfogénico de los gametófitos y esporófitos jóvenes de Asplenium blepharophorum Bertol. en condiciones de cultivo en tres sustratos naturales: maquique, tierra de hoja y musgo, recomendando el mejor de ellos para su reproducción.
Método
Trabajo de campo
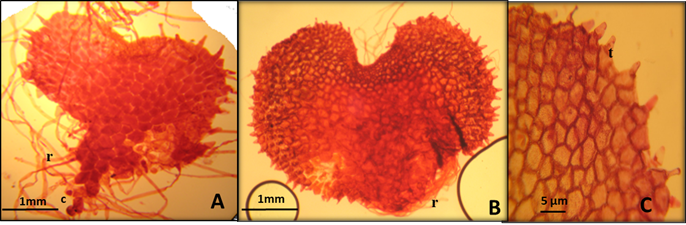
El ejemplar fue recolectado en San Antonio, a 1 km al norte de Amecameca, Municipio de Amecameca, Estado de México, en un bosque mesófilo de montaña, por M. L. Arreguín a una altitud de 2500 msnm. Además, se tomaron muestras de frondes con soros y esporas maduras de tres organismos (Fig. 2), que se depositaron en sobres de papel blanco. El ejemplar que se recolectó se llevó al laboratorio para la herborización, identificación, y resguardo en el herbario ENCB.
Trabajo de laboratorio
Los sobres que contienen las muestras de los frondes con las esporas maduras se mantuvieron en la obscuridad por quince días, en tanto el material recolectado se identificó con bibliografía especializada como la de Moran (1995); Arreguín-Sánchez, Fernández-Nava y Quiroz-García, (2004); Mickel y Smith (2004) y Vázquez (2006). Así también se contaron el número de esporas de diez esporangios. El ejemplar quedó depositado en el Herbario antes mencionado.
Posteriormente se realizó la siembra de las esporas con la técnica de Montoya Casimiro, Álvarez Varela, Pérez Hérnandez, & Arreguín Sanchez (2000). Las esporas se sembraron en quince frascos de vidrio de 125 ml y se utilizaron cinco frascos por sustrato. A cada frasco se les agregó 20 g de piedra de río, otro tanto de barro molido, encima se colocó un círculo de tela de mosquitero y se adicionó 20 g de tierra de hoja, otro tanto a cinco de maquique y los últimos cinco frascos se adicionó 20 g de musgo (Sphagnum), todo lo anterior previamente esterilizado en autoclave. Todos los frascos se taparon con bolsas de plástico y se amarraron con alambre de cobre y se etiquetaron con los datos del género y especie, sustrato y fecha. El maquique es el nombre tradicional del tallo de los helechos arborescentes, este material se tiene molido desde más de 30 años en el laboratorio debido a que una vez que se termina un estudio todos los materiales son reutilizados (frascos, piedra de río, barro molido, mosquitero, sustratos, alambre de cobre).
Continuando la técnica de Montoya-Casimiro, Álvarez-Varela, Pérez-Hernández y Arreguín-Sánchez (2000), en total por cada sustrato se sembraron 0.03 g de material que resultó de raspar los soros, mismos que se mezclaron en 0.5 g de arena de río esterilizada y este material se repartió por partes iguales en cada uno de los cinco frascos de cada sustrato. Las condiciones en que se mantuvieron los quince frascos germinadores fueron con luz natural en el invernadero a una temperatura de 20 a 25 ºC. Cada frasco contenía 2 ml del agua de la que se esterilizó cada sustrato. Se tomaron muestras de un frasco por sustrato cada 15 días en condiciones de asepsia, uno se quedó como testigo y los otros germinadores se abrían una vez que se hubiera agotado el material biológico del anterior, la cantidad de muestra que se tomaba cada dos semanas era la que se alcanzaba al obtener con unas pinzas de punta fina. El material se fijó en formaldehido Mallinckrodt en solución al 2% por 48 horas y posteriormente se teñía con safranina acuosa Hycel de México. Con lo anterior se realizaron preparaciones permanentes que se montaron con una mezcla de miel de maíz karo, agua 1:1 y trazas de fenol de la marca Meyer. Cada preparación se etiquetó con la fecha en que se fijó el material de cada sustrato. La serie de preparaciones se observaron, interpretaron, se tomaron medidas y fotomicrografías tanto al microscopio óptico binocular Zeiss como en el microscopio estereoscópico Nikon.
Cada una de las etapas correspondientes del desarrollo morfogénico como germinación, fase filamentosa, laminar y esporofítica fueron observadas y descritas de acuerdo a las características de cada una de ellas. En la germinación se menciona el tipo de la misma, en la fase filamentosa: largo de los filamentos, número de células, rizoides y tipo de desarrollo protálico como las concibieron Nayar y Kaur (1969, 1971); fase laminar: gametófito joven, largo, ancho, número de rizoides, gametófito adulto, largo, ancho, forma, sexualidad, número de rizoides; gametangios anteridios y arquegonios: tamaño, forma, número de anterozoides, número de células del canal del cuello; esporófitos: tricomas, forma de los primofrondes, venación. Estas medidas se tomaron cada 15 días para determinar el rango de desarrollo con el propósito de establecer cuál de los tres soportes tenía las mejores características y condiciones para el desarrollo de la fase sexual de esta planta.
Las medidas que se mencionan en las descripciones son los promedios de diez esporas y diez estructuras de cada fase y se incluyen tres cifras, la primera es la menor de las mediciones realizadas, entre paréntesis la media y la última es la mayor del total de mediciones que se realizaron en cada etapa del desarrollo morfogénico de los gametófitos y esporófitos. Las fotomicrografías se tomaron con una cámara de 7 megapíxeles Canon.
Resultados
Esporas
Al contar el número de esporas de diez esporangios, se apreció que la mayoría tenía 32 y en dos esporangios había 26; no se observaron esporas colapsadas o con morfología diferente. Las esporas (Figs. 3) fueron monoletes, de color marrón, anchamente elípticas de 52.8 (63.3) 78 µm de eje polar por 42.2 (43.2) 46.4 µm de eje ecuatorial, nexina y sexina de 2.1 µm de grosor, sexina equinada, perina de 4.2 a 8.4 µm formando crestas equinadas (Figs. 3 A), vista superficial granular (Fig. 3 B).
Germinación
La germinación fue tipo Vittaria (Nayar y Kaur, 1971) y se presentó en los tres sustratos desde los 29 días, el rizoide es mucho más pequeño, unicelular de 19.21 µm de largo y el filamento protálico midió entre 68(70)80 µm con 7 a 12 células (Fig. 4).
Gametófitos jóvenes
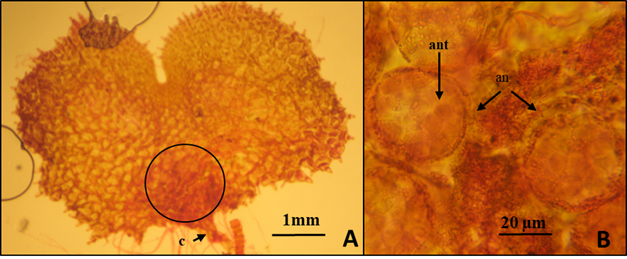
Se desarrollaron entre los 46 a los 81 días en los tres sustratos (Fig. 5) fue posible apreciar diferentes estadios de desarrollo (Fig. 5 A), donde se incluyen el filamento con hasta 21 células clorofílicas (5a), la formación de prótalos más grandes de entre 0.9(1)1.1 mm de largo por 1.8(2.15)2.7 mm de ancho que presentan varios tricomas en el margen de los mismos (5c izquierda) y el inicio del desarrollo protálico tipo Aspidium que se caracteriza por presentar desde la fase de filamento y los primeros estadios del prótalo, la presencia de un tricoma apical y rizoides (Fig. 5 B) y la formación de un segundo pelo (Fig. 5 A) que delimita la diferenciación de la zona meristemática (5c derecha) y posteriormente la zona de la escotadura .

Fig. 5 Primeras etapas del desarrollo de los gametófitos. 5A. Prótalos jóvenes que se observaron desde los 46 a 81 días, 5a filamento clorofílico, 5c prótalos en etapas más desarrolladas con varios tricomas marginales. 5B.- Desarrollo protálico tipo Aspidium mostrando el tricoma inicial (t) y tres rizoides (r).
Gametófitos cordados
El desarrollo de esta etapa en maquique y tierra de hoja se apreció de los 56 a los 456 días y en musgo de 81 a los 456 días (Figs. 6), esta amplitud de tiempo se debe al desarrollo anacrónico de los prótalos. Todos presentaron forma cordada con la diferencia que unos tenían cauda (Fig. 6 A) y otros carecían de ella (Fig. 6 B). La cauda varió entre 6 a 14 células. Los rizoides se encontraron de 10 a 30 en la superficie ventral en ambos tipos de prótalos. La forma de los tricomas marginales es triangular y en algunos se observaron una pequeña cabezuela (Fig. 6 C).
| Sustratos | Tamaño prótalos con cauda | Tamaños Prótalos sin cauda | Tamaño de los tricomas marginales |
|---|---|---|---|
| Maquique | 4.2(11.5)27 mm de largo y 5.9(17.3)33.1 mm de ancho |
3.7(11.7)22.5 mm de largo y 3.1(10.2)19.5 mm de ancho |
4.25(5.23)6.8 µm de largo |
| Musgo | 3.4(12.5)27.2 mm de largo y 5.5(18.9)34.2 mm de ancho |
4.6(16.7)28.9 mm de largo y 4.5(20.3) 31.3 de ancho |
3.4(5.7)11.9 µm de largo |
| Tierra de hoja | 4.4(10.7)18.7 mm de largo y 7.1(15)21.5 mm de ancho |
4.8(12.8)28 mm de largo y 3.4(9.2)25.8mm |
3.4(5.7)11.9 µm de largo |
Gametangios
Se observaron desde los 154 a los 428 días, los gametófitos fueron protándricos unisexuados masculinos y femeninos y en maquique solo unisexuales femeninos, todos los protálos presentaron tricomas marginales. Los gametangios se presentaron en los tres sustratos, aunque en ninguno de ellos maduraron. Los anteridios no formaron célula del pie, ni célula opercular, así como tampoco células parietales; los arquegonios no desarrollaron células del cuello, ni del canal del cuello, tampoco célula ventral y ovocélula, ambos gametangios se quedaron en las primeras etapas de desarrollo.
Anteridios
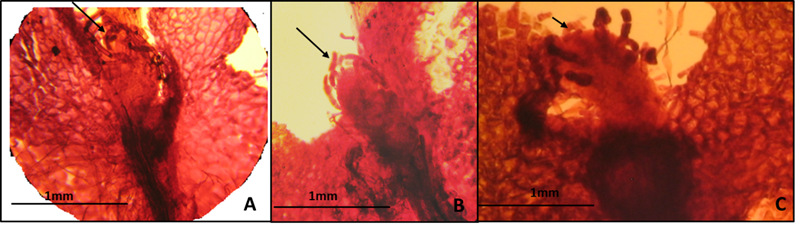
En maquique no se observaron, pero sí estuvieron presentes en musgo y tierra de hoja (Fig. 7). En musgo los anteridios se apreciaron a partir de los 154 hasta los 428 días, se desarrollaron trece días antes que los arquegonios en gametófitos que mostraban cauda con rizoides, estos gametangios se encontraron en la parte basal y central del prótalo y midieron 25(30)35 µm de diámetro y son de forma circular. En tierra de hoja se observaron solo el día 111 después de la siembra y se desarrollaron 111 días antes que los arquegonios. Los prótalos mostraron una cauda y rizoides en la parte ventral, los anteridios fueron circulares de 41.6 (46) 50 µm de diámetro y se encontraban en la base del prótalo (7 A y 7B). En algunos anteridios se apreció la formación de anterozoides inmaduros.
Arquegonios
Se desarrollaron en todos los sustratos y después que los anteridios en gametófitos unisexuales. La forma de los prótalos fue cordada a cordada-lobulada, formaron un cojinete con más de 50 rizoides en la parte ventral.
Los arquegonios se apreciaron en los tres sustratos (Fig. 8). En maquique los arquegonios se desarrollaron de los 334 a los 428 días (Fig. 8 A) en prótalos cordados a cordados-lobulados sobre un cojinete recorriendo toda la parte media. En musgo se apreciaron de los 167 a los 428 días (Fig. 8 B) localizados en la parte central de los gametófitos cordados-lobulados sobre un cojinete. En tierra de hoja de los 222 a los 308 debajo de la escotadura sobre un cojinete formando una media luna (8C). En todos los prótalos se observaron gran cantidad de rizoides, más de 50 y arquegonios inmaduros (Fig. 8D ).
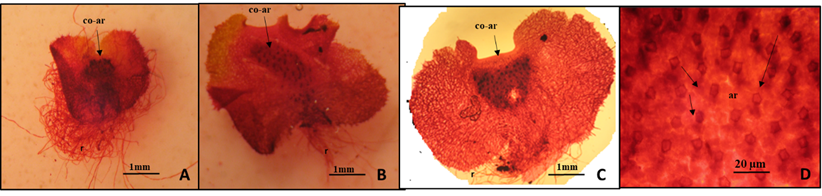
Fig. 8 Desarrollo de los arquegonios en los tres sustratos a los 308 días. 8A. Gametófito cordado en maquique con arquegonios sobre un cojinete recorriendo toda la parte media. 8B. Gametófito cordado-lobulado en musgo, en la parte central se encuentran los arquegonios sobre un cojinete. Gametófito cordado en tierra de hoja con los arquegonios sobre un cojinete debajo de la escotadura formando una media luna. Cojinete y arquegonios (co-ar). Rizoides (r).
Formación de la yema apogámica
Se presentó en los tres sustratos (Fig. 9). En maquique a partir del día 351 hasta los 456 (Fig. 9 A), en musgo partir de los 351 días hasta los 456 días (Fig. 9 B) y en tierra de hoja inició el día 202 hasta los 308 (Figs. 9C).
Esporófito
Se presentó en los tres sustratos (Fig. 10); en maquique se apreció a partir de los 351 a los 473 días constituido por un peciolo de 4.5 mm de largo, una lámina entera oblanceolada con venación dicotómica y tricomas de 1.7 mm de largo, esparcidos que cubren el peciolo y margen del primofronde (Fig. 10 A). En musgo se observaron a partir de los 456 a los 473 días, los esporófitos presentaron un peciolo de hasta 4.9 mm de largo, con dos tipos de láminas, una entera oblanceolada y otras flabeladas con venación dicotómica y pequeños tricomas dispersos de 1 mm de largo que cubren el peciolo y margen de la lámina (Fig. 10 B). En tierra de hoja se observó a los 473 días con un peciolo de hasta 4.5 mm de largo, con láminas enteras a oblanceoladas y otras de forma flabelada con venación dicotómica y tricomas dispersos de 1.7 mm de largo que cubren peciolo y primofrondes (Fig. 10 C). La observación del experimento terminó a los 473 días, fecha en que se comenzaron a observar esporófitos en el último sustrato en que se desarrollaron y que fue el de tierra de hoja.
En los esporófitos se encontró el mismo desarrollo morfogénico en los tres sustratos, en los esporófitos más jóvenes como los de la Fig. 15A, a los 351 días mostraron solo láminas foliares enteras, en días posteriores esos frondes comienzan a dividirse y forman una lámina flabelada como se muestra en las Figs. 15 B y 15 C a los 356 y 473 días respectivamente y así continúa la división de la lámina hasta la formación esporófitos con láminas más divididas y más grandes.

Fig. 10 Esporófitos jóvenes. 10A.- Maquique 351 días. 10B.- Musgo 356 días. 10C.- Tierra de hoja 473 días. Lámina foliar (l). Peciolo (p). Raíz (ra).
El Cuadro 1 muestra la comparación del desarrollo morfogénico de Asplenium blepharophorum en los tres sustratos, lo cual permitirá analizar los tiempos de desarrollo, las diferencias en el desarrollo morfogénico de las fases y así poder definir el mejor sustrato para esta planta. En la Figura 11 se sintetiza el desarrollo de los gametófitos y esporófitos de esta especie,
Cuadro 1 Etapas del desarrollo morfogénico de Asplenium blepharophorum en los tres sustratos.
| Fases de desarrollo morfogénico | Tipos de germinación, desarrollo protálico y otros datos | Maquique (los números indican días) | Musgo (los números indican días) | Maquique (los números indican días) |
|---|---|---|---|---|
| Germinación | Vittaria | A partir 29 | A partir 29 | A partir 29 |
| Gametófito joven | Aspidium | 46-81 | 46-81 | 46-81 |
| Gametófito cordado | 92-456 unisexuados femeninos | 81-456 unisexuados femeninos y masculinos | 56-456 unisexuados femeninos y masculinos | |
| Anteridios | Protandria, se apreciaron inmaduros | No se observaron | 154-428 en la parte basal de gametofitos con cauda | Solo se observaron a los 111 días en la parte basal de gametofitos con cauda |
| Arquegonios | Se apreciaron inmaduros | 334-428 Gametófitos con cojinete ventral y abundantes rizomas | 167-428 Gametófitos con cojinete ventral y abundantes rizomas | 222-308 Gametófitos con cojinete ventral y abundantes rizomas |
| Yema apogámica | 351-456 | 351-456 | 202-308 | |
| Esporófito | Apogámico | 351-473 | 456-473 | 473 fin de muestreo |

Fig. 11 Síntesis del desarrollo morfogénico de Asplenium blepharophorum Bertol. A.- Ejemplar herborizado de donde se obtuvieron las esporas. B.- Esporas (40x). C.- Germinación tipo Vittaria (10x). D.- Diferentes estadios de desarrollo de los gametófitos (10x). E.- Desarrollo protálico tipo Aspidium (10x). F.- Prótalo cordado mostrando tricomas marginales y rizoides (10x). G.- Gametófito cordado unisexuado femenino con arquegonios debajo de la escotadura y cojinete. (10x). H.- Detalle de arquegonios inmaduros (40x). I.- Prótalo cordado unisexuado masculino con cauda, con el círculo se muestra el sitio donde se encuentran los anteridios (10x). J.- Detalle de los anteridios (40x). K.- Detalle de la yema apogámica (10x). L.- Esporófito joven (10x).
Discusión
Al comparar los resultados del Cuadro 1 se aprecia que los tres sustratos presentaron las mismas etapas del desarrollo morfogénico de Asplenium blepharophorum, excepto en el sustrato de maquique que no se formaron anteridios. En el musgo estos gametangios se observaron durante 274 días, entre los 154 hasta los 428 después de la siembra; en tierra de hoja sólo se apreciaron el día 111 después de la siembra. Durante las observaciones del desarrollo morfogénico de esta especie, las condiciones de luz, humedad y temperatura se mantuvieron controladas, así que las diferencias que se encontraron en este trabajo se deben a las particulares de los sustratos. Los tres sustratos que se utilizaron son elementos de los bosques mesófilos de montaña, aunque en particular, en el sitio de recolección del ejemplar no se presentan helechos arborescentes; la especie puede encontrarse con hábitos terrestres y epífito. La factibilidad de reproducir esta especie se encuentra en los tres sustratos, sin embargo, en maquique los esporófitos se empezaron a desarrollar a los 351 días, esto es, 105 días antes que el musgo y 122 antes que en tierra de hoja.
En maquique, musgo y tierra de hoja se obtuvieron esporófitos apogámicos y el número de esporas por esporangio fue en la mayoría de 32 esporas y solo en dos se contaron 26, lo cual nos lleva a considerar que es una entidad híbrida o poliploide y que por lo tanto, independientemente del sustrato, no hubo reproducción sexual al no madurar los gametangios, situaciones que se han observado en otras especies del complejo Asplenium auritum cubano-monodon (Regalado, Prada, & Gabriel y Galán, 2010, pág. 137) y en otros géneros como Pteris (Huang, Chou, Hsieh, Wang, & Chiou, 2006, págs. 262-263; Huang, Hsu, Hsieh, Chou, & Chiou, 2011, pág. 79).
En el caso particular de los sustratos, Watson & Vázquez (1981, pág. 7) indican que el microhábitat es trascendental en la historia de vida de las especies y las propiedades del sustrato son importantes. Según estos autores el desarrollo apropiado del esporófito requiere de la asociación con musgos, ya que este evita la desecación y a la raíz del helecho joven le otorga agentes antimicóticos. Bryan & O'Kelly (1967, pág. 27) mencionan que Woodsia obtusata requiere de ciertas cantidades de calcio para que se desarrolle el esporófito y debido a eso se asocia a diferentes especies de musgo. En Woodsia mollis (Vivero-Barón, Arreguín-Sánchez, Quiroz-García, Fernández-Nava, & Acosta-Castellanos, 2012, pág. 82) encuentran que el desarrollo del esporófito sólo ocurrió en el musgo debido posiblemente a la relación con el calcio que requieren las especies de woodsias hasta ahora estudiadas. Lo anterior, nos lleva a sustentar que los sustratos son de vital importancia para el desarrollo morfogénico de los helechos y que las diferencias encontradas en A. blepharophorum se deben a los componentes de cada uno de ellos.
Al analizar el papel de cada uno de los sustratos en el desarrollo morfogénico de Asplenium blepharophorum, el musgo y la tierra de hoja proporcionan a los gametófitos elementos nutritivos que pueden ser aprovechados para la germinación de las esporas y las siguientes fases de desarrollo. El maquique es un sustrato usado tradicionalmente para el cultivo de orquídeas, bromelias, helechos y otras plantas epífitas compuesto por raíces muertas que conservan por mucho tiempo la humedad, tiene buen drenaje y se descomponen lentamente (Palacios Ríos, sin fecha http://naturalia.org.mx/publicaciones/helechos_arborescentes-compressed.pdf) y por las observaciones que hemos realizado en los cultivos de helechos, este material sirve para la fijación de los gametófitos desde la fase filamentosa hasta la adulta y esto también nos llevaría a dilucidar que en las primeras fases de desarrollo de los helechos es muy importante un sitio de fijación para los gametófitos.
Wagner y Evers (1963), Farrar (1967), McAlpin y Farrar (1978) estudiaron en diferentes regiones y especies, la relación de la dispersión de las esporas y la distribución geográfica de los esporófitos e indican, que los prótalos alcanzan mayor área de dispersión que los esporófitos. A través de estudios ecológicos y fisiológicos encuentran que la existencia final de los esporófitos depende de la fecundación en la generación de gametófitos y esto es lo que marca los patrones de distribución que, además, tienen que ver con presiones selectivas como luz, temperatura y sustratos que actúan sobre las generaciones gametofítica y esporofitica y que tienen un impacto único en la ecología y fisiología de una especie. Lo anterior sostiene la importancia de los sustratos para el desarrollo de los esporófitos y explicaría el desarrollo morfogénico de gametófitos y esporófitos en los tres sustratos de A. blepharophorum que son propios de los bosques mesófilos de montaña, de los bosques de pinos y pinos-encino donde crece esta especie.
Al comparar los resultados de esta investigación con la información bibliográfica recabada, se apreció que las descripciones de las diferentes investigaciones del desarrollo morfogénico de los gametófitos y esporófitos son heterogéneas, razón por la cual los datos que se aportan son las partes que incluyen los diferentes trabajos.
Con relación a las esporas del género Asplenium (Tryon & Lugardon, 1991, págs. 541-542), las han descrito en lo general como monoletes, de tamaños y formas variables, con exosporio cavado, generalmente con columelas que sostienen al tectum en la parte interna, superficie con pliegues generalmente prominentes, formando largas alas (o sin ellas), crestadas, equinuladas o reticuladas o con las areolas entre pliegues lisos o generalmente equinadas, fenestradas o reticuladas. Las especies de Asplenium daroides Desv. y A. monanthes L. descritas por (Lavalle y Prada, 2007, p. 17; Sánchez-Montiel, Arreguín-Sánchez. Fernández-Nava, 2008, p. 35) respectivamente, cumplen con las descripciones generales de las esporas del género al igual que las de Asplenium blepharophorum.
Al comparar los datos aportados por otros autores que estudiaron diferentes especies del género Asplenium, coinciden que la germinación de las esporas es tipo Vittaria según Herrero, Prada, Pangua, Escudero, Rubio y Pajarón (1993, p. 67) para cuatro subespecies de Asplenium trichomanes y Sánchez-Montiel, Arreguín-Sánchez y Fernández-Nava, (2008, p. 29) para Asplenium monanthes también la mencionan. Asplenium blepharophorum también presenta este tipo de germinación.
El tiempo de inicio de la germinación varió según la especie, en las cuatro subespecies de Asplenium trichomanes L. (Herrero, Prada, Pangua. Escudero, Rubio y Pajarón, 1993, p. 70) fue entre los 5 a los 20 días. Para Asplenium trichomanes spp. trichomanes (Muccifera y Gori, 1995, p. 266) fue de los 8 a 10 días. En el complejo Asplenium adiantum-nigrum (Prada. Pangua, Pajarón Herrero, Escudero y Rubio, 1995, p. 109) se llevó a cabo entre los 10 días hasta los tres años. Para Asplenium dareoides (Lavalle y Prada, 2007, p. 18) se obtuvo a los 10 días. En el caso de Asplenium monanthes (Sánchez-Montiel, Arreguín-Sánchez. Fernández-Nava, 2008, p. 34) a los 28 días y (Testo y Walkins, 2013, p. 2262) se presentó de los 6 a los 120 días. En Asplenium blepharophorum se observó a los 29 días lo cual se encuentra entre los rangos de tiempo de las otras especies.
El desarrollo protálico en Asplenium blepharophorum fue el tipo Aspidium que se comparte con autores como (Prada. Pangua, Pajarón Herrero, Escudero y Rubio, 1995, p. 107; Lavalle y Prada, 2007, p. 34 y Sánchez-Montiel, Arreguín-Sánchez. Fernández-Nava, 2008, p. 34), en muchos trabajos no se incluye este dato, sin embargo, Herrero, Prada, Pangua. Escudero, Rubio y Pajarón (1993, p. 70), al observar el desarrollo protálico de tres subespecies de Asplenium trichomanes, ssp. tricomanes, A. trichomanes ssp. quadrivalens y A. trichomanes ssp. pachyrachis consideran que es de tipo Adiantum, es decir, que los prótalos no presentan tricomas marginales en las primeras etapas de formación de los gametófitos y estos se presentan después de los 30 a los 40 días.
En el complejo Asplenium auritum-monodon también mencionan como desarrollo protálico el tipo Adiantum (Regalado, Prada y Gabriel y Galán, 2010, p. 137). Así también (Muccifera y Gori, 1995, p. 266-269) estudiaron Asplenium trichomanes ssp. tricomanes y si bien, no mencionan el tipo de desarrollo protálico, por las fotomicrografías que incluyen es evidente que se trata del tipo Adiantum y muestran gametófitos adultos cuyo margen no presenta tricomas y más bien, el término tricomas corresponden a rizoides que se producen en la parte ventral de los talos. Lo anterior sugiere que el desarrollo protálico en el género Asplenium puede ser de tipo Aspidium o Adiantum. En Asplenium blepharophorum es el típico desarrollo Aspidium con tricomas en el margen de los prótalos, los rizoides se encuentran en la parte ventral y que al momento de desarrollarse los gametangios adultos son abundantes y en particular en los gametófitos femeninos.
Una vez que los gametófitos presentan la forma cordada comienzan a diferenciarse los gametangios, los anteridios antes que los arquegonios que se presentan por lo menos dos semanas antes que los arquegonios según datos de Herrero, Prada, Pangija, Escudero (1993) para las cuatro subespecies de Asplenium trichomanes; Prada, Pangua, Pajarón, Herrero, Escudero y Rubio (1995) para el complejo Asplenium adiantum-nigrum. Lavalle y Prada (2007) para A. dareoides y Estrelles e Ibars (2017) para A. mayoricum. En Asplenium blepharophorum los anteridios se presentan primero y varios días después los arquegonios, concretamente en musgo los anteridios se observaron 13 días antes que los arquegonios, en tierra de hoja a los 111 días antes que los gametangios femeninos y en maquique no se formaron.
En relación a la diferenciación sexual de los gametófitos se cita que en el complejo de Asplenium adiantum-nigrum los gametófitos son unisexuales masculinos, femeninos y bisexuados, los tres tipos se encuentran en un mismo cultivo, además observaron que los gametófitos con anteridios son más pequeños que los femeninos y bisexuados (Prada, Pangua, Pajarón, Herrero, Escudero y Rubio, 1995). En Asplenium monanthes se describe la bisexualidad de los prótalos y ambos gametangios alcanzaron la madurez (Sánchez-Montiel, Arreguín-Sanchez y Fernández-Nava, 2008). Lo mismo ocurre con Asplenium trichomanes ssp. tricomanes donde se mencionan gametófitos bisexuados con arquegonios que constan de cuatro filas de cuatro células y anteridios que consisten en células operculares, anulares y basales, lo cual indica que alcanzaron la madurez (Muccifera y Gori, 1995).
Para Asplenium doroides se muestran tanto anteridios como arquegonios, sin embargo, explícitamente no se especifica si se encuentran en prótalos unisexuados o en gametófitos bisexuados (Lavalle y Prada, 2007), lo mismo sucede con Asplenium majoricum (Estrelles e Ibars, 2017) y aunque no se menciona este dato, en las fotomicrografías de estos trabajos se aprecia que tantos anteridios como arquegonios alcanzaron la madurez.
En Asplenium blepharophorum se encontraron datos diferentes a los anteriores, como gametófitos estrictamente unisexuados femeninos y masculinos que se presentan en un mismo cultivo como ocurre en el complejo Asplenium adiantum-nigrum (Prada, Pangua, Pajarón, Herrero, Escudero y Rubio, 1995), pero nuestro estudio difiere en que no se observaron prótalos bisexuados y la diferenciación entre gametófitos no es tanto en el tamaño cuando son masculinos o femeninos, sino más bien en la presencia de cauda en los masculinos y la ausencia de esta en los femeninos. Otra diferencia de Asplenium blepharophorum con relación a los demás trabajos es que en el sustrato de maquique no se formaron anteridios y los prótalos femeninos desarrollaron un cojinete que demarcó la zona de desarrollo de los arquegonios, estructura que no se había mencionado con anterioridad en otras investigaciones.
Schneller (2013, pág. 145) indica que está demostrada la presencia de anteridiógenos que se reconocen como feromonas empleadas por algunas especies de helechos para favorecer la reproducción sexual y que preferentemente se han investigado en medios nutritivos. Este autor señala que hay pocos estudios en relación de lo que sucede en el medio natural; las primeras evidencias de los efectos de los anteridiógeno en estudios de campo resaltan observaciones relacionadas con el patrón de desarrollo y la sexualidad que se estudiaron en los gametófitos de Asplenium pimpinellifolium Fée y Lygodium heterodoxum Kunze, con estas observaciones se explica las diferentes etapas de la sexualidad de estos helechos. En Asplenium blepharophorum la formación de anteridios y arquegonios en musgo y tierra de hoja y la ausencia de anteridios en el maquique, puede deberse a la acción de los anteridiógenos que están influyendo en los patrones de sexualidad en este sustrato.
En el género Asplenium, (Regalado, Prada, Gabriel y Galán, 2010) encontraron que en el complejo Asplenium auritum cubano-monodon ocurre la formación de esporófitos sexuales y apogámicos. En A. auritum que es un helecho sexual contiene 64 esporas por esporangio, mientras queA. monodon que es una especie apógamica produce 32 esporas. También estos autores observaron caracteres morfológicos apogámicos en A. monodon y en A.× lellingerianum con esporas principalmente abortadas y donde los arquegonios se produjeron regularmente en ambos superficies dorsal y ventral del prótalo, pero parecían ser algo gruesos y con cuellos inusualmente largos, los anteridios fueron escasos y los anterozoides parecían no ser funcionales y se produjeron esporófitos apogámico. Los autores no mencionan la presencia de yema apogámica en el desarrollo morfogénico, que pudiera ser indicio de hibridación o poliploidia. De acuerdo a estos autores la presencia de 32 esporas en Asplenium blepharophorum indicaría el origen apogámico de esta especie, lo cual se corroboró en esta investigación.
Sheffield, 2013, menciona que la apogamia se presenta en los ciclos de vida de los helechos apogámicos obligados y se caracteriza por dos eventos consecutivos: el número de cromosomas que normalmente se reducen en la meiosis, aquí no sucede y esto significa, que las esporas tienen el mismo número de cromosomas que la planta madre y la formación del esporófito se realiza sin la unión de los gametos y se desarrolla directamente del tejido gametófítico. La apogamia facultativa puede suceder debido a condiciones externas o del cultivo como exceso o carencia de agua para la planta, exceso de nutrientes entre otros.
Con base en lo anterior, Asplenium blepharophorus es una especie apogámica donde posiblemente no tuvo lugar la reducción del número de cromosomas en la meiosis, situación que sólo se comprobaría con el conteo cromosómico para considerarla apogámica obligada o bien, al guiarnos por el número de esporas presente en los esporangios, que en este caso son de 32 esporas, este rasgo asegura la apogamia obligada como lo explica (Regalado, Prada, Gabriel y Galán (2010) para el complejo Asplenium auritum cubano-monodon. Esto también está avalado por otros trabajos en otros géneros de helechos como sucede en Pteris (Huang, Chou, Hsieh, Wang y Chiou, 2006; Huang, Hsu, Hsieh, Chou y Chiou, 2011; Martínez, 2010). Por lo anterior se considera que A. blepharophorus no es una especie apogámica facultativa, debido a que la técnica de cultivo ocupa sustratos naturales y no químicos como los medios de cultivo y las esporas no estuvieron sometidas a condiciones ambientales estresantes y más bien, la apogamia que sucede en este taxón es obligada al presentarse 32 esporas por esporangio.
Los híbridos tienen ciclos apogámicos obligados y esta es una condición dominante, además hay una mayor proporción de esporangios en los que no se forman núcleos de restitución, lo que da como resultado 16 células madres de esporas en lugar de ocho. La meiosis entonces es irregular y da como resultado menos de 64 esporas, algunas colapsadas y en gran parte inviables Bell (1992, pág. S131) . En A. blepharophorum se contaron en la gran mayoría de los esporangios 32 esporas y solo en dos 26, lo que sugeriría un posible origen híbrido de esta entidad taxonómica, aunque no se observaron esporas colapsadas.
Los procesos de hibridación han sido ampliamente estudiados en el género Asplenium donde se ha observado que son comunes (Pangua, Prada, Pajarón y Salvo, 1992, p. 1-13; Pérez & Fernández, 1992, págs. 15-25; Pérez & Fernández, 1996, págs. 106-125 y Hunt, Ansell, Russell, Schneider y Vogel, 2011, p. 143). En estos trabajos se reconoce la hibridación con base en análisis citológicos y conteo de cromosomas, pero no en el desarrollo de gametófitos y de esporófitos.
Existen evidencias que en el género Asplenium pueden presentarse hibridaciones y poliploidias que están probadas por caracteres morfológicos, conteo de cromosomas y biología molecular. La presencia de entidades de origen poliploide en helechos se explica a través de numerosas meiosis que aumentan la probabilidad de formación de esporas poliploides, que desarrollarán gametófitos poliploides bisexuados que por autofecundación intragametofítica formarán esporófitos poliploides (Haufler, 2013, págs. 318-321). Estrelles e Ibars (2017), estudiaron la germinación de esporas y caracterización del desarrollo de los gametófitos de Asplenium majoricum con formación de gametófitos, gametangios y esporófitos. De acuerdo (Hunt, Ansell, Russell, Schneider y Vogel, 2011) esta entidad taxonómica se trata de un alotetraploide, sin embargo, Estrelles e Ibars (2017) no mencionan la formación de yema apogámica lo que implicaría el desarrollo sexual de los esporófitos, entonces cómo explicar los resultados del desarrollo morfogénico de A. majoricum al ser una especie poliploide y desarrollar esporófitos se origen sexual.
La explicación a los resultados de Estrelles e Ibars (2017) puede argumentarse por lo propuesto por (Hunt Ansell, Russell, Schneider y Vogel, 2011), quienes citan que en A. majoricum, pueden encontrarse poblaciones diploides y una gran mayoría de poliploides que al parecer estas son más exitosas en el aislamiento geográfico en relación al progenitor diploide. Estos autores no hacen mención a la importancia de la apogamia en la biología reproductiva, aunque seguramente es parte de las estrategias para aprovechar la oportunidad ecológica y facilitar el establecimiento de poblaciones poliploides. Por lo anterior, es probable que en el trabajo de Estrelles e Ibars (2017, p. 1-6) se realizó el estudio de los gametófitos en organismos diploides y no en poliploides. Por la información referida, queda claro que en el género Asplenium puede haber hibridaciones, poliploidías, así como progenitores diploides que tienen la encomienda de la reproducción sexual.
La formación de esporófitos en cultivos se cita en Asplenium platyneuron (Crist & Farrar, 1983, pág. 1809), quienes mencionan haber obtenido esporófitos producto de la siembra de esporas entre un 89 a 93%. Con A. monanthes (Sánchez-Montiel, Arreguín-Sánchez y Fernández-Nava, 2008, p. 29) obtuvieron esporófitos sexuales a los 349 días. En A. auritum, A. monodon y A. × lellingerianum (Regalado, Prada, Gabriel y Galán, 2010, p. 237) indican la formación de esporófitos sexuales en la primera especie y en A. monodon y A. × lellingerianum fueron apogámicos. En el caso de A. scolopendrium var. americanum (Testo y Waikins, 2013 2261) indican la formación de muy pocos esporófitos que se originaron a los 200 días después de la siembra de esporas y no se menciona el origen de los mismos. En A. majoricum (Estrelles e Ibars, 2017, p. 3) obtuvieron esporófitos y no se menciona el origen. En A. blepharophorum se desarrollaron esporófitos apogámicos en los tres sustratos, lo que sugiere un origen híbrido o poliploide de la especie.
Se estudió el híbrido Asplenium ×aran-tohanum que coexiste con sus especies parentales A. billotii y A. tricomanes subsp. quadrivalens en Europa occidental. La investigación consistió en la caracterización completa de las tres entidades y encontraron que el híbrido tiene caracteres morfológicos en su mayoría intermedios entre los padres, se detectó que los padres y el híbrido son tetraploide, los padres de A. billotii solo desarrollaron gametangios femeninos. Solo el 7% de las esporas fueron viables y los gametófitos resultantes no podían formar esporófitos, ni sexual ni apogámicos, lo que sugiere que existen barreras postcigóticas entre los padres. Este helecho es incapaz de completar su ciclo de vida o producir descendencia viable, al parecer, este es un raro ejemplo de hibridación en helechos (De la Fuente, Gabriel y Galán, Molino, Sessa y Quintanilla 2020, p. 1). En A. blepharophorum las esporas fueron viables, no se observaron colapsadas, se produjeron gametangios inmaduros y en maquique solo desarrollaron arquegonios, como sucedió en A. billotii, pero finalmente en los tres sustratos se formaron esporófitos apogámicos.
Conclusiones
Las etapas del desarrollo morfogénico fueron las mismas en los tres sustratos, con germinación de las esporas tipo Vittaria, sin esporas colapadas; desarrollo morfogénico de los gametófitos tipo Aspidium, unisexuados con dimorfismo sexual, los gametangios masculinos se desarrollaron en prótalos con cauda y los femeninos con la forma típica cordada a cordada-lobulada con gran cantidad de rizoides ventrales y cojinete. En el sustrato de maquique estuvieron presentes solo arquegonios. La presencia de cojinete en los gametófitos femeninos no se ha citado en otros trabajos para el género Asplenium.
Los anteridios y arquegonios no maduraron y los esporófitos fueron de origen apogámico, los esporófitos jóvenes se presentaron a partir de los 351 días en maquique, 356 en musgo y 473 en tierra de hoja.
La presencia de gametangios que no maduraron, la formación de esporófitos apogámicos y la presencia de 32 esporas por esporangios son elementos para considerar que Asplenium blepharophorum se trata de una entidad híbrida o poliploide.











 nueva página del texto (beta)
nueva página del texto (beta)