Introducción
La variación en la composición y riqueza de especies de hepáticas a lo largo de gradientes de altitud, se ha analizado ampliamente en distintas regiones de América y Asia, principalmente (Cacua-Toledo et al., 2018; Estepa-Ruiz & Campos, 2022; Feuillet-Hutado & Torres, 2016; Gupta & Asthana, 2016; Rodríguez-Quiel et al., 2022; Santos et al., 2017; Silva et al., 2019). Producto de estos estudios se ha documentado que la distribución espacial de las especies de hepáticas se relaciona con diferentes factores ambientales, bióticos (v. gr. variación en la composición de especies de plantas vasculares, grado de fragmentación del hábitat y tipo de vegetación) y abióticos (v. gr. temperatura, humedad relativa y disponibilidad de luz) en diferentes escalas espaciales (Corrales et al., 2010; de Oliveira & ter Steege, 2013; Delgado & Ederra, 2013; Ruíz-Agudelo & Aguirre-Ceballos, 2004; Wolf, 1995).
En México, el bosque mesófilo de montaña (BMM) o bosque de niebla, posee características ambientales particulares (temperatura moderada y humedad alta), idóneas para el desarrollo de las hepáticas, que dependen principalmente de la humedad para sobrevivir (Gradstein et al., 2001; Holz et al., 2002; Norris et al., 2017). Sin embargo, este tipo de vegetación se distribuye en un intervalo altitudinal amplio, lo cual implica la existencia de variación en las condiciones ambientales y en la composición y riqueza de especies de plantas entre diferentes pisos altitudinales (Rzedowski, 1978; Gual-Díaz & Rendón-Correa, 2017). Existen varios estudios en los que se ha evaluado la composición y riqueza de especies de hepáticas en gradientes de altitud en el BMM (v. gr. Estepa-Ruiz & Campos, 2022; Gradstein et al., 2001; Valente et al., 2013), pero en el caso de las hepáticas epifitas las investigaciones son escasas. El microambiente en donde se desarrollan las plantas epifitas es especial, porque el sustrato es inexistente o pobre en nutrimentos, el suministro de agua es escaso y la radiación suele ser alta, lo cual crea condiciones de aridez (Granados-Sánchez et al., 2003).
En ecosistemas húmedos, como el BMM, las hepáticas epifitas experimentan ciclos de hidratación y desecación más dinámicos que en otros ecosistemas más secos, lo cual favorece su mayor diversidad (Köhler et al., 2007). Aun así, el agua es el principal factor ambiental que limita su supervivencia (Granados-Sánchez et al., 2003; Johnson & Kokila, 1970), pues dependiendo de su capacidad de resistencia a la desecación, algunas especies de hepáticas pueden ser más sensibles que otras (Glime, 2018). En México el BMM es el tipo de vegetación con mayor riqueza florística por unidad de área, pero también es uno de los más afectados por el cambio de uso del suelo, el cambio climático y otras actividades humanas (Gual-Díaz & Rendón-Correa, 2017). La composición de especies de plantas vasculares del BMM de México llama la atención, pues en general el dosel es dominado por especies de afinidad neártica; en cambio, el estrato herbáceo y arbustivo están conformados principalmente por especies de afinidad neotropical (Rzedowski, 1978). En el caso de las especies de hepáticas (Marchantiophyta), existe información general que ha permitido hacer una estimación de su riqueza taxonómica en México (Juárez-Martínez y Delgadillo-Moya, 2014), además de las características morfológicas y anatómicas de las especies que se distribuyen en el Valle de México (Juárez-Martínez y Delgadillo-Moya, 2017), pero los estudios ecológicos y sobre la afinidad u origen geográfico de los taxones de hepáticas epifitas en el BMM y en otros tipos de vegetación en México son nulos (Juárez-Martínez y Delgadillo-Moya, 2017), por lo que es relevante aportar datos básicos sobre ambos aspectos.
Por lo antes mencionado, los objetivos del presente estudio fueron 1) realizar un inventario de las especies de hepáticas epifitas del BMM del estado de Hidalgo, región sur de la Sierra Madre Oriental (SMO) de México, 2) estimar si existe variación en la composición y riqueza de especies de hepáticas epifitas a lo largo del gradiente de altitud analizado, y 3) aportar información sobre la distribución geográfica de las especies de hepáticas epifitas que se desarrollan en el BMM del estado de Hidalgo, México.
Materiales y métodos
Área de estudio
El BMM primario (es decir, con mínima perturbación antropogénica) en el estado de Hidalgo, se localiza en el extremo sur de la SMO, ocupa una superficie de aproximadamente 71,283.42 ha y se distribuye en 24 municipios (INEGI, 2022). Se desarrolla en un intervalo altitudinal de entre 730 m y 2500 m en zonas montañosas de topografía irregular y que presentan diferentes tipos de suelos. El clima varía de templado a semicálido húmedo, con temperaturas que oscilan entre los 12 y 23 ºC. La precipitación total anual es mayor a los 1000 mm (Tabla 1) y la precipitación pluvial más alta ocurre en altitudes mayores de 1500 m (Ángeles, 2009). Las condiciones de humedad y las neblinas características provienen de los vientos húmedos del Golfo de México, los cuales son interceptados por la Sierra Madre Oriental (SMO) y se condensan por fenómenos adiabáticos, originando la estación principal de lluvias en el verano. La concentración de humedad por condensación que resulta de la precipitación horizontal, es común en el intervalo altitudinal de 1000 a 2200 m (Ángeles, 2009; Ruiz-Jiménez et al., 2012).
Muestreo
El estudio se llevó a cabo en tres municipios del estado de Hidalgo (Tepehuacán de Guerrero, Tlanchinol y Zacualtipán de Ángeles), en donde el BMM se distribuye en pisos de altitud contrastantes y está menos perturbado que en otras zonas de la entidad (Ángeles, 2009). En cada municipio se establecieron dos sitios de muestreo uno en el extremo inferior y otro en el extremo superior del gradiente de altitud donde se distribuye el BMM (Fig. 1 y Tabla 1), y en cada sitio se colocó una parcela de muestreo de 0.1 ha. Por parcela se eligieron al azar, de entre todas las especies de árboles presentes, 10 individuos con las siguientes características: 1) corteza cubierta en forma apreciable por hepáticas (≥20%) en la parte basal del tronco, y 2) diámetro del tallo ≥30 cm, medido a 1.30 m de altura (diámetro normal, sensuQuiñonez et al., 2012). Es importante mencionar que dentro de cada parcela se encontraron suficientes arboles con las características mencionadas, para hacer la selección al azar. En cada individuo seleccionado, se colocaron al azar tres micro parcelas de 10×10, desde la base hasta los primeros 2 m de altura del tronco, para estimar la riqueza y extraer las muestras para determinar la composición de especies de hepáticas epifitas (Tabua et al., 2017).
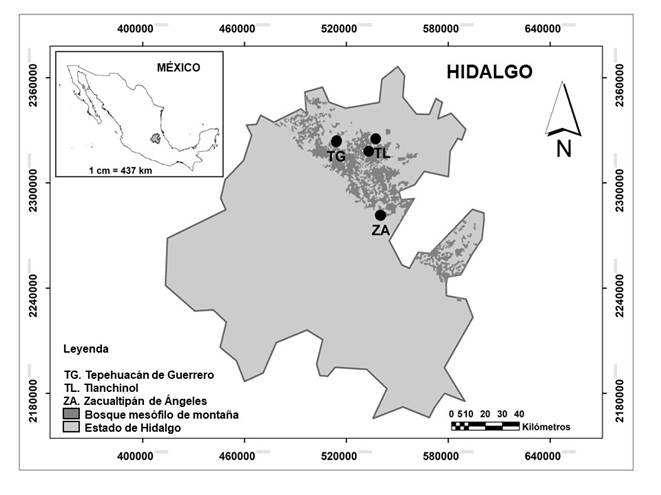
Fig. 1 Localización de los sitios de muestreo de las especies de hepáticas epifitas del BMM de Hidalgo. Las distancias geográficas entre los puntos correspondientes a los dos pisos altitudinales de Tepehuacán de Guerrero y Zacualtipán de Ángeles es corta, por lo que se sobreponen en la figura.
Tabla 1 Localización de los sitios de estudio dentro del BMM del estado de Hidalgo.
| Municipio | Ubicación del BMM | Coordenadas geográficas | Temperatura promedio °C | Precipitación pluvial (mm) | Pisos de altitud (m) |
|---|---|---|---|---|---|
| Tepehuacán de Guerrero | Norte | 21° 1' 2.30" N 98° 51' 44.70" O | 24.0 | 2,120 | 1,345-1,375 1,382-1,440 |
| Tlanchinol | Norte | 21° 1' 37.70" N 98° 38' 26.70" O | 18.9 | 2,601 | 1,433-1,533 1,519-1,564 |
| Zacualtipán de Ángeles | Centro | 20° 37' 55.90" N 98° 36' 50.20" O | 14.0 | 2,047 | 1,985-2,001 1,926-2,019 |
Tratamiento de muestras y análisis de datos
Los especímenes se determinaron utilizando las claves y descripciones taxonómicas disponibles, principalmente Bernecker-Lücking (1999), Fulford (1945), Gradstein (1994, 2015, 2016, 2017), Gradstein & Costa (2003), Gradstein et al. (2001) y Reiner-Drehwald (2000). La clasificación taxonómica a nivel de familia y género se basó en el trabajo de Crandall-Stotler et al. (2009); la nomenclatura de las especies y los nombres de las autoridades taxonómicas se verificaron y actualizaron a partir de Tropicos (Tropicos.org, 2022). Los ejemplares de hepáticas recolectados, se encuentran depositados en la colección de briofitas del laboratorio de Ecología de Poblaciones, del Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Hidalgo (colección no registrada) y un duplicado, se depositará en la colección de briofitas del herbario nacional MEXU, con sede en el Instituto de Biología de la Universidad Nacional Autónoma de México. Se utilizaron valores del peso seco de las muestras (biomasa) para estimar la semejanza en la composición de especies a lo largo del gradiente de altitud, por medio de un análisis de agrupamiento; en el que se eligió como medida de semejanza la distancia Euclidiana y el método de Ward para la unión de grupos (Ludwig & Reynolds, 1988). El análisis se realizó con el programa Statistica versión 7.0 (StatSoft, 2008).
Análisis de la distribución geográfica de las especies
Para obtener información sobre la distribución geográfica de los taxones se consultaron las bases de datos de Global Biodiversity Information Facility-GBIF (GBIF.org, 2022) y Tropicos (Tropicos.org, 2022), además de artículos de investigación, libros y capítulos de libros (Delgadillo, 1993: So, 2005; Dauphin et al., 2011; Gradstein, 1994, 2017, 2020; Gradstein & Hekking, 1989; Heinrichs et al., 1999; Heinrichs & Gradstein, 2000; Maidana, 2013; So, 2005; Valente & Pôrto, 2006). Las áreas de distribución o afinidades geográficas, se definieron con base en la distribución de las especies de hepáticas del BMM de Hidalgo, tomando como guía las categorías biogeográficas generales propuestas por Gradstein y Weber (1982) y Dauphin et al. (2011) para plantas no vasculares, y por Morrone (2015) para plantas vasculares. Las regiones consideradas fueron: 1) Neotropical, que incluye Sudamérica, Centroamérica, Centro-Sur de México y Antillas; 2) America, que comprende las regiones Neotropical y Neártica (Centro-Norte de México-Sur de Estados Unidos de América), 3) Distribución disyunta, con cuatro distintas combinaciones, especies con distribución Neotropical-África, América-África, América-Oceanía y Neotropical-Europa-África; y 4) Amplia distribución (cuatro o más regiones geográficas).
Resultados
Riqueza de especies
Se registraron nueve familias, 17 géneros, 29 especies y dos variedades de hepáticas epifitas del BMM de Hidalgo (Tabla 2). La familia más representativa fue Lejeuneaceae con siete géneros. Los géneros con mayor número de especies fueron Lejeunea Lib. y Plagiochila (Dumort.) Dumort., con siete y cinco especies, respectivamente. Las especies de árboles en los que se realizó la recolección de las hepáticas fueron Quercus spp. (40 individuos), Liquidambar styraciflua L. (8 individuos), Fagus grandifolia subsp. mexicana (Martínez) A.E. Murray) (5 individuos), Magnolia schiedeana Schlt. (2 individuos), Pinus sp. (2 individuos) y Cyathea fulva (M. Martens & Galeotti) Fée (1 individuo). En todas las localidades estudiadas, el dosel del bosque mesófilo estaba dominado por especies de encinos, excepto en Zacualtipán de Ángeles, donde dominaban Fagus y Quercus.
Tabla 2 Listado de especies epifitas de Marchantiophyta del BMM del estado de Hidalgo, presentes a lo largo del gradiente altitudinal analizado. TG-1. Tepehuacán de Guerrero (1345-1375 m); TG-2. Tepehuacán de Guerrero (1382-1440 m); TL-1. Tlanchinol (1433-1533 m); TL-2. Tlanchinol (1519-1564 m); ZA-1. Zacualtipán de Ángeles (1985-2001 m), ZA-2. Zacualtipán de Ángeles (1926-2019 m). F. Especie de Forófito: 1. Cyathea fulva (M. Martens & Galeotti) Fée; 2. Fagus grandifolia subsp. mexicana (Martínez) A.E. Murray; 3. Liquidambar styraciflua L.; 4. Magnolia schiedeana Schlt.; 5. Pinus L.; 6. Quercus L. Los símbolos indican presencia (+) o ausencia (-).
| Familia | Taxa | TG-1 | TG-2 | TL-1 | TL-2 | ZA-1 | ZA-2 | F |
|---|---|---|---|---|---|---|---|---|
| Calypogeiaceae | Calypogeia peruviana Nees & Mont. | + | - | - | - | - | - | 6 |
| Frullaniaceae | Frullania brasiliensis Raddi | - | - | - | - | - | + | 6 |
| Lejeuneaceae | Anoplolejeunea conferta (C.F.W. Meissn. ex Spreng.) A. Evans | - | - | - | - | + | - | 6 |
| Bryopteris filicina (Sw.) Nees | - | - | - | + | - | - | 6 | |
| Ceratolejeunea cubensis (Mont.) Schiffn. | + | + | + | - | + | + | 3, 6 | |
| Cheilolejeunea rigidula (Nees ex Mont.) R.M. Schust. | + | - | - | - | + | + | 2, 6 | |
| Dicranolejeunea axillaris (Nees & Mont.) Schiffn. | - | - | + | - | - | - | 6 | |
| Lejeunea calcicola R.M. Schust. | - | + | - | - | - | - | 6 | |
| Lejeunea cavifolia (Ehrh.) Lindb. | - | + | - | - | - | + | 2, 6 | |
| Lejeunea flava (Sw.) Nees | - | + | - | - | - | + | 3, 6 | |
| Lejeunea laetevirens Nees & Mont. | + | - | - | + | + | + | 4, 6 | |
| Lejeunea pterigonia (Lehm. & Lindenb.) Mont. | - | - | + | - | - | - | 6 | |
| Lepidolejeunea involuta (Gottsche) Grolle | - | + | + | - | - | - | 6 | |
| Lepidoziaceae | Bazzania falcata (Lindenb.) Trevis | + | - | + | - | - | - | 1, 3, 6 |
| Bazzania hookeri (Lindenb.) Trevis var. hookeri | - | - | + | - | - | - | 1, 6 | |
| Lepidozia cupressina (Sw.) Lindenb. | + | - | - | - | + | - | 3 | |
| Lophocoleaceae | Leptoscyphus porphyrius (Nees) Grolle | - | - | - | - | + | - | 5 |
| Lophocolea muricata (Lehm.) Nees | - | + | - | - | - | - | 5 | |
| Metzgeriaceae | Metzgeria conjugata Lindb. | - | + | - | + | + | - | 5, 6 |
| Plagiochilaceae | Plagiochila aerea Taylor | + | + | + | + | - | - | 6 |
| Plagiochila bifaria (Sw.) Lindenb. var. bifaria | - | - | - | - | + | - | 6 | |
| Plagiochila patula (Sw.) Nees & Mont. ex Lindenb. | - | - | + | + | + | + | 2, 6 | |
| Plagiochila raddiana Lindenb. | + | + | - | + | + | + | 3, 6 | |
| Plagiochila rutilans Lindenb. | - | + | + | + | - | - | 3, 6 | |
| Plagiochila simplex (Sw.) Lindenb. | - | - | - | + | - | - | 6 | |
| Plagiochila subplana Lindenb. | - | - | - | - | - | + | 2 | |
| Porellaceae | Porella swartziana (F. Weber) Trevis | - | - | - | + | + | + | 2, 6 |
| Radulaceae | Radula javanica Gottsche | - | - | - | - | + | + | 2, 4, 5 |
| Radula mexicana Lindenb. & Gottsche | - | - | - | - | + | - | 6 |
Distribución altitudinal
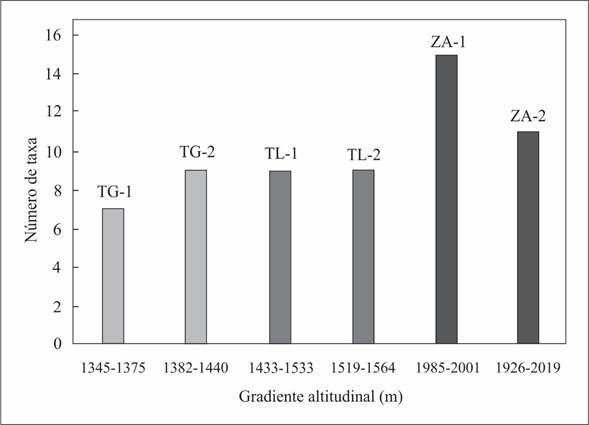
La mayor riqueza de especies se encontró entre los 1985 y 2001 m (Zacualtipán de Ángeles) y la menor riqueza entre 1345 y 1375 m (Tepehuacán de Guerrero), en los sitios de altitud más baja (Fig. 2). La distribución de cada una de las especies a lo largo del gradiente altitudinal analizado, fue diferente. En el caso de Ceratolejeunea cubensis (Mont.) Schiffn. y Plagiochila raddiana Lindenb), presentaron distribución amplia, es decir, en todo el gradiente altitudinal analizado. Plagiochila aerea Taylor se distribuye entre 1345 y 1564 m; Plagiochila patula (Sw.) Nees & Mont. ex Lindenb. entre 1433 y 2019 m, y Porella swartziana (F. Weber) Trevis. entre 1519 y 2019 m de altitud. El rango de distribución altitudinal en el resto de los taxones fue más restringido (Fig. 2).
Composición de especies
En el dendrograma generado (Fig. 3), se reconocieron tres grupos: el primero conformado por dos sitios de muestreo, ambos en el municipio de Zacualtipán de Ángeles, situados a mayor altitud (entre 1985 y 2019 m) y a mayor distancia geográfica que los demás; el segundo grupo está integrado por los dos sitios de muestreo de mayor altitud en Tepehuacán de Guerrero (1382-1440 m) y Tlanchinol (1519-1564 m); y el tercer grupo está constituido por los dos sitios de muestreo de menor altitud de Tepehuacán de Guerrero (1345-1375 m) y Tlanchinol (1433-1533 m).
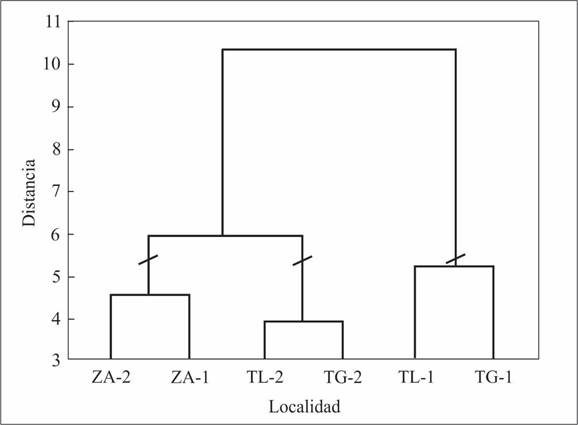
Fig. 3 Dendrograma del análisis de agrupamiento que muestra la semejanza en la composición de especies de hepáticas de diferentes sitios ubicados a distinta altitud en el BMM de Hidalgo. TG-1. Tepehuacán de Guerrero (1345-1375 m), TG-2. Tepehuacán de Guerrero (1382-1440 m), TL-1. Tlanchinol (1433-1533 m), TL-2. Tlanchinol (1519-1564 m), ZA-1. Zacualtipán de Ángeles (1985-2001 m), ZA-2. Zacualtipán de Ángeles (1926-2019 m).
Distribución geográfica
Se definieron siete grupos diferentes con base en la distribución geográfica de las especies de hepáticas epifitas presentes en el BMM de Hidalgo. Los grupos mejor representados fueron: el elemento Neotropical (55% de las especies, que se distribuyen principalmente en Centro y Sudamérica), el de amplia distribución (21%) y el Américano (10%), con especies que se distribuyen en el neotrópico y en el sureste de Estados Unidos de América. Los demás grupos, que incluyen especies con distribución disyunta en África, Europa Occidental y Oceanía, presentaron valores de 3.4%, cada uno (Fig. 4).
Discusión
Riqueza de especies. Las familias Lejeuneaceae y Plagiochilaceae fueron las más representativas con 11 y siete especies, respectivamente; lo cual puede estar relacionado con el alto número de especies de hábito epífito que ambas contienen (Cacua-Toledo et al., 2018; Christine et al., 2013; de Oliveira & ter Steege, 2013; Feuillet-Hutado & Torres, 2016; Holz & Gradstein, 2005). Los géneros Lejeunea y Plagiochila fueron los que presentaron un número más alto de especies, lo cual puede deberse, en parte, a que América tropical es el centro de diversificación principal de Lejeuneaceae (Gradstein, 2020), de ahí que, casi tres cuartas partes de los 72 géneros que integran esta familia a nivel mundial, y probablemente alrededor de un tercio de las especies, se encuentran en el Neotrópico.
La riqueza de especies encontrada en el presente estudio fue baja, comparada con la registrada en otras investigaciones realizadas en BMM en Sudamérica: en la región de Los Andes, Costa Rica y Colombia se determinaron 187, 200 y 166 especies, respectivamente (Campos et al., 2019; Gradstein et al., 2001; Holz & Gradstein, 2005; Wolf, 1993). Sin embargo, en los estudios referidos se recolectaron hepáticas de varios sustratos de crecimiento, microhábitats y/o el tamaño del área de muestreo fue considerablemente mayor que en el presente estudio.
Las 29 especies de hepáticas epifitas que componen la flora del BMM de Hidalgo representan sólo el 5.0% de las 600 especies estimadas para México (Delgadillo-Moya, 2022; Delgadillo-Moya & Juárez-Martínez, 2014). Sin embargo, las condiciones ambientales que prevalecen en el BMM, como la humedad atmosférica alta y la temperatura moderada (Gual-Díaz & Rendón-Correa, 2017; Jardel Peláez et al., 2014), son idóneas para el desarrollo y proliferación de las hepáticas, aunado a ello, este grupo de plantas se desarrolla sobre varios sustratos (suelo y rocas), que no fueron considerados en el presente estudio, por lo que la riqueza de especies debe ser más elevada si se realiza el muestreo en todos los sustratos de crecimiento (Alvarenga & Lisboa, 2009; Marques & Cavalcanti, 2007; Oliveira-da-Silva & Ilkiu-Borges, 2018).
Con respecto a los forófitos, la mayoría de las especies de hepáticas recolectadas crecen sobre árboles de Quercus sp. y Liquidambar styraciflua L., lo cual probablemente se relaciona con las características de la corteza (fisurada) y con el hecho de que son los árboles dominantes en los sitios de estudio. Tal como lo sugieren Frahm (2003) y Mota De Oliveira et al. (2009), las características de la corteza pueden influir sobre la riqueza y composición de las especies epifitas, la textura es importante, ya que las cortezas lisas acumulan poca humedad y humus en comparación con las rugosas. En contraste, solo dos especies de hepáticas crecen sobre Magnolia schiedeana (árbol de corteza lisa) y Cyathea fulva (helecho arborescente), lo cual puede estar relacionado con la baja importancia estructural de ambas especies de árboles en el BMM analizado; como la selección de los forofitos fue al azar, sólo se recolectaron hepáticas sobre un helecho arborescente y dos árboles de Magnolia. Sin embargo, otros factores ambientales tales como la edad, densidad y biomasa de los forófitos, también pueden influir en la variación en la riqueza de especies. Por ejemplo, se ha encontrado que las hepáticas epifitas suelen ser dominantes en bosques montanos maduros (Gradstein et al., 2001; Gradstein & León-Yánez, 2020; Valente et al., 2013), lo cual coincide con los valores de riqueza más altos, encontrados en los bosques maduros de encino y haya, de las dos localidades de Zacualtipán de Ángeles.
Distribución altitudinal y composición de especies. La composición, riqueza y distribución de las especies de hepáticas del BMM de Hidalgo cambió a lo largo del gradiente de altitud analizado. En general, la semejanza en la composición de especies fue menor entre sitios con altitudes contrastantes o distantes geográficamente entre sí; lo que es acorde con el patrón o fenómeno de decaimiento en la semejanza florística por la distancia, en el cual se asume que las condiciones ambientales locales serán más contrastantes entre sitios más lejanos (Canché-Delgado et al., 2011; Cavieres & Piper, 2004; Nekola & White, 1999; Soininen et al., 2007). En concordancia con lo anterior, Nöske et al. (2008) mencionan que las condiciones micro climáticas influyen marcadamente en la composición de especies de briofitas, es decir, cada taxón responde de diferente manera a las condiciones ambientales locales. En el presente estudio, la mayor riqueza de especies se encontró en la localidad de Zacualtipán de Ángeles, en los sitios de mayor altitud (entre los 1926 y 2019 m), por lo que es probable que en este bosque las condiciones micro climáticas (v. gr. temperatura promedio más baja, precipitación total anual > 2000 mm anuales), sean más idóneas para la existencia de un conjunto mayor de especies de hepáticas, que en las demás localidades analizadas.
La humedad y la temperatura del BMM varían, de acuerdo con el intervalo de altitud donde se distribuye en las diferentes regiones de la SMO (Ángeles, 2009; Gual-Díaz & Rendón-Correa, 2017). En el piso altitudinal inferior, el BMM, colinda comúnmente con el bosque tropical subcaducifolio, que se caracteriza por presentar menor humedad y temperatura más alta que el BMM; y en el piso de elevación superior con bosques de coníferas y de encino, en donde hay menor humedad y temperatura más baja que en el BMM; por lo que la afinidad florística de sus componentes está relacionada con las condiciones ambientales que predominan y con el medio local colindante (Valdez et al., 2003).
Distribución geográfica. La influencia del elemento Neotropical sobre la flora de hepáticas del BMM de Hidalgo podría estar asociada con la alta representatividad de especies de Lejeuneaceae, pues se considera que esta región biogeográfica es el centro de diversidad de la familia; por lo que la presencia de Anoplolejeunea conferta y Dicranolejeunea axillaris, especies endémicas del Neotrópico (Gradstein, 2020) en este ecosistema es plausible.
La distribución de las especies de plantas dentro de las áreas biogeográficas suele ser heterogénea, porque las condiciones ambientales adecuadas para la supervivencia y desarrollo de las especies no son homogéneas dentro de estas áreas; este fenómeno se observa con claridad en los taxones de hepáticas de América, pues en la región Neotropical están mejor representados en Centro y Sudamérica; y en la región Neártica en el Sureste de Estados Unidos de América (Dauphin et al., 2011; Gradstein, 1994, 2017, 2020; Gradstein & Hekking, 1989; Heinrichs et al., 1999; Heinrichs & Gradstein, 2000; So, 2005; Valente & Pôrto, 2006). Las especies de hepáticas con amplia distribución, que comprenden otro de los componentes más representativo en el presente estudio (segundo lugar), pueden considerarse como semi cosmopolitas, es decir, especies con distribución amplia, que ocupan varias unidades biogeográficas de rango mayor, como reino o región (sensuGuerrero et al., 2018), lo cual es un indicio de su alta capacidad de adaptación y dispersión en diferentes ambientes.
La presencia de especies con distribución disyunta, como Leptoscyphus porphyrius, que se distribuye en el Neotrópico y África, Porella swartziana en América y África, y Plagiochila bifaria en el Neotrópico, Europa Occidental y África, son de interés biogeográfico, pues pueden permitir confirmar o refutar hipótesis sobre como ocurrió la dispersión de las especies. La propuesta más aceptada para explicar este fenómeno es la que enfatiza la unión entre América y África, aunque también se han sugerido otras alternativas, como la dispersión de esporas a gran distancia y la migración a partir de áreas que se formaron después de la deriva continental (Delgadillo, 1993). La disyunción que llama más la atención es la de Plagiochila raddiana, cuya distribución incluye el Neotrópico, el sur de E.U.A. y el sur de Asia. En este caso, no hay una explicación convincente, pero se han propuesto dos causas posibles: 1) que sus ancestros habitaban originalmente una de las áreas y desde allí se dispersaron hacia las demás, o bien, 2) que sus ancestros ocupaban un superficie amplia, que comprendía las actuales áreas disyuntas, las cuales son restos de la distribución ancestral (Maidana, 2013). Otra explicación plausible es que el área de distribución de las especies es amplia, pero no existen suficientes registros en campo de su presencia, por la carencia de estudios florísticos y ecológicos.
Existen pocos trabajos sobre la composición, distribución y riqueza de especies de hepáticas (epifitas o de cualquier otro sustrato de crecimiento), en los diferentes ecosistemas terrestres de México (incluido el BMM). El listado florístico obtenido y los datos sobre su distribución altitudinal pueden servir como base para conocer otros aspectos biológicos de importancia de estas especies, v. gr. el papel ecológico que desempeñan, el estado de conservación de su hábitat y usos potenciales. Se ha documentado que las hepáticas son vulnerables a los cambios ambientales (humedad, nutrimentos, radiación, entre otros), por ello son consideradas excelentes indicadores de cambios, incluso sutiles, en las condiciones climáticas de los bosques (Ah-Peng et al., 2017).
Conclusiones
En el bosque mesófilo de montaña de Hidalgo se desarrollan al menos 29 especies de hepáticas epifitas, en el gradiente de altitud analizado la distribución de estas especies fue heterogénea. La menor riqueza de especies se encontró en sitios con altitud baja (1345-1375 m), mientras que el mayor número de especies ocurrió en sitios de altitud más elevada (1985-2001 m); probablemente porque las condiciones ambientales de humedad y temperatura en este intervalo de altitud, son más benignas e idóneas para las hepáticas. La semejanza en la composición de especies se relacionó en forma inversa con la distancia geográfica entre sitios, lo cual sugiere que las condiciones ambientales locales tienen alta influencia en la composición y riqueza de especies. El número de especies de hepáticas con distribución Neotropical predominó ampliamente con respecto a las que se distribuyen en otras regiones del planeta. Los resultados obtenidos sobre la composición, riqueza y distribución de las especies de hepáticas epifitas en el gradiente de altitud y a escala biogeográfica, aportan información básica sobre los patrones de distribución de este grupo de plantas, que pueden ser de utilidad en los programas de manejo y conservación de la biodiversidad del BMM de Hidalgo y de México.











 nueva página del texto (beta)
nueva página del texto (beta)