Introducción
Sequoia sempervirens (D. Don). Endl. pertenece a la familia Taxodiaceae; especie poliploide (2n = 6x = 66) (Ahuja, 2005), originaria de la costa oeste de California y suroeste de Oregón, Estados Unidos (Olson et al., 1990). Se ha introducido como especie de ornato en: Nueva Zelanda (Davies et al., 2014), Brasil (Ribeiro et al., 2011), Rumania (Clapa et al., 2010), Chile (Toral Ibañez et al., 2009), Italia (Ozudogru et al., 2011) y España (Rojas-Vargas et al., 2021).
S. sempervirens presenta bajo porcentaje de germinación (10%) y problemas de crecimiento de las plántulas (Olson, Roy, & Walters, 1990), debido a ello se ha optado por métodos de propagación asexual, como enraizamiento de estacas (Pereira, Ângelo, Navroski, Dobner Júnior, & De Oliveira, 2017) y cultivo in vitro (Rojas Vargas et al., 2021).
En cultivo in vitro, aspectos como concentración de macro y micronutrimentos, tipo y concentración de carbono, pH, y reguladores de desarrollo afectan el crecimiento en explantes (Molinos Da Silva et al., 2004). Para la proliferación de brotes en cultivo in vitro son utilizadas las citocininas (Hill & Schaller, 2013).
En S. sempervirens o secuoya se han realizado protocolos de embriogénesis somática (Liu, Xia, Yin, Huang, & Zhou, 2006), proliferación de brotes axilares (Whan Sul & Korban, 1994), en donde se utilizan principalmente sales MS (Murashige & Skooge, 1962), las cuales contienen concentraciones altas de macronutrimentos. En el caso de proliferación de brotes se han empleado ápices (Ribeiro et al., 2011), ocasionando crecimiento en longitud, con tasa de multiplicación baja, pero no se han explorado metodologías con medios de cultivo diferentes a los comúnmente usados (Phillips & Garda, 2019), además de explantes de tallo con y sin yemas apicales.
Secuoya tiene un papel ecológico importante en el área de distribución natural, y potencial como especie de ornato, por lo que el objetivo de este trabajo fue desarrollar una metodología in vitro para la proliferación de S. sempervirens D. Don. Endl. utilizando explantes de tallo apicales y basales, cuatro concentraciones de kinetina, además de un medio de cultivo con baja concentraciones de sales para sustituir el uso del medio MS.
Materiales y métodos
Material vegetal y desinfestación
En febrero de 2019 se recolectaron brotes laterales de 15 cm con yemas axilares en crecimiento activo, de un árbol de S. sempervirens de 18 años ubicado en la Universidad Autónoma Chapingo. Los brotes fueron lavados con agua y jabón, con cepillo dental se frotaron en sentido del crecimiento de las yemas, enjuagaron con agua y obtuvieron fracciones de tallo con dos yemas, para facilitar la desinfestación en la campana de flujo laminar.
Las soluciones utilizadas para desinfestar el tejido fueron: etanol 80%, hipoclorito de sodio comercial (10%) y peróxido de hidrógeno comercial (10%) por 2, 5 y 10 minutos, respectivamente; finalmente se realizaron tres enjuagues con agua desionizada estéril, de 5, 3 y 1 min. Al terminar dicho proceso, las fracciones de tallo se mantuvieron en agua desionizada estéril para evitar su deshidratación.
Medio de cultivo y establecimiento de explantes
Los componentes del medio de cultivo para establecimiento fueron: agar (Sigma®) y azúcar comercial no refinada; con 6 y 20 g L-1, respectivamente, estabilizado a pH 5.7 y esterilizado a 20 libras de presión en autoclave, por 15 minutos. Del material vegetal se extrajeron 20 ápices y colocaron en tubos de ensayo (25 × 150 mm) con 10 mL de medio de cultivo antes mencionado.
Una semana después de colocar los ápices en medio de establecimiento, aquellos que no presentaron contaminación se subcultivaron en el medio de cultivo para multiplicación (Tabla 1), con pH de 5.7 y esterilizado a 20 libras de presión, durante 15 minutos. Todos los reactivos utilizados fueron marca Sigma®.
Tabla 1 Medio de cultivo para multiplicación de Sequoia sempervirens (D. Don). Endl.
| Nutrimentos | Concentración |
|---|---|
| NH4NO3 | 8 mM |
| KNO3 | 6 mM |
| Ca(NO3)2 4H2O | 1.5 mM |
| MgSO4 7H2O | 1.5 mM |
| KH2PO4 | 1.2 mM |
| Quelatos* | 0.1 mM |
| Micronutrimentos** | 0.1 mM |
| Ácido indolbutírico | 0.98 μM |
| Kinetina | 1.85 μM |
| Sacarosa | 20 g |
| Agar | 6 g |
*Quelatos: FeSO4 7H2O (695 mg) y Na EDTA (931 mg), preparados en 250 mL de agua desionizada.
** Micronutrimentos: H3BO3: 155 mg, MnSO4 H2O: 422.5 mg, ZnSO4 7H2O: 215 mg, Na2 MoO2 H2O: 6.25 mg, CuSO4 5H2O: 0.625 mg, preparados en 250 mL de agua desionizada. Las concentraciones de los componentes del medio de cultivo fueron para preparar un litro de medio.
Multiplicación y tratamientos establecidos
El material vegetal para establecer tres experimentos consecutivos se obtuvo siete meses después de hacer el establecimiento in vitro. Durante este tiempo se hicieron tres subcultivos en el medio para multiplicación (Tabla 1) con el fin de tener la cantidad de explantes suficientes.
Los tratamientos establecidos fueron ocho: dos tipos de explante (apical y basal) que se obtuvieron del mismo brote (Fig. 1) y cuatro concentraciones de kinetina (6- furfuril-aminopurina) 0, 0.92, 1.85 y 3.71 μM L-1, con las que fue suplementado el medio de cultivo para multiplicación (Tabla 1). En cada tratamiento se utilizaron 12 explantes, siendo estos las unidades experimentales, numerados del 1 al 12.

Fig. 1 Tipo de explante utilizado en la multiplicación in vitro de S. sempervirens. A: apical; B; basal.
Los subcultivos (experimentos) se hicieron cada seis semanas. Las evaluaciones se hacían en ambos tipos de explantes, pero para establecer el experimento posterior solo se utilizaron explantes apicales, por dos razones, la primera, debido a la longitud que estos presentaban para obtener secciones apical y basal, y la segunda, para mantener el orden de la numeración colocada a los brotes (Fig. 1). El cuarto de incubación in vitro se mantuvo a 25 °C y fotoperiodo de 16 horas.
Variables evaluadas
Crecimiento de explantes apicales
Al momento del subcultivo se midió la longitud inicial de los explantes, y durante seis semanas se colocaron marcas en el tubo de ensayo para denotar el crecimiento de los segmentos. La altura real de cada explante se midió con papel milimétrico durante el subcultivo, determinando así el incremento de cada uno de ellos. Dicho proceso se hizo en los tres experimentos.
Efecto del tipo de explante en la brotación
En los tres experimentos se determinó de manera visual el desarrollo de yemas laterales, y durante el subcultivo de ambos tipos de explantes se contaron los brotes laterales aptos para ser utilizados. Los criterios que se consideraron para brotes aptos fueron: no presentar hiperhidratación, longitud mayor a 0.5 cm y cuando eran ≥ 5 cm, fueron divididos en segmentos apical y basal. En todos los subcultivos realizados se obtuvo material vegetativo extra, que se colocó en medio de cultivo para multiplicación (Tabla 1) con el objetivo de seguir multiplicando la especie, pero sin fines de experimentación.
Diseño experimental y análisis estadísticos
El diseño experimental fue completamente al azar con arreglo factorial (2 × 4). Dos tipos de explantes (apical y basal) y cuatro concentraciones de kinetina (0, 0.92, 1.85 y 3.71 μM L-1). Para los análisis de incremento en altura, solo se tomaron en cuenta los explantes apicales, haciendo pruebas de comparación de medias Tukey (p ≤ 0.05), con el programa SAS 9.4, las unidades experimentales fueron 12 ya que se analizaron los tres experimentos por separado. Se usó el análisis de series de tiempo (Minitab 18.1), para determinar la dinámica de crecimiento semanal, utilizando 36 unidades experimentales por tratamiento, tomando en cuenta los datos de los tres experimentos.
El efecto del tipo de explante en el número de brotes emitidos, se analizó con regresión Poisson (R 4.1.0), debido a que es variable de conteo. Para el número total de brotes aptos para subcultivo, se determinaron por conteo directo; reportándose de la misma forma. Las unidades experimentales usadas fueron 48 (resultado de 12 explantes por cuatro tratamientos), ya que no se tomaron en cuenta las concentraciones de kinetina.
Resultados
Establecimiento
De los 20 ápices colocados en el medio de cultivo para establecimiento, ninguno presentó daño visible por la desinfestación utilizada. A pesar de haber utilizado material de campo, no hubo contaminación ni oxidación. Lo que permite señalar que el protocolo de desinfestación aplicado y las medidas asépticas utilizadas durante el proceso de establecimiento; fueron eficientes.
Para obtener material suficiente y establecer los experimentos, fue necesario hacer tres subcultivos en medio para multiplicación (Tabla 1), el primero fue 3 meses después de colocados los 20 ápices, y se obtuvieron 27 brotes, en el segundo, un mes después se lograron 43 brotes y el último subcultivo se hizo seis semanas después con 75 brotes. El incremento en el número de brotes, del primero al tercer subcultivo puede deberse a que los explantes se adaptaron a las condiciones in vitro.
Incremento en altura
Con el medio de cultivo y las concentraciones de kinetina utilizadas, se generaron brotes de 3.46 - 7.05 cm, longitud suficiente para obtener fracciones de tallos de 1.5 - 2 cm para realizar subcultivos y seguir con el proceso de multiplicación de la especie.
Respecto a la prueba de medias, en el primer experimento no hubo diferencias estadísticas, pero sí en los posteriores. En los experimentos dos y tres, en el tratamiento sin kinetina se obtuvieron los mayores incrementos con 4.26 y 4.78 cm, respectivamente (Tabla 2). De manera general, con las concentraciones 0.92, 1.85 y 3.71 μM L-1 de kinetina, el incremento en altura disminuyó del experimento dos al tres, lo que indica que secuoya en condiciones in vitro no requiere kinetina para crecimiento.
Tabla 2 Comparación de medias para incremento en altura (cm) de S. sempervirens, en los tres experimentos realizados.
| Kinetina (μM L-1) | Exp. 1 | Exp. 2 | Exp. 3 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| AI (cm) |
Incremento (cm) | AI (cm) |
Incremento (cm) |
AI (cm) |
Incremento (cm) |
||||
| 0 | 2.08 | 2.35 | a | 2.03 | 4.26 | a | 2.27 | 4.78 | a |
| 0.92 | 2.02 | 1.85 | a | 1.96 | 2.99 | b | 1.92 | 2.20 | b |
| 1.85 | 2.34 | 1.88 | a | 1.84 | 2.92 | b | 2.09 | 2.58 | b |
| 3.71 | 2.54 | 2.15 | a | 1.96 | 2.71 | b | 1.96 | 1.50 | b |
| DMSH | 1.11 | 1.22 | 1.17 | ||||||
Exp.1: Experimento 1; Exp.2: Experimento 2; Exp.3: Experimento 3; AI: altura inicial DMSH: Diferencia mínima significativa honesta; letras diferentes en las columnas indican diferencia estadística significativa; p = 0.05; n = 12.
Crecimiento en el tiempo
Determinar el crecimiento de los explantes a través del tiempo, proporciona información para definir cuándo deben realizarse los subcultivos, ya que al colocar el explante en medio nuevo, la disponibilidad de nutrimentos y reguladores de desarrollo es mayor, lo que permite el crecimiento del brote.
Los experimentos se establecieron cada seis semanas, sin embargo, de acuerdo con los resultados se demuestran que los subcultivos para secuoya puede realizarse a las cinco semanas (Fig. 2, Tabla 3), ya que en la semana cuatro y cinco no se observa elongación del brote. Sin embargo, el pronóstico de crecimiento (Tabla 3), muestra que en la semana siete puede existir crecimiento, por lo que secuoya pudiera subcultivarse hasta esa semana, pero es necesario corroborarlo mediante experimentos.
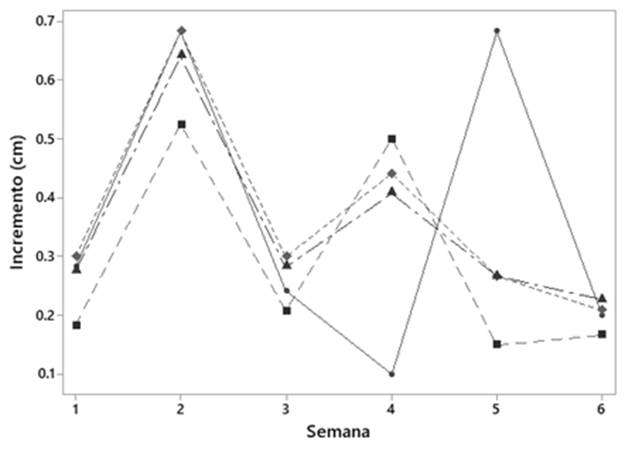
Fig. 2 Incremento en altura de explantes apicales de S. sempervirens a través del tiempo, en concentraciones de kinetina μM (0  , 0.92
, 0.92  , 1.85
, 1.85  y 3.71:
y 3.71:  ), n = 36.
), n = 36.
Tabla 3 Pronóstico de crecimiento de explantes apicales de S. sempervirens a través del tiempo, en cultivo in vitro
| Semanas | Concentraciones de kinetina (µM L-1) | |||
|---|---|---|---|---|
| 0' | 0.92¤ | 1.85" | 3.71º | |
| Crecimiento (cm) | ||||
| 1 | 0.28 | 0.18 | 0.30 | 0.28 |
| 2 | 0.68 | 0.53 | 0.68 | 0.64 |
| 3 | 0.24 | 0.21 | 0.30 | 0.28 |
| 4 | 0.10 | 0.50 | 0.44 | 0.41 |
| 5 | 0.68 | 0.15 | 0.27 | 0.27 |
| 6 | 0.20 | 0.17 | 0.21 | 0.23 |
| Pronóstico | ||||
| 7 | 0.31 | 0.20 | 0.21 | 0.23 |
| 8 | 0.29 | 0.17 | 0.17 | 0.19 |
| 9 | 0.28 | 0.14 | 0.12 | 0.16 |
| 10 | 0.26 | 0.12 | 0.08 | 0.12 |
Ecuaciones de pronósticos de crecimiento de S. sempervirens en concentraciones de kinetina,' Yt = 0.421 - 0.0160×t; ¤ Yt = 0.381 - 0.0262×t;" Yt = 0.523 - 0.0447×t;º Yt = 0.474 - 0.0354×t; Yt: Altura del explante con respecto al tiempo; t: tiempo en semanas.
Efecto del tipo de explante en la brotación
Con el esquema de propagación establecido se determinó que la multiplicación de secuoya puede realizarse por elongación y formación de brotes axilares (Fig. 3) aumentando la tasa de multiplicación. Cabe mencionar que para fines del experimento los segmentos apicales y basales, tenían en promedio 2 cm de longitud, pero en subcultivos (que no formaban parte del experimento) se colocaron segmentos de 1-1.5 cm, obteniendo brotes aptos para multiplicación, lo que hace aún más eficiente la metodología propuesta.

Fig. 3 Esquema de propagación propuesto para S. sempervirens. a) yema apical, b) elongación, c) obtención de explantes apicales y basales, d) multiplicación por explantes apicales y basales e) crecimiento y brotación de explantes y f) obtención y subcultivo de brotes.
Respecto al número de brotes originados por tipo de explante, en los basales se obtuvieron más brotes axilares en promedio con respecto a los apicales (Fig. 4), esto debido a la pérdida de dominancia apical. El uso de explantes basales en la multiplicación in vitro de secuoya no se utiliza, en este trabajo se utilizaron y demostraron una respuesta favorable en la formación de brotes, además puede ser una alternativa para aumentar de manera eficiente la multiplicación.
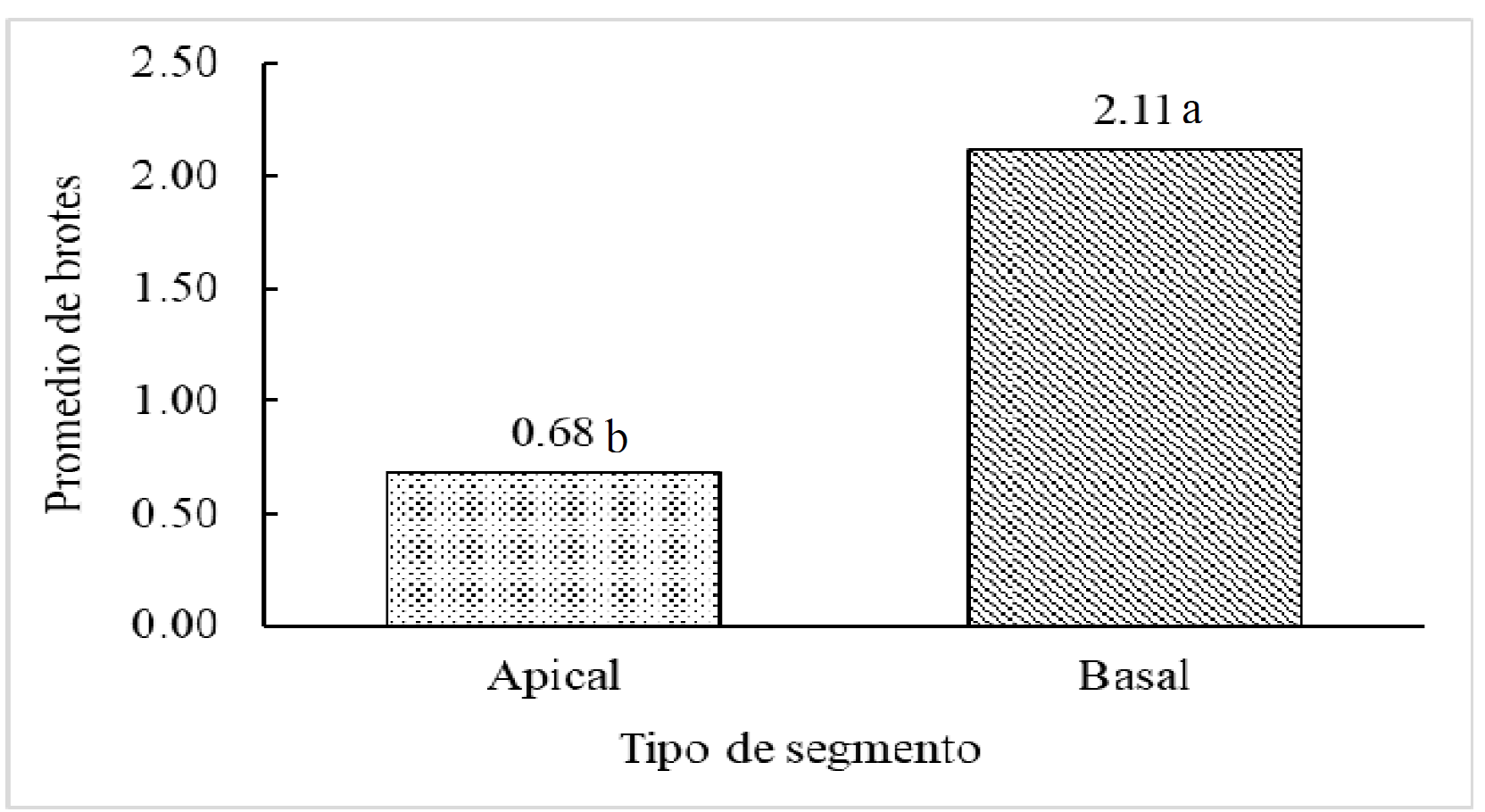
Fig. 4 Efecto del explante en la cantidad de brotes axilares emitidos. Letras diferentes en las barras indican diferencia estadística significativa, p = 0.05, n = 48 por tipo de explante.
Respecto al número de brotes (Tabla 4), se clasificaron en totales (tomando en cuenta todos los brotes sin importar la condición) y óptimos para subcultivo los cuales tenían al menos 2 cm de longitud y no presentar hiperhidratación. En los tres experimentos, la cantidad inicial de explantes fueron 12 por tipo de explante.
De manera general, en los explantes apicales se obtuvieron más brotes óptimos para subcultivo que en las fracciones basales. Con 0.92 µM L-1 de kinetina la eficiencia de brotes aptos fue de 90.8%, y con 3.71 µM L-1 solamente 77.2%. Respecto a la cantidad de brotes emitidos, con tres subcultivos realizados, la tendencia general en los explantes es a disminuir, siendo más notorio en los explantes basales, y en los apicales del segundo al tercer subcultivo el número de brotes se mantiene, y solo en la concentración de 3.71 µM L-1 aumenta (Tabla 4). Probablemente esto sucedio porque para los tres experimentos, los 12 explantes apicales iniciales se mantuvieron en cada experimento y tratamiento, ya que estos dieron origen a los explantes para los subcultivos posteriores; afectando probablemente la tasa de multiplicación.
Tabla 4 Cantidad de brotes totales y aptos por subcultivo de acuerdo a concentración de kinetina y tipo de explante.
| Kinetina (μM L-1) | NB | Exp.1 | Exp.2 | Exp.3 | Total | |||
|---|---|---|---|---|---|---|---|---|
| Tipo de explante | ||||||||
| Apical | Basal | Apical | Basal | Apical | Basal | |||
| 0 | BT | 33 | 55 | 24 | 64 | 24 | 31 | 231 |
| BO | 24 | 32 | 27 | 35 | 28 | 24 | 170 | |
| 0.92 | BT | 36 | 45 | 26 | 44 | 27 | 29 | 207 |
| BO | 24 | 30 | 26 | 40 | 31 | 37 | 188 | |
| 1.85 | BT | 38 | 50 | 30 | 58 | 29 | 28 | 233 |
| BO | 24 | 30 | 33 | 34 | 30 | 20 | 171 | |
| 3.71 | BT | 33 | 55 | 33 | 63 | 39 | 36 | 259 |
| BO | 24 | 35 | 36 | 41 | 41 | 23 | 200 | |
NB: número de brotes; BT: brotes totales; BO: brotes aptos para subcultivo; E1: experimento 1; E2: experimento 2; E3: experimento 3; BTE: brotes totales de todos los experimentos. n = 12 por tipo de segmento.
De acuerdo con las observaciones y datos obtenidos, las yemas en secuoya son visibles en la segunda semana de subcultivo; habiendo más en explantes basales que en apicales. Se considera que secuoya puede multiplicarse utilizando ambos tipos de explantes: apical y basal, y con el último obtener mayor proliferación.
Discusión
El cultivo in vitro en plantas es una técnica que se ha utilizado en la multiplicación de especies ornamentales, forestales, y frutales, con propósito distintos. Para el desarrollo de un protocolo de micropropagación es necesario contar con una metodología adecuada para desinfestación del explante inicial; los productos más utilizados para dicho proceso son: hipoclorito de sodio, de calcio, cloruro de mercurio y Tween-20, para el caso de secuoya no es la excepción (El-kadder & Fathy, 2012). Sin embargo, estos pueden resultar tóxicos para el investigador y dañinos para el ambiente. Chen et al. (2017) mencionan que el peróxido de hidrógeno y dióxido de cloro son alternativas efectivas para eliminar agentes patógenos en explantes establecidos in vitro. En el protocolo de desinfestación del presente estudio se utilizó peróxido de hidrogeno comercial, adicional al etanol e hipoclorito de sodio; a pesar de que el material se recolectó de campo no hubo contaminación, lo que comprueba que las concentraciones y tiempo de exposición fueron adecuadas para el tejido usado.
Los medios de cultivo utilizados para micropropagación de S. sempervirens son los constituidos por sales minerales MS (Murashige & Skoog, 1962) y WS (Wolter & Skoog, 1966) formuladas para proliferación de callo en tabaco y fresno, respectivamente. Ambos medios de cultivo tienen concentraciones contrastantes de nitrato de amonio 20.61 mM y 0.62 mM, para MS y WS, respectivamente. El medio de cultivo (Tabla 2) para la multiplicación de secuoya contiene 39 % (8 mM) de la concentración de nitrato de amonio que posee el MS, con estas concentraciones se observaron resultados favorables para multiplicación y crecimiento (Tablas 2 y 4). La propuesta aquí referida es acorde a lo indicado por Zhang et al. (2019) quienes mencionan que no se requieren altas concentraciones de nitrógeno (60 mM en medio MS), ya que mucho de este elemento se desperdicia, estas cantidades se encuentran por encima de los requerimientos in vitro de muchas especies, mientras que el medio de cultivo propuesto solo tiene 12.38 mM de nitrógeno total, 1.81 mM de amonio y 10.57 mM de nitrato (Tabla 2). Por lo que es necesario dejar de generalizar el uso de sales MS para propagación in vitro de especies leñosas y es necesario realizar medios de cultivo de acuerdo a los requerimientos de cada especie. Otro aspecto a resaltar es la utilización de medio de cultivo para establecimiento (agua, azúcar comercial y agar), que sirve como filtro para eliminar explantes contaminados, sin desperdiciar nutrimentos y reguladores de crecimiento, ya que las sales minerales no son necesarias para el desarrollo de hongos y bacterias in vitro como se usa en microbiología.
La adición de reguladores de crecimiento es parte fundamental del cultivo in vitro dependiendo de la etapa, por ejemplo, el uso de auxinas está relacionado con inducción de enraizamiento y las citocininas con brotación. Para la multiplicación de secuoya se ha utilizado: 6-benciladenina (BA), 6-N-bencilaminopurina (BAP), thidiazurom (TDZ), N6-(2-isopentanil) adenina (2ip) kinetina y zeatina, con diferentes concentraciones y resultados (Whan Sul & Korban, 1994; Meneguzzi et al., 2019; Rojas-Vargas et al., 2021). Con las concentraciones de kinetina utilizadas, se determinó que sin citocinina en explantes apicales hubo mejor crecimiento en longitud (Fig. 3). Sin embargo, con 0.92 µM L-1 de kinetina la eficiencia de brotes aptos para subcultivo fue 98%, y con concentraciones más altas disminuyó hasta 76% (Cuadro 4). El mayor crecimiento obtenido en el medio de cultivo sin kinetina muestra que esta especie no requiere este regulador, y que su presencia limita el crecimiento.
El crecimiento de las plantas en condiciones in vitro, está determinado por los componentes del medio de cultivo como: concentración de nitrógeno (Molinos Da Silva et al., 2004), fuente y concentración de carbono (Sato et al., 2001); al igual que la absorción de nutrimentos (de Oliveira et al., 2010). Se ha estandarizado que el sub-cultivo de explantes debe realizarse cada cuatro semanas, porque estos disminuyen su crecimiento (Rios et al., 2013). Se determinó con los resultados del pronóstico de crecimiento que los sub-cultivos en secuoya pueden ser cada siete semanas; sin embargo, se observó que a partir de la semana cinco el medio de cultivo comienza a deshidratarse pudiendo afectar el crecimiento de los explantes, por lo que se tomó como base hacer los subcultivos cada seis semanas.
La dinámica de crecimiento in vitro de secuoya (Fig. 3), puede estar asociada a la disponibilidad de nutrimentos, afectada por el pH del medio de cultivo (Chen et al., 2015). Se ha comprobado que en condiciones in vitro la relación nitrato: amonio modifica el pH en el medio de cultivo, esto influye en la absorción nutrimental (Chen et al., 2015; Singha et al., 1987). En el presente trabajo no se determinó la oscilación de pH, pero probablemente las fluctuaciones en el crecimiento de los brotes de secuoya están asociados a la relación nitrato:amonio, donde los mayores crecimientos semanales pueden ser resultado de la forma de nitrógeno asimilable por la especie, además de las múltiples interacciones con el resto de los componentes del medio. No hay estudios en secuoya para conocer la forma de nitrógeno asimilable, fluctuaciones de pH, relación nitrato: amonio y su relación en la absorción con los nutrimentos del medio de cultivo.
Los tipos de explantes utilizados in vitro son: ápices apicales o laterales (Chen et al., 2015), segmentos nodales (da Rocha et al., 2015), de tallo más yema (Raya- Montaño, Villegas- Monter, & Arellano-Ostoa, 2009). Para secuoya se han utilizado secciones de tallo con yema apical (Whan Sul & Korban, 1994), propiciando solo crecimiento en longitud y tasa de multiplicación baja. De acuerdo a los resultados, el tipo de explante utilizado, apical o basal afectan la cantidad de brotes emitidos (Fig. 5). Los explantes basales presentan más brotes en promedio (2.11), debido a la pérdida de dominancia apical; ya que la concentración endógena de citocininas incrementa, favoreciendo el crecimiento de yemas laterales (Tanaka, Takei, Kojima, Sakakibara, & Mori, 2006; El-Sayed, Salama, Salim, & Taha, 2021) obtuvieron hasta 18 brotes por explante con 7.5 cm de longitud, dichos resultados son superiores a cualquier trabajo reportado en secuoya, sin embargo en dicho trabajo no se reporta la cantidad de brotes aptos, aspecto importante al momento de hacer cultivo de tejidos. Cabe mencionar que la presenten metodología, el uso de fragmentos de tallos en cultivo in vitro para aumentar el número de brotes axilares para multiplicación se ha reportado es una opción viable que también se ha reportado en Quercus robur L. (Puddephat, Alderson, & Wright, 1997), Pinus taeda L.(Francisdo de Oliveira, Ribas, Quoirin, Koehler, & Higa, 2011), Calendula officinalis L. (Victório, Lage, & Sato, 2012), Selenicereus megalanthus L., y Hylocereus polyrhizus L. (Suárez Román, Caetano, Ramírez, & Morales Osorio, 2014).
El esquema de propagación propuesto (Fig. 4), permite que la multiplicación de S. sempervirens sea eficiente. Los explantes apicales al alcanzar 5 cm de longitud, pueden ser fraccionados en apical, medio y basal, para aumentar la tasa de proliferación. Por otro lado, los explantes basales dan origen a segmentos apicales, debido a la elongación de yemas axilares. Aun cuando se determinó que brotes de 2 cm de longitud eran aptos (sin hiperhidratación) para continuar con el proceso de multiplicación, también se comprobó que secciones apicales y basales de 0.5 cm generan brotes con características deseables para dichos procesos. Es importante mencionar que, aunque el protocolo propuesto se estableció para secuoya, puede ser utilizado para otras especies leñosas, debido a que, al utilizar secciones de tallo sin yema apical, se puede propiciar la elongación de yemas axilares.
Conclusiones
Se desarrolló un protocolo de desinfestación eficiente, sin necesidad de utilizar productos que puedan ser dañinos para el humano y el ambiente, esto a su vez permitió que la propuesta de multiplicación de S. sempervirens utilizando explantes apicales y basales tuviera éxito. Respecto a las concentraciones de kinetina utilizadas, se demostró que secuoya tiene mayor crecimiento en longitud sin la adición de este regulador de crecimiento, caso contrario cuando se requiere obtener brotes con 0.92 µM L-1 se promueve el desarrollo de brotes axilares en explantes basales. Respecto al medio de cultivo, con el propuesto en el presente trabajo, secuoya presentó buen crecimiento y brotación, por lo que puede sustituirse el medio de cultivo MS para esta especie.











 nueva página del texto (beta)
nueva página del texto (beta)


