Introducción
En el noreste de México, se ubica el Matorral Espinoso Tamaulipeco (MET), un ecosistema semiárido el cual se desarrolla dentro de un régimen de precipitación promedio anual de 650 mm (González-Medráno, 2012), donde se desarrollan especies arbóreas y arbustivas (González-Rodríguez & Cantú-Silva, 2001), con características, mecanismos y estructuras anatómicas de adaptación a condiciones de secano (Qin, Shangguan, & Xi, 2018). Una de las principales adaptaciones es la modificación de los rasgos morfológicos y anatómicos foliares (Palchetii, Barboza, & Cosa, 2014). Por ello, las hojas son indicadores de la variabilidad climática que se hacen presentes en el ecosistema donde se desarrollan las plantas (Striker, 2012). Las especies arbóreas y arbustivas nativas que coexisten en regiones áridas y semiáridas, presentan características anatómicas de adaptación en el tejido foliar bajo condiciones de escasa humedad, algunas de estas características son laminas foliares gruesas, cutícula que recubre la periferia de la epidermis adaxial, modificación en los grosores del tejido esponjoso y de empalizada (Rotondi, Rossi, Asunis, & Cesaraccio, 2003). En este sentido, se han realizado estudios comparativos entre los rasgos anatómicos foliares de especies del MET, y su relación con su adaptación a la escasez de humedad en el suelo, en el noreste de México (Rodriguez, Maiti, & Kumari, 2016). Por tanto, el objetivo fue determinar los rasgos anatómicos de la lámina foliar de cinco especies arbóreas (Diospyros texana, Celtis laevigata, Bumelia celastrina, Condalia hookeri y Havardia pallens) durante la época húmeda y de sequía.
Materiales y métodos
Área de estudio
La presente investigación se realizó en una parcela experimental del MET, en el noreste de México, en las coordenadas geográficas 24°46’43’’ LN y 99°31’39’’ LO a 370 msnm. Cuenta con un clima semiárido (BSh). La precipitación media anual es 695 mm, las cuáles se presentan en verano en los meses de agosto y septiembre (García, 1988). La temperatura promedio anual varía de 14.7 °C a 22.3 °C con una mínima de 5 °C y con máxima de hasta 45 °C (verano) (García, 1998).
Selección de especies
De acuerdo con su importancia ecológica y económica, se eligieron las especies leñosas arbóreas, Diospyros texana Scheele. (Ebenaceae), Celtis laevigata Willd. (Cannabaceae), Bumelia celastrina Kunth. (Sapotaceae), Condalia hookeri M.C. Johnst. (Rhamnaceae) y Havardia pallens Britton & Rose. (Fabaceae). De cada especie, fueron seleccionados cuatro individuos (repeticiones) con características fenotípicas y dasométricas similares.
Obtención del material vegetal foliar
Por cada individuo, se obtuvieron cuatro hojas maduras por orientación cardinal (Norte, Sur, Este, y Oeste) (Araque, Jaimez, Azócar, Espinoza, & Tezara, 2009). Las hojas fueron depositadas en bolsas de papel kraft para su traslado al laboratorio y llevar a cabo las determinaciones anatómicas de la lámina foliar. El estudio se realizó en dos condiciones ambientales; uno, durante la época húmeda (Octubre 31 de 2017) y el otro, durante la seca (Agosto 31 de 2018).
Preparación del material foliar
De cada hoja colectada, se extrajo la parte central, la cual se depositó en frascos etiquetados con una solución (65%, v/v) de FAA (formaldehído: ácido acético glacial: alcohol etílico (95%) (5:5:90) durante 48 horas (Johansen, 1940). Para medir el grosor de la cutícula y la epidermis en ambas caras, los parénquimas esponjoso y en empalizada, y el grosor total foliar de cada muestra, se realizaron cinco cortes transversales de forma manual con una navaja de afeitar, utilizando un estereoscopio (Leica, Modelo EZ4 HD), con un rango de aumento de 20x a 40x, los cuales fueron aclarados en una solución de cloro al 10 % (v/v) durante 20 minutos, para posteriormente ser colocados en un portaobjetos con una o dos gotas de glicerina fenolada al 50 % (v/v) y cubiertos con un cubreobjetos (Jensen, 1962). La determinación del largo y ancho de la estoma, así como la densidad estomática (número de estomas·mm-2), se empleó el método de impresiones, el cual consiste, en colocar una capa delgada de barniz de uñas transparente en la epidermis abaxial, dejándola secar entre 15 y 20 minutos, la cual se desprendió con una aguja de disección y se colocó en un portaobjetos. Posteriormente, se agregó glicerina fenolada al 50 % (v/v) y se cubrió con un cubreobjetos (Alfaro & Kohashi, 1976).
Observaciones y mediciones anatómicas
Con un microscopio (Carl Zeiss, Modelo Axiostar Plus), con ocular izquierdo micrométrico y con el objetivo de 40x de aumento, se midieron en los cortes el grosor (µm) de la cutícula adaxial (GCAD), la epidermis adaxial (GEAD), del parénquima esponjoso (GPES), del parénquima en empalizada (GPE), de la epidermis abaxial (GEAB), la cutícula abaxial (GCAB) y el grosor total foliar (GTF). Además, de las impresiones de la epidermis abaxial, se midió el largo (LE) y ancho (AE) de los estomas (µm) y se determinó la densidad estomática (DE, No. de estomas∙mm-2).
Análisis estadístico
Dado que los supuestos de distribución normal e igualdad de varianzas de los datos no se cumplieron para cada una de las variables estudiadas en cada época, se usó la prueba de Kruskal-Wallis (p≤0.05) para detectar diferencias significativas entre las especies (Ott, 2001). Asimismo, se empleó la prueba de correlación de Spearman por rangos (ρ, rho) (p≤0.05) para determinar el grado de asociación entre los rasgos anatómicos de cada especie (Ott, 2001). Además, se utilizó la prueba de Mann-Whitney U con la corrección de Bonferroni (p≤0.05) para comparar las medias de los distintos rasgos anatómicos foliares entre la época húmeda y seca (Ott, 2001). Los análisis estadísticos se realizaron mediante el uso del paquete estadístico SPSS (Statistical Package fot the Social Sciences, por sus siglas en inglés, versión 22. SPSS Inc., IL, USA).
Resultados
Anatomía de la lámina foliar en época húmeda
Durante la época húmeda, la especie D. texana presentó el mayor GCAD (5.21 μm), AE (23.54 μm) y LE (31.08 μm). Por otro lado, C. laevigata mostró un mayor GEAD (18.07 μm), GPE (77.63 μm) y DE (523; No. de estomas·mm-2). Finalmente, el mayor GEAB (9.80 μm), GPES (103.05 μm) y GTF (206.57 μm) se observaron en B. celastrina. En cambio, D. texana mostró el menor GPE (76.60 μm) y DE (159; No. de estomas·mm-2). La especie C. laevigata presentó el menor GPES (45.78 μm). Asimismo, la especie C. hookeri reflejó el menor GTF (137.50 μm), AE (12.56 μm) y LE (22.20 μm). En cambio, el menor GCAD (3.22 μm), GCAB (3.52 μm), GEAD (5.05 μm) y GEAB (6.28 μm) se observó en H. pallens (Figs. 1 y 2). Se detectaron diferencias significativas (p<0.001) entre las especies para todos los rasgos anatómicos estudiados (Cuadro 1). Respecto a la época húmeda, en D. texana, el GTF se correlacionó significativamente con el GCAD (ρ=0.555, p=0.025), GPE (ρ=0.806, p<0.001) y el GPES (ρ=0.627, p=0.009). Para la especie C. laevigata, el GTF mostró correlación negativa con el GEAD (ρ=-0.599, p=0.014) y positiva con el GPE (ρ=0.705, p=0.002), el GPES (ρ=0.893, p<0.001) y el AE (ρ=0.661, p=0.005). Por otro lado, el AE se correlacionó positivamente con el GEAD (ρ=0.640, p= 0.008), GPES (ρ=0.529, p=0.035) y el LE (ρ=0.756, p=0.001). Para la especie B. celastrina, se detectó correlación positiva y significativa entre el GEAB y el GCAD (ρ=0.516, p=0.041), el GPES y el GPE (ρ=0.594, p=0.015). Así mismo, el GTF se correlacionó positiva y significativamente con el GPE (ρ=0.815, p<0.001) y con el GPES (ρ=0.901, p<0.001). En lo que respecta a C. hookeri, se observaron correlaciones positivas entre el GTF con el GPE (ρ=0.776, p<0.001), GPES (ρ=0.666, p=0.005) y la DE (ρ=0.536, p=0.032). Similarmente, se detectó una correlación positiva entre el AE y el GEAD (ρ=0.530, p=0.035) y la DE con el GPES (ρ=0.271, p=0.025). Finalmente, en la especie H. pallens el GPE se encontraron correlaciones positivas y significativas con el GPES (ρ=0.521, p=0.038) y el GTF (ρ=0.965, p<0.001). Así mismo, el GPES se correlacionó positivamente con GTF (ρ=0.688, p=0.003) y negativamente con el AE (ρ=-0.533, p=0.033).

Fig. 1 Grosor de la cutícula adaxial (a) y abaxial (b), grosor de la epidermis adaxial (c) y abaxial (d), grosor del parénquima en empalizada (e) y esponjoso (f) en el tejido foliar en la época húmeda (barra negra) y época de sequía (barra gris). Cada valor graficado representa la media ± error estándar (n=16).
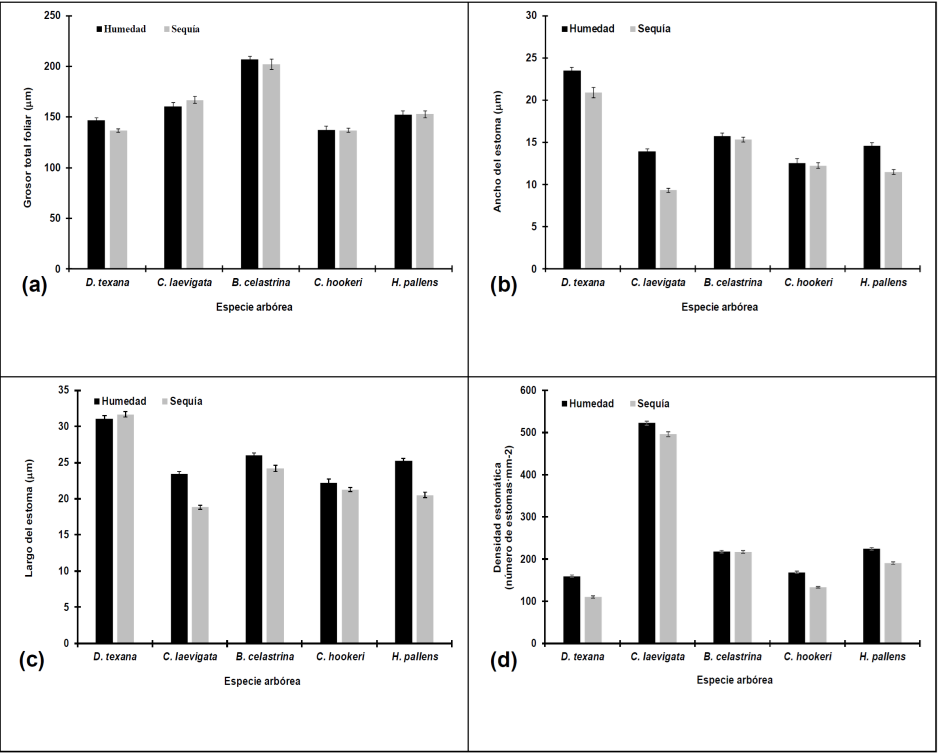
Fig. 2 Grosor total foliar (a), ancho del estoma (b), largo de la estoma (c) y densidad estomática (d) durante la época húmeda (barra negra) y época de sequía (barra gris). Cada valor graficado representa la media ± error estándar (n=16).
Cuadro 1 Resultados de la prueba de Kruskal-Wallis para detectar diferencias estadísticas en los rasgos anatómicos entre las cinco especies de plantas arbóreas durante la época húmeda y de sequía.
| Rasgo Anatómico | Época húmeda | Época de sequía | |||
|---|---|---|---|---|---|
| χ2 | Valor p | χ2 | Valor p | ||
| GCAD | 43.764 | <0.001 | 57.642 | <0.001 | |
| GCAB | 40.056 | <0.001 | 34.230 | <0.001 | |
| GEAD | 67.402 | <0.001 | 64.859 | <0.001 | |
| GEAB | 49.145 | <0.001 | 52.114 | <0.001 | |
| GPE | 54.098 | <0.001 | 64.818 | <0.001 | |
| GPES | 66.815 | <0.001 | 59.132 | <0.001 | |
| GTF | 48.322 | <0.001 | 60.153 | <0.001 | |
| AE | 56.038 | <0.001 | 71.133 | <0.001 | |
| LE | 61.232 | <0.001 | 65.919 | <0.001 | |
| DE | 69.381 | <0.001 | 74.512 | <0.001 | |
GCAD (grosor de cutícula adaxial), GCAB (grosor de la cutícula abaxial), GEAD (grosor de la epidermis adaxial), GEAB (grosor de la epidermis abaxial), GPE (grosor del parénquima en empalizada), GPES (grosor del parénquima esponjoso), GTF (grosor total foliar), AE (ancho del estoma), LE (largo del estoma) y DE (densidad estomática).
Anatomía de la lámina foliar en época seca
El mayor GCAD (10.41 μm), GCAB (6.90 μm), GPES (95.24 μm) y GTF (201.82 μm) se presentó en la especie B. celastrina; mientras que, los valores máximos para el GEAD (19.75 μm), GEAB (9.95 μm) y GPE (80.85 μm) se observaron en C. laevigata. La mayor longitud del AE (20.91 μm) y LE (31.68 μm) se presentaron en D. texana. En cambio, D. texana mostró el menor GPE (66.48 μm) y DE (110; No. de estomas·mm-2) siendo diferente a C. laevigata, quien presentó el menor LE (18.83 μm) y AE (9.34 μm). Por otro lado, la especie C. hookeri mostró el menor GCAD (4.90 μm), GCAB (7.04 μm) y GTF (136.89 μm). Finalmente, la especie H. pallens presentó el menor GEAD (7.20 μm) y GEAB (5.67 μm) (Fig. 1). La variación de las longitudes en los rasgos anatómicos permitió que se detectaran diferencias significativas (p<0.001) entre las especies (Cuadro 1). Por otro lado, durante la época de sequía, para la especie D. texana, el GTF se correlacionó estadística y positivamente con el GPES (ρ=0.841, p=<0.001), así como la DE mostró una correlación negativa y significativa con la LE (ρ=-0.660, p=0.005). Respecto a la especie C. laevigata, el GTF mostró una correlación con el GPE (ρ=-0.715, p=0.002) y el GPE (ρ=0.787, p=<0.001). Similarmente, el GEAB se correlacionó positivamente con el GEAD (ρ=0.497, p= 0.050). Para la especie B. celastrina, se detectó una correlación negativa entre el GEAB y el GCAB (ρ=-0.537, p=0.032) y una asociación positiva entre el GPES y el GPE (ρ=0.561, p=0.024), mientras que el GTF se correlacionó positivamente con el GEAD (ρ=0.499, p=0.049), el GPE (ρ=0.839, p=<0.001) y con el GPES (ρ=0.881, p=<0.001). En C. hookeri, el GEAB mostró correlación negativa y significativa entre el GCAB (ρ=-0.885, p=<0.001) y el AE (ρ=-0.575, p=0.020. El AE mostró correlación positiva entre el GCAB (ρ=0.580, p=0.018) y negativa con el GEAD (ρ=-0.500, p=0.049), al igual que, el GTF se correlacionó positivamente con el GPES (ρ=0.811, p=<0.001). Finalmente, en la especie H. pallens, el GCAB mostró correlación negativa con el GEAD (ρ=-0.522, p=0.038), Así mismo, el GTF se correlacionó positivamente con GPE (ρ=0.676, p=0.004) y el GPES (ρ=0.707, p=0.002). Durante la época de sequía, las especies mostraron un incremento en diferentes rasgos anatómicos; D. texana, C. laevigata, B. celastrina y H. pallens, en el GCAD (Figura 1a); B. celastrina, C. hookeri y H. pallens, en el GCAB (Fig. 1b); D. texana, C. laevigata y H. pallens, en el GEAD (Fig. 1 c ); C. laevigata, en el GEAB (Fig. 1d); C. laevigata y C. hookeri, en el GPE (Fig. 1e); C. laevigata, en el GTF (Fig. 2a); y D. texana, en el LE (Fig. 2c). Por el contrario, se observó una reducción en el grosor de siete rasgos en las diferentes especies: B. celastrina y C. hookeri, en el GEAD (Fig. 1c); B. celastrina, C. hookeri y H. pallens, en el GEAB (Fig. 1d); D. texana y H. pallens, en el GPE (Fig. 1e); D. texana, B. celastrina, C. hookeri y H. pallens, en el GPES (Fig. 1f); D. texana y B. celastrina, en el GTF (Fig. 2a); D. texana, C. laevigata y H. pallens en el AE (Fig. 2 b ); C. laevigata, B. celastrina, C. hookeri y H. pallens, en el LE (Fig. 2c); y D. texana, C. laevigata, C. hookeri y H. pallens en la DE (Fig. 2d). En relación con lo anterior, las especies que mostraron diferencias entre la época húmeda y de sequía, tal es el caso para D. texana, quien mostró diferencias en el GEAD (p=0.029), GPES (p<0.001), GTF (p=0.015), AE (p<0.001) y la DE (p=0.001). Por otro lado, la especie C. laevigata mostró diferencias en los rasgos como el AE (p<0.001), LE (p<0.001) y la DE (p<0.001). Las diferencias para B. celastrina se mostraron en GCAD (p<0.001), GCAB (p<0.001), GEAB (p<0.001), GPES (p=0.023) y en el LE (p=0.007); para C. hookeri, los rasgos que mostraron diferencias fueron el GCAB (p=0.006), GPES (p=0.019) y la DE (p<0.001); por último, H. pallens mostró diferencias significativas en el GCAD (p<0.001), GCAB (p<0.001), GEAB (p=0.015), AE (p<0.001), LE (p<0.001) y en la DE (p<0.001) (Cuadro 2).
Cuadro 2 Valores Z y p de la prueba de Mann-Whitney U para detectar diferencias significativas entre la época húmeda y de sequía para diferentes rasgos anatómicos de cinco especies arbóreas.
| Rasgo anatómico | Especie arbórea | |||||
|---|---|---|---|---|---|---|
| Estadístico | D. texana | C. laevigata | B. celastrina | C. hookeri | H. pallens | |
| GCAD | Valor Z | -1.607 | -2.396 | -5.118 | 0.000 | -5.128 |
| Valor p | 0.239 | 0.138 | <0.001 | 1.000 | <0.001 | |
| GCAB | Valor Z | 0.000 | 0.000 | -4.605 | -3.436 | -3.779 |
| Valor p | 1.000 | 1.000 | <0.001 | 0.006 | <0.001 | |
| GEAD | Valor Z | -2.429 | -1.922 | -1.202 | -2.010 | -2.104 |
| Valor p | 0.029 | 0.073 | 0.341 | 0.073 | 0.138 | |
| GEAB | Valor Z | 0.000 | -1.873 | -4.471 | -1.837 | -3.003 |
| Valor p | 1.000 | 0.128 | <0.001 | 0.102 | 0.015 | |
| GPE | Valor Z | -0.758 | -1.335 | -0.248 | -1.852 | -0.891 |
| Valor p | 0.468 | 0.196 | 0.809 | 0.073 | 0.381 | |
| GPES | Valor Z | -3.768 | -0.268 | -2.257 | -2.358 | -0.609 |
| Valor p | <0.001 | 0.809 | 0.023 | 0.019 | 0.564 | |
| GTF | Valor Z | -2.417 | -1.208 | -0.585 | -0.264 | -0.170 |
| Valor p | 0.015 | 0.239 | 0.564 | 0.809 | 0.867 | |
| AE | Valor Z | -3.469 | -5.112 | -1.099 | -0.590 | -4.499 |
| Valor p | 0.001 | <0.001 | 0.381 | 0.616 | <0.001 | |
| LE | Valor Z | -1.242 | -5.019 | -2.909 | -1.358 | -4.997 |
| Valor p | 0.287 | <0.001 | 0.007 | 0.224 | <0.001 | |
| DE | Valor Z | -4.845 | -3.170 | -0.038 | -4.855 | -4.660 |
| Valor p | <0.001 | <0.001 | 0.985 | <0.001 | <0.001 | |
GCAD (grosor de la cutícula adaxial), GCAB (grosor de la cutícula abaxial), GEAD (grosor de la epidermis adaxial), GEAB (grosor de la epidermis abaxial), GPE (grosor del parénquima en empalizada), GPES (grosor del parénquima esponjoso), GTF (grosor total foliar), AE (ancho del estoma), LE (largo del estoma) y DE (densidad estomática).
Discusión
Las diferentes condiciones ambientales prevalecientes durante la época húmeda (condiciones favorables) y de sequía (condiciones adversas) propició que existieran modificaciones en el grosor de los rasgos anatómicos foliares de las cinco especies estudiadas, mostrando un comportamiento típico de plantas xeromórficas. Estas alteraciones son adaptaciones a las condiciones climáticas del ecosistema donde se desarrollan, cuyo factor principalmente es la baja disponibilidad de agua en el suelo causada por las bajas precipitaciones (Qin, Shangguan, & Xi, 2018). En este sentido, la presencia de una cutícula gruesa en la parte adaxial y abaxial para B. celastrina y H. pallens durante la época de sequía, infiere que estas especies pueden mostrar la capacidad de evitar la desecación (Ramirez & Goyes, 2005). Este engrosamiento se puede deber, en parte, a que en la temporada de baja precipitación y humedad edáfica se acumulan ceras epicuticulares que recubren las células epidérmicas (Rodriguez, Maiti, & Kumari, 2016), reduciendo la pérdida de agua de los tejidos internos de la hoja (Rueda, 2003), provocada por la excesiva radiación solar y altas temperaturas (Marín, Rengifo, Herrera, & Tezara, 2005), permitiendo a estas especies mantener una regulación de su balance hídrico. En este contexto, resultados similares han sido reportados en el género Calatropis en temporadas de escaza precipitación (Colombo, Marin, Irazábal, & Tezara, 2007). Por su parte, el grosor de la epidermis adaxial y abaxial de C. laevigata, difiere a lo encontrado en Celtis ehrenbergiana (Klotzsch) Liebm, donde la especie mostró valores en el rango de 32.7 µm a 22.3 µm un ecosistema similar al Matorral Espinoso Tamaulipeco (Nughes, Colares, Hernández, & Arambarri, 2013). Lo anterior, pueden estar relacionado a que C. laevigata utiliza como estrategia a la desecación, la abscisión foliar en condiciones de sequía (Qin, Shangguan, & Xi, 2018). No obstante, sus hojas siguen mostrando a las de la época favorable, características anatómicas y morfológicas típicas de ambientes semiáridos (Castro & Granada, 2012). Estos resultados, concuerdan a lo reportado para plantas caducifolias como Cedrela odorata L., Cordia thaisiana G. Agostini, Tabebuia rosea (Bertol.) Bertero ex A.DC. y Swietenia macrophylla King (Araque, Jaimez, Azócar, Espinoza, & Tezara, 2009) cuyos valores de la epidermis adaxial y abaxial están dentro de los rangos observados en el presente estudio. En general, durante la época húmeda y de sequía, C. laevigata, mostró mayor grosor en el parénquima en empalizada, lo que hace suponer que esta especie, tiene un mayor número de células fotosintetizantes o podrían ser más largas (Oguichi, Onoda, Terashima, & Tholen, 2018), que de acuerdo con lo observado sería la razón por la cual son plantas de dimensiones mayores en cuanto a sus variables dasométricas como diámetro y altura que el resto de las especies evaluadas. Sin embargo, al contar con un bajo espesor del parénquima esponjoso en relación al de empalizada, esta especie pudiera estar en desventaja, ya que puede presentar un rápido intercambio de gases, el cual puede ser perjudicial en condiciones de periodos largos de sequía, causando deshidratación excesiva de sus tejidos y por ende la senescencia (Oguichi, Onoda, Terashima, & Tholen, 2018). Por otro lado, D. texana, B. celastrina y C. hookeri presentaron un mayor grosor del parénquima esponjoso que el parénquima en empalizada, que quizá les permita reducir el intercambio de vapor de agua por el flujo transpiracional (Rodriguez, Maiti, & Kumari, 2016). Este proceso se puede asociar con su lento crecimiento y a las variables dasométricas mínimas en cuanto a diámetro y altura en comparación con la especie C. laevigata. En este sentido (Delbón et al., 2010), en un estudio realizado en diferentes especies arbustivas en la región semiárida de Sierras Chicas de Córdoba, Argentina, se encontró que las características anatómicas foliares presentaron un mayor espesor del parénquima en empalizada, reducción del tejido esponjoso, un alto grado de xeromorfismo, mayor intercambio de gases y alta eficiencia en la fotosíntesis. En el presente trabajo, durante la época de sequía, se observó una disminución de las dimensiones de los estomas (largo y ancho) en D. texana, C. laevigata y H. pallens, lo cual está estrechamente relacionada con la resistencia estomática al proceso de la transpiración (Toral, Manriquez, Navarro, Tersi, & Naulin, 2010). En este contexto, la disminución del tamaño de las estomas juega un papel importante en el proceso de aclimatación de las especies vegetales a condiciones de déficit hídrico, haciéndose presente una relación inversa entre las dimensiones del estoma y el estrés hídrico (Aasamaa, Sober, & Rahi, 2001), lo que hace suponer que D. texana, C. laevigata y H. pallens pueden tener la capacidad de tolerar períodos largos de baja disponibilidad de agua en el suelo. Por tanto, la morfología de los estomas de diferentes especies vegetales son rasgos importantes que les faculta controlar la pérdida excesiva de agua, lo que les ha permitido adaptarse a los cambios de las condiciones ambientales extremas del sitio donde se desarrollan (Pivovaroff, Cook, & Santiago, 2018). La disminución de las dimensiones de las estomas de las especies estudiadas, coincide con lo reportado en Sequoia sempervirens D. Don) Endl donde existió una disminución de las dimensiones estomáticas en relación a mayor densidad aparente y menor profundidad del suelo, así como a una menor humedad atmosférica y de precipitación en las diferentes localidades de estudio, lo cual permitió una mayor plasticidad fenotípica y de aclimatación a condiciones ambientales contrastantes (Toral, Manriquez, Navarro, Tersi, & Naulin, 2010). Por otro lado, una alta densidad estomática observada en C. laevigata, B. celastrina y H. pallens durante la época húmeda respecto a D. texana y C. hookeri indicó que estas especies tendrían una mayor conductancia al CO2 y por ende, mayor eficiencia fotosintética (Nughes, Colares, Hernández, & Arambarri, 2013). Sin embargo, la reducción del número de estomas por área foliar en condiciones de déficit hídrico sería una desventaja, ya que incrementaría la resistencia estomática y reduciría la transpiración evitando que las especies puedan absorber CO2 para su fijación durante el proceso fotosintético (Nakata & Okada, 2013). En este sentido, los valores del área foliar (cm2) de las cinco especies estudiadas (D. texana, 7 cm2; C. laevigata, 27 cm2; B. celastrina, 5 cm2; C. hookeri, 4 cm2 y H. pallens, 15 cm2) (Rodríguez et al., 2015), la reducción de la densidad estomática y la dimensión de los estomas durante la época seca pueden estar relacionadas con los altos potenciales hídricos al mediodía reportados en B. celastrina y C. hookeri (González Rodríguez et al., 2016), cuando las condiciones ambientales de los componentes de demanda evaporativa fueron elevadas; resultado donde a mayor área foliar se presenta menor control estomático (Sperry, Hacke, Oren, & Comstock, 2002), por lo que una disminución en esta característica morfológica podría ayudar a reducir eficazmente el área de la transpiración (Librija Trejo, Perez García, Meave, Bongers, & Poorter, 2010). Con respecto a los resultados obtenidos para el grosor total foliar, se encontró que en la especie B. celastrina mantiene un espesor foliar mayor durante la época húmeda y seca, esto, debido a un mayor grosor de los tejidos que conforman el mesófilo (Colombo, Marin, Irazábal, & Tezara, 2007). Lo anterior puede dar respuesta a las correlaciones existentes entre los rasgos anatómicos durante la época húmeda y de sequía para las cinco diferentes especies, donde la mayor correlación existió entre el GTF con el GPE y el GPES. Estos resultados son similares a los obtenidos en Cedrela odorata, Cordia thaisiana, Tabebuia rosea y Swietenia macrophylla, donde encontraron valores del grosor total foliar de 279 µm, 214 µm, 189 µm y 221 µm, respectivamente (Araque, Jaimez, Azócar, Espinoza, & Tezara, 2009). La reducción del grosor total foliar durante la época de sequía en comparación a la época húmeda en D. texana puede indicar que un grosor mayor puede estar ligado a la disponibilidad hídrica en el suelo durante la época húmeda (Onoda, Richards, & Westoby, 2012). Asimismo, la correlación positiva existente entre la DE con el LE y AE solo en C. hookeri difiere con lo reportado en Pereskia guamacho (Edwards & Díaz, 2006), donde la densidad estomática y el tamaño de los estomas en las plantas mostraron una relación negativa y significativa. Las cinco especies estudiadas revelan rasgos anatómicos foliares que les permite hacer frente a períodos de sequía que se presentan en los ecosistemas semiáridos, como el MET en el noreste de México, lo que les permite sobrevivir, crecer y desarrollarse. No obstante, B. celastrina y H. pallens son las especies más responsivas en cuanto a las modificaciones de las variables antes mencionadas.
Conclusiones
Los resultados muestran que efectivamente las especies presentan modificaciones en sus características anatómicas foliares que les ha permitido adaptarse a las condiciones de sequía prevaleciente en el Matorral Espinoso Tamaulipeco, concediéndoles sobrevivir en este tipo de ecosistema. El menor grosor del parénquima esponjoso, cutícula adaxial y abaxial en C. laevigata y D. texana, pueden ser características desfavorables que no les permitan hacer frente a periodos largos de sequía, sin embargo, la reducción de su densidad estomática y dimensiones de sus estomas, pueden ser responsables de que estas especies mantengan su crecimiento y desarrollo en el Matorral Espinoso Tamaulipeco. De acuerdo con los resultados observados, la disminución del número de estomas por área de las cinco especies, así como sus dimensiones durante la época de sequía, son respuestas adaptativas que permite a las especies evadir esta condición desfavorable. Finalmente, de acuerdo con las características evaluadas, se puede inferir que las especies arbóreas B. celastrina y H. pallens están mejor adaptadas y pueden tolerar periodos más largos de sequía, dado que presentaron modificaciones en su estructura anatómica, la cual les permite evitar en gran medida la deshidratación de sus tejidos.











 nueva página del texto (beta)
nueva página del texto (beta)


