Introducción
Heimia es un género de siete especies de plantas con flores pertenecientes a la familia Lythraceae, encontrando principalmente hierbas, arbustos y árboles. Poseen una morfología generalizada, por lo cual, no hay una sinapomorfía que defina a la familia, dificultando su detección in situ. (Graham S. A., 1994).
Heimia salicifolia es un arbusto herbáceo perenne de hasta tres metros de altura, posee hojas sésiles, lanceoladas y lineales posicionadas de forma opuesta. Su floración es amarilla con dos centímetros de diámetro, formada por seis pétalos en pares a la porción axilar de la hoja y semillas de 0.5mm de diámetro, que en ambientes óptimos su germinación se produce entre los 10 y 16 meses. (Rother, 1985).
Este arbusto ha empleado para la adoración de la deidad Xochipilli, diosa azteca de la primavera y el deseo. (Díaz Daniel, 1999). Registrándose usos medicinales tradicionales como diurético, laxante, emético, analgésico y antiinflamatorio. La ingesta de una bebida producida tras su fermentación provoca desórdenes espaciotemporales dada su concentración de alcaloides. (Malone & Rother, 1994). Estos efectos aún no han sido del todo elucidados, por lo cual requiere estudios a profundidad.
Análisis previos mediante la inhibición de prostaglandina sintetasa revelaron que los alcaloides nesodina y criogenina podrían ser el doble de potentes que la aspirina en cuanto al efecto analgésico, sin embargo, la efectividad antipirética requiere de estudios avanzados, concluyendo que poseen actividad antiinflamatoria significativa y potencial terapéutico. Estos alcaloides son producidos en hojas de Heimia salicifolia tras dos años de crecimiento in situ, además de no ser comercializados y en la mayor parte de los estudios no se ha aplicado el uso de herramientas como la clonación in vitro, por lo cual su estudio es lento. (Lema et al., 1986).
El cultivo in vitro se define como el cultivo de tejidos vegetales, en medios nutritivos bajo condiciones estériles en ambientes óptimos que permiten mantener la homogeneidad de las plantas y las concentraciones adecuadas de nutrientes en adición a reguladores de crecimiento acorde al protocolo seleccionado para cada especie (Bhojwani Saran Sant & Dantu Kumar Prem, 2013). Este tipo de cultivo permite el crecimiento y desarrollo de plantas, semillas, embriones, órganos, tejidos, células y protoplastos, posibilitando la reducción de tiempo de crecimiento a semanas, aunado a una manipulación completamente estéril y controlada, siendo una herramienta adecuada para la clonación de Heimia salicifolia; lo que podría implicar la reducción del tiempo de germinación, en comparación con el tiempo que tomaría in situ. (Ochoa-Villarreal et al., 2016).
Los protocolos de propagación vegetal o clonación permiten la producción de plantas a una mayor escala, desde su germinación, para conservar su esterilidad y emplear explantes completamente asépticos; por lo cual, se propone el uso de estos protocolos para la producción de plantas de interés farmacológico, tal como Heimia salicifolia. (Espinosa-Leal et al., 2018).
El empleo de explantes para la propagación de plántulas se fundamenta en la obtención de meristemos laterales aislados de internodos o secciones de la planta, con potencial de generar plántulas sanas con una mayor producción de brotes y hojas nuevas como efecto derivado de la eliminación de la dominancia apical. Está técnica suele emplear reguladores de crecimiento con la finalidad de obtener vitroplantas vigorosas en condiciones óptimas y un menor lapso para la continuación de su estudio. (Galán-Ávila et al., 2020).
En este estudio se propuso el estudio de Heimia salicifolia in vitro con la finalidad de establecer un protocolo adecuado para su germinación y micropropagación, permitiendo la obtención de plantas vigorosas en un lapso reducido, en comparación con el necesario in situ en comparación con referencias previas; ajustando así las características físicas y químicas en el protocolo in vitro para una germinación y clonación óptimas, que permitirían un estudio continuo y con mayor densidad de alcaloides dado el potencial de mayor producción de peso fresco en prospectiva, tras el establecimiento adecuado del protocolo propuesto en este trabajo.
Materiales y métodos
Fuente de las semillas y esterilización
Las semillas maduras fueron adquiridas a través de plantswithapurpose.org de origen estadounidense (Jacksonville, F.L 32257 US) y almacenadas a temperatura ambiente. Se homogenizaron las semillas en tamaño y aspecto previo a la esterilización y desinfestación de semillas mediante lavado de agua con jabón durante 10 minutos; desinfección con alcohol al 70% (v/v) durante cinco minutos y cloro al 10% (v/v) durante 15 minutos, posteriormente se mantuvieron en agua estéril durante 10 minutos previos a la siembra en condiciones de cultivo in vitro.
Condiciones del cultivo
Las condiciones en las cuales se colocaron las semillas para la germinación fueron: temperatura entre 24 y 26 °C durante el día y 22 °C durante la noche en fotoperiodo de 16:8. La luminosidad medida fue ajustada con un luxómetro resultando en 485.75µmol/s/m2.
Diseño experimental para germinación
Se sembraron 60 semillas para cada tratamiento en un total de 48 frascos, es decir, se sembraron 5 semillas en cada frasco, dando un total de 240 semillas sembradas. Se evaluaron los tratamientos con distintas concentraciones de hormonas comparadas con el control (Tabla 1). Tras la germinación, se observó el desarrollo de 15 vitroplantas seleccionadas aleatoriamente por cada tratamiento; se permitió su desarrollo durante cuatro meses para la evaluación de su calidad a partir del número de hojas producidas, longitud de las plántulas en tamaño promedio (cm) y el vigor definido por una escala preestablecida.
Diseño experimental para micropropagación a partir de yemas apicales y basales.
Una vez finalizados dos meses de crecimiento tras la germinación, se emplearon aquellas plántulas de 1cm de longitud obtenidas del tratamiento control, para la evaluación del protocolo de micropropagación sin afectaciones hormonales previas que pudiesen alterar el efecto de los reguladores de crecimiento adicionados en este protocolo. Se obtuvieron explantes de 0.5cm de la zona apical y basal del tallo de la vitroplanta, colocando tanto explantes basales, como apicales en frascos con los distintos tratamientos (Tabla 3).
Tabla 2 Índices empleados para el monitoreo del vigor de crecimiento de vitroplantas de Heimia salicifolia.
| Índice | Interpretación |
|---|---|
| 0 | Vitroplanta muerta, muriendo o enferma. |
| 1 | Crecimiento lento, sin la apariencia deseada. |
| 2 | Apariencia deseada deficiencia de vigor. |
| 3 | Apariencia deseada con crecimiento vigoroso. |
Tabla 3 Concentraciones expresadas en mg L−1 de los tratamientos para micropropagación
| Tratamientos | Kinetina | BA | 2iP |
|---|---|---|---|
| Control (T0) | 0.0 | 0.0 | 0.0 |
| Tratamiento 1 (T1) | 0.1 | 0.1 | 0.1 |
| Tratamiento 2 (T2) | 0.3 | 0.3 | 0.3 |
| Tratamiento 3 (T3) | 1.0 | 1.0 | 1.0 |
Los tratamientos fueron empleados en medio MS (1962) suplementados con 30g/L de sacarosa, 100 mg L−1 de Mioinositol, 40 mg L−1 de Tiamina, 60 mg L−1 de L-cisteína, pH 5.7± 0.1, 8g/L de agar-agar. Se realizó un conteo del número de brotes obtenidos por cada explante; longitud de los brotes en tamaño promedio, vigor (0,1,2,3) y el número de hojas producidas, un mes tras la obtención del explante proveniente de plantas germinadas dos meses previos a la micropropagación.
Toma de datos y parámetros.
La germinación se monitoreó de manera continua en un tiempo determinado de dos semanas; se calculó el tiempo promedio de germinación (MGT= ∑(nT)/ ∑n) donde: n es el número de semillas germinadas a determinado tiempo T; T representa los días del inicio de la prueba y ∑n es referido a la germinación final por cada tratamiento. Se determinó la germinación acumulada y los porcentajes de germinación finales. Se permitió, el crecimiento y desarrollo de las vitroplantas germinadas durante cuatro meses para la evaluación de la calidad de las plantas in vitro. (Al-Ansari & Ksiksi, 2016)
En cuanto al protocolo de micropropagación, se emplearon vitroplantas con 2 meses de germinación con la finalidad de obtener vitroplantas que permitiesen la obtención de explantes de un centímetro bajo el criterio de que previamente estas plantas debieron obtenerse del tratamiento control que muestra mejor vigor en respuesta al tratamiento. Tras la obtención de explantes apicales y basales, se permitió el desarrollo durante un mes, calculando las medias del número de brotes producidos, número promedio de hojas, tamaño final promedio de los explantes (cm) y vigor.
Fue indispensable establecer el modelo exponencial que seguirían las plántulas aplicando los datos arrojados por el mejor tratamiento para la micropropagación, permitiendo la estimación del número de vitroplantas anuales a producir considerando que cada brote generaría una vitroplanta y que estas a su vez produzcan nuevos brotes. El modelo general de crecimiento exponencial plantea la siguiente fórmula: Y=C(1+r) t. donde C es la cantidad inicial de vitroplantas; r es la tasa de crecimiento y t es el tiempo transcurrido tras la siembra (Arenas Solá, 2007)
El modelo general de crecimiento exponencial se aplicó al protocolo de micropropagación; calculando que lo obtenido en un mes debía seguir este crecimiento durante 12 meses, obteniendo un número aproximado de plantas a producir anualmente, fundamentando la relevancia de la técnica y las capacidades de esta para estudios futuros de Heimia salicifolia, incrementando la producción de peso fresco obtenido.
Análisis estadístico
El experimento de germinación fue llevado a cabo a partir de la homogenización de 240 semillas dispuestas en cuatro tratamientos. Se realizó una prueba no paramétrica de Kruskall-Wallis (p<.05) para la normalización de datos. La evaluación de la calidad de las plántulas cuatro meses tras la germinación, respondió satisfactoriamente a la prueba de hipótesis confirmando que el empleo de la prueba de ANOVA con un valor de p<.0001 era adecuado.
En lo referente al protocolo de micropropagación, se emplearon plántulas al azar provenientes del tratamiento control que cumpliesen con el vigor requerido, con la finalidad de mantener la homogeneidad del protocolo. Se llevaron a cabo 45 repeticiones de explantes de la zona apical y de la zona basal por cada tratamiento; a partir de los cuales, los datos obtenidos fueron sometidos a un análisis de varianza (ANOVA), detectando así las diferencias significativas complementado por una prueba de TUKEY (HSD), con un valor de p<.0001. Este ANOVA fue llevado a cabo a partir del análisis de medias LS que corrige el posible desbalance en el análisis de los datos obtenidos, dado el empleo de múltiples frascos, proporcionando un diseño estadístico más cercano a lo que realmente sucede con las vitroplantas. (Rasch Dieter & Schott Dieter, 2018)
El monitoreo del vigor durante el crecimiento de las vitroplantas en los cuatro meses tras la germinación y la micropropagación fue realizado a partir de la interpretación de índices preestablecidos (Tabla 2).
El software empleado en todas las pruebas estadísticas fue XLSTAT desarrollado por Addinsoft.
Resultados
Efectos de las distintas concentraciones de giberelinas y citocininas in vitro sobre la germinación de semillas y el desarrollo de plántulas
Se determinó la germinación de las vitroplantas a partir de la protrusión de la radícula, en un tiempo máximo de 2 semanas (Fig. 1), obteniendo que los picos de germinación son similares en los tratamientos; el tiempo promedio de germinación (MGT) (Fig. 2) no posee diferencias significativas entre los tratamientos, obteniendo un tiempo promedio de 9 a 10 días.

Fig. 1 Número de semillas germinadas durante 30 días en cada tratamiento diferencial en la concentración de giberelinas (GA3) y citocininas (BA) expresadas en mg L−1.
Cuatro semanas a partir de la siembra, una vez finalizada la cohorte de semillas germinadas, se evaluó el porcentaje final de germinación por cada tratamiento, sin diferencias significativas entre sí. Esta similitud entre los porcentajes de germinación, indica que, el empleo de reguladores de crecimiento como lo son giberelina y benziladenina no tienen efectos diferenciales relacionados con el tiempo de germinación en Heimia salicifolia.
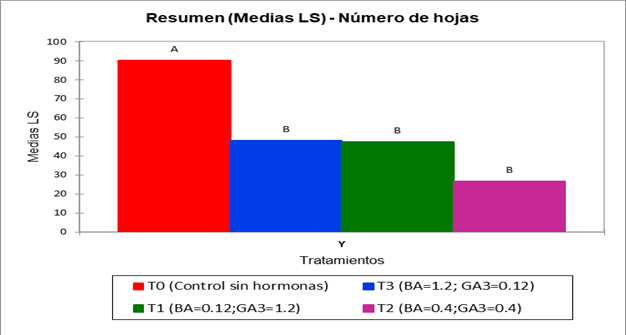
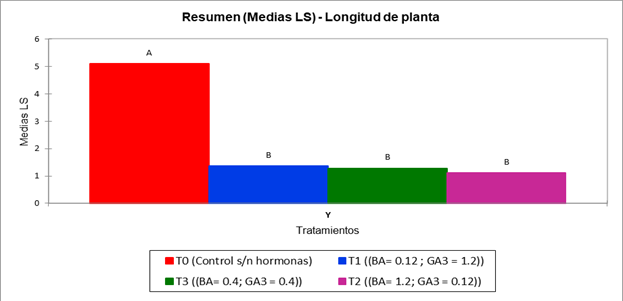
30 días tras la germinación, se permitió el desarrollo de 15 plántulas y se evaluó, el número de hojas promedio (Fig. 4), longitud de las plántulas (Figura 5) y vigor. Los datos que aportaron estas características fueron analizados mediante una prueba de ANOVA y Tukey p<.0001.
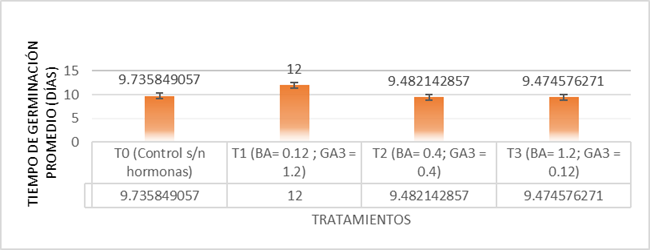
Fig. 2 Tiempo de germinación promedio tras incubación en medio basal MS al 100%; tratamientos con distintas concentraciones de giberelinas (GA3) y citocininas (BA).

Fig. 3 Porcentaje de germinación de semillas de Heimia salicifolia, tras 30 días (4 semanas) en los tratamientos evaluados.
Se observa ante la presentación de los resultados, que el tratamiento control presenta diferencias significativas con el resto de los tratamientos en cuanto al número de hojas producidas y la longitud de las plántulas producidas por su tamaño promedio (cm) cuatro meses tras la siembra. (Figs. 4, 5)
Mientras a partir de las características visuales obtenidas, se definió el vigor de las plántulas en los tratamientos (Tabla 4); denotando que las características óptimas fueron desarrolladas en el tratamiento control por la diferencia significativa con el resto de los tratamientos (Fig. 6).
Tabla 4 Clasificación de vigor de tratamientos 4 meses tras la germinación.
| Tratamiento | Vigor |
|---|---|
| Tratamiento 0 (Control) | “3” Apariencia deseada, crecimiento vigoroso. |
| Tratamiento 1 (BA= 0.12; GA 3 = 1.2) | “1” Crecimiento lento, sin la apariencia deseada. |
| Tratamiento 2 (BA= 0.4; GA 3 = 0.4) | “1” Crecimiento lento, sin la apariencia deseada. |
| Tratamiento 3 = (BA= 1.2; GA 3 = 0.12) | “0” Planta indeseada, senescente. |

Fig. 6 Calidad de plántulas 4 meses tras la germinación. T0 (Control sin reguladores); T1 (BA= 0.12; GA3= 1.2); T2= (BA= 0.4; GA3= 0.4); T3 (BA= 1.2; GA3= 0.12) mg L−1.
Efecto de balance de citocininas (BA, 2iP y KIN) sobre la micropropagación de Heimia salicifolia.
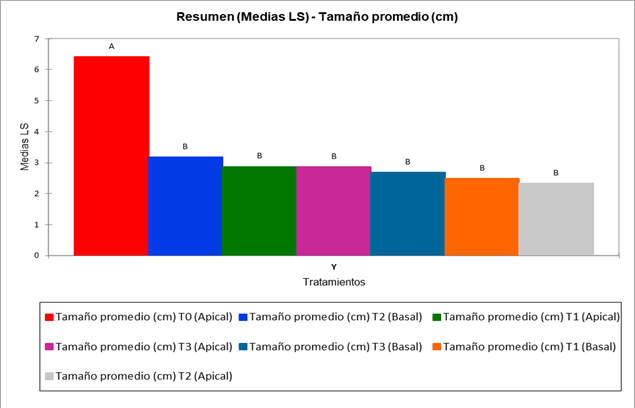
Fig. 7 Medias LS del tamaño promedio de las plántulas por cada tratamiento. ANOVA/Tukey (p<.0001). T0= Control (s/n reguladores); T1= 0.1 mg L−1 (BA, 2iP, KIN); T2= 0.3 mg L−1 (BA, 2iP, KIN); T3= 1 mg L−1 (BA,2iP, KIN).

Fig. 8 Medias LS de número de hojas producidas en cada tratamiento. Prueba de ANOVA y TUKEY con una p<.001. T0= Control (s/n reguladores); T1= 0.1 mg L−1 (BA, 2iP, KIN); T2= 0.3 mg L−1 (BA, 2iP, KIN); T3= 1 mg L−1 (BA,2iP, KIN).

Fig. 9 Resumen de Medias LS del número de brotes producidos por tratamiento a partir de ANOVA/TUKEY (p<.001). T0= Control (s/n reguladores); T1= 0.1 mg L−1 (BA, 2iP, KIN); T2= 0.3 mg L−1 (BA, 2iP, KIN); T3= 1 mg L−1 (BA,2iP, KIN).
En lo que refiere al vigor, número de hojas promedio y número de brotes producidos, los mejores tratamientos fueron el tratamiento dos (0.3 mg L−1 de BA, 2iP, KIN) y tres (1 mg L−1 de BA,2iP, KIN); por lo cual se requirió del vigor como la característica definitiva para la definición del mejor tratamiento. Tras analizar los datos obtenidos mediante la aplicación de tratamientos con concentraciones diferentes de BA,2iP, KIN, se concluye, que el uso de explantes basales fue benéfico para el protocolo, ya que se logró la eliminación de la dominancia apical, dando lugar a la producción de brotes similar a los explantes apicales. El mejor vigor fue obtenido en el tratamiento dos dado que las vitroplantas muestran un crecimiento más uniforme y con hojas desarrolladas, mientras que en el tratamiento tres, es visible la formación de tejido sin diferenciar y senescencia en algunos individuos, lo cual no es deseable en el protocolo de micropropagación, ya que no permite la continuación de la propagación para el crecimiento exponencial (Fig. 10).
Discusión
La germinación de semillas de Heimia salicifolia fue exitosa en todos los tratamientos, dado que no existe diferencia significativa, resultando innecesario el empleo de BA/GA3 como reguladores de crecimiento para la optimización de la germinación (Fig. 2), pese a evidencias de efectos positivos relacionados con la adición de giberelinas exógenas en otras especies, como es el caso de Punica granatum (Gunasena et al., 2017) donde la especie presenta efectos positivos en la síntesis de enzimas que permiten la movilización de proteínas de reserva hacia los cotiledones, no obstante, para Heimia salicifolia el tratamiento sin reguladores fue eficaz reduciendo el costo de producción y facilidad de siembra, lo que evita la espera de germinación de entre 10 y 16 meses in situ según lo mostrado por Malone y Rother en 1989, produciendo además una reducción del tiempo de germinación a tan sólo 9 días tras la siembra (Fig.1). La ausencia de efectos positivos de los reguladores de crecimiento implica que la semilla requiere sólo condiciones esenciales de luz y humedad sin la necesidad de reguladores exógenos en una vía de feedback regulatorio.
El desarrollo de las plántulas cuatro meses tras la germinación se ve afectado por la adición de GA3 y BA como reguladores de crecimiento. De acuerdo a la estadística proporcionada y su fenotipo a partir del índice de vigor (Fig. 6), las características obtenidas permiten definir que el tratamiento control es el adecuado para el crecimiento y desarrollo de plántulas, exhibiendo diferencias significativas con el resto de los tratamientos en las características evaluadas con efectos y respuestas no deseadas en el fenotipo, como lo es la casi nula producción de hojas y la lentitud de crecimiento de la planta tras la germinación, por lo cual, se concluye que el tratamiento control es eficaz previo a la micropropagación (Figs. 4-5). El desarrollo ineficiente de las plántulas, la senescencia y deterioro de vitroplantas en el resto de los tratamientos podría deberse a la actividad de la regulación de biosíntesis de giberelinas y su pico de actividad promovido por un feedback negativo entre las giberelinas endógenas y exógenas, lo cual ha sido demostrado en otras especies como es el caso de Arabidopsis thaliana y Coffea arabica a partir de la observación de patrones de regulación de las giberelinas que pueden exhibir efectos negativos en la germinación y desarrollo de vitroplantas, lo cual concuerda con lo descrito en Heimia salicifolia. (Chiang et al., 1995); (Xu et al., 1995); (da Silva, 2005).
En lo que refiere al protocolo de micropropagación, fue considerada la aplicación exógena de citocininas debido a que estas estimulan la formación de yemas laterales que permiten la propagación a partir de explantes, favoreciendo la pérdida de dominancia apical, tal como en Spondias mangifera y Lawsonia Inermis; optimizando a partir del empleo de estos reguladores de crecimiento, en distintas concentraciones el protocolo de micropropagación, favoreciendo la producción de peso fresco y por lo tanto la multiplicación clonal de las plántulas (Tabla 2). (Tripathi & Kumari, 2010); (Rout G.R. et al., 2001)
(Ram & Shekhawat, 2011) evaluaron en Lawsonia inermis la respuesta óptima a distintos tratamientos de auxinas y citocininas como reguladores de crecimiento, lo que resultó en que el balance adecuado de estos, para la especie es BA 0.25 mg L−1, kinetina 0.25 mg L−1, ácido indolacético 0.1 mg L−1 y sulfato de amonio 150 mg*L−1, logrando un incremento en la generación de brotes múltiples y su longitud (Agrawal & Sardar, 2006). Los antecedentes de éxito de protocolos similares en otras especies herbáceas y en otras especies de la familia Lythraceae como lo es Lawsonia inermis, validan el empleo de citocininas para la producción de brotes y nuevas plántulas para la micropropagación de Heimia salicifolia, justificando así su adecuación a la especie del presente trabajo. Se han reportado, efectos positivos de la actividad de BA como la citocinina más activa para la multiplicación de explantes en plantas herbáceas, como Cassia angustifolia(Husain & Anis, 2009), Melia azadirachta(Ram & Shekhawat, 2011) y en Lawsonia inermis (Shiji & Siril, 2018); motivo por el cual se decidió su implementación en este protocolo, junto con el resto de los reguladores de crecimiento.
Se analizaron las tres variables propuestas como fundamentales para la definición del mejor tratamiento en la micropropagación de Heimia salicifolia, es decir, número de hojas, longitud de los brotes y vigor, permitiendo definir que, el mejor tratamiento para la clonación de plántulas provenientes de un tratamiento sin reguladores de crecimiento es el tratamiento dos (0.3 mg L−1 de BA, 2iP y Kinetina, suplementado con 100 mg L−1 de Mio-inositol, 0.40 mg L−1 de Tiamina y 60 mg L−1 de L-cisteína), produciendo en promedio 77±1 hojas por explante (Fig. 8) y 12±1 brotes nuevos por cada explante (Fig. 9); estas características no fueron diferenciales comparadas con el tratamiento tres, sin embargo, considerando el vigor como la característica diferencial, el tratamiento dos se encuentra en la categoría tres, mientras que el tratamiento tres se ubicó en la categoría uno, exhibiendo características no deseadas como enanismo, decoloración de las hojas y formación de callo (Tabla 3; Fig. 10). El tratamiento dos es eficaz para la producción de hojas y numerosos brotes vigorosos, lo cual se traduce en mayor cantidad de peso fresco producido, a emplearse en pruebas futuras referentes a su producción de alcaloides; estas concentraciones y su uso también ha sido eficaz en la micropropagación de otras especies con potencial farmacéutico, como Sophora tonkinensis (Jana et al., 2013) y en miembros de la misma familia como Lawsonia inermis (Shiji & Siril, 2018). La producción de hojas y brotes idénticas en los explantes basales contra los apicales del tratamiento dos, se relaciona con la disrupción de la dominancia apical del meristemo, proveyendo por lo tanto de un sistema eficaz y consistente para micropropagación de Heimia salicifolia sin muestra de signos de variación genética, generando una clonación a partir de dos vías de explantes, con lo cual se logra la duplicación de plántulas provenientes de una sola semilla germinada. Esta disrupción además de asociarse al uso de reguladores de crecimiento se relaciona con el estado fisiológico de las plantas y la etapa de crecimiento adecuada en la cual se emplearon los reguladores de crecimiento. (Rameau et al., 2015).
El mejor tratamiento para elongación a partir de la evaluación del tamaño promedio de la vitroplanta es el tratamiento sin reguladores de crecimiento, con explantes provenientes de la zona apical en medio MS al 100% suplementado con vitaminas, que produjo mayor longitud de las plántulas (6.4±1cm) con diferencias significativas comparado con el resto de los tratamientos (Fig. 7).
Las explicaciones a la presencia de diferencias significativas en cuanto a la elongación de las plántulas en este tratamiento comparada con los otros tratamientos, es que, al no interactuar con reguladores de crecimiento, la dominancia apical permanece y por consiguiente no hay desarrollo de yemas laterales comparado con el resto de los tratamientos, donde la pérdida de la dominancia apical fue exitosa. Esta pérdida de dominancia apical se considera exitosa para la producción de brotes axilares que juegan un papel fundamental en la producción de plántulas a grandes escalas, bajo el modelo de micropropagación ya que de acuerdo con lo estudiado previamente (Müller et al., 2015), el hecho de incrementar la dosis de citocininas a niveles adecuados dependientes de la especie lleva a la pérdida de dominancia apical eliminando el feedback negativo producido por las auxinas de forma endógena.
La germinación in vitro de Heimia salicifolia con el protocolo propuesto inicia a partir de nueve días, en comparación con el tiempo que toma en vida silvestre que es de seis a diez meses, dependiente de las condiciones ambientales en las cuales se encuentra; la reducción del tiempo de germinación en las condiciones adecuadas de laboratorio es diferente significativamente, obteniendo plantas maduras con el potencial de producir metabolitos secundarios, en un lapso de tan sólo tres meses, mediante el empleo de este protocolo, estimamos que la producción de metabolitos secundarios in vitro pueda suscitarse en tan sólo medio año, lo cual es una reducción significativa comparada con lo que toma in situ, que suele ser de entre 2 y 4 años. (Golebiewski W.M & Wrobel J.T., 1981).
La micropropagación de plántulas de Heimia salicifolia es posible a partir de un lapso de dos meses tras la germinación, logrando la obtención, de acuerdo con el modelo exponencial propuesto, de 643,230±1 vitroplantas en tan sólo un año a partir de la germinación de semillas en un tratamiento sin vitaminas y sin reguladores de crecimiento.
El crecimiento y desarrollo de plántulas de dos meses tras la germinación y la obtención de explantes apicales y basales en un tratamiento con medio MS al 100% aunado a los reguladores de crecimiento BA, 2iP y Kinetina en una concentración de 0.3 mg L−1 suplementado con 100 mg L−1 de Mioinositol, 0.40 mg L−1 de Tiamina y 60 mg L−1 de L-cisteína.
El tiempo total desde la germinación hasta la culminación de la micropropagación es de tres meses, esto, en comparación con estudios previos donde dos meses tras la germinación se promovía la división continúa y se obtenían plántulas similares, pero con ocho meses tras el cultivo suplementado con citocininas y auxinas a partir de plántulas completas (Malone & Rother, 1994). Estas diferencias en cuanto a los tiempos de propagación y la organización del protocolo, nos permitió la obtención de plántulas vigorosas con una reducción de tiempo de ocho a tres meses, realizando una comparación entre ambos protocolos.
Las diferencias fundamentales del protocolo comparado con lo realizado por Malone (1994) radica en diferencias de concentración de reguladores de crecimiento, sustituyendo el uso de ácido indolacético por 2ip, además de la adición de L-cisteína y el incremento del porcentaje de sacarosa empleado pasando de un 2% a un 3%. Aunado a la obtención de explantes de la zona apical y basal con la finalidad de lograr una mayor obtención de peso fresco. Los viales obtenidos a partir del protocolo de micropropagación permiten la producción de un área de 11cm x 8.5cm x 8.5cm en tan sólo dos meses tras el inicio de esta técnica, siendo de mayor proporción al área ocupada en estudios previos donde pese a ser un área menor de cobertura por las plántulas, estas toman de seis a ocho meses de crecimiento una vez iniciado el protocolo para cubrir un área similar a la propuesta en este trabajo, demostrando así la eficacia de las concentraciones de reguladores de crecimiento empleadas.
Conclusiones
Se ha logrado el desarrollo de un protocolo eficiente y simple para la germinación y propagación de Heimia salicifolia, originando plántulas desde la semilla hasta la obtención de explantes apicales y basales que darían lugar a 643,230 plántulas en tan sólo un año bajo el modelo de crecimiento exponencial previamente descrito, justificando así el empleo de esta técnica.
La ausencia de valores que sean significativamente diferentes entre el tratamiento control contra los distintos tratamientos propuestos con diferentes concentraciones de giberelinas y citocininas sugieren que el empleo de estas no es necesario para la germinación de Heimia salicifolia, haciendo hincapié a sugerir que la germinación se relaciona directamente con el contenido de macro y micronutrientes, disponibilidad de agua y sacarosa aunado a las condiciones de incubación de las semillas.
En el caso de la micropropagación se encontraron dos mejores medios, el tratamiento dos con el cual se obtuvo el mejor vigor y número de brotes y hojas, sin embargo, el proceso debe complementarse con un tratamiento sin hormonas para su mejoramiento en lo que refiere al tamaño promedio. Se considera adecuado aseverar que la actividad de BA en la producción de nuevos brotes y su elongación en Heimia salicifolia es benévola y representa una herramienta adecuada para la producción de plantas a gran escala en combinación con 2ip y kinetina.
El protocolo de micropropagación desarrollado en esta investigación a partir de explantes apicales y basales resultó exitoso y relevante para esta especie, ya que permite reducir significativamente el tiempo de crecimiento in situ de 10 a 16 meses a tan sólo cuatro meses. Esto facilitaría el estudio de sus metabolitos secundarios, dada la gran cantidad de peso fresco que se podría producir con ellas y la concentración que podría obtenerse de estos para un estudio a profundidad, además del planteamiento de pruebas in vivo con los principales alcaloides producidos por la especie.











 nueva página del texto (beta)
nueva página del texto (beta)