Introducción
Los aspectos relacionados con las causas de la degradación de los bosques de manglar deben ser considerados como primera base de información para su manejo (Lugo et al., 2014; Wang et al., 2020). El estudio de largo plazo de la dinámica poblacional, los diferentes gradientes ambientales y la implementación de estrategias reproductivas de las especies, ayudan a comprender la vulnerabilidad en la salud de estos ecosistemas (Bakhtiyari et al., 2019; Noguera, 2016). El concepto de degradación, casi siempre se relaciona con la disminución de la cobertura vegetal medida a través del análisis de información satelital (Keim et al., 2013; Kovacs et al., 2009; Lewis et al., 2016), son pocos los trabajos que enfocan el estudio de la degradación a cambios estructurales, funcionales y de los servicios de los ecosistemas (Herrera-Silveira et al., 2020;Lewis et al., 2016; Wang et al., 2020) y aún cuando los avances en la tecnología de imágenes satelitales proporcionan información sobre nuevas variables, siempre se recomienda la verificación en campo (Lewis et al., 2016; Proisy et al., 2018; Razali et al., 2019).
Lewis et al. (2016), con base en los estudios de Pool et al. (1977) y Cintron et al. (1978) mencionan que la estructura del bosque de mangle se correlaciona con el estrés del mismo. El índice de complejidad de Holdridge (1967) ajustado para manglares por Lugo & Cintrón (1975) y Pool et al. (1977) es un buen indicador de la estructura de un bosque (George et al., 2019; Loría-Naranjo et al., 2015; Zamprogno et al., 2016). Blanco et al. (2001) lo aplicaron para el estudio de bosques perturbados, sugiriendo algunos ajustes en su implementación, por ejemplo, obtener el Índice por cohortes con relación al diámetro de los árboles.
En un ambiente degradado, no solo es importante indicar cómo se encuentra la estructura arbórea, también debe incluirse el comportamiento de su regeneración. La mayoría de los índices aplicados a la regeneración natural de un bosque contemplan la densidad (Alfaro-Sibaja et al., 2015; Tsitsoni, 1997; Volpato, 1994) o clases de altura (McWilliams et al., 2015; Shirer & Zimmerman, 2010). Para el caso de los bosques de mangle, no se tienen registrados en la revisión de reportes de trabajos de investigación índices que indiquen el grado de estrés de la regeneración natural de sitios perturbados.
Valores del Índice de Complejidad en sitios contrastantes, por ejemplo, un sitio de referencia y un sitio con evidente degradación se comparan, Lewis et al. (2016) establecen que se puede definir si un bosque está bajo estrés o saludable. Si este mismo principio se aplica a valores que sean un buen indicador de la regeneración natural, también se puede determinar la salud o estrés de un bosque.
En el área de estudio se presenta una degradación del bosque, que integra sitios aparentemente sin daño hasta aquellos en que existe la pérdida total de árboles. La mortandad es atribuida a una modificación hidrológica causada por la interrupción del flujo laminar interno al interior del bosque debido a la construcción, en 1989, de tres terraplenes sólidos que soportan torres de transmisión de un complejo termoeléctrico, que parten desde la orilla de la laguna hacia el interior (Vovides et al., 2011). Como consecuencia, un bosque que hasta 1986 era un manglar continuo quedó fraccionado en cuatro secciones, una al sur, sin estrés alguno y tres altamente inundables en temporada de lluvias y con extrema sequedad del suelo en temporada seca, dos fragmentos pequeños a los costados del terraplén central y un fragmento mayor al norte. En el presente estudio, se utilizó el Índice de Complejidad y un Estimador de regeneración, para encontrar diferencias estructurales y de regeneración entre un sitio de referencia y los fragmentos degradados y así comprender la degradación del bosque.
Materiales y métodos
El área de estudio se encuentra en la llanura costera del Golfo de México, al norte del estado de Veracruz, aproximadamente a 10 km al oeste de la ciudad y puerto de Tuxpan. El área forma parte del sitio Ramsar 1602 “Manglares y Humedales de Tuxpan” y se encuentra dentro de la Reserva Ecológica del Complejo Termoeléctrico “Presidente Adolfo López Mateos”, en colindancia con la laguna de Tampamachoco y el Golfo de México. Se ubica en una latitud de 21°00’51.52” Norte y longitud 97°20’31.251Oeste, como punto central. El sitio presenta cuatro secciones fragmentadas (1, 2, 3, 4 y 4N) con diferentes grados de degradación de la orilla de la laguna de Tampamachoco al interior del bosque, hasta la colindancia con el Complejo Termoeléctrico (secciones 2, 3 y 4) (Fig. 1).
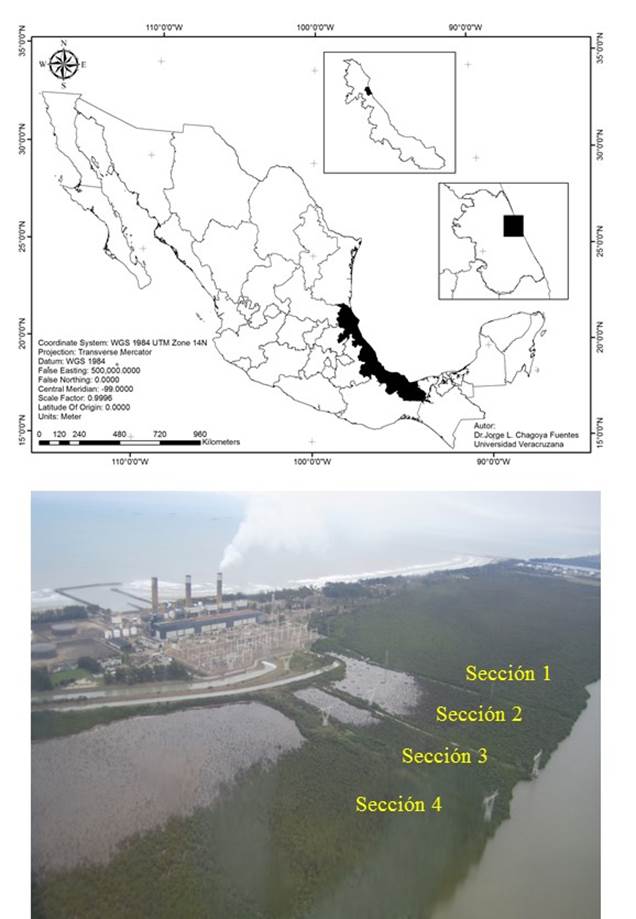
Fig. 1 Macrolocalización y localización del área de estudio mostrando la condición sin estrés (Sección 1) y de degradación (Secciones 2, 3 y 4). Fotografía de 2011, cortesía de F. Javier Martos
En el área de estudio, a partir de 2012 se comenzó con la rehabilitación hidrológica del sitio con el desbloqueo del flujo laminar mediante la conformación de vados que atravesaron los terraplenes. En 2019 se aperturaron canales de la laguna de Tampamachoco hacia el sitio completamente degradado, así como la restauración mediante la adecuación de montículos con sustrato del mismo sitio que aseguraron el arraigo de propágulos. En 2017, se llevó a cabo el presente trabajo, 28 años después de la modificación hidrológica, cinco años posteriores a la rehabilitación hidrológica y dos años antes de la restauración.
En la sección 1, el bosque no presenta signos de estrés de los árboles en los 850 m de extensión del bosque a partir del cuerpo de agua. Esta sección fue considerada como el sitio de referencia (condición sin estrés). De la orilla de la laguna de Tampamachoco hacia el interior del manglar, en los fragmentos de manglar de las secciones 2, 3 y 4 se presenta un gradiente de degradación visible que comienza con una zona de condición aparentemente no degradada en la orilla del cuerpo de agua (0 m) hasta los 200 m, seguida de 100 m con una combinación de árboles vivos, muertos y con signos de estrés (sin follaje, con solo ramas bajas y pocas hojas, condición semidegradada), para posteriormente, a partir de los 300 m y hasta el final del ancho del bosque (500 m) se contempla un paisaje de mortandad total. En la sección 4, 750 m al norte de terraplén, se observa otro gradiente de degradación compuesto por una condición aparentemente no degradada (hasta los 200 m del cuerpo de agua), seguida de 400 m de una condición semidegradada, para posteriormente una zona de 300 m hasta el final del bosque, en la cual los árboles no presentan signos de estrés (aparentemente no degradada).
En cada sección del bosque (1, 2, 3, 4 y 4N), se aplicó un muestreo lineal de regeneración (Bosire et al., 2006; Kairo et al., 2002; Mchenga, 2015) al trazar cinco transectos perpendiculares a la laguna de Tampamachoco que abarcaron todo el ancho del bosque y todos los gradientes de degradación encontrados (Fig. 2). De forma sistemática, en los cinco transectos a cada 25 m se establecieron cuadros temporales de 10 x 10 m para medir los árboles ≥ 2.5 cm de diámetro a la altura del pecho (DAP) y dentro de estos cuadros, otros menores de 5 x 5 m para las plántulas y juveniles (hasta 3 m de altura pero < 2.5 cm de diámetro normal). En total, se muestrearon 101 cuadros de 101 m2 y 101 de 25 m2 (35 en el transecto 1, 12 en los transectos 2 y 3, 13 en el transecto 4 y 29 en el transecto 4N). El largo de los transectos varió de 850 m en el transecto 1 a 275 m en los transectos 2 y 3, el transecto 3 fue de 300 m y 750 m en el transecto 4N. En cada cuadro se anotaba el número de individuos por especie, altura total de árboles, juveniles y plántulas y DAP (solo en árboles, con base en el DAP se estimó el área basal). En la condición semidegradada, la altura fue medida hasta la copa (altura total), tanto en árboles vivos como aquellos que aún cuando ya no se tenía follaje, se presentaban hojas en las ramas inferiores.

Fig. 2 Ubicación de los transectos 1, 2, 3, 4 y 4N perpendiculares a la laguna de Tampamachoco. En color gris se muestra el área degradada.
Con esta información se calculó el Índice de Complejidad por cada uno de los cuadros para tener una representación lineal del cambio de los valores por transecto y de los cambios de condición de degradación reportados, a su vez, se obtuvo el índice de Complejidad por condición de degradación Los datos son referidos en 1000 m2 o 0.1 ha.
Para los árboles adultos se utilizó la fórmula propuesta por Holdridge (1967) (en el presente estudio, se utilizó la media de altura, por lo que sus valores no son comparables con estudios que utilizan el promedio de los tres arboles más altos).
IC, es el Índice de Complejidad de Holdridge ajustado para manglares por Lugo & Cintrón (1975) y Pool et al. (1977) que incluye individuos ≥ 2.5 cm de DAP
s, es el número de especies,
d, es densidad (0.1 ha),
b, es el área basal total (0.1 ha)
h, es el promedio de altura (m)
En las plántulas y juveniles, se tomó de referencia la altura de <50 cm para la primera categoría y ≥50 cm para juveniles. Para el presente estudio, si bien la densidad (Matteucci & Colma, 1982) o la proporción de individuos de cada categoría (plántulas y juveniles) (Amakanga et al., 2021), estiman la capacidad de regeneración, se propone el uso de un estimador de regeneración (ER) que integra la densidad, altura promedio de plántulas, juveniles y el número de especies presentes en cada cuadro, con el fin de adecuarse a los cálculos establecidos por el Índice de Complejidad de Holdridge para los árboles adultos y poder contar, a su vez, con una representación lineal del cambio de valores en cada condición de degradación.
ER, es un estimador de regeneración (plántulas y juveniles)
s, es el número especies
d, es densidad (0.1 ha)
h, es el promedio de altura (m)
Se aplicó la prueba de normalidad de Lilliefors a los valores de densidad, altura, área basal e Índice de Complejidad y la prueba de Kruskal-Wallis (prueba post hoc, Mann-Whitney; α = 0.05) para conocer la existencia de diferencia significativas entre los tipos de condición del bosque encontrados (sin estrés, aparentemente no degradada y semidegradada) y por las distancias (cada 25 m) del cuerpo de agua (0 m) hasta los 275 m (a partir de esta medida en los transectos 2, 3 y 4 se tiene mortalidad total de los individuos). Todos los cálculos se efectuaron con el paquete estadístico Past 4.0.
Resultados
Las especies encontradas en los diferentes estadios fueron Rhizophora mangle, Avicennia germinans y Laguncularia racemosa. Se contaron 11,320 plántulas y juveniles y 2,181 árboles. El 81% de plántulas o juveniles pertenecian a la especie R. mangle y el 54% de adultos fueron de A. germinans. En la condición semidegradada, del total de individuos (13,501), solo se presentó el 2% de las plántulas y juveniles y el 12% de los árboles.
En la Tabla 1, se puede observar las características estructurales de las tres condiciones que se presentaron en el área de estudio y las secciones correspondientes. En la condición sin estrés (sitio de referencia) se tuvo el mayor promedio de altura, pero no así en su densidad, DAP y Área basal. La densidad de la sección 4 en la condición aparentemente no degradada presentó un valor que destaca sobre los encontrados en las condiciones que no mostraron estrés en sus individuos, pero su valor de DAP fue el más alto de estas condiciones. Es en la condición semidegradada donde se encontraron valores contrastantes, como la densidad, la altura y el número de especies comparada con las otras condiciones. El DAP de las secciones 4 y 4N en esta condición fue el más alto de los sitios muestreados, pero está en discordancia con la altura de los individuos.
Tabla 1 Estructura arbórea promedio (DAP ≥ 2.5 cm) en el sitio de estudio por condición y sección.
| Estructura arbórea (DAP ≥ 2.5 cm) | ||||||
|---|---|---|---|---|---|---|
| Condición | Sección | Densidad (individuos/0.1 ha) |
DAP (cm) |
Área basal (m2) |
Altura (m) |
Número de especies |
| Sin estrés | 1 | 246 ±116.98 | 7.39 ±2.84 | 1.1716 ±0.5200 | 4.45 ±1.09 | 3 |
| Aparentemente no degradada | 2 | 254 ±104.89 | 7.58 ±1.60 | 1.6420 ±0.1073 | 4.37 ±0.86 | 3 |
| 3 | 359 ±123.33 | 6.69 ±1.31 | 1.6700 ±0.0975 | 4.05 ±0.57 | 3 | |
| 4 | 179 ±70.97 | 8.58 ±1.96 | 1.3018 ±0.0297 | 4.07 ±0.46 | 3 | |
| 4N | 256 ±219.07 | 8.40 ±5.11 | 1.9183 ±0.2083 | 3.93 ±0.53 | 3 | |
| Semidegradada | 2 | 86 ±23.09 | 4.01 ±0.28 | 0.1533 ±0.0107 | 2.02 ±0.25 | 1 |
| 3 | 133 ±64.29 | 6.06 ±1.26 | 0.5219 ±0.0397 | 2.18 ±0.38 | 1 | |
| 4 | 103 ±51.88 | 12.06 ±0.87 | 1.1891 ±0.0482 | 3.12 ±0.48 | 1 | |
| 4N | 95 ±28.25 | 11.54 ±2.03 | 1.2191 ±0.0597 | 3.05 ±0.41 | 1 | |
La densidad que se presentó en la condición sin estrés fue la segunda más alta del área de estudio, por el promedio de altura, se concentró en la presencia de plántulas de las tres especies. Con relación a la condición aparentemente no degradada, se tuvieron valores diferenciados de densidad, el valor más alto fue en la sección 4, su promedio de altura estuvo en el límite entre plántula y juvenil y se reportaron las tres especies presentes. El menor valor de densidad de esta condición se observó en la sección 2 y fue notoria la presencia de juveniles. No se tuvieron observaciones de plántulas ni juveniles en las secciones 2 y 3 de la condición semidegradada y en las secciones 4 y 4N, los valores de densidad fueron muy bajos comparados con las condiciones sin estrés y aparentemente no degradada. Con base en la altura promedio, se presentó la categoría de plántula de dos especies (Tabla 2).
Tabla 2 Valores promedio de plántulas y juveniles reportados de densidad (valor máximo y mínimo) y altura en el sitio de estudio por condición y sección. El número de especies es el total encontrado
| Condición | Sección | Densidad (individuos/0.1 ha) |
Valor máximo |
Valor mínimo |
Altura (m) |
Número de especies |
|---|---|---|---|---|---|---|
| Sin estrés | 1 | 6,517 ±5,205.70 | 20,680 | 520 | 0.46 ±0.12 | 3 |
| Aparentemente no degradada |
2 | 2,160 ±1,545.83 | 5,040 | 120 | 0.73 ±0.33 | 3 |
| 3 | 4,022 ±5,000.56 | 14,720 | 40 | 0.55 ±0.25 | 2 | |
| 4 | 7,208 ±7,015.63 | 17760 | 360 | 0.51±0.13 | 3 | |
| 4N | 6,020 ±6,940.80 | 22,120 | 200 | 0.48 ±0.11 | 2 | |
| Semidegradada | 2 | - | - | - | ||
| 3 | - | - | - | |||
| 4 | 107 ±61.10 | 160 | 40 | 0.35 ±0.02 | 2 | |
| 4N | 421 ±410.95 | 1,640 | 40 | 0.28 ±0.07 | 2 |
Cuando se hizo un análisis, basado en el índice de Complejidad, de la estructura forestal (≥ 2.5 cm DAP), se apreció diferencia significativa por tipo de condición del bosque (H = 41.79; p = <0.0001), cuando se aplicó la prueba de comparación de medias de Mann-Whitney se observó que la condición sin estrés y aparentemente no degradada, fueron diferentes a la semidegradada (Fig. 3) (Tabla 3). Las diferencias se relacionaron con la densidad (H = 32.1; p = <0.0001) y altura (F = 31.45; p = <0.0001), con relación al área basal, la diferencia se presentó entre la condición aparentemente no degradada con la semidegradada (H = 6.94; p = <0.0310).
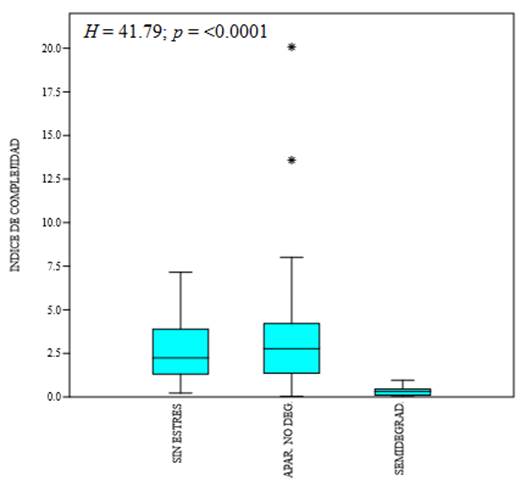
Fig. 3 Índice de Complejidad para individuos adultos por tipo de condición muestreada con relación a la degradación del bosque (sin estrés, aparentemente no degradada y semidegradada).
Tabla 3 Índice de Complejidad y sus indicadores de densidad, área basal, altura y número de especies por condición para individuos adultos.
| Estructura arbórea | ||||||
|---|---|---|---|---|---|---|
| Densidad (árboles/0.1 ha) |
Área basal (m2/0.1 ha) |
Promedio de altura (m) |
Número de especies |
Índice de Complejidad |
||
| Condición | ||||||
| Sin estrés | 246 | 1.1716 | 4.45 | 3 | 3.84 | |
| Aparentemente no degradada | 261 | 1.5114 | 4.09 | 3 | 4.84 | |
| Semidegradada | 100 | 1.0028 | 2.83 | 1 | 0.28 | |
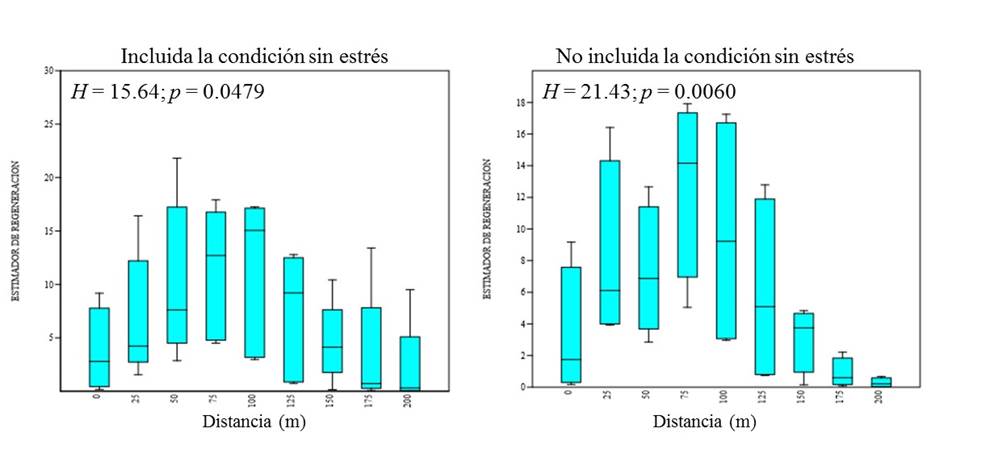
Cuando se comparó el Índice de complejidad por distancia (desde la orilla de la laguna, hasta los 275 m), incluida la condición sin estrés, la prueba de Kruskal-Wallis mostró diferencias significativas (H = 32.89; p = 0.0005). De acuerdo con la prueba de comparación de Mann-Whitney se presentaron diferencias a los 200, 250 y 275 m con las distancias anteriores (0 a 175 m) (Fig. 4a). Al aplicar las mimas pruebas, sin contemplar del cálculo estadístico la condición sin estrés (que no presentó un área semidegradada), las diferencias a partir de los 225 m se hicieron más notorias (H = 35.26; p = 0.0006) (Fig. 4b).

Fig. 4 Índice de Complejidad para individuos adultos por distancia desde la orilla de la laguna (0 m) hasta los 275 m. a: izquierda, se incluye la condición sin estrés, b: derecha, se excluye la condición sin estrés.
La prueba de Kruskal- Wallis aplicada a plántulas y juveniles estableció diferencias significativas por condición (H = 37.17; p = 0.0001) y al aplicar la prueba de comparación de medias de Mann-Whitney se observó que la condición sin estrés y aparentemente no degradada no presentaron diferencias, sin embargo, la semidegradada se diferenció de las otras dos condiciones, en densidad (H = 33.42; p = 0.0001y altura (H = 32.96; p = 0.0001) (Fig. 5) (Tabla 4).

Fig. 5 Estimador de regeneración para plántulas y juveniles por tipo de condición muestreada con relación a la degradación del bosque (sin estrés, aparentemente no degradada y semidegradada).
Tabla 4 Estimador de regeneración y sus indicadores de densidad, altura y número de especies por condición para plántulas y juveniles.
| Sección | Regeneración natural (plántulas y juveniles) | |||
|---|---|---|---|---|
| Densidad (individuos/0.1 ha) | Promedio de altura (m) | Número de especies | Estimador de regeneración | |
| Condición | ||||
| Sin estrés | 6517 | 0.46 | 3 | 8.98 |
| Aparentemente no degradada | 4995 | 0.56 | 3 | 8.39 |
| Semidegradada | 369 | 0.30 | 2 | 0.22 |
La regeneración natural (plántulas y juveniles) se dejó de observar a los 200 m en los transectos 2 y 3. Al aplicar la prueba de Kruskal-Wallis entre estas distancias (0 a 200 m) y al incluir la condición sin estrés, se observó diferencia significativa (H = 15.64; p = 0.0479) en este análisis (Figura 6a), al aplicar la prueba post hoc de Mann-Whitney, la diferencia solo fue significativa entre los 100 m con los 175 y 200 m, y 200 m con 75 y 100 m. El análisis solo con las condiciones de aparentemente no degradada y semidegradada, se amplío la diferencia significativa (H = 21.43; p = 0.0060) y fue más evidente la diferencia de los valores del Estimador de Regeneración de la distancia de 175 m con los 25 a los 100 m, y de los 200 m con los 25 a 125 m, que reflejó una evidente área de 50 m con baja densidad de plántulas y juveniles en la condición aparentemente no degradada (Fig. 6b)).
Discusión
En el área de estudio se encontraron tres de las cuatro especies presentes en el país, Rhizophora mangle, Avicennia germinans y Laguncularia racemosa (la cuarta especie, Conocarpus erectus también está presente, pero fuera de los sitios de muestreo, obs. pers.). La presencia de tres especies de mangle en el área de estudio implicó una adecuada composición de especies y a su vez, un buen indicador del Índice de complejidad.
De acuerdo con Cintrón & Schaeffer-Novelli (1983), que consideran individuos < 10 cm DAP como árboles jóvenes, todas las condiciones encontradas en el presente estudio, se relacionan con un bosque joven. Solo A. germinans en la sección 4 presentó un promedio superior a los 10 cm de DAP (11.51 cm), pero su baja altura de 3.76 m (la media en el área de estudio es de 5.8 m (Basañez, et al., 2020) indica un reclutamiento reciente (Blanco et al., 2001). En la sección 1, L. racemosa se muestreó al final del bosque, en colindancia con remanentes de selva, y por sus valores de altura (9.34 m) y DAP (16.97 cm) altos se puede considerar uno de los cohortes más antiguos y es posible asegurar que contribuyó a un mayor valor al Índice de Complejidad
La especie R. mangle no estuvo presente en la condición semidegradada, aun cuando en la condición sin estrés, a la misma distancia de la laguna (225 a 275 m) si se presentó. L. racemosa solo se presentó en el inicio del bosque y al final del mismo en la condición sin estrés. A. germinans, fue la única con individuos en la condición semidegradada, la cual, como se indicó, está compuesta por árboles vivos, muertos y sin follaje, pero con ramas bajas con hojas. Esta última categoría fue la más representativa, razón por la cual se tuvo una baja altura (2.89 m) con relación a las otras condiciones, aunque un DAP relacionado con árboles adultos (> 10 m, Cintrón & Schaeffer-Novelli, 1983)). Este promedio de altura, fue el menor de todas las condiciones muestreadas es indicador de perturbación, por lo que se decidió usar el Índice de Complejidad sobre otros. Blanco et al. (2001), recomiendan el análisis de la altura como una variable importante para la evaluación de perturbaciones. Además, árboles con alturas bajas están relacionados con alta salinidad (Cintron et al., 1978; Soto & Jiménez, 1982), que de acuerdo con Vovides et al. (2011) fue un factor que contribuyó en la degradación del sitio.
Para George et al. (2019) la estructura del manglar está muy correlacionada con el estrés, la condición semidegradada presentó los valores más bajos de densidad (arboles/0.1 ha), área basal (m2/0.1 ha), promedio de altura (m) y número de especies de todo el análisis y por lo mismo el menor Índice de Complejidad (IC) (0.28). Si se considera lo establecido por Duke (2001), Estrada et al. (2013) y Zamprogno et al. (2016) quienes mencionan que la madurez y la densidad se correlacionan negativamente y el DAP y la madurez positivamente, solo la sección 3 cumplió con estas dos aseveraciones. Es de llamar la atención que la sección 3 quedó aislada por el terraplén central y el que se ubica al norte, de hecho, fue la sección que más alto IC presentó (3.43). Al hacer un análisis más fino de esta sección, se tiene posiblemente la cohorte más antigua de A. germinans en los primeros 25 m de la orilla de la laguna, con un promedio de DAP de 15.09 ±6.53 cm y una altura promedio de 5.63 ±1.00 m, que junto con una estructura promedio de R. mangle le confirió a este cuadro, el más alto IC (14.68) de todos los cuadros muestreados. Feller et al. (2010) y Zamprogno et al. (2016) indican que los bosques con menor influencia o estrés presentan mejor desarrollo estructural. Los cuadros en distancias de 200, 175 y 150 en las secciones 2, 3 y 4 y en la sección 4N sumadas las de 625, 650 y 675 m, es decir aquellos que se van alejando de la condición semidegradada (225 a 275 m y 225 a 600 m) fueron incrementando su IC en comparación con ésta.
Las secciones 1 y 2, y por otra parte las 4 y 4N, exhibieron poca diferencia entre sus IC, lo que Bosire et al. (2014) señalan como una baja variabilidad entre sitios de muestreo. La misma situación se observó entre el IC de la condición sin estrés (3.84) y la aparentemente no degradada (4.84).
En la condición semidegradada la densidad de árboles (100 árboles/0.1 ha), implica una baja proporción de árboles parentales, aspecto que puede comprometer la producción de propágulos y limitar la regeneración del área (Bosire et al., 2014). Si bien en esta condición aún se presenta un área basal (m2/0.1 ha) similar a la condición sin estrés, esto corresponde a árboles que han perdido el follaje de copa y solo presentan ramas bajas con hojas, lo que se muestra por su altura (2.02 a 3.12 m). Por esta característica de los árboles se puede asumir que existe un menor esfuerzo reproductivo, al invertir su energía en la adaptación a la condición estresante (Grime, 1977).
Para las condiciones sin estrés y aparentemente no degradada, al presentar arboles altos, área basal y densidad intermedia con relación a las secciones, indicó un bosque adulto, es decir, en el área de estudio no se tuvieron bosques jóvenes, que evidencien, en general, nuevas cohortes.
En México se han realizado varios estudios de estructura del manglar que utilizan como indicador el Índice de Complejidad, pero no se han enfocado en la identificación lineal de valores a lo largo del transecto y no se ha utilizado para comparar sitios de referencia y degradados. Se tienen los trabajos de Jiménez & González (1996) en Juluápan, Colima (IC = 0.06), Pool et al. (1977) en cinco localidades en Tecapan, Sinaloa (IC = 0.9 a 41.3), Corella et al. (2001) en una localidad de la Reserva de la Biosfera Pantanos de Centla, Tabasco (IC = 31.8), Lara-Domínguez et al. (2005) en cuatro manglares de la costa caribeña del noreste de la Península de Yucatán (IC = 0.01 a 10.5), Velázquez-Pérez et al. (2019) en la zona núcleo de la Reserva de la Biosfera La Encrucijada, Chiapas (IC = 40.1). Para el sitio de estudio (laguna de Tampamachoco, Veracruz) el IC fue reportado por López-Portillo et al. (2012) en 20.3, considerándolo como intermedio en el Golfo de México y Mar Caribe.
En las mismas distancias con respecto a la laguna, (200 a 500 m) de las condiciones sin estrés (sección 1) y aparentemente no degradada (secciones 2, 3, 4 y 4N), se reportan las tres especies, en la condición semidegradada solo existe A. germinans. Los trabajos de restauración que se realicen en la condición semidegradada deberán contener la aportación de R. mangle y L. racemosa, para generar una tendencia natural en valores de índice de complejidad próximos a las otras condiciones. Si esta recomendación es considerada, la tendencia natural se traduciría en complejidad en el bosque recuperado (George et al., 2019).
En cuanto al número de individuos de plántulas y juveniles muestreados, la condición sin estrés, las áreas aparentemente no degradadas y la condición semidegradada de la sección 4N, tuvieron una cantidad suficiente para asegurar una adecuada repoblación natural del área, no así la condición semidegradada de las secciones 2, 3 y 4; el valor mínimo recomendado es de 2,500 plántulas por hectárea (Food and Agriculture Organization [FAO, 1994]) en Bosire et al., 2014). A su vez, el potencial de regeneración descrito por Gan (1995 en George et al., 2019), que considera que el número total de plántulas y juveniles, para considerarse adecuado, debe ser superior al 50% de los árboles maduros, se cumple en las mismas condiciones.
Una mayor proporción de juveniles sobre plántulas, implica una alta tasa de crecimiento de plántulas (George et al., 2019) y por lo tanto una mayor sobrevivencia, misma que impulsa el crecimiento de la población. Cuando se analizaron los valores por condición del bosque, mostró una proporción desigual para la condición semidegradada, las dos especies presentes, R. mangle y A. germinans, tuvieron un promedio de altura menor al 50 cm, las plántulas de A. germinans apenas sobrepasaron los 30 cm, lo que podría afectar su sobrevivencia en condiciones de presencia de algún factor estresante y por lo tanto un bajo o incipiente crecimiento poblacional.
El Estimador de Regeneración fue aplicado a los individuos en categorías de plántulas y juveniles como referencia para ubicar cambios de valores por condición de estrés. Aquí fue evidente que el mejor valor de regeneración se presenta en la Sección 1. Esta situación estuvo dada principalmente por la densidad. Lo que se observó fue que por su altura media de 0.46 cm, se observó una presencia mayoritariamente a nivel de plántula, que si bien puede asegurar una adecuada regeneración natural, el no tener una proporción más alta de juveniles, podría interpretarse como una baja sobrevivencia de las plántulas (Bosire et al., 2014). Pero si se toma en cuenta la observación hecha por la FAO (1994) de un buen potencial de regeneración con 2,500 plántulas por hectárea, todas las secciones de la condición sin estrés y aparentemente no degradada sobrepasaron esta cifra, y en la condición semidegradada, solo la sección 4N, por lo que es necesario manejar con cautela el valor proporcionado por esta institución. La presencia de las tres especies en su categoría de ≥2.5 cm DAP fue en todas las secciones y solo la ausencia de L. racemosa en la condición semidegradada, y a nivel de regeneración, solo hay presencia en dos de las tres secciones, se atribuye a que la cantidad de árboles parentales (Bosire et al., 2014) de L. racemosa muestreados son muy pocos o como lo comentan da Souza et al. (2014) y Zamprogno et al. (2016), esta especie es un buen indicador de estrés en el sistema.
Muy probablemente la baja densidad y altura promedio de los individuos de plántulas y juveniles en la condición semidegradada sea producto de procesos de mortandad-establecimiento de propágulos-crecimiento a nivel de plántula-mortandad, dado el estrés que se evidenció en los árboles del sitio. A este respecto, George et al. (2019) establecen que los potenciales de regeneración dependen de la densidad de árboles maduros (sanos) y esta ausencia condiciona los valores reportados.
Los valores del Estimador de Regeneración (ER) de la condición sin estrés (8.98) y la aparentemente no degradada (8.39), tienen poca diferencia por lo que variabilidad de sus indicadores son relativamente reducidos. El valor de ER = 0.22) En la condición semidegradada fue muy distinto.
Conclusiones
La degradación del manglar estudiado se comprobó con las diferencias entre los valores del Índices de Complejidad (IC) y el Estimador de Regeneración (ER) utilizados. Los valores de IC y ER de la condición semidegradada estuvieron muy por debajo del sitio de referencia (sección 1) con una condición sin estrés. Es muy importante observar que los valores de IC y ER entre las condiciones sin estrés y aparentemente no degradada estuvieron muy próximos, lo que indica que son ambientes en donde los indicadores de estos índices, son muy similares.
Con relación a las secciones, la 1 (sin estrés), ésta fue segundo mejor valor por número de individuos adultos y el primero en plántulas y juveniles, por lo que se considera que fue un buen sitio de referencia. La sección 4N, de la condición semidegradada, que fue el más bajo valor de densidad (94.66 ind/0.01 ha) pero presentó una densidad de plántulas y juveniles mayor de 2,5000 ind/ha con 4,213. En general, en las secciones 2, 3, 4 y 4N (que tienen diferentes escenarios de degradación) apoyados en una buena estructura arbórea y alta regeneración, de la condición aparentemente no degradada, si el factor estresante es solventado, aún pueden presentar un adecuado desarrollo, solo que éste, como lo establecen Lewis et al. (2016), tardaría un aproximado de 10 años en observar su recuperación.
Lo que se observó por el análisis realizado a los indicadores estructurales, tanto a nivel arbóreo como de regeneración es que, si bien la causa de la perturbación y posterior degradación del bosque fue el mismo, la fragmentación del bosque, la escala y la magnitud de los cambios reportados son sumamente diferentes entre las secciones fragmentadas, es decir, los escenarios de degradación responden a las diferentes disponibilidades de los recursos, los reguladores e hidroperíodo, por lo que las medidas de solución a aplicar en una restauración, deben ser diferenciadas.











 nueva página del texto (beta)
nueva página del texto (beta)