Introducción
Las semillas de las cactáceas presentan una gran variedad en formas, tamaños y colores (Bravo-Hollis & Sánchez-Mejorada, 1991). Así mismo se distinguen tres estructuras principales: cubierta seminal o testa, embrión y tejido de reserva (Barthlott & Voit, 1979) y la presencia de atributos morfológicos con valor taxonómico asociados a la dispersión con posibles implicaciones evolutivas (Rojas-Aréchiga, 2012). Esto se ha podido precisar con imágenes de microscopía estereoscópica, óptica y de barrido (MEB) (Rojas-Aréchiga, 2012; Singh, 1999). Barthlott & Hunt (2000) desarrollaron un catálogo de micrografías con las descripciones de la estructura de la testa de las semillas de 1050 especies pertenecientes a 230 géneros de la familia Cactaceae, trabajo que resulta una aportación fundamental para la taxonomía (Arias & Terrazas, 2004; Arroyo-Cosultchi et al., 2006, 2007; Zamudio & Guzmán, 2017) e ulteriores hipótesis sobre la relación con la germinación y la dispersión (Barrios et al., 2020; Bregman, 1988). Al respecto, Sánchez-Salas et al., (2015) estudiaron la morfometría de las semillas de la cactácea Astrophytum miryostigma Lem. usando imágenes de microscopía estereoscópica; sus resultados los llevaron a concluir que la forma navicular de las semillas está relacionada con la hidrodispersión. Bregman (1988) y Sánchez-Salas et al., (2012) estudiaron la relación de la morfología de las semillas de cactáceas con los mecanismos de dispersión utilizando MEB y aunque sus resultados no son concluyentes sugieren relaciones con la hidrocoria. Por otro lado Maiti et al., (1994) estudiaron con MEB la morfología de cinco especies de semillas de cactáceas, sin encontrar relación con el proceso de germinación, sin embargo, sólo sugieren que la presencia de testas de paredes delgadas, de gránulos de almidón y el alto porcentaje de germinación están asociados. Uribe Salazar (2016) estudió la germinación de semillas Astropytum ornatum Lem y de Echinocactus platyacanthus Link & Otto, sin encontrar relación entre la morfometría y el peso de las semillas con el tiempo de inicio de germinación y la probabilidad de germinación. Con respecto a los estudios histoquímicos, Núñez-Mariel et al., (2001) describen la embriología de Pachycereus militaris (Audot) D.R.Hunt, reportando presencia de proteínas en el embrión. En este sentido Alencar et al., (2012) señalan que las reservas más abundantes en semillas de Cereus jamacaru DC. son lípidos y proteínas. Por otro lado, en el caso de semillas del género Echinocactus Link & Otto, Lux et al., (1994) señalan que las sustancias de reserva del embrión maduro se localizan en cuerpos lipídicos y cuerpos proteicos. A pesar de la importancia que tiene el género Mammillaria Haw. la información sobre la morfoanatomía de las semillas es escasa. En este sentido sólo se conocen las descripciones morfológicas de la testa de 52 especies de este género, incluyendo a M. parkinsonii, que realizaron Barthlott & Hunt (2000) y el trabajo de Hernández-García & García-Villanueva (1991) en el que describen la escultura de la testa, el tamaño, la forma y la posición del embrión, así como su desarrollo y la identificación de proteínas y almidón en Mammillaria rhodantha Link & Otto y Mammillaria compressa DC. En México se han registrado 164 especies de 560 para este género, de las cuales 85 % son endémicas y 113 están en la Norma Oficial Mexicana NOM-059-SEMARNAT-2010 (SEMARNAT, 2010) debido al saqueo intensivo de sus ejemplares ya que son muy apreciadas como plantas de ornamento, por sus flores llamativas y por su facilidad para cultivar (Hernández-García & García-Villanueva, 1991). Para este género se reconocen seis áreas de distribución geográfica: una en el desierto sonorense, cuatro en el desierto chihuahuense y la última en el Valle de Tehuacán-Cuicatlán (Hernández & Gómez-Hinostrosa, 2015).
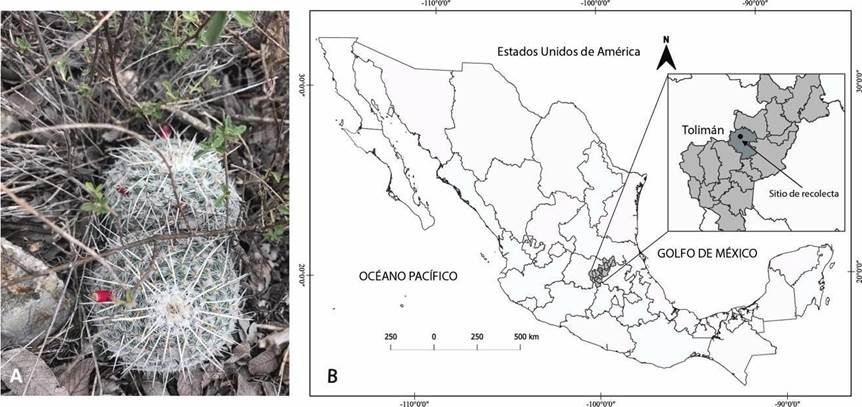
Mammillaria parkinsonii Ehrenb. es endémica de México y se distribuye en los estados de Guanajuato, Hidalgo y Querétaro. Actualmente se encuentra en la categoría de Protección especial (Pr) en la NOM-059-SEMARNAT-2010 (SEMARNAT, 2010) se enlista en el Apéndice II de (CITES) y en peligro (EN) en la (UICN). Al igual que muchas especies del género, por su forma, sus flores llamativas y el arreglo de sus espinas tiene un alto valor ornamental por lo que el saqueo intensivo ha menguado sus poblaciones silvestres. Es una planta de color verde-azulado que en etapa temprana el tallo presenta un crecimiento solitario globoso, en estadío juvenil se ramifica poco a muy abundantemente (Solórzano et al., 2017) y cuando no se ramifica su forma de crecimiento es columnar de hasta 15 cm de altura y 8 cm de diámetro. Las areolas al surgir son redondas y presentan lana, posteriormente son desnudas, se sitúan ventralmente en los ápices de los tubérculos. Las espinas son radiales, aciculares, lisas y blancas. Las flores son de color rosa, en forma de campana de 1.2 a 1.5 cm de largo. Los frutos son carnosos (baya) de color rojo escarlata, claviforme de 1 cm de longitud (Fig. 1A). Las semillas son de color marrón, piriformes, con testa lisa, de 1.8 mm de longitud y 0.8 mm de diámetro (Bravo-Hollis & Sánchez-Mejorada, 1991). Generalmente crece en altitudes de 1400 msnm cerca de rocas calcáreas (Gómez-Sánchez, 2001). Para esta especie sólo se conoce el estudio demográfico en una población ubicada en Peñamellier, Qro. (Jiménez, 2016). Esta autora encuentra que la población está mayormente representada por dos categorías: juveniles y adultos 1 y se asocia con plantas nodrizas; así mismo sugiere que por el tamaño de la semilla, el fotoblastismo positivo y la viabilidad es potencial formadora de bancos de semillas de suelo. Por lo anterior los objetivos de este estudio se enfocaron en la descripción morfoanatómica, la identificación y la ubicación de los tipos de sustancias ergásticas, así como el registro del proceso de germinación de semillas maduras de Mammillaria parkinsonii.
Métodos
Área de recolecta
Los frutos maduros recolectados de Mammillaria parkinsonii proceden de una población de la región sur del desierto chihuahuense en Tolimán, Querétaro, México (latitud 20° 52´ N; longitud 99° 57´ W), altitud de 1200 msnm (Fig. 1B). La temperatura media anual es de 19.2 °C y con precipitación media anual de 361.4 mm (CONAGUA, 2010). La vegetación es un matorral xerófilo (González-Medrano, 2012). El tipo de suelo es calizo intercalado con afloramientos de lutitas (Bayona, 2016). Se elaboró un mapa de localización de la zona de procedencia con el software QGIS (QGIS Development Team, 2020).
Morfometría y germinación de semillas
Los frutos de M. parkinsonii fueron recolectados en julio de 2017, cada uno de diferente planta (N=15), los que se depositaron en una bolsa individual de papel estraza y se dejaron secar durante 40 días a temperatura ambiente. Posteriormente las semillas de cada fruto se extrajeron, contaron y limpiaron con toallas de algodón húmedas para retirar los residuos de la pulpa del fruto. El total de semillas de todos los frutos (N = 252) se guardaron en una bolsa de papel de estraza y se conservaron a temperatura ambiente. Para obtener el peso y el tamaño se tomaron 50 semillas al azar. El peso de cada semilla se obtuvo con una balanza analítica (OHAUS, analytical standard AS 120). Los valores obtenidos se registraron en una base de datos y se hizo la estadística descriptiva empleando Microsoft Excel 365.
Para obtener el tamaño de la semilla, primero se obtuvo una imagen escaneada del lote de 50 semillas, empleando el Escaner Epson perfection V370 photo. Esta imagen se corrió en el programa Fiji, versión 2.1 (Schindelin et al., 2012) con el que se obtuvieron las variables: largo y ancho y la proporción largo/ancho de cada semilla, así como la estadística descriptiva. Con esta información y utilizando como referencia las escalas propuestas por Barthlott & Hunt (2000) se definió el tamaño y la forma de la semilla.
La preparación y siembra de las semillas de 14 meses de edad de cosecha se realizó en septiembre de 2018, siguiendo el protocolo de Reyes (2009). Se inició con un choque térmico sumergiendo el lote completo de semillas (N=210) en agua destilada a 50 °C donde permanecieron por 24 horas. Las semillas posteriormente se desinfectaron con hipoclorito de sodio (Cloralex) al 10% durante 10 minutos y con fungicida (Captan Bayer (PH 50) 1g/100 ml en agua destilada) por 10 minutos. La siembra se realizó colocando 35 semillas/caja Petri en agar bacteriológico (Bioxon) al 1% con seis réplicas y se mantuvieron en una cámara de crecimiento (Lumistell, modelo ICP-19) a temperatura constante de 25 °C, con un fotoperiodo de 12 h luz/12 h oscuridad. Al emerger la radícula con al menos 2 mm de longitud se consideró como semilla germinada. El registro de datos se realizó diariamente por 40 días. Los datos obtenidos fueron: día de inicio y término de germinación; porcentaje final de germinación y tiempo medio de germinación, el que se calculó con la siguiente ecuación; TMG = ∑(Dn/∑n) donde; TMG= tiempo medio de germinación, n= número de semillas que germinan el día D, y D= es el número de días a partir de la fecha de siembra (Ellis & Roberts, 1981) y se obtuvo la gráfica de la curva de germinación acumulada empleando Microsoft Excel 365.
Anatomía e histoquímica
Microscopía Electrónica de Barrido. Para la fijación y procedimientos de secado y montaje para microscopía electrónica de barrido (MEB) se emplearon seis semillas y los protocolos estándares (Bozzola & Russell, 1999). Para la desecación al punto crítico se empleó un desecador (Samdri-780B, marca Toumisii) y para cubrir con oro un recubridor por pulverización (Desk III, marca Denton Vacuum). Las observaciones y las micrografías se realizaron bajo un microscopio electrónico de barrido (JMS-5900 LV, marca JEOL). Se describieron las siguientes características en la superficie de la exotesta de las semillas: microrelieve de la testa, contorno, patrón celular de la región lateral y dorsal, límites celulares anticlinales y periclinales y características de la región hilo micropilar (RHM).
Histoquímica. Para los protocolos histoquímicos y elaboración de laminillas permanentes se emplearon 15 semillas fijadas en FAA (formaldehído (10v): ET-OH 96% (50v): ácido acético glacial (5v): agua destilada (35v)) (Ruzin, 1999). Se lavaron con agua destilada por 48 horas. Las semillas se montaron en platinas para criostato usando el medio Tissue Tek® OCT Compound. Se elaboraron cortes medianos longitudinales y transversales de hasta 15 µm, empleando un criostato (marca Leica) a -20°C (Krishnamurty, 1988; Ruzin, 1999).
Para la localización de sustancias ergásticas se usaron usó: azul de toluidina (1% acuoso) para ubicar lignina y taninos; sudán IV (0.2% alcohólico acidificado) para lípidos (aceites y ceras); lugol (yoduro de potasio al 1.5% y yodo al 0.3%, madurado) para carbohidratos no estructurales (almidones y pectinas); eosina amarilla (1%) y azul de Coomasi (0.02%) para proteínas (cuerpos proteicos) (Johansen, 1940; Krishnamurty, 1988; Ruzin, 1999).
Anatomía. Se elaboraron laminillas permanentes usando un tren de deshidratación alcohólica (60º-100º EtOH). En el cambio a 70º EtOH se tiñó con safranina alcohólica (1% en 70º EtOH) por 20 minutos, lavado con 70º EtOH tres cambios continuos. Previo al cambio a 100º EtOH se tiñó con verde rápido (0.05% 100 EtOH) por media hora; se hicieron tres lavados con 100º EtOH. Posteriormente se usó un tren con soluciones alcohólicas (ETOH absoluto/Alcohol terbutílico absoluto (TBA)) de 75º EtOH/25ºTBA, 50º EtOH/50ºTBA, 100ºTBA, se hicieron dos cambios por concentración alcohólica, cada cambio con 3 minutos. Se montaron en resina Entellán®. El protocolo empleado se ajustó siguiendo a Ruzin (1999). La descripción y toma de fotografías se realizó con un par de microscopios ópticos compuestos Zeiss modelo K7 con cámara Nikon D-50, y Leica modelo DM 500 con cámara integrada ICC50W.
Las características anatómicas que se midieron en las secciones transversales fueron: grosor de la cutícula, grosores de la exotesta: mayor, menor y total; grosor total de la exotesta + grosor de la cutícula; longitud de las protuberancias, grosor del endotegmen, grosor de la membrana embrionaria y el largo y ancho de los cuerpos proteicos (Fig. 2). En sección longitudinal se midieron: el largo y ancho del embrión en la zona media de la semilla, la longitud total de la semilla, grosor del endospermo en cresta dorsal, largo y ancho de las células corticales, medulares, del procambium, de la caliptra y del ápice caulinar y radicular, empleando un ocular micrométrico calibrado. Con los datos obtenidos se obtuvieron las medias y desviaciones estándar, empleando Microsoft Excel 365.

c = cutícula; cpcg = cuerpos proteicos y cristales globoides en el embrión; etc = exotesta con cutícula; etm = exotesta total menor; ett = exotesta total sin cutícula; lp = longitud de las protuberancias; me = membrana embrionaria; te = endotegmen.
Fig. 2 Características anatómicas empleadas en la descripción de la semilla de Mammillaria parkinsonii.
Resultados
Morfometría y germinación
Los frutos de Mammillaria parkinsonii pueden contener entre 7 y 41 semillas y en promedio 18 ± 9.2 semillas/fruto. Las semillas pesan 0.4 ± 0.1 mg; miden 0.98 ± 0.11 mm de largo y 0.62 ± 0.07 mm de ancho. Las semillas son de tamaño pequeño y presentan una proporción largo/ancho de 1.58 ± 0.18 por lo que se consideran de forma oval. La cubierta seminal tiene color castaño rojizo, apariencia semi-mate y aspecto rugoso. Las paredes anticlinales y periclinales observadas en superficies paradermales con MEB, se aprecian elevadas con apariencia alargada y ondulada (Fig. 3B, 3C y 3E). En la periferia lateral de la semilla destaca una cresta dorsal sin dehiscencia y en la región apical la forma es redonda (Fig. 3A).

D) Región hilo-micropilar. E) Microscopía de luz. Sección paradermal de la red de paredes anticlinales y periclinales que conforman la cubierta seminal. ecd = exotesta cresta dorsal; etl = exotesta lateral; p = protuberancias; pa = paredes anticlinales en vista paradermal; RMH = Región Hilo Micropilar; *material péctico y proteico.
Fig. 3 Mammillaria parkinsonii. A-D, micrografías en Microscopio electrónico de barrido. A) Región lateral de la semilla. B) Detalle de la superficie lateral de la semilla. C) Detalle de la superficie de la región de la cresta dorsal.
La curva de germinación acumulada muestra que a partir del día 5 y hasta el día 8 el incremento es lineal y germinó 50% que equivale a 105 semillas. Del día 9 al 15 germinó otro 15% y a partir del día 16 solo el 6%. Después de los 30 días ya no se registraron semillas germinadas. El porcentaje final de germinación fue de 74.3% y el tiempo medio de germinación se observó al día 8.9 (Fig. 4).
Histología e histoquímica
En vista superficial, las células de la exotesta de la cara lateral muestran un patrón profundamente lobulado (Fig. 3B, 3C y 3E); las paredes periclinales (PP) y anticlinales (PA) forman una “U”. Entre ellas se aprecia una red de membranas anticlinales (protuberancias), sobre la pared periclinal de la exotesta (Figs. 3E, 5D-5G, 6G). En la región de la cresta dorsal las PA de las células de la exotesta son más alargadas con lóbulos más cerrados (Fig. 3C) y entre sus PA también se aprecian las protuberancias (Figs. 3E y 5E). En secciones transversales, la exotesta con cutícula mide 38.7 µm ± 4.79, se observa que la cutícula es uniforme superficialmente y hacia el interior en algunas zonas forma domos pequeños (Fig.s 5E); en grosor mide 4.75 µm (± 0.92), presenta lípidos y proteínas (Fig. 5A, 5C-5E y 5G). La exotesta es irregular, la superficie periclinal más gruesa sin cutícula mide 30.56 µm ± 2.52, y la menos gruesa 17.05 ± 2.62 (Fig. 2), con engrosamientos laminares de las PP que cierran el lumen celular, con presencia de proteínas (Fig. 5C, 5D y 5G), ceras (Fig. 5E) y lignina (Fig. 6H). Las protuberancias de la exotesta miden aproximadamente 13.39 µm ± 2.87 de alto (Fig. 2). Entre la cutícula y la exotesta se aprecia un espacio irregular que mide 2.98 µm ± 0.59 con presencia de sustancias de origen péctico y proteico (Figs. 3E, 5G y 6H).

Fig. 5 Sección media transversal de la semilla de Mammillaria parkinsonii. D, E y G. Detalles de la exotesta. A-C y F. Detalle de la cresta dorsal. c= cutícula; cd= cresta dorsal; cpcg= cuerpos proteicos y cristales globoides; em= embrión; en= endospermo; etd= exotesta dorsal; etv= exotesta ventral; ga= granos de almidón; ls= láminas de suberina; me= membrana embrionaria; p= protuberancias; PA= pared anticlinal; PP= pared periclinal; te= endotegmen. A y D. Sudán IV. B y F. Lugol. C y G. Eosina amarilla. D. Azul de Coomasi
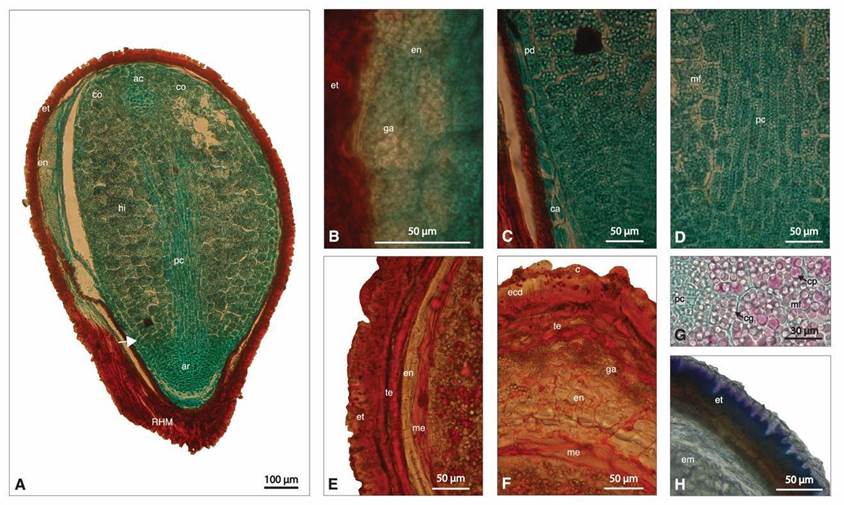
Fig. 6 Secciones longitudinales A-D y transversales E-H de la semilla de Mammillaria parkinsonii. A. Semilla completa. B y E. Detalle de exotesta y endospermo. C y D. Detalle de la zona basal del hipocótilo. F. Detalle de la cresta dorsal. G. Detalle de la zona del meristemo fundamental y procambium con cristales globoides y cuerpos proteicos. H. Detalle de la cutícula y exotesta. ac = ápice caulinar; ar = ápice radicular; c = cutícula; ca= células de la caliptra; cg = cristal globoso; co = cotiledón; cp = cuerpo proteico; ecd = exotesta dorsal; en = endospermo; em = embrión; et = exotesta; ga = granos de almidón; hi = hipocótilo; me = membrana embrionaria; mf = meristemo fundamental; pc = procambium; pd = protodermis; RHM = región hilo micropilar; tg = endotegmen; flecha: indica el límite superior de la radícula y el límite inferior del hipocótilo. A-D y G Safranina-Verde Rápido, E y F Sudán IV. H. Azul de Toluidina.
El endotegmen es una estructura que está formada por una capa de células de paredes gruesas, aplanadas en dirección anticlinal, con lumen reducido, tiene un grosor de 11.42 µm ± 1.23 (Figs. 5G y 6E). Las paredes muestran ceras, posiblemente suberina (Fig. 5E).
La cresta dorsal presenta un grosor máximo de aproximadamente 67 µm. Formada por un estrato de células de la exotesta y tres o cuatro hileras de células aplanadas del endotegmen, seguidas de varios estratos de células del endospermo que presentan granos de almidón (Fig. 5A -5C y 5F).
El endospermo está localizado en posición lateral y longitudinal en la zona de la cresta dorsal (Fig. 5A y 5B). Las células de paredes primarias, delgadas y aplanadas con pequeños granos de almidón casi esféricos que miden 4.16 µm ± 0.88 (Figs. 5F y 6B y 6F). Fuera de la cresta dorsal continúa como una lámina delgada hasta antes del diámetro medio de la semilla y se ubica claramente entre el endotegmen y la membrana embrionaria (Figs. 5A-5C y 6E).
El embrión tiene forma globular, es recto, con una longitud de aproximadamente 850 µm y un ancho de 596 µm. Con una membrana embrionaria rodeándolo de 8.35 µm ± 1.74 de grosor, sin contenidos ergásticos y reacciona intensamente a lípidos (Figs. 5G y 6E y 6F). El hipocótilo ocupa la mayor parte del volumen de la semilla (Figs. 6A y 7A). Los cotiledones son apenas dos protuberancias apicales (Figs. 6A y 7B). El ápice caulinar mide aproximadamente 38.46 µm de alto y 53 µm de ancho, formado por una sola capa de células (dermatógeno) y dos o tres iniciales (Fig. 7A y 7B). El meristemo fundamental ocupa la región cortical y medular del hipocótilo (Fig. 7A); estas últimas son pequeñas y ovaladas, miden 26 µm ± 0.73 de alto y 36 µm ± 0.42 de ancho; las corticales son isodiamétricas y miden 36 µm ± 0.83 de largo y 46 µm ± 1.95 de ancho (Figs. 6A y 7A), con cristales globoides y cuerpos proteicos que en conjunto miden 8.4 µm ± 0.96, los que aumentan de tamaño al incrementar el volumen celular (Fig. 6G).

Fig. 7 Mammillaria parkinsonii. A y B. Sección longitudinal de la semilla y ápice caulinar del embrión. B. Detalle del ápice caulinar. C. Detalle de la región del hilo micropilar. D. Detalle de la región de la exotesta que cubre a la RHM. E. Sección transversal del ápice radicular. ar = ápice radicular; c = cutícula; co = cotiledón; em = embrión; t = exotesta; hi = hipocótilo; mf = meristemo fundamental; pc = procambium; RHM = región hilo micropilar; tg = endotegmen; tplRHM = tejido de paredes lignificadas de la RHM; tppRHM = tejido parenquimatoso de paredes primarias de la RHM; flecha = ápice caulinar. Azul de Toluidina
El procambium tiene aproximadamente 650 µm de largo; en la parte media del embrión se observan dos ramificaciones de este que entran a los cotiledones (Figs. 6A y 7A). Estas células derivadas son pequeñas y rectangulares de 46 µm ± 1.17 de alto y 10 µm ± 0.60 de ancho; contienen cuerpos proteicos y cristales globoides que en conjunto miden 4.67 µm ± 0.96 (Fig. 6A, 6C-6D y 6G).
La radícula se orienta hacia la región hilo-micropilar (Figs. 6A y 7A). El ápice radicular de 137.8 µm de largo y 148.6 µm de ancho, sugiere ser de tipo cerrado pues no se distinguen las células iniciales de las derivadas ni del centro quiescente. Apenas se distingue una breve región de la columela y la caliptra formada por tres a cuatro capas de células en la zona apical, las que miden 21.29 µm ± 8.9 x 12.0 µm ± 2.26 (Figs. 6C y 7A). Las células de la protodermis y las del tejido fundamental de esta zona tienen forma y tamaño característicos. Las primeras son más comprimidas y las segundas isodiamétricas de aproximadamente un tercio del tamaño de las células del hipocótilo. Estas características definen claramente el límite superior del ápice radicular y el basal del hipocótilo (Fig. 6A y 6C).
La región hilo-micropilar (RHM) es pequeña de forma oval, oblicua, superficial y fusionada, mide 142.8 µm x 428.5 µm (Fig. 3D); formada por células de parénquima de paredes primarias (Fig. 7C -7E). La RHM está rodeada por la exotesta, la que en esa zona presenta hasta seis estratos de células de paredes secundarias lignificadas. Las formas celulares que se observan son de dos tipos: unas aplanadas y ubicadas hacia la periferia (Fig. 7D y 7E) y otras isodiamétricas que hacen contacto con las células del parénquima de la RHM (Fig. 7C) con cavidades que contienen posiblemente polifenoles. El endotegmen llega hasta el micrópilo (Fig. 7D).
Discusión
Las semillas de M. parkinsonii presentaron tamaño pequeño, lo que es similar a lo reportado para especies del mismo género por Barthlott & Hunt (2000); Serna-Navarrete-L (2007); López-Godínez (2009); Jiménez (2016) y Zamudio & Guzmán (2017). El tamaño pequeño puede evitar la depredación por mamíferos (pequeños o medianos) e insectos (Rojas-Aréchiga & Batis, 2001). Esta característica también puede facilitar la dispersión por viento y agua (Rojas-Aréchiga & Vázquez-Yanes, 2000). El viento puede ser un vector importante en la dispersión debido al peso y en época de lluvias las corrientes de agua pueden trasladar las semillas lejos de las plantas madre. Este último factor podría dañar la superficie seminal provocando escarificación natural. Adicionalmente el tamaño pequeño está asociado a la formación de bancos de semillas de suelo (BSS) lo que favorece su fotoblastismo positivo y longevidad ecológica a corto plazo (Jiménez, 2016). Al quedar enterradas pueden conservarse en la oscuridad a bajas temperaturas lo que conlleva a la condición quiescente y por tanto su permanencia en el BSS.
El porcentaje final de germinación de las semillas de este estudio fue del 74.3%. Jiménez (2016) encuentra que en general para semillas de diferentes edades de M. parkinsonii, germinan en un 80% las más viejas y en un 90% las más jóvenes. Rojas-Aréchiga et al., (2013) reportan los porcentaje de germinación de semillas pequeñas de ocho especies para este género (Mammillaria discolor Haw., Mammillaria haageana Pfeiff., Mammillaria lanata Orcutt, Mammillaria microhelia Werderm., Mammillaria mystax Mart., Mammillaria pottsii Scheer ex Salm-Dyck, Mammillaria solisioides Backeb., Mammillaria sphacelata Mart.) que oscilaron entre 30 y 100%, aunque no documentan las edades. Sánchez-Salas et al., (2006) encontraron para Astrophytum myriostigma Lem. que las semillas pequeñas y grandes tuvieron el 90% y el 58% de germinación respectivamente. Lo anterior sugiere que el tamaño y la edad de la semilla pueden estar relacionados con el porcentaje de germinación, por lo que es indispensable hacer más estudios sobre esta relación. Por otro lado, el tiempo medio de germinación para M. parkinsonii fue en el día 8.9 dato que se reporta por primera vez. Para esta variable no existe mayor información que ayude a sugerir si estos tiempos pueden ser característicos de semillas pequeñas.
En este estudio se reporta por primera vez la presencia de cutícula, con contenidos de origen péctico y proteico, lo que sugiere que los pequeños domos cuticulares internos que descansan en las terminaciones de las paredes periclinales (PP) de la exotesta se mantengan adheridos. En este sentido (Hernández-García & García-Villanueva (1991) localizan esta estructura en Mammillaria rhodantha Link & 0tto y en Mammillaria compressa De Candolle, sin embargo, Barthlott & Hunt (2000) reportan su ausencia en M. parkinsonii y enfatizan la importancia de esta estructura, con o sin estrías, como atributo taxonómico, por lo que se debe revisar su presencia en otras especies del género.
La exotesta de esta especie adquiere una arquitectura superficial característica, dado que las células ubicadas en la cresta dorsal tienen menos protuberancias que las laterales, debido a que las paredes anticlinales (PA) son más cerradas, lo que se evidencia en las secciones transversales de la semilla y en la vista paradermal. Las ondulaciones tipo U y las protuberancias irregulares encontradas en las PP y PA para M. parkinsonii parecen ser características del género, ya que Hernández-García & García-Villanueva (1991) las reportan para M. compressa y M. rodantha y Barthlott & Hunt (2000) en otras especies del género; sin embargo, éstos últimos autores encuentran mayor diversidad de ondulaciones al reportar tipos U, V, S y 𝝮 en 52 especies de Mammillaria. Si estos caracteres son relevantes en la taxonomía, es requisito abordar su gran diversidad morfológica.
Las paredes de la exotesta de M. parkinsonii presentaron láminas de suberina, depósitos de lignina y proteínas. Para esta estructura solo se han reportaron taninos en las cavidades de la exotesta de Pereskia lichnidiflora DC. (Jiménez-Durán et al., 2014) y en las de M compressa y M. rodantha y (Hernández-García & García-Villanueva, 1991). Con respecto al endotegmen, éste se conserva con presencia de lípidos en sus PP y sin depósitos ergásticos en sus cavidades, atributos morfológicos que no le otorgan rasgos cuticulares, como lo sugieren Hernández-García & García-Villanueva (1991). Tanto estos autores como Jiménez-Durán et al., (2014) reportan que el endotegmen no se pierde durante la embriogénesis y lo ubican como una región con células elongadas, con taninos y comprimidas hacia el micrópilo. En M. parkinsonii, tanto éste carácter junto con la exotesta representan el 6.8% del volumen de la semilla. Los contenidos encontrados en ambas estructuras le confieren una condición hidrofóbica, vital para la impermeabilidad.
El endospermo de M. parkinsonii está confinado principalmente hacia la cresta dorsal, sin sufrir compresión y con presencia de granos de almidón, aunque en la región lateral se presenta como una lámina comprimida disfuncional sin material ergástico, asumiendo el hipocótilo el compromiso de almacenamiento de nutrientes (Hernández-García & García-Villanueva, 1991). En este sentido Núñez-Mariel et al., (2001) reportan que durante el desarrollo del embrión de Pachycereus mylitarys, el perispermo está reducido a una pequeña franja en la región cóncava del embrión y el endospermo formado por un solo estrato de células que rodea a la radícula y al hipocótilo, ambos tejidos consumidos casi en su totalidad, lo que contrasta con lo observado para el género Mammillaria y para la especie en estudio.
En el presente estudio se confirma la existencia de una membrana embrionaria como una tercera estructura que envuelve al embrión y para el género Mammillaria se reporta por primera vez. Esta estructura sólo se ha reportado en Astrophytum myriostigma por Sánchez-Salas et al., (2015). Su composición sugiere un atributo funcional adicional que reviste al embrión con fines hidrofóbicos.
El embrión de M. parkinsonii ocupa aproximadamente el 93% del volumen de la semilla, formado por células meristemáticas que contienen dos estructuras asociadas: los cristales globoides y los cuerpos proteicos. Destaca que en las células isodiamétricas corticales del meristemos fundamental se localizan los cuerpos proteicos de mayor tamaño, es decir, es la zona de almacenamiento más importante; en contraste los de menor talla se localizan en las células del procambium, esto es similar para los tamaños de los cristales globoides, lo que se describe por primera vez para esta especie. Estas dos estructuras proveen del equipamiento de proteínas protectoras a la desecación, como fuente de energía y nitrógeno, y los segundos como fuente de minerales como: P, K y Mg y ocasionalmente presentan Ca, Mn, Fe, Ba, Zn, S y Cl, fundamentales para la germinación (Guevara-Farfan, 2019; Lux et al., 1994; Matilla, 2008). En este sentido se han reportado presencia de cuerpos lipídicos y proteicos en las semillas de Echinocactus platyacanthus Link & Otto, por Lux et al., (1994) enfatizando su localización en la radícula. En Pachycereus militaris (Audot) D.R.Hunt. Núñez-Mariel et al., (2001) en M. compressa y M. rodantha, Hernández-García & García-Villanueva (1991) y en Pereskia lichnidiflora DC. Jiménez-Durán et al., (2014) sólo se refieren a la presencia de proteínas. Y finalmente Alencar et al., (2012) reportan para las semillas de Cereus jamacaru DC. lípidos, proteínas y en menor proporción, azúcares solubles, aminoácidos y almidón como las moléculas de reserva más abundantes. Resalta que por un lado los cristales globoides no han sido reportados en las semillas de ninguna otra especie de la familia Cactaceae y por otro lado que el origen y ubicación de la asociación “cristales globoides/cuerpos proteicos” contrasta con el de los granos de aleurona presentes en las semillas de otras familias botánicas.
En M. parkinsonii la RHM es una estructura similar a un tapón, el que está formado por células de parénquima de paredes primarias, lo que le da atributos altamente higroscópicos. Esta estructura está forrada por células de la exotesta y por células isodiamétricas con paredes secundarias fuertemente lignificadas (esclerificadas) lo que sugiere que la dirección de entrada del agua es exclusivamente por el micrópilo donde ocurrirá la absorción e hidratación de las células del parénquima. Por su forma isodiamétrica las células lignificadas tienen menor superficie de contacto entre ellas y por lo tanto pueden favorecer la ruptura de esa zona cuando emerge la radícula, lo que Bregman & Bouman (1983) demuestran cuando estudian la emergencia de la radícula en Mammillaria bella Backeb. En contraste, Orozco-Segovia et al., (2007) mencionan que en la RHM de la semilla de Opuntia tomentosa se forman dos estructuras: un canal que se embebe de agua y una válvula de germinación por donde emergerá la radícula. Estas estructuras se forman durante la deshidratación y maduración de la semilla.
Conclusiones
M. parkinsonni presenta semillas de tamaño pequeño con alta viabilidad características que pueden ser asociadas a la formación de BSS. La morfología externa de la semilla representa un gran valor taxonómico a nivel de género y de especie lo que puede contribuir con un papel importante en la sistemática de la familia.
La relación morfoanatómica de la cubierta seminal le confiere a la semilla atributos que direccionan la entrada del agua exclusivamente por el micrópilo. La estructura de la exotesta, el endotegmen, la membrana embrionaria y la composición con sustancias disímiles al agua, garantizan esta direccionalidad de entrada de líquido, es decir, no existe posibilidades de otros mecanismos de mojado. El endospermo, aunque presente, está confinado hacia la cresta dorsal pero manteniendo todavía almidones lo que contrasta con el cuerpo del embrión cuyas células meristemáticas han acumulado la asociación “cristales globoides/cuerpos proteicos”. Esta asociación garantiza los elementos nutrimentales, de energía y fuente de nitrógeno requeridos para la germinación. Es de importancia para la semilla almacenar proteínas lo que le permite resistir a la deshidratación que el medio físico ejerce, manteniendo baja actividad metabólica y con ello su viabilidad, lo que ocurre con las semillas intermedias u ortodoxas. Por otro lado se sugiere profundizar en aspectos morfofisiológicos y moleculares que permitan vislumbrar qué tipo de relaciones existen con la germinación. Finalmente los resultados de este estudio podrían apoyar a planes de conservación de la especie para la reintroducción de ejemplares a su hábitat.











 nueva página del texto (beta)
nueva página del texto (beta)