Introducción
Existen diferentes formas para definir a las plantas arvenses según el ámbito de estudio; en agronomía, estas plantas son competidoras que afectan negativamente a los cultivos (Blanco & Leyva, 2010), para la agroecología y la etnobotánica, este grupo vegetal puede incrementar la heterogeneidad del paisaje y proporcionar una gran variedad de beneficios, tales como refugio para insectos benéficos (Sans, 2007), salud, alimentación y rasgos de identidad cultural (Albino-García, Cervantes, López, Ríos-Casanova & Riva, 2011; Blancas, Casas, Pérez-Salicrup, Caballero & Vega, 2013). La alta diversidad promovida por las plantas arvenses contribuye con sitios de refugio (Letourneau et al., 2011) y microhabitats (Munro, Fisher, Wood & Lindenmayer, 2009), que disparan distintas interacciones ecológicas que son vitales para los agroecosistemas, tales como la polinización, almacenaje de carbono, reciclaje de nutrientes, control de microclimas y procesos hidrológicos, así como la regulación de organismos dañinos contra los cultivos (Bengtsson, Ahnström & Weibull, 2005).
Se ha observado que en sistemas de cultivo tradicional hay una mayor diversidad de arvenses que en sistemas de cultivos intensivos (Perfecto, Mas, Dietsch & Vandermeer, 2003; Fernández & Marasas, 2015), como consecuencia en la agricultura intensiva hay pocos servicios ambientales lo que encarece las estrategias de control contra plagas y malezas (como también se denomina a las especies arvenses), por tal razón es importante conocer los rasgos ecológicos que promueven la diversidad taxonómica y funcional dentro de los agroecosistemas. En México hay más de 3,000 especies de plantas dentro de la categoría arvense, que corresponde al 12% de toda la flora vascular (Martínez-De la Cruz et al., 2015), muchas de estas plantas tienen registro de utilidad práctica dentro de la salud, alimento y forraje, además de que inciden en los procesos culturales de los agroecosistemas campesinos-indígenas.
El Bajío Guanajuatense es una región agrícola importante para México principalmente por la variedad de cultivos que se producen tales como granos básicos (maíz, trigo, cebada, sorgo), hortalizas como lechuga, brócoli, espárrago y frutillas como la fresa. En el caso particular de los granos cubren el 70% de la superficie agrícola del Estado concebidos bajo un sistema altamente productivo, cuyos productos son destinados a los mercados nacionales e internacionales para alimento, forraje y propósitos industriales (Smale, Bellon, & Aguirre, 2001), lo que implica un alto consumo de insumos agroindustriales, en particular el 66.6% de los ingredientes activos de los herbicidas utilizados corresponde a la categoría de altamente peligrosos (Pérez-Ortega, Navarro-Garza, Flores-Sánchez, Ortega-García, & Tristán-Martínez, 2017).
En Guanajuato como en otras zonas agrícolas económicamente importantes, las plantas arvenses son consideradas como un obstáculo importante para la producción de cultivos ya sea por su capacidad de competencia o porque albergan plagas y enfermedades, razón suficiente para que las aplicaciones con herbicidas sean el principal medio de control con resultados moderados. Lo anterior ha derivado que la agricultura del Bajío como en muchas otras partes del mundo enfrente el grave reto de la pérdida de biodiversidad, que no sólo implica la desaparición de especies sino también de características ecológicas funcionales para los agroecosistemas, lo que conforma un conjunto de rasgos útiles para diseñar estrategias de manejo, control y aprovechamiento en un esquema agroecológico. Por lo que el objetivo del trabajo fue registrar, evaluar y comparar la diversidad de plantas arvenses presentes en tres monocultivos tomando en cuenta el estatus migratorio de las especies. Esto con el fin de proporcionar información que sume evidencia al desarrollo de nuevos modelos conceptuales en torno al control, manejo y aprovechamiento de la riqueza vegetal arvense asociada a los agroecosistemas.
Sitio de estudio
El trabajo se realizó en tres tipos de monocultivos de maíz (mz), trigo (tg) y sorgo (sg), ubicados en la comunidad de El Copal, Irapuato Guanajuato en las coordenadas 20º 44' 39.2'' N y 101º 19' 39.4'' W y a una altitud de 1,760 msnm. Las parcelas fueron localizadas entre sí a los 10 y 20 m de distancia, en un clima cálido semi húmedo dentro de una zona con irrigación de 28.5 ha, con una siembra regular de granos básicos como sorgo, trigo y maíz, y aplicación de agroquímicos como fungicidas, insecticidas, nematicidas y herbicidas, muchos altamente peligrosos tales como atrazina (2-cloro-4-6-1,3,5-triazina), glifosato (N-fosfonometilglicina, C₃H₈NO₅P, CAS 1071-83-6), paraquat (Dicloruro de 1,1’-dimetil-4,4’-bipiridilo), acetoclor (2 cloro N etoximetil -6’-etilacetato-toluidina) entre otros, aplicados por lo menos desde hace una década. El suelo es Xerosol con materia orgánica, el clima es cálido semi húmedo con lluvias en verano, con una temperatura promedio de 17.4 °C y una precipitación anual 680 mm (INEGI, 2011; García, 2004).
Muestreo de arvenses
Los muestreos se realizaron en cinco parcelas de mz y tg que comprendieron un total de 55,472 m2 y 128,358m2 respectivamente, y dos parcelas de sg con un total de 6,390 m2. A partir del conocimiento del tamaño de las parcelas se contabilizó el número máximo de cuadrantes de 2x2 m y fueron trazados y numerados consecutivamente sobre una imagen aérea 1:100. La numeración de los cuadrantes fue organizada en Excel y la selección ocurrió a partir de las 100 aleatorizaciones, en mz (n = 42), tg (n = 35) y sg (n = 11). A partir de noviembre 2018 a mayo 2019 comprendiendo un ciclo como en otros estudios (Sánchez-Blanco & Guevara-Féfer, 2013; Loss, 2014; Albino-García, Cervantes, López, Ríos-Casanova & Riva, 2011), se realizaron tres visitas mensuales para medir la abundancia, riqueza y diversidad de plantas de cada uno de los cultivos. La selección del periodo de muestreo responde a que las plantas arvenses son más abundantes y representan un problema para los productores, quienes prefieren eliminar que conocer la identidad de las especies presentes en las parcelas, entonces el periodo seleccionado permite en este sentido obtener la mayor información posible sobre el tipo de especies que se pueden presentar en las parcelas. El esfuerzo de muestreo incluyó un total de 3,528 m2 en mz, 2,940 m2 en tg y 924 m2 en sg. Las plantas en floración o fructificación fueron recolectadas para su identificación a especie usando las claves taxonómicas de Calderón de Rzedowski & Rzedowski (2004, 2005) y Espinosa & Sarukhán, (1997). Además, las especies se categorizaron en exóticas o nativas, según su estatus migratorio de acuerdo con la página de la CONABIO Malezas de México. Todas las plantas identificadas fueron depositadas en el Herbario de la División Ciencias de la Vida, Departamento de Agronomía Campus Irapuato, Universidad de Guanajuato,
Análisis estadístico
Los datos obtenidos por cultivo fueron usados para calcular riqueza, abundancia y diversidad de especies. Con esta información se calcularon las curvas máximas potenciales de riqueza de especies con los modelos Chao 1 y 2, ambos ocupados convencionalmente para evaluar inventarios biológicos con respecto al esfuerzo de muestreo (Jiménez-Valverde & Hortal, 2003); de acuerdo con López-Gómez & Williams-Linera (2006), estos modelos presentan ventajas para comparar comunidades vegetales en contraste con modelos paramétricos de análisis de riqueza de especies, para la realización de este análisis se ocupó el programa EstimateS 7.0 (Colwell, 2004).
Se calcularon los índices de diversidad Shannon y Simpson, el primero fue para contrastar estadísticamente los valores observados por cultivo mediante la prueba t de Hutcheson (Zar, 1999), el segundo índice permitió calcular el índice de dominancia (1/λ) (Ludwing & Reynolds, 1988) y el índice de igualdad de Pielou’s (J’), estos análisis se llevaron a cabo con el programa PAST (Hammer, Harper & Ryan, 2001).
Con el fin de minimizar la variabilidad entre los cultivos, los datos de abundancia fueron transformados a √n+0.5 (Zar, 1999), y se realizó un análisis de varianza no paramétrico de Kruskal-Wallis, en caso de encontrar diferencias significativas se aplicó una prueba de rangos con el programa Infostat (Di Rienzo, y otros, 2011).
Los datos de abundancia del estatus migratorio de cada especie fueron usados para calcular las curvas de rango-abundancia de Whittaker con el programa Biodiversity pro version 2 (McAleece, 1997). Las curvas fueron graficadas usando el logaritmo de la proporción de cada especie (n/N), y los datos ordenados de la mayor a menor abundancia. Los datos de abundancia también fueron transformados a √n+0.5 y comparados con la prueba U Mann-Whitney.
Con el fin de reconocer posibles diferencias entre las comunidades de arvenses en los cultivos se llevó a cabo un Análisis Discriminante (AD) con el programa Infostat (Di Rienzo et al., 2011).
Resultados
Abundancia y diversidad de plantas arvenses
Se registraron 15 familias y 28 especies de plantas arvenses, de acuerdo con las curvas de máximo potencial de especies se obtuvo la mayor parte de la representatividad de la comunidad vegetal (Fig. 1). Las familias más representativas fueron: Asteraceae (S= 10), Brassicaceae (S= 4) y Solanaceae (S= 2) (Tabla 1). Del número total de especies 60.7 % fueron nativas (S= 17) y 39.2 % exóticas (S= 11) pertenecientes a 11 y 6 familias respectivamente, siendo Asteraceae la de mayor cantidad de especies nativas (S= 4), mientras que las especies exóticas fueron comúnmente encontradas en Asteraceae y Brassicaceae (Tabla 2). En este estudio cinco especies fueron muy abundantes, cuatro de ellas nativas: Parthenium hysterophorus L. (Asteraceae), Portulaca oleracea L. (Portulacaceae), Amaranthus hybridus L. (Amaranthaceae) y Tithonia tubaeformis (Jacq.) Cass. (Asteraceae). Brassica nigra (L.) W.D.J. Koch (Brassicaceae) fue la especie exótica más abundante (Tabla 1).
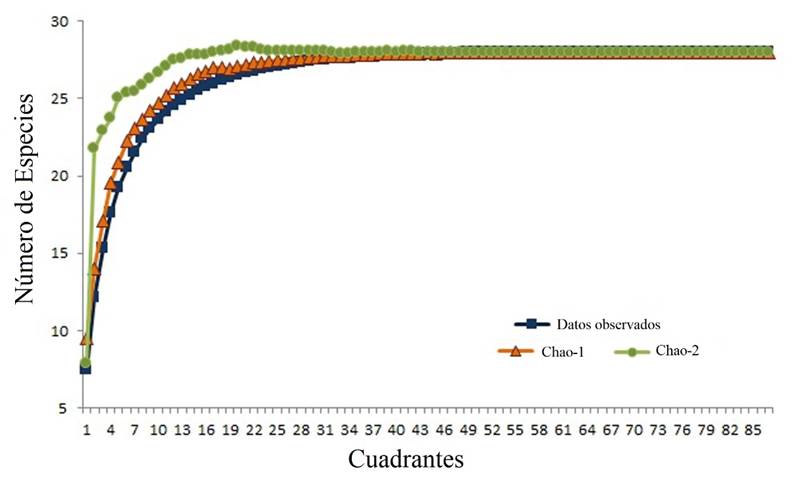
Fig. 1 Curvas de acumulación máxima de especies con los modelos de Chao 1 y Chao 2 para las especies observadas en el estudio.
Tabla 1 Listado de presencia-ausencia y cantidad total de especies arvenses en maíz (mz), trigo (tg) y sorgo (sg); ab= abundancia (media ±EE); Em = estatus migratorio (N = nativa, E = exótica).
| Familia/Especie | mz | tg | sg | ab | Em |
|---|---|---|---|---|---|
| Aizoaceae | |||||
| Trianthema portulacastrum L. | X | X | - | 44 (0.5 ±0.1) | N |
| Amaranthaceae | |||||
| Amaranthus hybridus L. | X | X | X | 120 (1.3 ±0.1) | N |
| Asteraceae | |||||
| Bidens pilosa L. | X | - | - | 23 (0.2 ±0.2) | N |
| Flaveria trinervia (Spreng.) C. Mohr | X | - | - | 8 (0.09 ±0.1) | N |
| Galinsoga parviflora Cav. | X | - | X | 24 (0.2 ±0.1) | N |
| Helminthotheca echioides (L.) Holub | - | X | - | 27 (0.3 ±0.1) | E |
| Lactuca serriola L. | X | - | - | 6 (0.06 ±0.1) | E |
| Parthenium hysterophorus L. | X | X | X | 231 (2.6 ±0.2) | N |
| Sonchus oleraceus L. | X | X | X | 71 (0.8 ±0.1) | E |
| Taraxacum officinale F.H. Wigg. | X | - | X | 46 (0.5 ±0.1) | E |
| Tithonia tubaeformis (Jacq.) Cass. | X | X | - | 108 (1.2 ±0.2) | N |
| Zinnia haageana Regel | X | X | X | 99 (1.1 ±0.1) | N |
| Brassicaceae | |||||
| Brassica nigra (L.) W.D.J. Koch | X | X | X | 105 (1.1 ±0.1) | E |
| Capsella bursa-pastoris (L.) Medik. | X | - | X | 40 (0.4 ±0.1) | E |
| Lepidium virginicum L. | X | - | - | 21 (0.2 ±0.1) | N |
| Raphanus raphanistrum L. | - | X | - | 17 (0.1 ±0.1) | E |
| Convolvulaceae | |||||
| Convolvulus arvensis L. | X | X | X | 35 (0.3 ±0.1) | E |
| Euphorbiaceae | |||||
| Ricinus communis L. | X | - | - | 11 (0.1 ±0.1) | E |
| Lamiaceae | |||||
| Salvia tiliifolia Vahl | X | - | - | 40 (0.4 ±0.1) | N |
| Malvaceae | |||||
| Anoda cristata (L.) Schltdl. | X | X | - | 48 (0.5 ±0.1) | N |
| Onagraceae | |||||
| Oenothera rosea L'Hér. ex Aiton | X | - | - | 14 (0.1 ±0.1) | N |
| Orobanchaceae | |||||
| Castilleja arvensis Schltdl. & Cham. | X | - | - | 51 (0.5 ±0.1) | N |
| Papaveraceae | |||||
| Argemone ochroleuca Sweet | X | - | X | 11 (0.1 ±0.1) | N |
| Polygonaceae | |||||
| Rumex longifolius DC. | X | X | X | 44 (0.5 ±0.1) | E |
| Portulacaceae | |||||
| Portulaca oleracea L. | X | X | X | 136 (1.5 ±0.1) | N |
| Primulaceae | |||||
| Lysimachia arvensis subsp. Arvensis | X | - | - | 61 (0.6 ±0.2) | E |
| Solanaceae | |||||
| Calibrachoa parviflora (Juss.) W.G. D’Arcy | X | X | X | 89 (1.0 ±0.1) | N |
| Physalis nicandroides Schltdl. | X | - | - | 7 (0.07 ±0.1) | N |
Tabla 2 Cantidad de especies arvenses nativas y exóticas por familia taxonómica.
| Familias | Arvenses Nativas | Arvenses Exóticas |
|---|---|---|
| Aizoaceae | 1 | - |
| Amaranthaceae | 1 | - |
| Asteraceae | 6 | 4 |
| Brassicaceae | 1 | 3 |
| Convolvulaceae | - | 1 |
| Euphorbiaceae | - | 1 |
| Lamiaceae | 1 | - |
| Malvaceae | 1 | - |
| Onagraceae | 1 | - |
| Orobanchaceae | 1 | - |
| Papaveraceae | 1 | - |
| Polygonaceae | - | 1 |
| Portulacaceae | 1 | - |
| Primulaceae | - | 1 |
| Solanaceae | 2 | - |
El resultado de la prueba de Mann-Whitney encontró diferencias significativas en la abundancia entre plantas nativas y exóticas (U= 361, p= 0.02), siendo las primeras más abundantes (Mediana ± Desviación Intercuartil = 36.9 ±21.6) con respecto a las arvenses exóticas (12.6 ±15.5). También hubo diferencias significativas en el índice de diversidad de Shannon (t0.5(2)1137.8 = 7.28, p < 0.0001) entre nativas (H’= 2.44) y exóticas (H’= 2.18). Sin embargo, la igualdad fue menor para las especies de arvenses nativas (J’= 0.72) que en las exóticas (J’= 0.82). La alta abundancia de P. hysterophorus puede ser la respuesta a este resultado (Fig. 2).
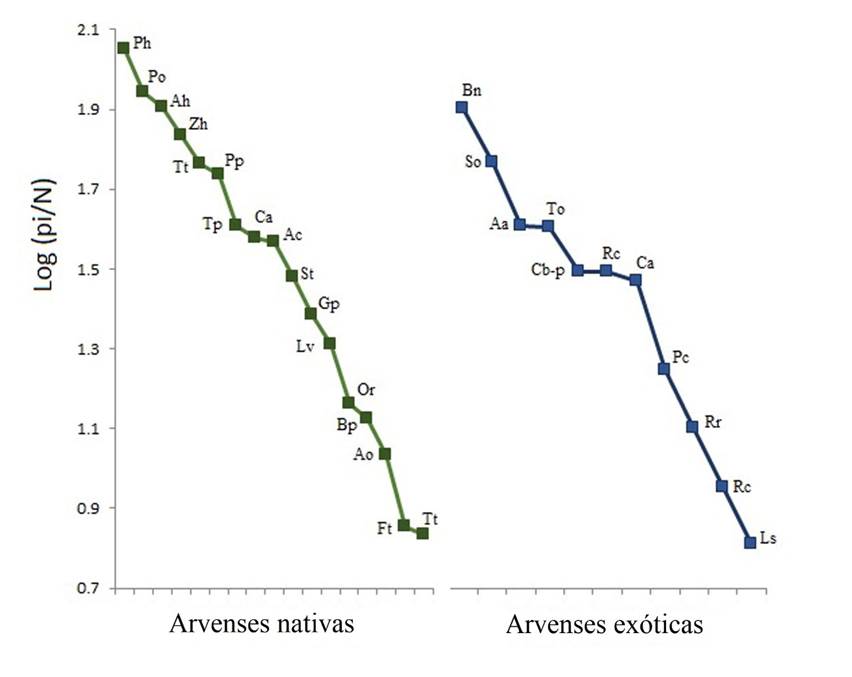
Fig. 2 Curvas de Rango-Abundancia ordenadas de mayor a menor abundancia. Las letras representan el nombre científico de las especies enlistadas en la Tabla 1.
Riqueza y diversidad de plantas arvenses por cultivo
Se encontró la mayor riqueza de especies en mz (S= 26), mientras que tg y sg tuvieron 14 y 13 especies respectivamente. Las curvas de acumulación máxima de especies indican que se obtuvo la mayor cantidad de especies en mz y tg. Pero en sg no se logró llegar a la asíntota en la curva, lo que sugiere incrementar el esfuerzo de muestreo (Fig. 3).
De acuerdo con el resultado de t-Hutcheson, mz tuvo la mayor diversidad de plantas arvenses (mz-tg: t0.05(2)845.2= 12.48, p<0.0001; mz-sg: t0.05(2)139.07= 9.66, p<0.0001) y sg el valor más bajo de diversidad (tg-sg: t0.05(2)150.7= 3.96, p<0.001). El valor de la dominancia fue bajo en mz y más grande en sg, en contraste el valor de igualdad fue alto en mz y bajo en sg (Tabla 3).
Tabla 3 Dominancia (1/λ), igualdad (J’) y diversidad (H’) arvenses en: mz= maíz, tg= trigo, sg= sorgo);
| mz | tg | sg | mzN | tgN | sgN | mzE | tgE | sgE | |
|---|---|---|---|---|---|---|---|---|---|
| 1/λ | 0.067 | 0.093 | 0.14 | 0.10 | 0.16 | 0.21 | 0.15 | 0.21 | 0.28 |
| J’ | 0.90 | 0.94 | 0.84 | 0.88 | 0.92 | 0.92 | 0.88 | 0.92 | 0.81 |
| H’ | 2.94 | 2.48 | 2.16 | 2.51 | 1.91 | 1.65 | 1.94 | 1.65 | 1.45 |
La mayor proporción de riqueza de especies nativas y exóticas se encontró en mz (60.7 %, S= 17 y 32.1 %, S= 9 respectivamente), mientras que tg and sg tuvieron proporciones similares: 28.5 % (S = 8) para nativas, 21.4 % (S = 6) para exóticas y 25 % (S = 7) y 21.4 % (S = 6), respectivamente. Mz tuvo la mayor diversidad de arvenses nativas (mz-tg: t0.05(2)453.9= 12.87, p<0.0001; mz-sg: t0.05(2)282.35= 16.72, p<0.0001) y sg presentó la menor diversidad (sg-tg: t0.05(2)282.35= 4.58, p<0.0001). Con respecto a la diversidad de arvenses exóticas, la comparación encontró a mz como el más diverso (mz-tg: t0.05(2)325.46= 5.30, p<0.0001; mz-sg: t0.05(2)32.17= 3.26, p= 0.002), mientras que tg y sg no tuvieron diferencias significativas en su diversidad. La dominancia de plantas arvenses exóticas fue mayor que en especies nativas, en este caso la igualdad fue muy similar entre cultivos (Tabla 3).
Composición de las poblaciones de plantas arvenses
Se registró un total de 1537 plantas, el 69.1% se encontraron en maíz, 23.3% en trigo y 7.6% en sorgo. Los resultados de Kruskall-Wallis mostraron diferencias significativas en la mediana de plantas obtenidas por cultivo (χ2 (0.05)2=26.27, p<0.0001). Maíz tuvo la mayor abundancia de arvenses (n= 1063, mediana = 0.90, Desviación Intercuartil = ±0.03). La prueba de rangos no mostró diferencias entre tg (n= 356, 0.36 ±0.05) y sg (n= 118, 0.38 ±0.10).
La mayor abundancia tanto de nativas como de exóticas fue registrada en mz (72.4% y 61.5% respectivamente); después tg (nativa = 19.2% exótica = 32.1%) y finalmente sg (nativa = 8.2% exótica = 6.2%). El resultado de la comparación mostró una diferencia estadística en cuanto a la abundancia de arvenses nativas (χ2 (0.05)2=24.27, p<0.0001), la prueba de rangos sugirió una clara separación de mz y los otros cultivos (30.2 ±24.0), y no detectó diferencia entre tg y sg (16.7 ±14.5 y 7.5 ±5.4, respectivamente). Tomando en cuenta a las arvenses exóticas, las diferencias fueron constantes en los datos (χ2 (0.05)2=7.34, p<0.0218), de nuevo mz tuvo la mayor abundancia (29.6 ±30.5) y sg la más baja (2.1 ±4.3).
Las especies no fueron igualmente abundantes entre los cultivos, por ejemplo P. hysterophorus (n=178, prom.= 4.2 E.E.= ±0.27), P. oleracea (n= 81, 1.9 ±0.17) y A. hybridus (n= 70, 1.6 ±0.19) fueron las arvenses nativas más abundantes en mz, mientras que las arvenses exóticas más abundantes en este mismo cultivo fueron: Lysimachia arvensis subsp. arvensis (n= 61, 1.4 ±0.31), B. nigra (n= 51, 1.2 ±0.18) y Sonchus oleraceus L. (n= 51, 1.2 ±0.17). En tg las arvenses nativas más abundantes fueron: T. tubaeformis (n= 49, 1.4 ±0.41), P. oleracea (n= 40, 1.1 ±0.23) y A. hybridus (n= 37, 1.0 ±0.24), y las exóticas: B. nigra (n= 51, 1.5 ±0.17), Convolvulus arvensis L. (n= 29, 0.8 ±0.2) y Helminthotheca echioides L. (n= 27, 0.7 ±0.27). En sg, la arvense nativa P. hysterophorus fue la más abundante (n = 34, 3.0 ±0.56), y dos arvenses exóticas: Rumex crispus L. (n= 11, 1.0 ±0.61) y S. oleraceus (n= 10, 0.9 ±0.38).
El resultado del AD indicó diferencias entre las comunidades de arvenses, con el 83.5% de la varianza explicada el primer eje separó a los tres cultivos. Los centroides para este eje mostraron un valor positivo para mz (2.38) y negativo para tg (-2.74) y sg (-1.41), lo que indica una clara diferencia en la composición de especies de arvenses entre los cultivos. De acuerdo con las variables estandarizadas en las funciones discriminantes, cuatro arvenses fueron importantes en el primer eje canónico, tres de éstas fueron arvenses nativas: Bidens pilosa L., Salvia tiliifolia Vahl. y C. arvensis, así como una arvense exótica: Taraxacum officinale F.H. Wigg. El error medio aparente de la ordenación fue de 6.1% (Fig. 4).
Discusión
A pesar de la proximidad entre cultivos la abundancia, la riqueza y la diversidad de plantas arvenses fue diferente. Esto resalta la importancia de la heterogeneidad que es promovida por factores relacionados con el manejo tales como el tipo de cultivo, rotaciones y labores culturales, entre otros (Roschewitz, Gabriel, Tscharntke, & Thies, 2005; Blanco & Leyva, 2010). Estos factores no sólo afectan la presencia y la abundancia de plantas arvenses, sino que también influyen en la composición de las comunidades, la igualdad y la diversidad (Mhlanga et al., 2015). Nowak et al. (2015) mencionan que las prácticas agrícolas están íntimamente relacionadas con la composición de especies arvenses. Esto puede ser observado en las curvas de Rango Abundancia y en el resultado del AD, en ambos resultados se muestra una composición distinta de las comunidades de arvenses. Además, el valor de la dominancia fue mayor en sg, intermedio en tg y bajo en mz, lo que se refleja a su vez en los valores de igualdad, en este caso fueron similares entre tg y mz, pero bajo en sg. El valor bajo de la igualdad observada en sg, se asoció con un índice bajo de diversidad.
Sobresale el resultado de la diversidad observada en mz, en este cultivo se encontraron la mayor riqueza, abundancia y diversidad de arvenses en comparación con tg y sg. Incluso los valores de la riqueza de especies de arvenses de mz, comparados con otros reportes, sugieren niveles similares o al menos dentro del rango de la riqueza de especies observada en otros agroecosistemas. Por ejemplo, la riqueza a nivel de parcelas en campos de maíz del Lago de Cuitzeo, Michoacán, osciló entre 16 y 17 especies durante un periodo de muestreo de dos meses: octubre y noviembre (Sánchez-Blanco & Guevara-Féfer, 2013); Silva-Aparicio y otros (2003) reportaron 28 especies de arvenses en campos de maíz de temporal en muestreos realizados de mayo a septiembre. En contraste, en cultivos tradicionales como el sistema milpa (Albino-García, Cervantes, López, Ríos-Casanova & Riva, 2011), monitoreando durante 12 meses encontraron 40 especies de plantas arvenses en un área semi-árida de Tehuacán-Cuicatlán, Puebla y Rivera-Ramírez et al. (2021) reportaron 42 especies en muestreos que ocurrieron de junio a noviembre. Con respecto a estos últimos casos, donde la agricultura tradicional a través de los policultivos y manejos culturales promueve una mayor riqueza de especies, es notable que el uso de herbicidas en la agricultura intensiva, como el objeto del presente estudio, ha ejercicio su función deletérea sobre la riqueza de plantas arvenses.
No obstante, se observa un patrón interesante en el valor del índice de diversidad obtenido en el cultivo mz (H’ = 2.94), pues fue mayor al promedio de los registros de Albino-García, Cervantes, López, Ríos-Casanova & Riva (2011) en 11 campos de maíz en sistema milpa (H’ = 1.4); lo mismo ocurre cuando se compara el resultado de mz con el trabajo de Rivera-Ramírez et al. (2021) llevado a cabo en dos parcelas de sistema milpa y en dos de cultivos de maíz tecnificado, aquí la diversidad promedio de todo el estudio fue de H’ = 2.0. Para tg también se obtuvo una diversidad mayor (H’= 2.48) a la encontrada en otros estudios donde se han manejado distintos tipos de labranza para el control de arvenses en trigo; por ejemplo, Woźniak (2018) encontró diversidades de H’ = 0.81 a1.07, sólo para sg el valor de diversidad fue menor a otros reportes de arvenses en sorgo (Giancotti et al., 2017). Inclusive la diversidad arvense promedio de todo el trabajo presentado aquí (H’= 2.52), es mayor a los valores promedio de estudios hechos en otras partes del mundo; Godoy et al. (1995) encontraron una diversidad de H’= 2.46 en parcelas de maíz intercalado con frijol en un estudio de monitoreo de tres años en el Valle del Yeguare, Honduras; Légère et al. (2005), en un estudio de tres años bajo condiciones experimentales de labranza de un cultivo de Cebada en Quebec, Canadá, encontraron una diversidad de H’ = 2.0; en China se monitoreó la diversidad de arvenses (H’ = 0.44) en cultivos sujetos a condiciones distintas de fertilización (Yin, Cai & Zhong, 2006); y en localidades del norte de España en parcelas manejadas orgánicamente la diversidad fue de H = 2.0 (Armengot, José-María, Chamorro & Sans, 2013).
La comparación de los resultados de este estudio con aquellos provenientes de sistemas de cultivo con menor uso de insumos agroquímicos hace posible diferir de la idea que el control químico contra plantas arvenses es capaz de disminuir la diversidad vegetal (Légère, Stevenson & Benoit, 2005), de hecho el uso de herbicidas en los cultivos aquí estudiados puede ser poco efectivo para el control de las arvenses, pues la diversidad es alta en comparación con reportes donde se ha evaluado el efecto de los herbicidas sobre la diversidad, Mayerová et al. (2018) encontraron valores de diversidad de H’ = 1.61-1.90, donde se evaluó la eficiencia de diferentes herbicidas selectivos. Todo lo anterior sugiere que no necesariamente los sistemas de cultivo tradicional como las milpas o aquellos manejados con un enfoque orgánico, son capaces de albergar una alta diversidad de plantas arvenses. Entonces, además del manejo como la labranza, la fertilización, el tipo de cultivo y la aplicación de herbicidas, otros factores como los centros de origen de las especies cultivadas y la posición biogeográfica, pueden estar involucrados en la diversidad de la vegetación arvense. Fried et al. (2019) encontraron una influencia importante de la estacionalidad y de las variaciones a nivel regional (suelo, pH, entre otros), sobre la determinación de la composición de las comunidades de plantas arvenses.
En los cultivos estudiados la alta proporción de arvenses nativas, su abundancia, riqueza de especies y su diversidad, parecen indicar que aún son un componente importante del ambiente. Es notable en mz la baja cantidad de arvenses exóticas, la baja cantidad de especies muestra que la diversidad local es importante para la producción (Fernández & Marasas, 2015). Además, se ha sugerido que altos niveles de diversidad y de riqueza de especies hacen a los ecosistemas naturales más resilientes contra especies invasoras; esto puede estar ocurriendo en ecosistemas antropizados como las tierras de cultivo, donde han sido reconocidos distintos servicios ofrecidos por la diversidad al agroecosistema (Thrupp, 2000; Storkey & Neve, 2018). La notable proporción de especies nativas en la flora arvense de los cultivos estudiados incrementa la importancia ecológica de este grupo de plantas para los cultivos en principio, a través de la polinización (Hernández-Villa, Vibrans, Uscanga-Mortera & Aguirre-Jaimes, 2020), por lo que los beneficios potenciales que esta diversidad proporciona a la agricultura intensiva pueden ser aún mayores.
La composición de arvenses en los monocultivos fue diferente, esto indica que las especies pueden responder a condiciones microclimáticas modificadas por el manejo de los cultivos. Esta respuesta es importante en las plantas arvenses, porque se ven afectadas a escala local del paisaje y por pequeños cambios espaciales en la heterogeneidad ambiental (Gaba, Chauvel, Dessaint, Bretagnoelle, & Petit, 2010), dichos factores hacen que la composición de comunidades de plantas sea diferente, con la presencia de distintas especies y su abundancia. En este sentido algunas especies fueron específicas a un cultivo en particular, por ejemplo C. arvensis y Calibrachoa parviflora (Juss.) W.G. D’Arcy tuvieron afinidad en tg y sg respectivamente. Convolvulus arvensis es reconocida como una planta competidora con el cultivo de trigo y capaz de modificar su estructura morfológica y reproductiva dependiendo del estrés ambiental (Gianoli, 2004); mientras que C. parviflora aunque no hay información sobre su papel como maleza en cultivos, Sierra-Muñoz; Siqueiros-Delgado et al. (2015) la describen como una planta de vegetación secundaria y sensible al fuego. Otras especies interesantes fueron Flaveria trinervata (Spreng.) C. Mohr reportada en varios tipos de ambientes naturales (González, Giménez de, García & Aguirre-Rivera, 2007); T. officinale como bioindicador de alta fertilidad (Carlesi & Bàrberi, 2017) o Physalis nicandroides Schltdl., como una especie con potencial de ser un cultivo alternativo (Singh et al., 2014), todas estas especies se establecieron en mz.
Aunque las plantas arvenses no son deseables para los productores, hay evidencia sobre la importancia de la biodiversidad de este grupo vegetal y de los beneficios que proporcionan estas plantas a los agroecosistemas (Storkey & Neve, 2018). Fernández et al. (2001) encontraron que P. hysterophorus es un hospedero recurrente para himenópteros, coleópteros y dípteros, que incluyen polinizadores, depredadores y parasitoides, también se ha encontrado que esta especie puede mejorar las propiedades químicas del suelo al incrementar el contenido de materia orgánica (Etana, Kelbessa, & Soromessa, 2015). Brassica nigra es otra arvense interesante pues tiene una influencia notable sobre las preferencias de ovoposición de insectos plaga y sobre la abundancia de parasitoides (Kaasik et al., 2014). Desde el punto de vista cultural, se pueden encontrar otros aspectos positivos de esta arvense en medicina, nutrición y forraje. En África, A. hybridus está siendo considerada un cultivo prometedor debido a su resistencia a la sequía, a las plagas y a las enfermedades y sobre todo por su gran valor nutricional y de forraje (Achigan-Dako, Sogbohossou & Maundu, 2014).
A pesar del uso de herbicidas mz es un cultivo interesante porque promueve la presencia de muchas especies de plantas arvenses, incrementando así su biodiversidad y permitiendo a su vez el mantenimiento de interacciones ecológicas muchas de ellas importantes para la producción. Considerando que las plantas arvenses también tienen una importancia ecológica, económica y cultural, la diversidad de estas plantas en cultivos de maíz puede tener implicaciones no solamente ecológicas, sino también culturales, por lo que los estudios sobre manejo, control y funcionalidad ecológica de plantas arvenses deben propiciarse a través aproximaciones transdisciplinares como la agroceoclogía a que den información completa a los gestores de manejo y planes de desarrollo rural.
Conclusiones
Los cultivos estudiados poseen una riqueza de 28 plantas arvenses con una diversidad de H’= 2.94 para mz y H’ = 2.52 promedio general de todo el estudio, que puede ser considerada alta cuando se compara con valores encontrados en otros estudios en agroecosistemas en diferentes partes del mundo. La alta proporción de especies nativas (60.7%) con respecto a las exóticas sugiere que la diversidad arvense aún es un elemento importante asociado a la producción agrícola de la zona a pesar del control con herbicidas al que han estado sujetas las plantas arvenses. Dado que muchas de estas plantas representan recursos naturales que ofrecen beneficios a los agroecosistemas y que su abundancia y diversidad responde a múltiples factores, su estudio debe fundamentarse en una visión que integre distintas disciplinas científicas en un marco de desarrollo agroecológico, que permitan perspectivas multi y transdisciplinarias, que ayuden a disminuir la dependencia en el uso de herbicidas en sistemas de agricultura intensiva como la del Bajío Guanajuatense.











 nova página do texto(beta)
nova página do texto(beta)




