Introducción
El género Phaseolus es originario de América y pertenece a la familia Leguminosae (Fabaceae), sub-familia Papilionoideae y tribu Phaseoleae. El género Phaseolus es monofilético y comprende 81 especies y, alrededor de 30 taxa infra específicos, conforman ocho grupos filogenéticos dentro de dos clados (Debouck, 2021; Delgado-Salinas et al., 2006; Dohle et al., 2019; Freytag & Debouck, 2002; Ramírez-Villegas et al., 2010). Cinco especies se han domesticado: Phaseolus vulgaris L., P. lunatus L., P. coccineus L., P. acutifolius A. Gray y P. polyanthus Greenman [sin. P. dumosus] y dicho proceso ocurrió en distintos eventos prehistóricos y en diversas áreas geográficas de América (Hernández-López et al., 2013).
En el territorio mexicano las especies endémicas del género Phaseolus representan un recurso genético importante. De las especies descritas (Debouck, 2021; Freytag & Debouck, 2002) al menos 31 son endémicas de México, lo que lo convierte en el país con la mayor biodiversidad del género (Debouck, 2021). Sin embargo, la mayor parte de los estudios relacionados con Phaseolus, así como las colecciones de recursos fitogenéticos del mismo se han centrado principalmente en P. vulgaris y, en menor medida, en el resto de las especies domesticadas del género: P. lunatus, P. coccineus, P. acutifolius y P. polyanthus (Dohle et al., 2019).
El marcado interés en P. vulgaris se entiende si consideramos que el frijol común, por su alto valor nutricional y otras cualidades, es una de las leguminosas de mayor cultivo, distribución y consumo en México y otros países de Latinoamérica y África, principalmente. A pesar de que se le atribuye una importancia creciente al estudio de las especies silvestres como reservorio potencial de rasgos y fenotipos valiosos con fines de mejoramiento genético (Acosta-Gallegos et al., 2007), existen pocos estudios sobre la genética de las especies silvestres de Phaseolus.
El estudio de 70 especies de Phaseolus con base en ITS/5.8 S de DNA y los loci trnK y matK del cpDNA indicó que Phaseolus es un género monofilético con dos clados principales que luego se ramifican en ocho clados con todas las especies excepto cinco ‘enigmáticas’ (P. glabellus, P. macrolepis, P. microcarpus, P. oaxacanus y P. talamancensis) o ‘incertae sedis’. Los ocho clados muestran rasgos morfológicos, ecológicos y biogeográficos distintivos (Delgado-Salinas et al., 2006). La edad del clado troncal de Phaseolus es de 6 a 8 millones de años y la diversificación de los ocho clados ocurrió hace 1 - 2 millones de años, después que cesó la actividad tectónica en la Cordillera Volcánica Trans mexicana (Alva-Valdivia et al., 2000). Entre los ocho clados de Phaseolus, el grupo más ancestral es vulgaris con cerca de cuatro millones de años de antigüedad, mientras que el más derivado incluye a filiformis, pedicellatus y polystachios con ≈ 1 millón de años (Delgado-Salinas et al., 2006). Por su parte, Servin y Márquez-Ortiz (2007) identificaron nueve subclados al analizar la filogenia de diversas especies de Phaseolus, y coincidieron en señalar cuatro especies sin resolverse (P. glabellus, P. macrolepsis, P. microcarpus y P. oaxacanus) como lo reportaron Delgado-Salinas et al. (2006).
El conocimiento detallado de las relaciones filogenéticas de Phaseolus es esencial en el entendimiento del origen y diversificación genética (Smýkal et al., 2015), así como para su conservación, aprovechamiento y su mejoramiento genético (López Soto et al., 2005; Meza-Vázquez et al., 2015). Este trabajo se llevó a cabo para analizar las relaciones filogenéticas de especies de Phaseolus de México con base en marcadores moleculares de ADN cloroplástico.
Materiales y métodos
Muestreo y extracción del ADN
Se trabajó con semillas de 34 accesiones representando 19 especies de Phaseolus, incluyendo dos subespecies de P. coccineus, colectadas en diferentes sitios de México (Tabla 1). Las especies en estudio, salvo P. albiviolaceus, P. maculatifolius y P. rotundatus, se incluyeron en la filogenia disponible del género (Delgado-Salinas et al., 2006), para poder comparar mejor el trabajo realizado aquí. Las semillas de cada accesión se escarificaron con un bisturí para romper la testa y facilitar la germinación (Lépiz-Ildefonso et al., 2010), luego se sembraron en una mezcla de tierra de campo, turba y perlita (1:1:1 peso: peso: peso) (Lépiz-Ildefonso et al., 2010) . Las muestras de tejido se tomaron de trifolios jóvenes completamente expandidos y los mismos se lavaron con agua estéril. Las muestras se conservaron a -70° C hasta su uso. Para el aislamiento del ADN genómico se utilizaron diferentes métodos: Wizard Genomic de Promega® (Madison, EUA); DNeasy Plant Mini Kit de Qiagen® (Hilden, Alemania) y CTAB (Cota-Sánchez et al., 2006), recomendado para especímenes de herbario y tejidos mucilaginosos. Las muestras obtenidas se re-suspendieron en TE a 0.1X de concentración y se almacenaron a -20 °C hasta su uso y la visualización y cuantificación se realizó mediante electroforesis en gel de agarosa al 1%, utilizando como referencia al DNA del fago λ (Invitrogen) y el sistema ‘Molecular Imager Gel Doc XR’ marca Bio-Rad® (Hercules, EUA). Las muestras de DNA se diluyeron a una concentración de 20 ng μL-1.
Tabla 1 Accesiones y especies del género Phaseolus seleccionadas para realizar el análisis filogenético.
| Especie | Origen | Latitud Norte |
Longitud Oeste |
Altitud (m s.n.m.) |
|---|---|---|---|---|
| P. acutifolius | Morelos | 19.01 | 98.99 | 2090 |
| P. acutifolius | Chihuahua | 27.01 | 107.74 | 591 |
| P. acutifolius | Durango | 24.0287 | 104.69 | 1890 |
| P. coccineus griseus | Jalisco | 20.55 | 102.51 | 1902 |
| P. coccineus striatus | Desconocido | |||
| P. esperanzae Seaton | Puebla | 18.86 | 97.37 | 2470 |
| P. filiformis | Baja California Sur | 24.96 | 111.88 | 17 |
| P. filiformis | Durango | 24.86 | 103.69 | 1648 |
| P. filiformis | Coahuila | 25.52 | 103.46 | 1131 |
| P. glabellus | Tamaulipas | 23.03 | 99.15 | 751 |
| P. glabellus | San Luis Potosí | 21.26 | 98.79 | 1153 |
| P. leptostachyus Benth | Veracruz | 20.54 | 98.48 | 2152 |
| P. lunatus silvestre | Campeche | 18.66 | 90.37 | 131 |
| P. maculatus | Coahuila | 26.99 | 102.06 | 726 |
| P. maculatus | Puebla | 19.18 | 97.99 | 3259 |
| P. microcarpus | Durango | 25.18 | 104.56 | 1350 |
| P. pedicellatus Benth | Hidalgo | 20.16 | 98.20 | 2208 |
| P. pluriflorus | Veracruz | 20.54 | 98.48 | 2152 |
| P. zimapanensis Delgado | Tamaulipas | 23.61 | 99.22 | 620 |
| P. zimapanensis Delgado | Hidalgo | 20.74 | 99.38 | 2478 |
| P. macvaughii | Guerrero | 17.64 | 101.55 | 25 |
| P. vulgaris | Morelos | 18.73 | 99.34 | 980 |
| P. vulgaris | Jalisco | 20.09 | 103.86 | 1700 |
| P. oligospermus Piper | Chiapas | 16.83 | 93.09 | 1175 |
| P. gladiolatus Freytag y Debouck | San Luis Potosí | 22.67 | 100.42 | 2100 |
| P. maculatifolius Freytag y Debouck | Nuevo León | 23.97 | 99.77 | 1960 |
| P. albiviolaceus Freytag y Debouck | Tamaulipas | 22.60 | 99.03 | 900 |
| P. leptostachyus Benth | Jalisco | 19.68 | 103.60 | 2200 |
| P. zimapanensis Delgado | Hidalgo | 20.74 | 99.38 | 1800 |
| P. lunatus silvestre | Veracruz | 20.45 | 97.38 | 149 |
| P. rotundatus Freytag y Debouck | Oaxaca | 17.46 | 97.26 | 2140 |
| P. lunatus silvestre | Tamaulipas | 22.40 | 97.93 | 20 |
| P. rotundatus Freytag & Debouck | Jalisco | 20.87 | 102.79 | 1990 |
| P. glabellus Piper | Veracruz | 19.56 | 96.93 | 1500 |
Análisis de ADN cloroplástico
La selección de las regiones de ADN cloroplástico a amplificar por PCR se basó en Chacón et al. (2007) quienes exploraron diez regiones no codificantes de ADN de cloroplasto (ADNc) incluyendo varios espaciadores inter génicos e intrones principalmente de la región grande de copia única (Tabla 2). Los oligonucleótidos se diluyeron a 10 μM en TE 1X. Los ensayos de PCR se llevaron a cabo en un termociclador Bio-Rad iCycler de 96 pocillos para tubos Eppendorf de 0.2 mL utilizando la siguiente mezcla de reacción: 1.0 μL de DNA genómico (20 ng), 2.0 μL de cada iniciador (‘Sentido’ y ‘Anti-sentido’) 0.5 μM, 0.8 μL de cada deoxinucleótido (dATP, dCTP, dGTP, dTTP) 0.2 mM, 0.3 μL de Taq DNA polimerasa (1.5 U), 8.0 μL de la solución amortiguadora, 3.2 μL de MgCl 2 mM y agua Milli-Q para un volumen final de 40 μL. Las condiciones de amplificación fueron las siguientes: 1 ciclo inicial de 94 °C por 1 min; 30 ciclos de tres pasos incluyendo desnaturalización a 94 °C por 1 min, acoplamiento a 52 °C por 1 min y extensión a 72 °C por 2 min; y un ciclo de extensión final de 72 °C por 10 min. Para la amplificación del intrón rpl16 la temperatura de extensión se cambió a 65 °C y para el espaciador rps14-psaB la concentración de los dNTPs se optimizó a 0.05 mM, mientras que el número de ciclos de PCR se aumentó de 30 a 45. La purificación de los productos de DNA amplificados se realizó utilizando dos protocolos. Los productos menores a 1000 pb se purificaron con el estuche comercial Wizard© SV Gel and PCR Clean-Up System de Promega® (Madison, EUA). Para el caso de los productos amplificados mayores a 1000 pb se utilizó el protocolo de purificación del estuche comercial ExoSAP-IT® (Cleveland, EUA). Las muestras con DNA obtenidas con ambos protocolos se almacenaron a -20 °C y su cuantificación se llevó a cabo con el protocolo para cuantificar DNA genómico.
Tabla 2 Regiones e iniciadores para amplificación por PCR (Chacón et al., 2005).
| Región de cpDNA | Iniciadores (5'- 3') para PCR |
Sentido | Temperatura de hibridación (°C) |
Tamaño amplificado (bp) |
Referencia |
|---|---|---|---|---|---|
| Espaciador trnT-trnL | CAT TAC AAA TGC GAT GCT CT TCT ACC GAT TTC GCC ATA TC |
Sentido Anti-sentido |
52 | 800 | Taberlet et al. (1991) |
| Intrón trnL | CGA AAT CGG TAG ACG CTA CG GGG GAT AGA GGG ACT TGA AC |
Sentido Anti-sentido |
52 | 630 | Taberlet et al. (1991) |
| Espaciador trnL-trnF | GGT TCA AGT CCC TCT ATC CC ATT TGA ACT GGT GAC ACG AG |
Sentido Anti-sentido |
52 | 530 | Taberlet et al. (1991) |
| Intrón rpl16 | CCA ACA CAT ACA TTC GGA TT GCT CCT CGC GAA TGA AGT AA |
Sentido Anti-sentido |
52 | 1210 | Jordan et al. (1996) Rediseñado por Chacón et al. (2005) |
| Espaciador rpoC1-rpoC2 | GAA GTT CAC TAT GAA TCT TTN GGT ACC TAG ACA TCG GTA CTC CAG TGC |
Sentido Anti-sentido |
52 | 1700 | Asmussen y Liston (1996) |
| Espaciador atpβ-rbcL | GAA GTA GTA GGA TTG ATT CTC TAC AGT TGT CCA TGT ACC AG |
Sentido Anti-sentido |
50 | 950 | Manen et al. (1994) |
| Espaciador rps14-psaB | CAT TTC ACG AAG TAT GTG TCC G TGG CGT GGA TAT TGG CAG GA |
Sentido Anti-sentido |
55 | 600 | Fofana et al. (1997) |
| Región petA-psbE | GCA TCT GTT ATT TTG GCA CA TAC CTT CCC TAT TCA TTG CG |
Sentido Anti-sentido |
53 | 1200 | Fofana et al. (1997) |
| Espaciador accD-psaI | GGA AGT TTG AGC TTT ATG CAA ATG G AGA AGC CAT TGC AAT TGC CGG AAA |
Sentido Anti-sentido |
55 | 700 | Small et al. (1998) |
| Intrón ndhA a | GGW CTT CTY ATG KCR GGA TAT RGM TC CTG YGC TTC MAC TAT ATC AAC TGT AC |
Sentido Anti-sentido |
42 | 1500 | Small et al. (1998) |
Análisis de secuencias
La secuenciación de los productos de la amplificación por PCR se realizó mediante electroforesis capilar por el método dideoxi (Sanger et al., 1977). Aquí se utilizaron los terminadores BigDye® v3.1 en un secuenciador Applied Biosystems modelo 3730xl. Los productos de amplificación (10 μL a 2.0 μM) se secuenciaron a una concentración de 30 a 50 ng μL-1. Las secuencias de los productos de PCR se procesaron en formato fasta, seq y abi. Para el ensamble del par de secuencias generadas para cada producto de PCR se utilizó el programa Sequencher 4.1.4 de Gene Codes (Ann Arbor, EUA). La integración de los ‘contigs’ se facilitó al usar como referencia la secuencia del genoma cloroplástico de P. vulgaris variedad Negro Jamapa (Guo et al., 2007). La edición de las secuencias se realizó con criterios conservadores como el recorte de los extremos de las secuencias que mostraban nivel de calidad en la lectura menor a una puntuación de QV20 en la escala del programa Sequence Scanner 1.0 (Applied Biosystems; Foster City, EUA). En los casos donde hubo discrepancias entre un par de secuencias complementario sólo se consideraron como válidas aquellas bases donde al menos uno de los trazos de los electroferogramas no admitía ambigüedad y podía corroborarse con la secuencia de referencia. Para polarizar la filogenia se incluyó como grupo externo a Vigna radiata, cuyo genoma completo fue publicado previamente (Tangphatsornruang et al., 2010). La monofilia de Phaseolus se determinó previamente (Delgado-Salinas et al., 2006).
Análisis filogenético
El alineamiento de las secuencias se llevó a cabo con el método MUSCLE en el programa MEGA (Edgar, 2004) en 16 iteraciones para cada región. El alineamiento múltiple de las regiones cloroplásticas en matrices individuales se concatenó directamente taxón por taxón (Kupczok et al., 2010). Para determinar los parámetros óptimos para la reconstrucción filogenética de las especies estudiadas primero se realizó un análisis de verosimilitud con el programa jModelTest (Schwarz, 1978) aplicando dos criterios informáticos: el AIC o ‘Akaike Information Criteria’ (Akaike, 1998) y el BIC o ‘Bayesian Information Criteria’. Para la reconstrucción filogenética se utilizaron tres métodos: máxima parsimonia, máxima verosimilitud y análisis Bayesiano de probabilidades posteriores. En el primer caso se generó un árbol filogenético de expansión mínima por el método de parsimonia con ‘DNAPARS’ del paquete PHYLIP v3.52 (Felsenstein, 1993) y el uso del algoritmo NNI (‘nearest neighbor interchange’) a través de la interfase bioinformática del programa Seaview (Gouy et al., 2010). Para el análisis de máxima verosimilitud se utilizó el algoritmo de Guindon & Gascuel (2003) con el programa Seaview. El análisis Bayesiano de probabilidad posterior se realizó con el programa MrBayes versión 3.1.1 (Ronquist & Huelsenbeck, 2003) en la interfase del programa Geneious versión 5.1 (Drummond et al., 2011). En los dos últimos análisis se utilizó el modelo de sustitución nucleotídica GTR (‘General Time Reversible’) y la distribución gamma con cuatro categorías de variación entre sitios recomendadas por el programa jModelTest; el modelo seleccionado generó la menor puntuación BIC (Posada, 2008).
Estimación de tiempos de divergencia
Con el programa BEAST (‘Bayesian Evolutionary Analysis Sampling Trees’) versión 2.3.1 se estimaron la tasa de evolución y los tiempos de divergencia de las ramas en los árboles generados. Con BEAUti (‘Bayesian Evolutionary Analysis Utility’) versión 2.3.1 se convirtieron los alineamientos de secuencias del formato NEXUS al formato XML, propio de BEAST. El modelo de evolución nucleotídica fue el utilizado previamente con jModelTest (Posada, 2008) y que dio el mejor ajuste para el tipo de datos, GTR con una distribución gamma con cuatro categorías y auto estimación de la tasa de sustitución. Luego, se utilizó un Reloj Molecular Relajado (Relaxed Clock Log Normal) donde las tasas de sustitución pueden variar de manera continua a lo largo de cada rama. En el parámetro Árbol (Tree) de la pestaña de probabilidades a priori (Priors) se seleccionó el Modelo Yule, en el cual la tasa de especiación es constante a través del tiempo. Para inferir tiempos absolutos de divergencia se introdujo un punto de calibración como distribución de probabilidad a priori en el nodo del ancestro común más reciente entre P. coccineous y V. radiata, con un valor medio de 8.0 millones de años y un valor sigma de 0.5. Dichos valores se obtuvieron de análisis evolutivos de filogenias de plástidos pertenecientes a la familia Leguminosae (Fabaceae) donde se utilizaron registros fósiles de la era Terciaria como marco de referencia temporal absoluta (Lavin et al., 2005). Con dichos parámetros se realizaron dos corridas independientes y en cada una se generaron 10’000,000 iteraciones MCMC, con un descarte del 20% de las mismas como “burn-in”. Los resultados de BEAST se analizaron con el programa Tracer v1.6 para corroborar el tamaño efectivo de la muestra (ESS) y valorar que los productos posteriores obtenidos fueran superiores a 200. El total de árboles resultantes se combinaron en un solo archivo mediante el programa LogCombiner v2.3.1, de donde se seleccionó el árbol con la credibilidad máxima de 95% usando el programa TreeAnnotator versión 2.3.1.
Resultados
La evaluación preliminar de diez regiones de ADN cloroplástico resultó en la selección de cinco: espaciador trnT-trnL, espaciador trnL-trnF, intrón rpl16, espaciador rpoC1-rpoC2 y espaciador rps14-psaB (Tabla 2). La longitud en pares de bases y el número de sitios idénticos en cada matriz de las cinco regiones cloroplásticas indicó porcentajes de identidad desde 90.8 (espaciador trnT-trnL) hasta 98.9% (rpoC1-rpoC2); con un promedio del 95.2%. La variación observada incluyó tanto polimorfismos puntuales como inserciones y supresiones. La matriz combinada de las cinco regiones fue de 35 x 4475, con 310 sitios informativos (Tabla 3). El análisis de conglomerados por los tres métodos utilizados (máxima parsimonia, máxima verosimilitud y enfoque Bayesiano) produjo árboles filogenéticos con topologías similares y conformados por tres clados. El primero corresponde al grupo externo (V. radiata) y que polariza la filogenia de Phaseolus spp. En el segundo clado se agruparon nueve especies: P. pluriflorus, P. esperanzae (grupo Pauciflorus), P. pedicellatus (grupo Pedicellatus) (subclado 2a), P. microcarpus, P. glabellus (grupo Incertae sedis), P. oligospermus, P. gladiolatus, P. zimapanensis y P. albiviolaceus (grupo Tuerckheimii) (subclado 2b), todas especies silvestres. En el tercer clado se incluyen las diez especies restantes: P. filiformis (grupo Filiformis), P. acutifolius, P. coccineus griseus, P. coccineus striatus, P. vulgaris (grupo Vulgaris) (suclado 3a), P. macvaughii, P. leptostachyus (grupo Leptostachyus), P. lunatus (grupo Lunatus), P. maculatus, P. rotundatus y P. maculatifolius (grupo Polystachios) (subclado 3b); aquí se incluyen las especies domesticadas de Phaseolus representadas (P. acutifolius, P. coccineus, P. vulgaris, P. lunatus) (Figs. 1 a 3).
Tabla 3 Estadísticos descriptivos de los alineamientos múltiples obtenidos con cinco regiones cloroplásticas secuenciadas en 19 especies de Phaseolus. La última fila representa los valores de la concatenación de todas las regiones. En estos datos no se incluyó la secuencia testigo (V. radiata).
| Región | Longitud (pb) |
No. Sitios Idénticos |
Sitios Idénticos (%) |
Identidad por pares (%) |
Contenido de GC (%) |
|---|---|---|---|---|---|
| trnT-trnL | 849 | 572 | 67.37 | 90.8 | 17.9 |
| trnL-trnF | 552 | 401 | 72.64 | 94.1 | 25.0 |
| rpl16 | 822 | 632 | 76.89 | 93.7 | 22.7 |
| rpoC1-rpoC2 | 1643 | 1548 | 94.22 | 98.9 | 36.4 |
| rps14-psaB | 609 | 567 | 93.10 | 98.3 | 37.6 |
| Súper matriz | 4475 | 3720 | 83.13 | 95.2 | 29.1 |
pb = pares de bases, GC = Guanina-Citosina
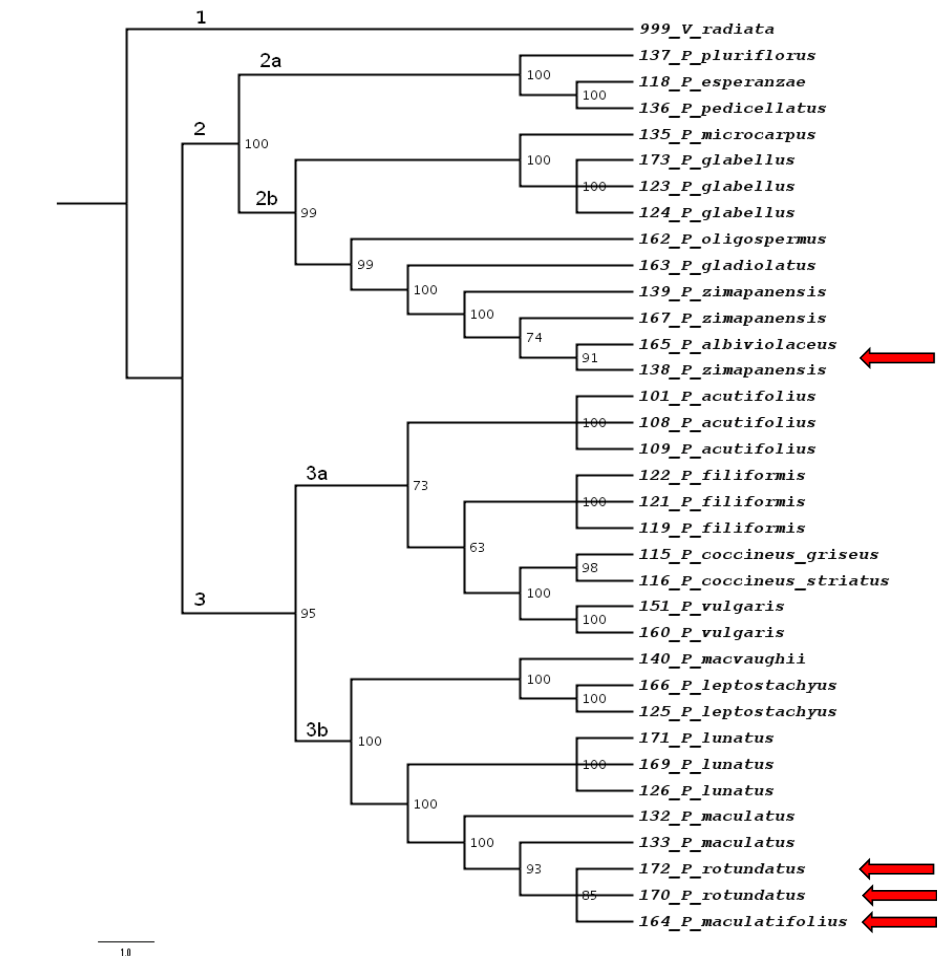
Fig 1 Cladograma de Máxima Parsimonia de 19 especies de Phaseolus de México Los números al lado de los nodos indican los valores del análisis de robustez en porcentaje. Las flechas indican las especies no analizadas anteriormente.

Fig. 2 Dendrograma de Máxima Verosimilitud de 19 especies de Phaseolus de México. Los números al lado de los nodos indican los valores del análisis de robustez en porcentaje. Las flechas indican las especies no analizadas anteriormente.

Fig. 3 Dendrograma Bayesiano de productos posteriores de 19 especies de Phaseolus de México. La probabilidad posterior se muestra en cada nodo donde 1 = 100%. Las flechas indican las especies no analizadas anteriormente.
Los tiempos de divergencia estimados entre especies van desde 7.97 M.a., que corresponden al nodo de calibración donde se unen las especies de Phaseolus con el grupo externo Vigna, hasta los 0.31 M.a. en el caso del ancestro en común más reciente de P. rotundatus y P. maculatifolius. Como es de esperarse, los nodos intraespecies muestran tiempos de divergencia aún menores. El clado ancestral de todas las especies de Phaseolus incluidas en este estudio aparece con una edad de 4.95 M.a. La diversificación de los dos clados principales de Phaseolus, muestra esencialmente la misma edad de 3.8 M.a. El subclado 2a (P. pluriflorus, P. esperanzae, P. pedicellatus) muestra una edad de 2.39 M.a., mientras que el subclado 2b (P. microcarpus, P. glabellus, P. oligospermus, P. gladiolatus, P. zimapanensis y P. albiviolaceus) tiene 2.87 M.a. El subclado 3a (P. filiformis, P. acutifolius, P. coccineus striatus, P. coccineus griseus y P. vulgaris) muestra una edad de 3.26 M.a. y el subclado 3b (P. macvaughii, P. leptostachyus, P. lunatus, P. maculatus, P. maculatifolius y P. rotundatus) tiene 2.68 M.a. La divergencia entre P. albiviolaceus y P. zimapanensis fue de 0.07 M.a.; mientras que entre P. rotundatus y P. maculatifolius fue de 0.31 M.a. La divergencia genética entre P. vulgaris y su más cercana rama monofilética, P. coccineus, ocurrió hace aproximadamente 0.91 M.a. (Fig. 4).
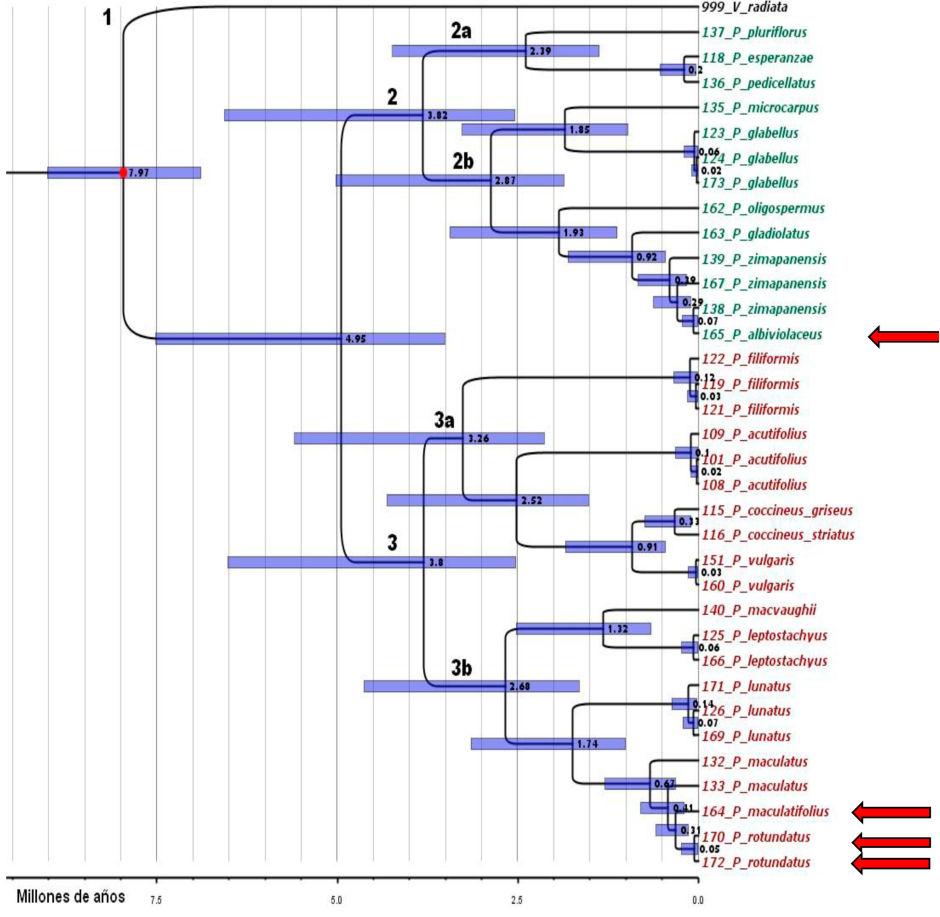
Fig. 4 Tiempos de divergencia entre especies de Phaseolus de México con base en análisis Bayesiano. El punto rojo indica la calibración cronológica a priori de ocho millones de años como constricción mínima. Las barras moradas sobre cada nodo representan los intervalos de credibilidad de 95% que incluyen su edad. Las flechas indican las especies no analizadas anteriormente.
Discusión
En este trabajo se ratificó que el género Phaseolus es un grupo monofilético que se subdivide en dos linajes principales: uno incluye a las especies P. pluriflorus, P. esperanzae, P. pedicellatus, P. microcarpus, P. glabellus, P. oligospermus, P. gladiolatus, P. zimapanensis y P. albiviolaceus y otro a las especies P. filiformis, P. acutifolius, P. vulgaris, P. coccineus, P. macvaughii, P. leptostachyus, P. lunatus, P. maculatus, P. maculatifolius y P. rotundatus. La topología de los subclados estuvo de acuerdo, en general, con la topología para Phaseolus reconocida a la fecha.
Delgado-Salinas et al. (2006) determinaron la filogenia de 70 especies de Phaseolus mientras que aquí se analizaron 19 especies y dos subespecies de Phaseolus colectadas durante 2009 y 2010, Delgado-Salinas et al. (1999) combinaron marcadores moleculares de origen nuclear (ITS) así como de origen cloroplástico; aquí se usaron marcadores cloroplásticos. Nuestros resultados coinciden con Delgado-Salinas et al. (2006) en cuanto a la conformación de los clados y subclados; así como en los valores de soporte, cuando se consideran datos de loci cloroplásticos. En nuestro caso, los tres métodos de análisis estadístico produjeron árboles filogenéticos con topologías similares y con altos niveles de robustez estadística. Con máxima parsimonia, se observa el 85% de los nodos con valores de soporte mayores al 90%; mientras que con máxima verosimilitud y enfoque Bayesiano los valores fueron del 81 y 96%, respectivamente.
De las 19 especies aquí incluidas hay tres que no se incluyen en estudios previos de taxonomía de Phaseolus basada en caracteres moleculares: P. albiviolaceus, P. maculatifolius y P. rotundatus. La filogenia derivada de las cinco regiones cloroplásticas concuerda con el agrupamiento global de Phaseolus spp. de Delgado-Salinas et al. (1999), indicando que el género es monofilético y que se ramifica en dos grandes linajes o clados. Delgado-Salinas et al., (1999) reportan que los dos linajes principales se ramifican a su vez en ocho subclados específicos con valores de soporte mayores a 95%; mientras que Servin L E y Márquez-Ortiz Y. (2007) reportan nueve sub-clados con algunas especies que no lograron resolverse.
El primer clado principal incluye los grupos Pauciflorus, Pedicellatus y Tuerckheimii; el segundo a Filiformis, Vulgaris, Leptostachyus, Lunatus y Polystachios. Las especies aquí incluidas también se agruparon dentro de los clados y sub-clados descritos por Delgado-Salinas et al. (2006). P. pluriflorus aparece como un taxón terminal independiente, porque es la única especie representada del grupo Pauciflorus. Sin embargo, el taxón de P. pluriflorus se asocia estrechamente con el nodo inter-específico que une a los grupos Pauciflorus y Pedicellatus (Delgado-Salinas et al., 1999). En este trabajo, tanto P. maculatifolius como P. rotundatus aparecen junto con P. maculatus en el grupo Polystachios dentro del segundo clado principal, como lo indicó la clasificación morfológica de Freytag & Debouck (2002). Además, el grupo que aparece no resuelto en la filogenia de Delgado-Salinas et al. (2006) e Incertae sedis en este estudio se presenta invariablemente como un sub-clado distinto. El primer clado incluyó especies silvestres exclusivamente, mientras que el segundo clado incluyó a las especies domesticadas de Phaseolus (Freytag & Debouck, 2002; Delgado-Salinas et al., 2006; Debouck, 2021) se observa una distribución parcialmente diferenciada entre clados de las especies de acuerdo con su adaptación climática, tanto a climas semicálidos o templados de México (Cerda-Hurtado et al., 2018).
La especie P. rotundatus, endémica del occidente de México, se considera en peligro de extinción y las pocas poblaciones conocidas a la fecha se localizan en áreas naturales no protegidas como Tepatitlán de Morelos, Jalisco (Salcedo et al., 2009). La colecta de los especímenes de esta y otras especies fue difícil debido principalmente a la expansión creciente de los asentamientos humanos y la consiguiente afectación de los hábitats naturales de las especies silvestres de Phaseolus (Acosta-Diaz et al., 2015; Baez-González et al., 2019). Las especies de Phaseolus agrupadas en el segundo clado de los árboles filogenéticos corresponden, en general, a sitios geográficos de recolección ubicados hacia el Este de México.
La especie P. albiviolaceus aparece en el grupo Tuerckheimii y no en Pedicellatus, como se diagnosticó morfológicamente (Freytag & Debouck, 2002). En este estudio se ubica a P. glabellus Piper en el clado Incerta Sedis, lo mismo que Delgado-Salinas et al. (2006) y fuera de la sección Coccinei (Freytag & Debouck, 2002) fuera del grupo Pedicellatus, en donde alguna vez se incluyó con base en su morfología por Delgado-Salinas et al. (1999).
El clado ancestral de las especies de Phaseolus estudiadas mostró una edad de 4.95 M.a. y la diversificación de los dos clados principales exhibió edad similar (3.8 M.a), la edad menor (0.31 M.a.) se observó en el ancestro en común de P. rotundatus y P. maculatifolius. El subclado 2a (P. pluriflorus, P. esperanzae, P. pedicellatus) tuvo una edad de 2.39 M.a. y el subclado 2b (P. microcarpus, P. glabellus, P. oligospermus, P. gladiolatus, P. zimapanensis y P. albiviolaceus) tiene 2.87 M.a. El subclado 3a (P. filiformis, P. acutifolius, P. coccineus striatus, P. coccineus griseus y P. vulgaris) muestra una edad de 3.26 M.a. y el subclado 3b (P. macvaughii, P. leptostachyus, P. lunatus, P. maculatus, P. maculatifolius y P. rotundatus) tiene 2.68 M.a. Las edades aquí calculadas son similares a las descritas previamente (Delgado-Salinas et al., 2006). Respecto a las especies no estudiadas antes, se determinó que la divergencia entre P. albiviolaceus y P. zimapanensis fue de 0.07 M.a.; mientras que entre P. rotundatus y P. maculatifolius fue de 0.31 M.a.
Estudios a futuro deben contemplar las especies ya conocidas y las que se identifiquen como nuevas a partir de colectas recientes y amplias de germoplasma (Debouck, 2021), de modo que se puedan resolver las inconsistencias e incertidumbres con respecto a la clasificación filogenética de las especies del género Phaseolus, considerando las tasas evolutivas rápidas en el género (Delgado-Salinas et al., 2006).
Conclusiones
El género Phaseolus es un grupo monofilético que se subdivide en dos linajes principales: uno incluye P. pluriflorus, P. esperanzae, P. pedicellatus, P. microcarpus, P. glabellus, P. oligospermus, P. gladiolatus, P. zimapanensis y P. albiviolaceus; y otro a P. filiformis, P. acutifolius, P. vulgaris, P. coccineus striatus, P. coccineus griseus, P. macvaughii, P. leptostachyus, P. lunatus, P. maculatus, P. maculatifolius y P. rotundatus.
La topología de los subclados distales en las filogenias reconstruidas con tres estuvo de acuerdo, en general, con la topología para Phaseolus de Delgado-Salinas et al. (2006). De las especies no estudiadas previamente se observó que P. albiviolaceus, según su morfología, pertenece al grupo Pedicellatus pero aquí se ubicó en el grupo Tuerckheimii, mientras que P. maculatifolius y P. rotundatus se incluyeron en el grupo Polystachios.
El clado ancestral de las especies de Phaseolus mostró una edad de 4.95 M.a. y la diversificación de los dos clados principales exhibió edad similar (3.8 M.a), La divergencia entre P. albiviolaceus y P. zimapanensis fue de 0.07 M.a. mientras que entre P. rotundatus y P. maculatifolius fue de 0.31 M.a.











 nueva página del texto (beta)
nueva página del texto (beta)



