Introducción
Las cactáceas son un grupo de plantas con características biológicas y ecológicas particulares que las hacen vulnerables a diversos factores de perturbación naturales y humanos, además, poseen tasas bajas de crecimiento y a menudo sus ciclos de vida son largos (Álvarez et al., 2017); (Castañeda-Romero et al., 2016). Estas plantas se han convertido en un grupo sensible a la extinción (Jiménez-Sierra et al., 2007). La familia Cactaceae presenta su máxima diversidad e importancia en el territorio mexicano con alrededor de 670 especies, de las cuales cerca del 80% son endémicas (Talonia et al., 2014);(Jiménez-Sierra, 2011); no obstante, el empobrecimiento biológico de las comunidades desérticas y semidesérticas de México es causado por la extracción ilegal de ejemplares adultos completos y a la comercialización de su parénquima para la elaboración del acitrón (Jiménez-Sierra & Eguiarte, 2010).
Echinocactus platyacanthus es endémica de México y también es conocida como biznaga tonel, biznaga dulce o acitrón (Bravo Holis & Sánchez Mejorada, 1978); está ampliamente distribuida en las zonas áridas del altiplano central, así como en los estados de Oaxaca y Puebla (Guzmán et al., 2003). Sin embargo, la SEMARNAT en las últimas décadas ha incluido a esta especie en la NOM-059, con el estatus de especie Pr-sujeta a protección especial (SEMARNAT, 2002), es decir, es una especie con limitaciones en su aprovechamiento por tener poblaciones reducidas; también, esta reportada en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales (IUCN por sus siglas en inglés) en la categoría de “casi amenazada”(Hernández et al., 2017), por lo que se considera importante conservar su germoplasma mediante técnicas de propagación adecuadas como las de laboratorio.
El conocimiento de los procesos reproductivos así como la dinámica poblacional de especies vegetales, permite mantener las estrategias de uso sustentable o de protección de estos recursos; al respecto, se ha reportado la simulación del crecimiento poblacional proyectado a un tiempo de 100 años para Echinocactus platyacanthus (Jiménez-Sierra & Matías Palafox, 2015), en este estudio se determinó que es imposible llevar a cabo la permanencia de plántulas y los estadíos de plántula a juvenil, así como de juvenil a adulto en condiciones naturales. En este sentido, es importante mencionar que algunas zonas donde esta cactácea crece, se ha encontrado que sus poblaciones son de tipo recesiva, por lo que tienen un mayor riesgo de extinguirse (Castañeda-Romero et al., 2016). Al respecto, una alternativa de gran impacto y viabilidad para micropropagar especies con importancia biológica, ecológica y económica son las técnicas de cultivo in vitro con las que es posible controlar factores abióticos como humedad relativa, fotoperiodo, pH, entre otros, con la finalidad de obtener un gran número de plantas a partir de una o bien, de manera alterna, alcanzar porcentajes de germinación elevados, cuidando los factores que determinan este proceso biológico (Gómez-Serrano et al., 2010). La producción de plántulas depende del método empleado para efectuar el proceso de germinación y del conocimiento biológico que se tenga de la semilla. No obstante, existen especies que aún no han sido examinadas para este proceso de producción y el conocimiento biológico es muy limitado (Castillo Reyes et al., 2014).
Los reportes sobre germinación para la especie E. platyacanthus, se basan mayormente en la aplicación de tratamientos pre-germinativos, por ejemplo, mediante el empleo de ácidos fuertes (Rosas López, 2002); (Navarro et al., 2014), por inoculación con Bacillus spp., Trichoderma spp., Glomus intraradices y Rizobacterias haloficas (Castillo Reyes et al., 2014), usando semillas provenientes de la defecación de ganado caprino (Baraza & Fernández-Osores, 2013), mediante ciclos de hidratación y deshidratación (Contreras Quiroz et al., 2016); o con el uso de semillas vivíparas (Aragón-Gastélum et al., 2017).
Con respecto a la micropropagación, a través de la técnica de cultivo de tejidos vegetales son escasos los estudios reportados y de manera general están dirigidos hacia la formación de brotes (Rodríguez González, 2006).
Los propósitos de este trabajo fueron estudiar la germinación in vitro y ex vitro evaluando también los efectos de los reguladores de crecimiento vegetal y acelerando la talla y la biomasa de E. platyacanthus para la obtención de plántulas vigorosas, que puedan mantenerse posteriormente en el invernadero como una alternativa sustentable y de conservación de las poblaciones naturales.
Materiales y método
Durante el mes de septiembre del 2017, se recolectaron porciones del tallo globoso con parte de las costillas, areolas y espinas, así como flores, frutos y semillas maduras de E. platyacanthus en el cerro de los Ramírez en la Localidad de San Antonio, Municipio de Tecozautla, Hidalgo, México, en las coordenadas (20° 33’ 16.25760’’ LN y -99° 44’22.0020’’ LW), a una altitud de 1793 m (Fig. 1). El suelo que predomina en esta zona es feozem háplico y calcárico, xerosol háplico con litosol y regosol éutrico (Rojas et al., 2013). La vegetación que se observó en el lugar de la recolecta, está conformada principalmente por matorral xerófilo con biznagas Ferocactus latispinus (Haw.) Britton y Rose; pitaya Isolatocereus dumortieri (Scheidw.) Backeb.; huizache Acacia farnesiana (L.) Willd.; maguey Agave americana L., A. lechuguilla Torr., A. striata Zucc.; nopal Opuntia joconostle A. AC Weber, O. tomentosa Salm-Dyck; pirul Schinus molle L. y pino Pinus cembroides Zucc. (Fig. 2). Los materiales vegetales recolectados se prensaron y se llevaron al Laboratorio de Fanerógamas de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB), donde se eliminó la mayor cantidad del parénquima de reserva de las muestras del tallo y se colocaron en una secadora botánica al igual que las flores y algunos frutos. Las semillas que expulsaban los frutos maduros no se incluyeron a la secadora, estos se guardaron en bolsas negras que fueron las que se utilizaron para el experimento de germinación.
Los materiales recolectados contenían frutos amarillentos, elipsoidales a globosos, de 4 a 7 cm de largo, cubiertos con tricomas y escamas, eran secos o semicarnosos con dehiscencia irregular, caracteres que corresponden a un tipo de frutos llamado cápsula (Kesseler & Stuppy, 2014). Las semillas medían de 1.6 a 2.5 mm de largo, ampliamente ovadas a globulosas, testa negra a pardo oscura con tonos castaños, brillantes y reticuladas, típicas de Cactaceae (Niembro Rocas, 1989). Cuando los frutos de estas plantas están maduros es fácil reconocerlos, debido a que las cápsulas se abren y dejan salir las semillas, lo que indica la madurez en este órgano y de los elementos seminales (Fig. 3).
Las plantas recolectadas ya secas se colocaron en una cámara con cloroformo por 48 h para detener el desarrollo de huevecillos u organismos vivos de insectos o esporas de hongos. Después el material se identificó, etiquetó y el mejor espécimen se cosió en una cartulina bristol con las medidas convencionales para los herbarios, posteriormente se colocó el ejemplar seleccionado dentro de una bolsa de plástico y se metió en un congelador Tappan a -20° C por 72 h antes de incorporarlo al herbario (ENCB). Para la identificación de los ejemplares recolectados se utilizaron documentos especializados como el de la Flora del Valle de Tehuacán-Cuicatlán (Arias et al., 2012) y el de las cactáceas ornamentales del desierto Chihuahuense (Villavicencio-Gutiérrez et al., 2010), finalmente el ejemplar fue depositado en la colección del herbario para formar parte del acervo (Fig. 4).
Germinación de las semillas
In vitro.
Las semillas recolectadas en el campo se lavaron con agua y detergente en polvo de la marca ROMA® y se desinfectaron superficialmente con etanol (C2H5OH) al 70% v/v durante un min, seguido de una inmersión por 15 min en una solución de hipoclorito de sodio (NaClO) al 1.5% de cloro activo (Cl2) y tres lavados con agua destilada estéril. Las semillas se remojaron con agua destilada durante 24 h (tratamiento pre-germinativo) y se colocaron en frascos de vidrio con 20 mL de medio nutritivo MS al 50% de su concentración original (15 gL-1 de sacarosa y 7 gL-1 de agar como agente gelificante, manteniendo un pH de 5.8). Se depositaron 25 semillas en cada frasco y se registró el porcentaje de germinación al término del experimento, se consideró que la germinación inicia cuando emerge la radícula. Todos los frascos se mantuvieron durante cuatro semanas en un cuarto de cultivo con un fotoperiodo de 16 h de luz y 8 h de oscuridad a una temperatura entre 23 °C y 25 °C, con una intensidad luminosa de 364 µmol m-2s-1. Los experimentos se realizaron por triplicado.
Ex vitro.
Para la germinación ex vitro, se utilizaron semillas que se desinfectaron con el método descrito anteriormente, estas se remojaron en agua destilada estéril durante 24 h (tratamiento pre-germinativo). Las semillas se sembraron en charolas de plástico homogéneas, cada una con 25 semillas en cuatro sustratos diferentes previamente esterilizados: tierra negra + tezontle + agrolita (S1), tierra negra + agrolita (S2), tierra negra (S3) y tierra del sitio de recolecta (S4). Las semillas se sembraron superficialmente y se registró el porcentaje de germinación al final de las cuatro semanas, se consideró que esta inicia cuando emerge la radícula. Todas las charolas se mantuvieron en un cuarto de cultivo con un fotoperiodo de 16 h de luz y 8 h de oscuridad, en un rango de temperatura entre 23 °C y 25°C con una intensidad luminosa de 364 µmol m-2s-1 y riego de una vez a la semana. Los experimentos se realizaron por triplicado.
Promoción de crecimiento in vitro
Para este experimento se llevó a cabo un diseño factorial de cuatro medios de crecimiento, empleando como base MS al 100% y con diferentes combinaciones de reguladores, conservando la relación de 10:1 de auxinas y citocininas: M1: 0.5 mgL-1 de 6-Bencilaminopurina (BAP); M2: 5 mgL-1 de ácido 1-naftalenacético (ANA) + 0.5 mgL-1 de BAP; M3: 5 mgL-1 de ANA y M4: MS al 100% sin reguladores de crecimiento como control (Gómez-Serrano et al., 2010).
Las plántulas obtenidas de la germinación in vitro se seccionaron transversalmente y se obtuvieron explantes apicales y basales de aproximadamente 0.5 cm de altura, los cuales se colocaron en cada frasco de vidrio con los medios descritos anteriormente, colocando en cada frasco 10 explantes, 5 apicales y 5 basales. Todos los frascos contenían 20 mL de medio con 30 gL-1 de sacarosa, 7 gL-1 de agar como agente gelificante, manteniendo un pH de 5.8 y se colocaron en un cuarto de cultivo con un fotoperiodo de 16 h de luz y 8 h de oscuridad, en un rango de temperatura de 23 °C a 25 °C y una intensidad luminosa de 364 µmol m-2s-1. Los experimentos se realizaron por triplicado y al cabo de seis semanas se tomaron medidas de altura y diámetro empleando un calibrador vernier Mitutoyo, modelo 530-101 con un error instrumental de + 0.05 mm, la biomasa fresca se registró mediante una balanza digital OHAUS, modelo PR124 con una resolución de 0.0001 g.
Análisis estadístico
Para la comparación de medias en el experimento de germinación se utilizó la prueba de Tukey con p < 0.05 para considerar diferencia significativa entre los porcentajes finales de germinación (Wong González, 2010). Se utilizó el software estadístico MINITAB® 20.2.
El diseño experimental que se aplicó en el experimento de crecimiento acelerado fue el diseño completamente aleatorizado con un criterio de clasificación conocido como ANOVA de una vía. Para la comparación de medias se empleó la prueba de Dunnet con un valor p < 0.05 para considerar que hubo diferencias significativas (Wong González, 2010). Se utilizó el software estadístico MINITAB® 20.2.
Resultados
Germinación de semillas
Las plántulas germinadas en condiciones in vitro se observaron libres de contaminación y de oxidación con un color verde uniforme (Fig. 5a); las plántulas germinadas ex vitro presentaron oxidación y resultó difícil controlar la contaminación por hongos después de la cuarta semana (Fig. 5b). En ambos casos presentaron una germinación epígea que comenzó entre la segunda y tercera semana respectivamente, la cual inicia con el rompimiento de la testa (Fig. 5c), posteriormente, surge la raíz primaria, el hipocotilo y la parte inferior de los cotiledones; el epicotilo es más pequeño con respecto al hipocotilo y con presencia de areolas separadas con algunos tricomas microscópicos. La testa de la semilla es removida por el alargamiento gradual de los cotiledones, que son carnosos, poco separados entre sí, además, presentan un contorno lanceolado y ápice agudo (Osca Lluch, 2019). A la cuarta semana el epicotilo es microscópicamente visible y se empieza a formar un tallo alargado con el ápice redondeado (Fig. 5d).

Fig. 5 Germinación de Echinocactus platyacanthus: a) in vitro b) ex vitro c) germinación epígea d) aspecto de una plántula de cuatro semanas.
El porcentaje de germinación más alto se obtuvo en MS al 50%, donde se alcanzó un 70% de germinación después de 28 días de cultivo, seguida de un 60% en el sustrato S3 conformado por tierra negra y un 46% en el sustrato S2 compuesto por tierra negra y agrolita; el menor porcentaje de germinación se obtuvo en el sustrato 1 conformado por la mezcla de tierra negra, tezontle y agrolita (Tabla 1).
Tabla 1 Porcentajes de germinación de Echinocactus platyacanthus en diferentes sustratos.
| In vitro | Ex vitro | |||
|---|---|---|---|---|
| MS 50% | Sustrato 1 | Sustrato 2 | Sustrato 3 | Sustrato 4 |
| 70 + 2.83 a | 2 + 2.83 c | 46 + 14.1 a,b | 60 + 0 a,b | 28 + 11.31 b,c |
MS al 50%: medio de cultivo de Murashige y Skoog al 50% de su concentración original, S1: tierra negra + tezontle + agrolita, S2: tierra negra + agrolita, S3: tierra negra, S4: tierra del sitio de recolecta. Las medias que no comparten una letra tienen diferencias significativas (p < 0.05).
El análisis estadístico reveló que las diferencias encontradas entre los porcentajes de germinación obtenidos en MS al 50% con respecto a los obtenidos en S1 (tierra negra + tezontle + agrolita) y S4 (tierra del sitio de recolecta) fueron significativamente diferentes; así como los porcentajes encontrados en el S1 (tierra negra + tezontle + agrolita) con respecto a S2 (tierra negra + agrolita) y S3 (tierra negra) (Fig. 6).
Promoción de crecimiento in vitro
Después de seis semanas de cultivo, todos los explantes apicales que estuvieron en contacto con reguladores de crecimiento, presentaron visiblemente un aumento en su diámetro y altura con respecto al control, los tallos desarrollaron una forma alargado-globoso, carnoso, con cuatro costillas con areolas, tricomas y espinas duras de color rojizo que sobresalen de la areola (Fig. 7a,7b y 7c); todos los explantes desarrollaron raíces y algunos presentaron un callo no morfogenético de color café.

Fig. 7 Crecimiento in vitro de E. platyacanthus en: a) M1 (BAP 0.5 mgL-1), b) M2 (ANA 5 mgL-1+BAP 0.5 mgL-1), c) M3 (ANA 5 mgL-1) y d) M4 (MS 100%). ap: explantes apicales, bs: explantes basales.
En la Tabla 2 observamos que el análisis estadístico muestra diferencias significativas en los diámetros de los explantes apicales que crecieron en el M1 con respecto al control, alcanzando una longitud promedio de 0.94 cm; en cuanto a la altura, los explantes apicales que crecieron en los medios M2 y M3 resultaron significativamente diferentes con respecto al control, alcanzando tallas promedio de 1.747 cm y 1.783 cm respectivamente; para la variable de biomasa fresca, los explantes apicales mostraron diferencias significativas en todos los medios probados (M1, M2 y M3) con respecto al control, registrándose pesos promedio de 0.5654 g, 0.4708 g y 0.4914 g respectivamente en un periodo de 6 semanas. Con relación a los explantes basales, se observó un ligero incremento en el diámetro, pero este no resulto significativo con respecto al control en ninguno de los medios probados; en cuanto a la altura solo los que crecieron en el M3 el aumento de esta variable fue significativo, alcanzando una talla promedio de 1.047 cm; con respecto a los explantes basales que crecieron en el M1 tuvieron un aumento significativo en cuanto a su biomasa fresca alcanzando un peso promedio de 0.2552 g.
Tabla 2 Diámetro, altura y biomasa promedio de Echinocactus platyacanthus de 6 semanas de edad en 4 medios diferentes de crecimiento.
| Explante | Variable | Medio 1 BAP (0.5 mgL-1) | Medio 2 BAP (0.5 mgL-1) + ANA (5 mgL-1) | Medio 3 ANA (5 mgL-1) | Control MS 100% |
|---|---|---|---|---|---|
| Apical | Diámetro (cm) |
0.94+0.6983 b | 0.7533+0.2074 a | 0.7033+0.1778 a | 0.49+0.1713 a |
| Altura (cm) |
1.285+0.2583 a | 1.747+0.5899 b | 1.783+0.6326 b | 0.9133+0.3916 a | |
| Biomasa fresca (g) |
0.5654+0.6913 b | 0.4708+0.3256 b | 0.4914+0.257 b | 0.1294+0.1049 a | |
| Basal | Diámetro (cm) |
0.545+0.1092 a | 0.4667+0.2273 a | 0.4833+0.09574 a | 0.4+0.1323 a |
| Altura (cm) |
0.97+0.2616 a | 0.79+0.3879 a | 1.047+0.3749 b | 0.678+0.2131 a | |
| Biomasa fresca (g) | 0.2552+0.1171 b | 0.1872+0.1439 a | 0.193+0.1096 a | 0.1084+0.1096 a |
Se reporta la media +/- la desviación estándar. Las medias que no comparten una letra tienen diferencia significativa con respecto al control a nivel p < 0.05 según prueba de Dunnet.
En la Figura 8a y 8c se puede observar que la citocinina BAP en una concentración de 0.5 mgL-1, promovió un incremento significativo en los factores de diámetro y biomasa fresca de todos los explantes apicales con respecto al control; también la citocinina BAP tuvo efecto sobre el aumento de biomasa fresca en los explantes basales (Fig. 9c). Cuando la citocinina BAP se combinó con la auxina ANA en una concentración de 0.5 mgL-1 y 5 mgL-1 respectivamente, se observó una ganancia significativa en la altura y biomasa fresca en los explantes apicales (Fig. 8b y 8c) y cuando la auxina ANA actuó sola en concentraciones de 5 mgL-1 tuvo un efecto significativamente estadístico en altura (Fig. 8b) y biomasa fresca de explantes apicales (Fig. 8c); en lo que respecta a los explantes basales solo se obtuvo un efecto significativo en la altura (Fig. 9b).

Fig. 8 Comparación de: a) diámetro apical; b) altura apical; c) peso apical en diferentes medios de cultivo M1: 0.5mgL-1 BAP; M2: 5mgL-1 ANA + 0.5 mgL-1 BAP; M3:5 mgL-1 ANA y M4: MS al 100% sin reguladores como control. La altura de la barra representa la media con desviación estándar. Las barras que no comparten la misma letra son significativamente diferentes con respecto al control.
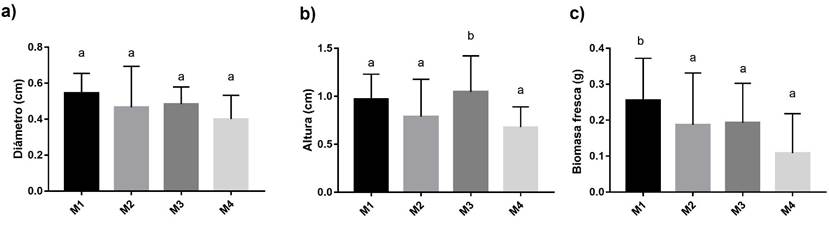
Fig. 9 Comparación de: a) diámetro basal; b) altura basal; c) peso basal en diferentes medios de cultivo M1: 0.5mgL-1 BAP; M2: 5mgL-1 ANA + 0.5 mgL-1 BAP; M3:5 mgL-1 ANA y M4: MS al 100% sin reguladores como control. La altura de la barra representa la media con desviación estándar. Las barras que no comparten la misma letra son significativamente diferentes con respecto al control.
Discusión
La respuesta germinativa proporciona la base para elaborar un programa de manejo sustentable de cualquier recurso vegetal (Ruiz Barrera, 2012), por lo que es importante generar experimentos que consigan este fin. Además, se debe de tomar en cuenta que los factores importantes en la germinación de muchas especies son la luz, la humedad y la temperatura (Sánchez Soto et al., 2010).
En este trabajo se contempló la aplicación de un tratamiento pre-germinativo para la semilla ya que es un factor determinante para la germinación, y este proceso es capaz de activar la semilla de un organismo seco, inactivo y latente (Contreras Quiroz et al., 2016). En este sentido, la imbibición en agua de las semillas de Echinocactus platyacanthus durante un periodo de 24 h fue suficiente para alcanzar porcentajes altos de germinación que van del 46% al 70% (Tabla 1) lo cual coincide con lo expuesto en investigaciones previas (Godínez-Alvarez & Valiente-Banuet, 1998); (Secorun & de Souza, 2011); (Bauk et al., 2017), donde se ha reportado la experimentación con varias cactáceas, que la imbibición de las semillas en agua promueven el ablandamiento de la testa y de esta manera la radícula pueda emerger, debido a que el grosor de la testa no es muy grande y tiene una baja permeabilidad.
Es importante comentar que en varias especies de cactáceas, las semillas requieren de luz para poder germinar (Rodríguez-Ortega et al., 2006) y, de acuerdo con los autores anteriores, los mayores porcentajes de germinación se obtienen a un intervalo de temperatura entre 25 (C y 30 (C (Barrios et al., 2020); (Meiado et al., 2016); (Seal et al., 2017); (Bauk et al., 2017); (Loza Cornejo et al., 2012). También, en la bibliografía consultada se menciona que el porcentaje disminuye hasta un 50%, si la temperatura se ubica en 17 (C o en 34 (C, siendo 25 °C la temperatura óptima para E. platyacanthus (De La Barrera & Nobel, 2003); (Rojas-Aréchiga et al., 1998); (Sánchez Soto et al., 2010). En este trabajo se utilizó un rango de temperatura de 23 (C a 25 ºC en todos los experimentos, el cual fue proporcionado por lámparas fluorescentes (364 µmol m-2s-1), las cuales combinadas con un fotoperiodo de 16 h luz/8 h oscuridad, proporcionaron las condiciones óptimas para la germinación y crecimiento adecuado de plantas de E. platyacanthus tal y como se obtuvo para Acourtia cordata (Gómez-Serrano et al., 2010), así como para Gymnocalycium monvilley (Bauk et al., 2017); y Ferocactus histrix y Mammillaria uncinata (Loza Cornejo et al., 2012).
De acuerdo a la Tabla 1, el mayor porcentaje de germinación obtenido para E. platyacanthus, es el que se llevó a cabo en condiciones in vitro, lo cual puede ser debido a la mayor cantidad de nutrientes y un rico contenido de sales proporcionados por el medio MS (Clayton et al., 2019); (Cassells & Curry, 2001), los cuales permiten el crecimiento y un mejor desarrollo de una planta, al contener una menor cantidad de solutos y propiciar una mayor hidratación, por lo tanto cumple con las características apropiadas para que germinen y se cultiven una gran cantidad de tejidos de diferentes especies. Además los cultivos in vitro son sistemas cerrados, que no requieren de cuidados adicionales (Rosas López, 2002) como el uso de fungicidas que controlen el crecimiento de hongos en tierra cuando el riego es excesivo.
Se ha reportado en la literatura para E. platyacanthus altos porcentajes de germinación (88%) empleando escarificación química como tratamiento pre-germinativo (Rosas López, 2002), en MS al 50% en 34 días. En esta investigación el porcentaje de germinación obtenido fue del 70% de germinación en 28 días con el mismo medio, pero sin escarificación química ya que se considera que los ácidos fuertes con tiempos de exposición altos pueden dañar al embrión. Además, es conocido que los frutos junto con las semillas de E. platyacanthus no son carnosos, en este sentido es difícil que un animal los ingiera y, de esta forma, la posibilidad de que las semillas sean escarificadas en su tracto digestivo disminuye (Godínez-Alvarez & Valiente-Banuet, 1998).
Con respecto a la germinación ex vitro, en trabajos previos se obtuvieron del 61% al 94% de germinación en una mezcla de tierra de hoja más arena y tepojal, con la misma mezcla, pero con tierra negra se obtuvo el 24% de germinación con escarificación previa. (Navarro et al., 2014). En este trabajo se obtuvo un 60% de germinación en el sustrato conformado por tierra negra (S3) sin escarificación y con un remojo de 24 h, seguido de un 2%, 40% y 28% en los sustratos S1, S2 y S4 respectivamente, esto puede deberse a la riqueza de nutrientes que aporta la tierra negra y a la mayor cantidad de agua que retiene.
En cuanto al crecimiento de las cactáceas, se ha descrito que estas plantas son muy sensibles en las primeras etapas de su desarrollo y, el establecimiento de nuevos individuos puede ser nulo en muchos años, por lo que el empleo de técnicas de cultivo de tejidos vegetales representa una alternativa para reducir el tiempo de propagación (Rosas López, 2002). Así, en el cultivo de tejidos vegetales es bien conocido que las citocininas y las auxinas son los reguladores de crecimiento vegetal más empleados (Stepan Sarkissian, 1990), estimulando, inhibiendo o modificando diversos procesos fisiológicos de las plantas. En la literatura se ha reportado el uso de BAP en concentraciones mayores a 1 mgL-1 para promover brotación en E. platyacanthus (Rodríguez González, 2006); (Pérez et al., 1998); (Clayton et al., 2019); sin embargo en este trabajo se encontró que el empleo de este regulador en concentraciones menores tiene un efecto en el aumento de talla y biomasa de los explantes de esta especie.
Al analizar la Tabla 2 se encontró que el uso de la citocinina BAP en una concentración de 0.5 mgL-1 y de la auxina ANA en una concentración de 5 mgL-1 en cultivos in vitro de E. platyacanthus promovieron un incremento significativo de las tallas de los explantes apicales y de algunos explantes basales, dependiendo de la presencia de uno o ambos reguladores de crecimiento en los medios; lo cual coincide con lo reportado en trabajos previos en los que se encontró que estos reguladores del crecimiento dan lugar al alargamiento celular, crecimiento y espesor de tallos y están involucrados en el tropismo, así como la diferenciación de raíces (Vázquez, 2016); (Fakhrai & Fakhrai, 1990); (Pérez et al., 1998); (Santos-Díaz et al., 2003).
Está bien documentado que las cactáceas tienen ciclos de vida muy largos con tasas de crecimiento lentos y alta especificidad ambiental (Téllez-Román et al., 2017); sin embargo en esta investigación se obtuvieron plántulas de E. platyacanthus con tallas más grandes que los controles, triplicando su altura, quintuplicándo su diámetro y aumentando 18 veces más su biomasa fresca en un lapso de 42 días de cultivo. Cabe mencionar que todos los explantes generaron raíces; incluso los que estuvieron creciendo en MS basal sin reguladores de crecimiento, lo cual suele presentarse en varias especies de cactáceas pero en un desarrollo posterior de estas, puede haber diferencias en la morfología o en la frecuencia de enraizamiento en las raíces desarrolladas con auxinas (Clayton et al, 1990), por lo que este protocolo de crecimiento in vitro, representa una alternativa biotecnológica para la especie en estudio.
Conclusiones
Se obtuvieron altos porcentajes de germinación in vitro y ex vitro para Echinocactus platyacanthus, 70% en MS a la mitad de su concentración original, 60% en tierra negra y 46% en una mezcla de tierra negra+agrolita, después de 28 días de la siembra de la semilla.
El uso de la citocinina BAP en concentraciones de 0.5 mgL-1 y de la auxina ANA en concentraciones de 5 mgL-1 de manera aisladas o combinadas en cultivos in vitro aceleraron el crecimiento de los explantes apicales y basales, obteniendo plántulas vigorosas con tallas de hasta 1.8 cm de altura y 2.25 cm de diámetro, con un peso fresco de 2.3 g en un lapso de 70 días de cultivo después de la siembra de las semillas.
La combinación de los protocolos de germinación y crecimiento in vitro, ofrecen una alternativa para la obtención de plántulas vigorosas para su posterior establecimiento en invernadero y su futuro aprovechamiento en la elaboración de acitrón de manera sustentable, contribuyendo así, a la protección de sus poblaciones in situ.











 nueva página del texto (beta)
nueva página del texto (beta)







