Introducción
México es considerado como el centro de origen y diversidad del género Tagetes con cerca de 50 especies (García-Sánchez et al., 2012; Strother, 1977). Varias especies del género Tagetes (Asteraceae) han mostrado tener propiedades bactericidas (Arenas, López, Alvarez, Llano, & Loke, 2004; Espinoza-Ruíz, Palomeque-Rodas, Salazar-Sandoval, Domínguez-Arrevillaga, & Canseco-Ávila, 2009; Souza, Avancini, & Wiest, 2000), fungicidas (Romagnoli et al., 2005; Zygadlo, Guzman, & Grosso, 1994), nematicidas (Ball-Coelho, Bruin, Roy, & Riga, 2003; Reynolds, Potter, & Ball-Coelho, 2000), acaricidas (Eguaras et al., 2005) incluso insecticidas para varias plagas de insectos incluyendo al piojo de la cabeza (Cestari, Sarti, Waib, & Branco Jr., 2004), gorgojos de granos almacenados (D. K. Weaver et al., 1994; David K. Weaver et al., 1997), áfidos (Serrato-Cruz, Díaz-Cedillo, & Barajas-Pérez, 2008; Tomova, Waterhouse, & Doberski, 2005; Tripathi, Upadhyay, Bhuiyan, & Bhattacharya, 2009), moscas blancas (Camarillo R, Ortega A, Serrato C, & Rodríguez H, 2009), dípteros (Nivsarkar, Cherian, & Padh, 2001; Perich, Wells, Bertsch, & Tredway, 1994), entre otros.
Las propiedades antes mencionadas se debe a que las especies de Tagetes poseen una gran variedad de compuestos como el trans-anetol, alilanisol, β-cariofileno y tagetona, que son tóxicos y repelentes para insectos (Saxena & Srivastava 1973; Camarillo R. et al., 2009; Cestari et al., 2004; Tomova et al., 2005; Tripathi et al., 2009; D. K. Weaver et al., 1994).
Muchas especies de Tagetes son nativas de México, sin embargo, existen pocos estudios sobre los volátiles de especies mexicanas de este género. Entre estas se encuentra Tagetes erecta la cual contiene 1,8-cineol, α-pineno, limoneno, α-terpineol, piperitona, piperitenona, oxido de piperitenona y sabineno como el principal componente (Krishna, Mallavarapu, & Ramesh, 2004; Ogunwande & Olawore, 2006). Otra especie mexicana es Tagetes pa¬rryi en la cual se identificaron: canfeno (96%), 3,6,6-trimetil-2-norpinanol (91 %), anisol (60 %), 4-isopropil-1-metil-2-ciclohexenol (50%), cineol (48%), eugenol (14%) y α-terpineol (12%) (Díaz-Cedillo & Serrato-Cruz, 2011). Para Tagetes lacera se identificaron 6 compuestos principales: (E)-tagetona (26.2%), crisantenona (24.8%), verbenona (22.1%), α-tujeno (20.5%), β-pineno (3.1%) y α-pineno (1.9%) (Díaz-Cedillo, Serrato-Cruz, Arce-Montoya, & León-De La Luz, 2012) y Tagetes coronopifolia, la cual contiene cuatro compuestos mayoritarios en tallo y hoja: verbenona, crisantenona, 2-oxo-decanoato de metilo y 6,6-dimetil-2-metil-biciclo [3.1.1] heptan-3-ona, dos de ellos también presentes en la cabezuela (Díaz-Cedillo, Serrato-Cruz, de la Cruz-Marcial, Sánchez-Alonso, & López-Morales, 2013).
Tagetes nelsonii es un especie Mexicana que se encuentra en el municipio de San Cristóbal de Las Casas, localizado en el estado de Chiapas, México. Los habitantes de esa región tradicionalmente utilizan las hojas frescas de esta planta conocida comúnmente como “Chik chawa”, las maceran o licuan y el líquido filtrado lo toman durante un periodo de 8 días para el tratamiento empírico de las diarreas, dolor de cabeza y fiebre, por lo cual los pobladores la han adoptado como una planta medicinal (Espinoza-Ruíz et al., 2009). La migraña también es tratada por los shamanes Tzentales de los altos de Chiapas con un extracto de T. nelsonii (Carod-Artal & Vázquez-Cabrera, 2007).
Con el fin de extender el conocimiento de los volátiles de las especies mexicanas de Tagetes, el objetivo del presente trabajo es investigar los volátiles de Tagetes nelsonii, Chiapas, México.
Métodos
Colecta de material vegetal
Las muestras de Tagetes nelsonii se recolectaron en la colonia Fátima de la Ciudad de San Cristóbal de las Casas, durante septiembre y octubre de 2013. Se realizó su caracterización botánica con el número de registro 38718 en el Instituto de Historia Natural y Ecología del Estado de Chiapas, México.
Microextracción en Fase Sólida
En un matraz erlenmeyer de 200 ml se colocaron 200 gr hojas frescas de la planta y se cubrió con papel aluminio. Se insertó en el frasco una fibra de Microextracción de Fase Sólida (SPME) con (polidimetilsiloxano y divinilbenceno, Supelco, Toluca, México). La fibra estuvo expuesta por 20 seg y luego fue introducida al inyector del sistema de Cromatografía de Gases y Espectrometría de Masas (GC-MS). (Salazar Sandoval et al., 2007). Se analizaron 6 muestras.
Identificación de volátiles por GC-MS
La caracterización química de los volátiles se realizó con un cromatógrafo de gases acoplado a un espectrómetro de masas (GC-MS Varian Star model CP-3800 GC, Palo Alto, CA, USA). Se utilizó una columna capilar FactorFour VF-5MS, de 30 mm de longitud con 250 micrones de diámetro interno (Varian, Palo Alto, CA, USA). La temperatura del horno de la columna fue programada con una temperatura inicial de 50 °C por 2 min y posteriormente 280 °C durante 10 min. El incremento de la temperatura fue de 15 °C/min, con helio como gas acarreador a un flujo constante de 1mL/min. La temperatura del inyector fue de 250 °C. El análisis por impacto electrónico con un haz de electrones de 70-eV para la ionización. La identificación de los compuestos se efectuó mediante la comparación del tiempo de retención y el espectro de masas con la biblioteca espectral NIST 2002. Una solución estándar de hidrocarburos (C12-C60) se inyecto para determinar los índices de retensión (IR) de los compuestos identificados. La abundancia relativa (%) de los componentes fue calculada considerando el área de los picos de todos los compuestos.
Resultados y discusión
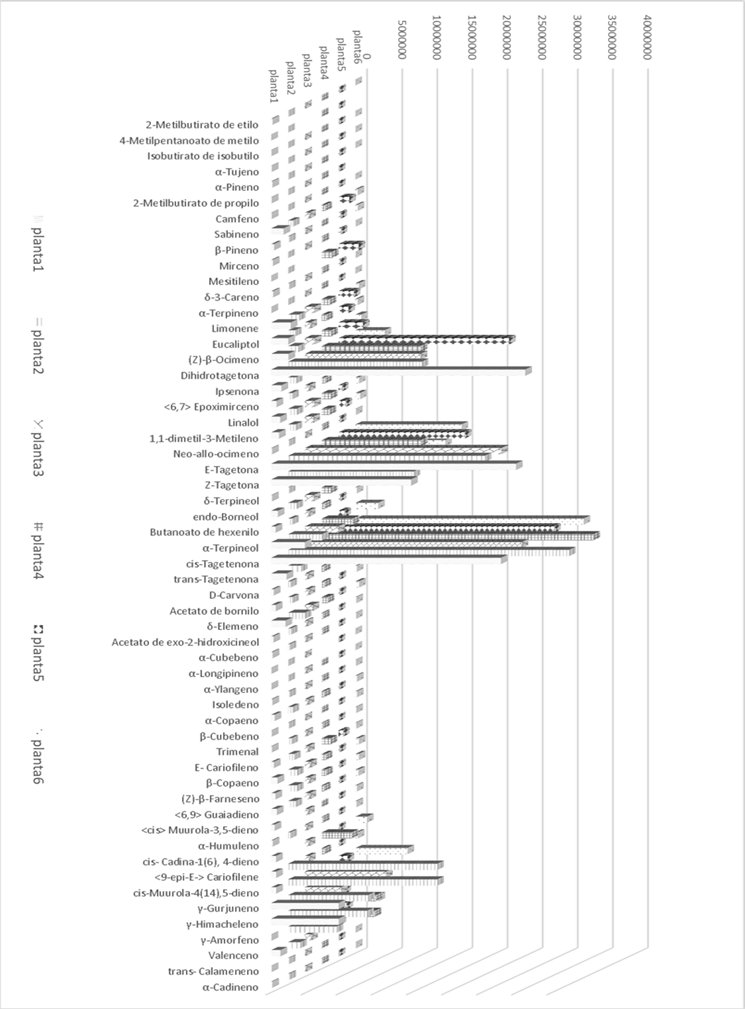
Los volátiles encontrados en T. nelsonii se muestran en la Figura 1 y Tabla 1. Los compuestos identificados en los volátiles de T. nelsonii son una mezcla de compuestos terpénicos. Se caracterizaron 56 compuestos. Los compuestos principales incluye una mezcla de monoterpenos: dihidrotagetona (12.66%), (E)-β-tagetona (15.31%), (Z)-β-tagetona (10.34%) y cis-tagetenone (24.95%) seguidos por limoneno (1.05 %), trans-β-ocimeno (1.22%), α-terpineol (2.53%) y una mezcla de sesquiterpenos: 9-epi-(E)-cariofileno, cis-muurola-4(14),5-dieno, γ-gurjuneno, γ-himacheleno y γ-morfeno. El resto de los compuestos observados están presentes en cantidades en el rango de 0.01% a 0.96% (por ejemplo: α-pineno, mirceno, mesitileno, α-terpineno, eucaliptol, linalool y β-copaeno).
Tabla 1 Abundancia (%) de los volátiles de producidos por T. nelsonii.
| Pico | TR | IR | Compuesto | % | Promedio | EE |
|---|---|---|---|---|---|---|
| 1 | 4.20 | 843 | 2-Metil-butirato de etilo | 0.06 | 59283 | 29904 |
| 2 | 4.35 | 855 | 4-Metil-pentanoato de etilo | 0.02 | 25351 | 5934 |
| 3 | 5.01 | 905 | Isobutirato de isobutilo | 0.01 | 18984 | 7272 |
| 4 | 5.21 | 920 | α-Tujeno | 0.03 | 47633 | 10388 |
| 5 | 5.32 | 929 | α-Pineno | 0.05 | 70125 | 24250 |
| 6 | 5.43 | 938 | 2-Metil-butirato de propilo | 0.03 | 41827 | 9892 |
| 7 | 5.55 | 947 | Camfeno | 0.02 | 29058 | 11184 |
| 8 | 5.81 | 967 | Sabineno | 0.60 | 907629 | 240435 |
| 9 | 5.90 | 974 | β-Pineno | 0.14 | 209953 | 61050 |
| 10 | 5.97 | 980 | Mirceno | 0.10 | 156391 | 48539 |
| 11 | 6.11 | 991 | Mesitileno | 0.96 | 1440414 | 558274 |
| 12 | 6.22 | 999 | δ-3-Careno | 0.09 | 142073 | 32014 |
| 13 | 6.35 | 1010 | Terpineno | 0.01 | 21514 | 3766 |
| 14 | 6.49 | 1022 | Limoneno | 1.05 | 1577925 | 326311 |
| 15 | 6.55 | 1024 | Eucaliptol (1,8-cineol) | 0.73 | 1095614 | 303717 |
| 16 | 6.61 | 1032 | trans-β-Ocimeno | 1.22 | 1830694 | 393620 |
| 17 | 6.74 | 1038 | Dihidrotagetona | 12.66 | 19031231 | 4370748 |
| 18 | 7.10 | 1073 | Ipsenona | 0.69 | 1040747 | 148009 |
| 19 | 7.16 | 1078 | 6,7-Epoximirceno | 0.34 | 516213 | 69858 |
| 20 | 7.26 | 1087 | Linalool | 0.68 | 1019945 | 169404 |
| 21 | 7.37 | 1096 | 1,1-dimetil-3-metileno | 0.68 | 1021726 | 77422 |
| 22 | 7.58 | 1115 | Neo-allo-ocimeno | 0.08 | 116758 | 13352 |
| 23 | 7.81 | 1136 | (E)-Tagetona | 15.31 | 23014637 | 3445783 |
| 24 | 7.86 | 1141 | (Z)-Tagetona | 10.34 | 15541552 | 2093971 |
| 25 | 8.11 | 1164 | δ-Terpineol | 0.07 | 104740 | 13458 |
| 26 | 8.17 | 1170 | endo-Borneol | 0.66 | 995492 | 123082 |
| 27 | 8.29 | 1181 | Butanoato de hexenilo | 0.28 | 427303 | 77958 |
| 28 | 8.35 | 1186 | α-Terpineol | 2.53 | 3804588 | 644965 |
| 29 | 8.69 | 1215 | cis-Tagetenona | 24.95 | 37507700 | 4583301 |
| 30 | 8.74 | 1224 | trans-Tagetenona | 0.92 | 1388264 | 280499 |
| 31 | 9.14 | 1264 | D-Carvona | 0.19 | 285623 | 42636 |
| 32 | 9.22 | 1272 | Acetato de bornilo | 0.28 | 415495 | 87883 |
| 33 | 9.66 | 1316 | δ-Elemeno | 0.78 | 1167974 | 356171 |
| 34 | 9.70 | 1321 | Acetato de exo-2-hidroxicineol | 0.15 | 226437 | 54841 |
| 35 | 9.79 | 1330 | α-Cubebeno | 0.10 | 143587 | 30575 |
| 36 | 9.88 | 1340 | α-Longipineno | 0.02 | 23365 | 4157 |
| 37 | 10.03 | 1356 | α-Ylangeno | 0.04 | 54964 | 21851 |
| 38 | 10.09 | 1362 | Isoledeno | 0.08 | 120772 | 24978 |
| 39 | 10.18 | 1373 | α-Copaeno | 0.24 | 359337 | 82067 |
| 40 | 10.23 | 1377 | β-Cubebeno | 0.06 | 92984 | 31091 |
| 41 | 10.28 | 1382 | (Z)-Trimenal | 0.13 | 191497 | 63939 |
| 42 | 10.51 | 1409 | (E)-Cariofileno | 0.41 | 620183 | 164513 |
| 43 | 10.59 | 1416 | β-Copaeno | 0.46 | 687112 | 161620 |
| 44 | 10.64 | 1422 | (Z)-β-Farneseno | 0.41 | 618366 | 153754 |
| 45 | 10.71 | 1431 | 6,9-Guaiadieno | 0.38 | 564724 | 143243 |
| 46 | 10.79 | 1439 | cis-Muurola-3,5-dieno | 0.20 | 303922 | 89328 |
| 47 | 10.84 | 1444 | α-Humuleno | 0.13 | 190602 | 37709 |
| 48 | 10.88 | 1449 | cis-Cadina-1(6),4-dieno | 0.96 | 1439976 | 688026 |
| 49 | 10.95 | 1457 | 9-epi-(E)-Cariofileno | 2.59 | 3890548 | 3471756 |
| 50 | 11.04 | 1467 | cis-Muurola-4(14),5-dieno | 5.80 | 8718467 | 3100846 |
| 51 | 11.11 | 1475 | γ-Gurjuneno | 4.14 | 6226310 | 1660643 |
| 52 | 11.16 | 1481 | γ-Himacheleno | 3.90 | 5864328 | 1725233 |
| 53 | 11.22 | 1487 | γ-Amorfeno | 2.52 | 3790198 | 1373163 |
| 54 | 11.29 | 1495 | Valenceno | 0.63 | 940569 | 219497 |
| 55 | 11.35 | 1502 | trans-Calameneno | 0.04 | 62180 | 15768 |
| 56 | 11.47 | 1517 | α-Cadineno | 0.07 | 106650 | 24990 |
El compuesto mayoritario cis-tagetenona el cual se ha identificado en varias especies de Tagetes: T. caracasana, T. patula y T. subulata (Armas et al., 2012), T. minuta (Hethelyi et al. 1988), T. lemmonii (Turker & Maciarello 1996). El otro compuesto mayoritario (E)-tagetona se ha registrado en varias especies de Tagetes. En algunas especies este compuesto al igual que T. nelsonii se encuentra en grandes cantidades como en T. terniflora en el cual se ha reportado en un 27% (Stefanazzi, Gutierrez, Stadle, Bonini, & Ferrero, 2006) o en T. lacera (26.2%) (Díaz-Cedillo et al., 2012). También se ha encontrado en cantidades más pequeñas en T. minuta (Shirazi et al. 2014), en T. patula y T. zipaquinensis (Cropwatch 2006). Los aceites de Tagetes con una gran cantidad de (E)-tagetona han mostrado un efecto biológico contra plagas y enfermedades (Saavedra et al. 2002; Stefanazzi et al., 2006). El otro compuesto mayoritario dihidrotagetona en T. nelsonii también se ha identificado en varias especies de Tagetes. Por ejemplo, en T. minuta, y T. patula (Krishna, Mallavarapu, Kumar, & Ramesh, 2002; Moghaddam, Omidbiagi, & Sefidkon, 2007). Los compuestos tagetona junto con dihidrotagetona y las tagetenonas le proporcionan a la mayoría de las plantas Tegetes el aroma agradable cuando se rompen los tallos, hojas o flores (Cropwatch 2006). Los otros monoterpenos como la α-pineno, sabineno, linalool y z-β-ocimeno son compuestos comunes en varias especies de Tagetes (Díaz Cedillo et al., 2012; Martínez et al., 2009; Gakuubi et al. 2016).
Conclusiones
Los compuestos biosintetizados por T. nelsonii son una mezcla de compuestos terpénicos. Los compuestos mayoritarios son (E)-tagetona (43-9%) y dihidrotagetona (20.7%), seguidos por trans-β-ocimeno, eucaliptol, limoneno y β-cubebeno. T. nelsonii contiene compuestos fragantes como, α y β-pineno, trans-β-ocimeno, limoneno, linalool, (E) y (Z)-tagetona, dihidrotagetona y cis y trans-tagetenona.











 nueva página del texto (beta)
nueva página del texto (beta)