Introducción
La miel se define como una sustancia dulce producida por la abeja Apis mellifera L. (Hymenoptera: Apidae) a partir del néctar de las plantas, secreciones o excreciones de insectos que son recolectadas, transformadas y combinadas con sustancias específicas para ser almacenadas dentro de las celdas de la colmena (Normex, 1997; Codex Alimentarius Commission, 2001). Igualmente colectan polen, el cual proporciona a las abejas las proteínas, ácidos grasos, vitaminas y minerales esenciales para su desarrollo y crecimiento (Free, 1993; Grosso et al., 2008). El polen es transportado hasta la colmena de diferentes maneras: adherido al cuerpo de la abeja por el contacto con las anteras de la flor; cuando es recolectado y almacenado en las corbículas localizadas en el último par de patas de las abejas obreras o acopiadoras; o cuando cae por acción mecánica desde las anteras hasta los nectarios donde es succionado junto con el néctar (Sawyer, 1988).
En la actualidad se manifiesta un creciente interés de los consumidores por las mieles diferenciadas, siendo esto una de las principales limitantes para la planeación apícola, ya sea fija o trashumante, debido a la carencia de información sobre la procedencia de la miel que implica conocer las fuentes o recursos florales que la abeja utiliza para su producción en un lapso de tiempo y región específica (Alaniz-Gutiérrez et al., 2017). Asimismo, otro factor a considerar es la falta de conocimiento por parte de los apicultores sobre plantas “melíferas”, la mayoría suele estar sustentado en observaciones hechas en campo que pueden sobreestimar o subestimar el aprovechamiento de una especie vegetal por parte de la abeja. Una técnica que nos permite identificar los recursos florales aprovechados por la colmena es el análisis melisopalinológico, que establece los recursos poliníferos, nectaríferos y/o néctar-poliníferos aprovechados por la abeja para el sostén de la colonia y por consiguiente para la producción de miel. El estudio del polen contenido en la miel permite conocer su origen botánico y geográfico, así como, el estado de conservación del hábitat en donde ésta fue producida (Louveaux et al., 1978; Alaniz-Gutiérrez et al., 2017).
Es de resaltar que aun siendo México uno de los principales productores apícolas en el continente americano, los estudios sobre el origen botánico y/o geográfico de la miel son escasos (SAGARPA, 2001). Sin embargo, se han realizado algunos análisis palinológicos tanto a mieles de abejas europeas como nativas, desarrollados principalmente en la Península de Yucatán, y en estados como Baja California, Chiapas, Guerrero, Jalisco, Morelos, Oaxaca, Puebla, Tabasco y Veracruz (Villanueva-Gutiérrez, 1984; Martínez-Hernández et al., 1993; Villanueva-Gutiérrez, 2002; Piedras-Gutiérrez y Quiroz-García 2007; Quiroz-García y Arreguín-Sánchez, 2008; Villanueva-Gutiérrez et al., 2009; Castellanos-Potenciano et al., 2012; Ramïrez-Arriaga et al., 2016, Alaniz-Gutiérrez et al., 2017). Este último estado contando con solo un trabajo de referencia (Villanueva-Gutiérrez, 1984) dirigido al análisis de cargas de polen curbicular.
El objetivo de este trabajo es ampliar los conocimientos sobre los principales recursos florales aprovechados por la abeja Apis mellifera para la producción de miel en dos localidades de la zona centro del estado de Veracruz, consideradas ambas por los apicultores como áreas de gran valor para la producción de miel. Para lograrlo, se recolectaron muestras de miel que fueron procesadas y caracterizadas utilizando técnicas y metodologías propuestas por Erdtman (1943), Louveaux et al. (1978) y Von Der Ohe et al. (2004).
Material y métodos
Área de estudio
La zona centro del Estado de Veracruz colinda al oeste con la Sierra Madre Oriental y la Meseta Central de México, y al este con el Golfo de México, está conformada por diferentes condiciones climáticas y hábitats, por un lado, están las montañas de la Sierra Madre y la parte oriental del Eje Neovolcánico Transversal que incluye el Cofre de Perote y el pico de Orizaba. Podemos encontrar hábitats que se rigen principalmente por bosques de coníferas, latifoliados, mesófilo de montaña, vegetación semidesértica de la meseta central y pequeños manchones de bosques de yuca, con climas templados y de alta montaña (García, 1981; Rzedowski, 2006). Por otro lado, en la parte intermedia y baja podemos encontrar tierras con climas tropicales y planicies costeras que presentan mosaicos de vegetación en donde dominan las selvas tropicales caducifolias y humedales. Conformadas por especies vegetales como palo mulato (Bursera simaruba), pochote (Ceiba aesculifolia) y copales (Bursera spp.), entre otras. En las áreas cubiertas por este tipo de vegetación, el uso más común de la tierra consiste en la ganadería, ya que desde el punto de vista de la explotación forestal sus especies son de escasa importancia (Rzedowski, 2006).
Para el presente estudio se tomaron muestras de miel provenientes de apiários de dos localidades, su ubicación se muestra en la Figura 1. La primera localizada en Altotonga con coordenadas geográficas 19°45′58″ latitud norte y 97°14′44″ latitud oeste, con un clima templado húmedo y una temperatura media anual de 15°C; la segunda en Plan del Rio con coordenadas geográficas 19° 20’ 33.5″ latitud norte y 96° 34’ 39.9″ latitud oeste, con un clima cálido subhúmedo y una temperatura media anual sobre los 22°C.
Metodología
Se estableció un calendario a partir de las agendas apícolas utilizadas por los apicultores de las dos localidades seleccionadas, en las cuales se definieron dos temporadas de muestreo que abarcaron los siguientes meses: octubre y noviembre del año 2015; y marzo, abril y mayo del 2016. De igual forma, para la selección de los sitios de estudio se tomó en consideración las áreas que utilizan los apicultores para ubicar sus colmenas en búsqueda de floraciones exuberantes. Las muestras fueron tomadas el último día de cada mes y en un apiario fijo por sitio, en donde se procedió a seleccionar tres colmenas al azar de las cuales se extrajo un bastidor de alza melaría, el cual debía de cumplir con dos condiciones: no contener celdas con polen y no poseer opérculo lo que se le conoce comúnmente como “miel inmadura”. A los bastidores seleccionados se les extrajo con la ayuda de un cuchillo una porción de panal cuadrada de 10 centímetros de lado que fue almacenada en bolsas de plástico individuales, las cuales fueron marcadas con las letras AL (Altotonga) y PL (Plan del Rio) seguidas de un número consecutivo (1, 2, 3, etc.). La miel fue exprimida manualmente de las muestras de panal y se almacenó en frascos de cristal independientes marcados con los datos de cada sitio.
Procesamiento y análisis de las muestras
Las muestras de miel resultantes fueron acetolizadas siguiendo la metodología de Erdtman, (1943). Posteriormente fueron montadas en pares con la finalidad de tener un resguardo y selladas en aceite de silicón sobre un portaobjetos, para posteriormente ser analizadas en un microscopio utilizando los objetivos 10X, 40X, y 100X. La identificación de los tipos polínicos se realizó a diferentes niveles taxonómicos, cuando no se logró identificar hasta especie se agregó un superíndice consecutivo para distinguir los granos de polen identificados por primera vez y pertenecientes a un mismo nivel taxonómico (ej. Asteraceae1, Asteraceae2, etc.), asimismo, aquellos que no lograron ser identificados se etiquetaron como morfoespecie 1, 2, 3, 4, 5. Los granos de polen fueron comparados con diferentes claves y atlas palinológicos realizados por Palacios-Chávez et al. (1991), Roubik y Moreno (1991) y Martínez-Hernández et al. (1993). Asimismo, para el caso de Altotonga y debido a que no se cuenta con un estudio de referencia previo, como si se tiene en Plan del Rio (Villanueva-Gutiérrez, 1984), se realizó un levantamiento de la flora (Atlas palinológico) alrededor del apiario que fue acetolizada para facilitar la identificación de los granos de polen. Siguiendo la metodología propuesta por Louveaux et al. (1978) y Von Der Ohe et al. (2004), se trazaron 5 líneas imaginarias equidistantes, paralelas y uniformemente distribuidas a lo largo del área del cubreobjetos y se procedió a cuantificar al azar 100 granos de polen por línea hasta alcanzar 500 granos. En el caso de mieles con un bajo contenido de polen se cuantificó el total de granos presente en la muestra. Se calcularon los porcentajes de cada tipo polínico presente en las muestras y se categorizaron de la siguiente manera (Louveaux et al., 1978; Sawyer, 1988): traza (< 3%); minoritario importante (3-15%); secundario (16-44%); y dominante (> 45%). Por último, en este trabajo se consideraron especies de importancia apícola aquellos tipos polínicos que registraron porcentajes mayores o iguales a 10% en alguna muestra de miel.
Resultados
En ambas localidades se determinaron y describieron palinológicamente un total de 64 tipos polínicos correspondientes a 28 familias botánicas, 31 especies fueron registradas en Altotonga y 33 en Plan del Río (Tabla 1). Para la conformación del atlas palinológico se colectaron y acetolizaron un total de 24 especies botánicas que fueron identificadas y resguardas en el Herbario Xal del Instituto de Ecología.
Tabla 1 Tipos polínicos determinados por sitios. Especies de importancia apícola que registraron frecuencias > 10% en muestras de miel (*); tipos polínicos que fueron registrados en el atlas palinológico de referencia (AP).
| Altotonga | Plan del Río | ||
|---|---|---|---|
| Adoxaceae | Sambucus nigra subsp. canadensis (L.) Bolli* (AP) | Anarcadiaceae | Spondias purpurea L. |
| Asteraceae | Ageratum sp.1* | Arecaceae | Cocos nucifera L. |
| Asteraceae1* | |||
| Asteraceae2 | Asteraceae | |Asteraceae3* | |
| Asteraceae4 | Asteraceae6 | ||
| Asteraceae5 | Eupatorium sp.1 | ||
| Asteraceae7 | Heliantheae 1 | ||
| Barkleyanthus salicifolius (Kunth) H. Rob & Bretell (AP) | Viguiera dentata (Cav.) Spreng. * | ||
| Bignoniaceae | Cydista sp.1* | ||
| Bidens pilosa L.* | Boraginaceae | Cordia dodecandra DC. | |
| Eupatorium sp.2 | Cordia sp.1* | ||
| Betulaceae | Alnus sp. 1 | Bromeliaceae | Tillandsia sp.1* |
| Brassicaceae | Raphanus raphanistrum L.* (AP) | Burseraceae | Bursera simaruba (L.) Sarg.* |
| Curcubitaceae | Sicyos sp.1 | Bursera sp.1* | |
| Fabaceae | Fabaceae1* | Cannabaceae | Trema micrantha (L.) Blume |
| Fabaceae4 | Convolvulaceae | Convolvulaceae1 | |
| Trifolium repens L.* (AP) | Euphorbiaceae | Croton sp.1 | |
| Vicia faba L. | Euphorbia sp.1 | ||
| Lauraceae | Persea americana Mill. * (AP) | Euphorbia sp.2 | |
| Lamiaceae | Lamiaceae1 | Fabaceae | Acacia pennatula (Schltdl. & Cham.) Benth. |
| Myrtaceae | Eugenia sp.1 | Caesalpinia sp.1 | |
| Onagraceae | Lopezia racemosa Cav* (AP) | Delonix regia (Bojer ex Hook.) Raf. | |
| Rhamnaceae | Rhamnus sp.1* | Fabaceae2 | |
| Rosaceae | Malus domestica Borkh* (AP) | Fabaceae3 | |
| Prunus sp.1* | Leucaena lanceolata S. Watson | ||
| Rosaceae1 | Malvaceae | Abutilon sp.1 | |
| Rosaceae2 | Ceiba aesculifolia (Kunth) Britten & Baker f. | ||
| Rubiaceae | Rubiaceae1* | Heliocarpus sp.1* | |
| Solanaceae | Datura metel L. | Heliocarpus sp.2 | |
| Solanaceae1 | Poaceae | Poaceae1 | |
| Solanum sp.1 | Rhamnaceae | Rhamnaceae1* | |
| Umbelliferae | Umbelliferae1 | Rutaceae | Rutaceae1 |
| Sapotaceae | Pouteria sp.1 | ||
| Pouteria sp.2 | |||
Las familias botánicas que registraron el mayor número de tipos polínicos fueron Asteraceae (14) y Fabaceae (10). Así pues, hubo otras familias que registraron más de uno: Rosaceae (4), Malvaceae (4), Solanaceae (3), Euphorbiaceae (3), Sapotaceae (2), Rhamnaceae (2), Burseraceae (2) y Boraginaceae (2) (Tabla 1). Altotonga registró ocho muestras en donde una especie vegetal se catalogó como dominante, siendo Raphanus raphanistrum la mejor representada con cuatro, seguida de Prunus sp.1 (3) y Rhamnus sp.1 (1). En el caso de Plan del Rio se registraron 14 muestras con categoría de polen dominante de las cuales seis fueron de Bursera simaruba, seguida de Heliocarpus sp.1 (3), Viguiera dentata (3) y Cordia sp.1 (2). A continuación, se muestran fotografías de todos los tipos polínicos que alcanzaron la categoría de dominante durante todos los meses de muestro (Fig. 1).
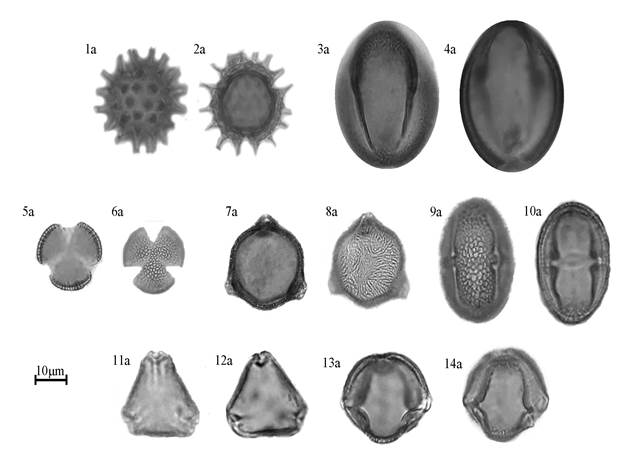
Fig. 1 Asteraceae. 1a-2a: Viguiera dentata; Boraginaceae. 3a-4a: Cordia sp.1; Brasicaceae. 5a-6a: Raphanus raphanistrum; Burseraceae. 7a-8a: Bursera simaruba; Malvaceae. 9a-10a: Heliocarpus sp.1; Rhamnaceae. 11a-12a: Rhamnus sp.1; Rosaceae. 13a a 14a: Prunus sp.1
En Altotonga las muestras AL01, AL02, AL03 y AL06, Raphanus raphanistrum registró porcentajes que van de 46.8 a 65.1%. Asimismo, se identificaron otras cuatro especies de importancia apícola: Asteraceae1, Bidens pilosa, Lopezia racemosa y Fabaceae1, la segunda y la cuarta catalogadas como polen secundario (Tabla 2). En el mes de marzo de 2016 las muestras resultantes fueron catalogadas como dominantes de Prunus sp.1 que fluctuó sus porcentajes de 49.6% a 54.8% (Tabla 2). Malus domestica fue un componente habitual en las tres muestras de este mes, categorizándose como polen secundario al igual que Persea americana en AL08. Por último, se registró otra especie de la familia Asteraceae con porcentajes >10% (Asteraceae1), en este periodo de muestreo destaca la presencia de polen proveniente de plantas cultivadas, relegando especies silvestres a categorías inferiores. Para abril del mismo año solo una muestra (AL12) etiqueto a Rhamnus sp.1 como especie dominante (46.2%), acompañada por Ageratum sp.1 como polen secundario (26.6%) y en menor medida a Prunus sp.1 que es relegada a la categoría de polen minoritario importante en todas las muestras de este mes, disminuyendo su presencia en comparación al periodo anterior. En AL10 y AL11 ningún tipo polínico predomino y los mejor representados en ambas muestras fueron: Ageratum sp.1 (23.7% y 22.6%, respectivamente) y Rhamnus sp.1 (35.7% y 40.2%, respectivamente), ambas como polen secundario (Tabla 2). Pocas especies se conservan del mes anterior, sin embargo, elementos arbóreos se mantienen constantes. En el último mes analizado de 2016, ningún tipo polínico registro altas proporciones en las muestras recolectadas (Tabla 2), sin embargo, se compartieron especies del mes anterior indicando una alta preferencia por estos recursos. La especie mejor representada fue Rhamnus sp.1, que alcanzó porcentajes de entre 26.3% a 38%, catalogándose como polen secundario. Hubo otras tres especies que presentaron frecuencias relativas altas sin llegar a categorías secundarias: Sambucus nigra que en AL14 obtuvo 12.7%; Trifolium repens en AL13 y AL15 logro 13% y 13.2% respectivamente; Rubiaceae1 que en AL15 obtuvo 12% (Tabla 2).
Tabla 2 Distribución porcentual y categoría registrada por cada tipo polínico identificado en las muestras de Plan del Rio (PL) y Altotonga (AL). T, polen traza (< 3 %); M, minoritario importante (3-15%); S, secundario (16-44%); D, predominante (> 45%).
| Especie | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nov- 2015 | Oct-2015 | Mar-2016 | Abr-2016 | Mayo-2016 | ||||||||||||||||||||||||||
| PL01 | PL02 | PL03 | AL01 | AL02 | AL03 | PL04 | PL05 | PL06 | AL04 | AL05 | AL06 | PL07 | PL08 | PL09 | AL07 | AL08 | AL09 | PL10 | PL11 | PL12 | AL10 | AL11 | AL12 | PL13 | PL14 | PL15 | AL13 | AL14 | AL15 | |
| Sambucus nigra | - | - | - | - | - | - | - | - | - | 1.2 T | - | 1 T | - | - | - | - | - | - | - | - | - | 2.3 T | 5.9 M | 1.6 T | - | - | - | 10.6 M | 12.7 M | 7.6 M |
| Spondias purpurea | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 1.8 T | 0.8 T | 0.4 T | - | - | - | - | - | - | - | - | - |
| Cocos nucifera | - | - | - | - | - | - | - | - | - | - | - | - | 1.5 T | 2.2 T | 1.2 T | - | - | - | 1.6 T | 1 T | 0.4 T | - | - | - | 1.4 T | 0.7 T | 0.4 T | - | - | - |
| Ageratum sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 23.7 S | 22.6 S | 26.6 S | - | - | - | - | - | - |
| Asteraceae1 | - | - | - | 7 M | 5.4 M | 8.4 M | - | - | - | 14.4 M | 10.8 M | 10.2 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Asteraceae2 | - | - | - | 0.6 T | 1 T | - | - | - | - | - | 0.4 T | 1.4 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Asteraceae3 | - | - | - | - | - | - | 33.3 S | 20.4 S | 24.2 S | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Asteraceae4 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | 0.2 T | 0.4 T | - | - | - | - | - | - | - | - | - | - | - | - |
| Asteraceae5 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 2 T | - | - | - | 7.6 M | 9.9 M | 4 M | - | - | - | - | - | - |
| Asteraceae6 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.6 T | - | - | - | - | - |
| Asteraceae7 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 5.2 M | 2.2 T | 4.4 M |
| Barkleyanthus salicifolius | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 2 T | 2.2 T | 1.8 T | - | - | - | - | - | - | - | - | - | - | - | - |
| Bidens pilosa | - | - | - | 20.4 S | 16.3 S | 18 S | - | - | - | 7.4 M | 16.8 S | 8.8 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Eupatorium sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 6 M | 5.4 M | 5 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Eupatorium sp.2 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 2.2 T | 2.9 T | 1.4 T |
| Heliantheae1 | - | - | - | - | - | - | - | - | - | - | - | - | 0.5 T | 0.4 T | 2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Viguiera dentata | 96.2 D | 95.8 D | 94.6 D | - | - | - | 4.3 M | 1.8 T | 1.4 T | - | - | - | 0.5 T | 2.2 T | 1.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Alnus sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | 0.2 T | - | - | - | - | - | - | - | - | - | 0.2 T | 0.3 T | - |
| Cydista sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 2 T | - | - | - | - | 12 M | 9.3 M | 9 M | - | - | - |
| Cordia dodecandra | - | - | - | - | - | - | - | - | - | - | - | - | 8.5 M | 0.2 T | 1.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Cordia sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 50.5 D | 43.6 S | 48.8 D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Raphanus raphanistrum | - | - | - | 56.2 D | 65.1 D | 58.2 D | - | - | - | 38 S | 42 S | 46.9 D | - | - | - | 1.6 T | 4.2 M | 2.8 T | - | - | - | 4.1 M | 2 T | 3 M | - | - | - | 13 M | 11.8 M | 12.9 M |
| Tillandsia sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 11.5 M | 16 S | 10.6 M | - | - | - | - | - | - | - | - | - | - | 0.3 T | - | - | - | - |
| Bursera simaruba | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 65.4 D | 79.2 D | 75.4 D | - | - | - | 53.8 D | 49.7 D | 58 D | - | - | - |
| Bursera sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 16.8 S | 15.6 M | 20 S | - | - | - | 11.2 M | 9.9 M | 12 M | - | - | - |
| Trema micrantha | - | - | - | - | - | - | - | 2.2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Convolvulaceae1 | - | - | - | - | - | - | 0.6 T | - | 0.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Sicyos sp.1 | - | - | - | 1.4 T | 1.4 T | 3 M | - | - | - | 2.8 T | 0.6 T | 1.2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Croton sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 3.5 M | 6 M | 3.6 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Euphorbia sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 4.5 M | 6.2 M | 8 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Euphorbia sp.2 | - | - | - | - | - | - | - | - | - | - | - | - | 5.5 M | 6.4 M | 5.4 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Acacia pennatula | - | - | - | - | - | - | - | - | - | - | - | - | 4.5 M | 1.2 T | 1 T | - | - | - | 4 M | 1 T | 0.2 T | - | - | - | 1 T | 2 T | 1.8 T | - | - | - |
| Caesalpinia sp.1 | - | - | - | - | - | - | 0.8 T | 2 T | 0.4 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Delonix regia | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.3 T | - | - | - | - |
| Fabaceae1 | - | - | - | 1.2 T | 0.9 T | 1 T | - | - | - | 33.6 S | 27.4 S | 29.3 S | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Fabaceae2 | - | - | - | - | - | - | - | - | - | - | - | - | - | 2.2 T | 2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Fabaceae3 | - | - | - | - | - | - | - | - | - | - | - | - | - | 3.4 M | 3 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Fabaceae4 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 3 M | 1 T | 2.6 T |
| Leucaena lanceolata | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | - | - | - | - | 5.8 M | 0.6 T | 1.4 T | - | - | - | 0.6 T | 1.3 T | 0.4 T | - | - | - |
| Trifolium repens | - | - | - | - | - | 0.2 T | - | - | - | 1.6 T | 0.6 T | - | - | - | - | - | - | - | - | - | - | 5 M | 4 M | 6.2 M | - | - | - | 13 M | 9.9 M | 13.2 M |
| Vicia faba | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 4 M | 2.7 T | 2.4 T | - | - | - | - | - | - | - | - | - | 0.4 T | 1.3 T | 0.6 T |
| Persea americana | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 12 M | 18.4 S | 3.2 M | - | - | - | - | - | - | - | - | - | - | - | - |
| Lamiaceae1 | - | - | - | - | - | 0.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Abuliton sp.1 | 2.2 T | 3.2 M | 4.1 M | - | - | - | - | 4.2 M | 0.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Ceiba aesculifolia | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 4.6 M | 0.6 T | 2.2 T | - | - | - | - | - | - | - | - | - |
| Heliocarpus sp.1 | 0.4 T | 0.5 T | 0.2 T | - | - | - | 60.6 D | 69.4 D | 72.2 D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Heliocarpus sp.2 | - | - | - | - | - | - | - | - | - | - | - | - | 0.5 T | 1.4 T | 3 M | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Eugenia sp. 1 | - | - | - | - | - | - | - | - | - | 0.2 T | 0.6 T | 0.2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Lopezia racemosa | - | - | - | 13.2 M | 9.9 M | 10.4 M | - | - | - | 0.8 T | 0.6 T | 1 T | - | - | - | - | - | - | - | - | - | - | 1 T | - | - | - | - | 1 T | - | 3.7 M |
| Poaceae1 | 1.2 T | 0.5 T | 1.1 T | - | - | - | 0.4 T | - | 0.2 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Rhamnaceae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 10 M | 16.6 S | 12 M | - | - | - |
| Rhamnus sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | - | - | - | 35.7 S | 40.2 S | 46.2 D | - | - | - | 38 S | 33.4 S | 26.3 S |
| Malus domestica | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 28 S | 20.6 S | 30.6 S | - | - | - | 3.5 M | 0.6 T | 0.8 T | - | - | - | 0.4 T | 2.8 T | - |
| Prunus sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 52 D | 49.6 D | 54.8 D | - | - | - | 13.2 M | 11.4 M | 8.6 M | - | - | - | 10.6 M | 11.8 M | 13.2 M |
| Rosaceae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | 1.7 T | 1.4 T | - | - | - | 0.4 T | 0.4 T | - | - | - | - | - | - | - |
| Rosaceae2 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 1 T | - | 0.6 T |
| Rubiaceae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 1.2 T | 9.6 M | 12 M |
| Rutaceae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 9.4 M | 9.9 M | 6.4 M | - | - | - |
| Pouteria sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | 2.5 T | 1.8 T | 1 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Pouteria sp.2 | - | - | - | - | - | - | - | - | - | - | - | - | - | 1.2 T | 1.8 T | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Datura metel | - | - | - | - | - | - | - | - | - | - | 0.2 T | 0.2 T | - | - | - | - | - | - | - | - | - | 3.5 M | 0.6 T | 0.2 T | - | - | - | - | - | - |
| Solanaceae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.6 T | 0.6 T | - | - | - | - | - | 0.6 T |
| Solanum sp.1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 1 T | 0.4 T | 2 T | - | - | - | - | - | - |
| Umbelliferae1 | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | 0.2 T | 0.2 T | - | - | - | 0.2 T | 0.3 T | 0.9 T |
En Plan del Rio las muestras PL01, PL02 y PL03 correspondientes al mes de octubre de 2015 la especie Viguiera dentata es la más representativa registrando valores de 94.5% a 96.2% (Tabla 2). Este mes registró el menor número de especies de todo el estudio, así como las proporciones más altas alcanzadas por un tipo polínico. De la misma forma Heliocarpus sp.1 alcanzó categoría de dominante en el mes de noviembre contando con frecuencias relativas que variaron de 60.5% a 72.2%. Asteraceae3 fue otra especie de importancia en este mes como polen secundario. Para marzo del 2016 en las muestras PL07 y PL09 la especie Cordia sp.1 alcanzó porcentajes importantes de entre 50.5% y 48.8% respectivamente (Tabla 2). Cabe resaltar que en este mes se identificó el mayor número de tipos polínicos de todo el estudio (17) y el único que registró una muestra en donde ningún tipo polínico logró ser predominante (PL08) para todos los meses analizados en este sitio. Tillandsia sp.1 consiguió categoría de polen secundario en PL08 y fue junto con la primera, las únicas especies que significaron una fuente alimenticia importante para la colmena. En las muestras de abril y mayo de 2016 la especie Bursera simaruba fue la más destacada, siendo un recurso alimenticio constante e importante para las abejas, con porcentajes de entre 49.6% a 79.2% (Tabla 2). En ambos meses se identificó como polen secundario a Bursera sp.1, fluctuando sus proporciones de 9.9% a 16.8%, registrando los valores más altos en el mes de abril. Por último, resaltan otras dos especies relevantes para el sostén de la colmena: Rhamnaceae1 con categoría de polen secundario en PL14 con 16.6%; y Cydista sp.1 como polen minoritario importante (12%) en PL13 (Tabla 2).
Discusión
Las familias Asteraceae y Fabaceae registran el mayor número de especies, concordando con lo reportado por Villanueva-Gutiérrez (1984), Martínez-Hernández et al. (1993), Villanueva-Gutiérrez (2002), Moguel-Ordoñez et al. (2005), Quiroz-García y Arreguín-Sánchez (2008) y Villanueva-Gutiérrez et al. (2009), que las ubican como las familias más importantes en trabajos sobre melisopalinología. De la misma forma, es importante resaltar que se determinaron tipos polínicos pertenecientes a familias propias de una vegetación secundaria como las Convolvulaceae, Poaceae y Euphorbiaceae ( Guevara et al., 2008; Gómez-Pompa et al., 2010). Hubo especies características de la selva baja caducifolia (localidad de Plan del Rio) que lograron altas proporciones en muestras de miel, destacando los géneros: Bursera spp. y Tillandsia spp., indicando que, aunque el grado de perturbación es mayor con respecto a lo reportado por Villanueva-Gutiérrez (1984), todavía existen elementos propios de la vegetación original. En Altotonga los cultivos de clima templado son los recursos nectaríferos de mayor importancia, complementándose con elementos herbáceos. Aunque la familia Asteraceae registra el mayor número de especies solamente Ageratum sp.1, Asteraceae1, Asteraceae3, Bidens pilosa y Viguiera dentata lograron alcanzar porcentajes de importancia, y únicamente la última alcanzó la categoría de dominante. Villanueva-Gutiérrez, (1984) y Villanueva-Gutiérrez et al. (2009) reportan a esta especie como dominante en muestras de miel y polen, identificándola en los mismos meses y dependiendo la producción de miel casi exclusivamente de ella.
Es de remarcar que la familia Burseraceae con las especies Bursera simaruba y Bursera sp.1 fue de los principales recursos nectaríferos utilizados por las colmenas en el primer semestre del año en Plan del Rio. Han sido reportadas por Villanueva-Gutiérrez et al. (2009) en mieles de la Península de Yucatán, Ramírez-Arriaga et al. (2011) en Oaxaca y por Córdova-Córdova et al. (2013) en Tabasco, asimismo, Villanueva-Gutiérrez (1984) identifica a la familia como un elemento abundante en cargas de polen curbicular en la misma localidad. Porter-Bolland et al. (2009) la destaca como una de las floraciones más importantes y significativas en la Península de Yucatán.
Raphanus raphanistrum (Brassicaceae) es la herbácea más importante, relacionándose la presencia de esta especie con el periodo de “descanso” que se da entre ciclos de cultivo a finales del año y siendo el único tipo polínico que estuvo presente en todos los meses muestreados en Altotonga. La familia ha sido reportada en muestras de miel en el estado de Zacatecas por Acosta-Castellanos et al. (2011), sin embargo, no alcanzó porcentajes significativos, contrastando con lo encontrado en este trabajo. Es conocida comúnmente como Jaramado por los apicultores de la región, sin embargo, que no la consideran una especie importante para la producción de miel, ubicándola por debajo de especies melíferas como acahual (Simsia spp.) y mozote amarillo (Sclerocarpus spp.), no obstante, ninguna figuró dentro de las muestras analizadas. Cabe resaltar que se determinaron tipos polínicos de los cuales no se tiene registro dentro de lo reportado en la flora de importancia apícola para el estado de Veracruz (Villegas et al., 2003) y que sobresalen por ser fuentes alimenticias aprovechadas de manera secundaria por la abeja: la primera Sambucus nigra (Adoxaceae) fue descrita en Altotonga y es distinguida por Basilio y Romero (2002) y Wróblewska y Warakomska (2009) como un recurso néctar-polinífero importante en zonas de clima templado, coincidiendo con las condiciones climatológicas de esta localidad; y la segunda Tillandsia sp.1 (Bromeliaceae) registrada de igual forma como abundante por Villanueva-Gutiérrez, (1984) en cargas de polen curbicular en Plan del Río. Las abejas de manera general son reconocidas como visitantes florales y polinizadores de la familia Bromeliaceae (Carranza-Quiceno y Estévez-Varón, 2008).
La Bignoniaceae del género Cydista spp., fue registrada con categoría de polen minoritario importante en el mes de mayo para Plan del Rio. El género es reportado en trabajos melisopalinológicos en la Península de Yucatán, igualmente, la especie Cydista potosina es identificada como una de las principales fuentes néctar-poliníferas aprovechadas por la abeja Melipona beecheii en la Península de Yucatán (Villanueva-Gutiérrez, 2002). Cordia sp.1 (Boraginaceae) es una especie dominante en la localidad de Plan del Rio en el primer semestre del año, el género es reconocido por Villanueva-Gutiérrez (1984), Martínez-Hernández et al. (1993), Villanueva-Gutiérrez (2002), Porter-Bolland et al. (2009) y Alfaro-Bates et al. (2010) como una especie néctar-polinífera importante para las abejas. La segunda familia con el mayor número de especies fue las Fabaceae, no obstante, solamente Fabaceae1 y Trifolium repens, en Plan del Rio y Altotonga respectivamente, registraron categorías de importancia apícola. De manera general los apicultores de Altotonga identifican a la miel producida entre los meses de septiembre y octubre como “miel de trébol” (Trifolium repens), sin embargo, dentro del periodo analizado no logró categoría de dominante difiriendo con especulado por los productores sobrevalorando su presencia. Los cultivos de clima templado Persea americana (Lauraceae), Prunus sp.1 (Rosaceae) y Malus domestica (Rosaceae) fueron sin duda los elementos arbóreos más importantes en Altotonga. La primera es una de las floraciones más apreciadas por los apicultores de la zona entre los meses de diciembre y marzo, la miel derivada de este cultivo cuenta con un singular color y sabor. Varios estudios identifican a la abeja europea como uno de los principales visitantes florales del aguacate, catalogándola como un excelente polinizador del cultivo (Vithanage, 1990; Cabezas y Cuevas, 2007) y justificando su presencia en las muestras de miel de marzo. Yuca-Rivas (2016) identifica polen de aguacate en muestras de miel analizadas en el Perú. Prunus sp.1 fue la única de las tres que registró categoría dominante, Roselló Caselles et al. (1996) y Yuca-Rivas (2016) la catalogan como una especie néctar-polinífera significativa. Por otro lado, Malus domestica adquirió un papel secundario y es mencionada por diferentes investigadores como una especie frecuentemente visitada por la abeja, reportándose un aumento importante en la producción en presencia de ésta ya que la especie presenta un alto grado de incompatibilidad, requiriendo de un vector para la polinización de sus flores, agregándole un extra a la actividad apícola (Botero-Garces y Morales-Soto, 2000; Thomson y Goodell, 2001; Vicens y Bosch, 2007). La especie Heliocarpus sp.1 fue categorizada como dominante en el primer periodo de muestreo en Plan del Rio. Villanueva-Gutiérrez (1984) reporta el género como abundante en muestras de polen curbicular, asimismo, Martínez-Hernández et al. (1993) describe dos especies de la familia Malvaceae aprovechadas por abejas meliponas ya sea como fuente de polen y/o néctar. Jacinto et al. (2016) al igual que Quiroz-García & Arreguín-Sánchez (2008) describen al género en muestras de miel provenientes del estado de Tabasco, clasificándola como polen secundario.
Lopezia racemosa (Onagraceae) fue otra herbácea con una presencia significativa en Altotonga sin llegar a ser dominante y reportándose en cuatro de los cinco meses analizados, asociada su presencia a los periodos en donde la actividad agrícola de la zona cesa. Quiroz-García y Arreguín-Sánchez (2008) catalogan de igual manera el género Lopezia spp., como polen minoritario importante en mieles provenientes del estado de Morelos. Dentro de las Rhamnaceae se identificaron dos especies importantes: la primera Rhamnaceae1 en Plan del Río; y la segunda Rhamnus sp.1 en Altotonga, esta última con categoría de dominante. La familia ha sido reportada por Naab et al. (2001) y Yuca-Rivas (2016) como una de las fuentes principales de néctar para la producción de miel en Argentina y Perú, respectivamente. En México (Martínez-Hernández et al. (1993) reporta a la familia como una de las principales fuentes alimenticias aprovechadas por abejas meliponas, sin embargo, no se documenta como una especie visitada por la abeja europea. No es considerada una especie melífera en la región, por lo que su presencia resulta de vital importancia para el sostén de las colmenas en los periodos interanuales dentro del calendario apícola. Rubiaceae1 fue la única representante de las Rubiaceae, identificada en muestras de miel provenientes de Altotonga con porcentajes >10%. Se sabe que la familia en general es una fuente importante de polen, presentándose mayormente en acahuales. Ha sido reportada en trabajos de Wróblewska y Warakomska, (2009) y Jacinto et al. (2016) como una fuente de polen minoritario importante. Por otro lado, Villanueva-Gutiérrez et al. (2009) registra algunos géneros de la familia con categorías de monofloral para la Peninsula de Yucatán.
Hubo familias como Anarcadiaceae, Arecaceae, Betulaceae, Bignoniaceae, Curcubitaceae, Euphorbiaceae, Lamiaceae, Myrtaceae, Poaceae, Rubiaceae, Rutaceae, Sapotaceae, Solanaceae y Umbelliferae con tipos polínicos que registraron porcentajes por debajo del 10%, considerados como recursos alternos para Apis mellifera (Ramïrez-Arriaga et al., 2016). De acuerdo con lo registrado por Villanueva-Gutiérrez (1984) en la localidad de Plan del Rio, encontramos que 35 años después de haber realizado este primer estudio hubo una disminución del 57.7% respecto al número total de especies descritas en los mismos meses en los que se realizó el trabajo (78).
Conclusiones
Los resultados permitieron identificar los recursos nectaríferos más representativos en cada una de las áreas de estudios en un tiempo determinado, se ratifica la importancia de las Asteraceae, Burseraceae y Brassicaceae para la producción de miel, asimismo, es de resaltar la presencia de las familias Adoxaceae y Bromeliaceae, que de manera general no son clasificadas como flora apícola, sin embargo, variaron su presencia a lo largo de los meses alcanzado categorías significativas. En la última parte del año (otoño), en ambas localidades se observa una alta dominancia de elementos herbáceos, confirmando que la vegetación persistente en los alrededores de los apiários posiblemente este conformada por acahuales y áreas perturbadas. Las especies leñosas registran una mayor presencia en los meses de primavera, yendo de la mano con la fenología reproductiva que se observa en especies vegetales perennes. Los cultivos de clima templado son una fuente indispensable de néctar y polen en los alrededores de la localidad de Altotonga, sin éstos, la región posiblemente perdería mucho del valor apícola por el que se distingue. Se reafirma la importancia apícola de las especies Bursera simaruba y Viguiera dentata que garantizan ser fuentes de néctar primordiales para la producción de miel. Es necesario continuar este trabajo en años consecutivos y afinar el levantamiento de la flora nectarífera que facilite la identificación de todos esos tipos polínicos que no fueron identificados hasta especie. Finalmente se espera contribuir a la consolidación de la apicultura como una de las principales actividades pecuarias del estado de Veracruz.











 nueva página del texto (beta)
nueva página del texto (beta)