Introducción
Las enfermedades bacterianas son un problema grave en sistemas de producción en invernadero y a campo abierto. Entre los principales patógenos bacterianos responsables del daño en órganos de tomate como raíces, tallos, ramas, hojas, brotes, flores y frutos en las regiones cálidas y templadas del mundo se encuentran las tres bacterias que se emplearon en este trabajo: Pseudomonas syringae pv. tomato, agente causal de la peca bacteriana que provoca la deformación de los frutos, los cuales aparecen con manchitas deprimidas o manchas pequeñas y sobresalientes, asimismo, esta enfermedad provoca la caída de las flores, lo cual puede reducir en un 75% la cosecha. Por otro lado, Xanthomonas vesicatoria, es una bacteria que afecta hojas, tallos y frutos, y causa manchas de 2 a 3 mm que se vuelven angulares y cuya superficie puede parecer grasienta, con el centro traslúcido y el borde negro. Finalmente, Clavibacter michiganensis subsp. michiganensis es el agente causal del cancro bacteriano, enfermedad muy seria en tomate, distribuida a nivel mundial, afecta los frutos, provocando manchas oscuras rodeadas de un halo blanco, similar a un ojo de pájaro (López-Marín, 2017). Las dos primeras bacterias causan enfermedades parenquimáticas, mientras que la última causa enfermedades parenquimáticas y vasculares (Balestra, Heydari, Ceccarelli, Ovidi, & Quattrucci, 2009).
En la actualidad, solo se dispone de algunas medidas para el control de las enfermedades mencionadas, en particular en la agricultura orgánica. Los principales problemas en el control de enfermedades bacterianas son la falta de disponibilidad de compuestos antibacterianos comerciales adecuados. Los antibióticos son cuestionables por varias razones y, por lo tanto, están prohibidos en muchos países. Los tratamientos con cobre y las prácticas agronómicas apropiadas, como la certificación de semillas, el riego y la fertilización, son las principales medidas utilizadas actualmente para controlar las enfermedades mencionadas. Como alternativa a los compuestos de cobre, recientemente se han propuesto algunas sustancias naturales, pero se necesitan más estudios para optimizar su efectividad. Considerando la falta de alternativas válidas a los compuestos de cobre y la falta de disponibilidad de cultivares comerciales resistentes a Pst, Xcv y Cmm, se ha propuesto como alternativa el uso de extractos vegetales y/o sus metabolitos secundarios (Handelsman & Stabb, 1996).
De acuerdo con (Cowan, 1999), entre los principales grupos de metabolitos secundarios presentes en las plantas con propiedades antimicrobianas se encuentran los compuestos fenólicos, algunos terpenoides presentes en los aceites esenciales y los alcaloides que son compuestos nitrogenados heterocíclicos.
J. dioica perteneciente a la familia Euphorbiaceae, es una de las 199 especies hasta ahora registradas y una de las 48 especies endémicas de México (Steinmann, 2002). J. dioica es una planta que crece en zonas áridas del noreste de México y es empleada en la medicina tradicional preparada como decocción para el control de caída de cabello, dolor de riñones y problemas de digestión (Manzanero-Medina, Flores-Martínez, Sandoval-Zapotitla, & Bye-Boettler, 2009). Se tienen registros de su actividad antiviral (Silva-Mares et al., 2013) y antimicrobiana contra patógenos humanos (Silva-Belmares, Rivas-Morales, Viveros-Valdez, de la Cruz-Galicia, & Carranza-Rosales, 2014) además, se han demostrado sus propiedades antioxidantes y quimioprotectoras (Martínez et al., 2014). Actualmente se han identificado tres diterpenos con actividad biológica presentes en J. dioica: riolozatriona (Dominguez et al., 1980) citlalitriona y jatrophona (Villarreal, Dominguez, Williams, Scott, & Reibenspies, 1988), además de algunos compuestos como metabolitos secundarios propios de las plantas como flavonoides y polifenoles (Silva-Belmares et al., 2014) que posiblemente son los responsables de las propiedades curativas de la planta. Sin embargo, para el caso del diterpeno citlalitriona, no se ha evaluado su bioactividad.
El objetivo de este trabajo fue evaluar mediante el método de microdiluciones en microplaca la actividad antimicrobiana de extractos de diferente polaridad y en su caso, metabolitos secundarios obtenidos de raíces de J. dioica, contra las bacterias fitopatógenas Clavibacter michiganensis subsp. michiganensis (Cmm), Pseudomonas syringe pv. tomato (Pst), Xanthomonas campestris pv. vesicatoria (Xcv).
Material y métodos
Bacterias fitopatógenas
Las cepas bacterianas fueron proporcionadas por Departamento de Fitosanidad-Fitopatología del Colegio de Postgraduados, Campus Montecillo, Estado de México. Las bacterias Ccm, Pst y Xcv se cultivaron en caldo nutritivo BIOXON® (extracto de carne 3 g L-1, peptona de carne 5 g L-1, pH=7± 0.2) a 28oC y 110 rpm hasta obtener una absorbancia de 0.5 a 600 nm. Se mantuvieron en refrigeración a 4˚C hasta su uso.
Material vegetal
Las raíces de J. dioica fueron colectadas en la localidad de Buenavistilla, Municipio de San José Iturbide, Guanajuato, México en junio-julio 2017. Un ejemplar fue identificado y depositado en el Herbario-Hortorio “Jorge Espinoza Salas” del departamento de Preparatoria Agrícola de la Universidad Autónoma Chapingo. Las raíces se dejaron secar a la sombra, después se cubrieron y resguardaron a temperatura ambiente hasta su procesamiento.
Obtención de extractos de raíces de J. dioica
Las raíces de J. dioica previamente secas y molidas (9 kg) se maceraron en metanol por 120 horas. El extracto metanólico se concentró en un rota-evaporador marca Buchi modelo R-210 a una temperatura de 50˚C. Una porción del extracto se disolvió en agua en una proporción 1:20 (p/v) y se extrajo sucesivamente con n-hexano y acetato de etilo, después de evaporar los disolventes, se calculó el rendimiento obtenido de cada uno de los extractos.
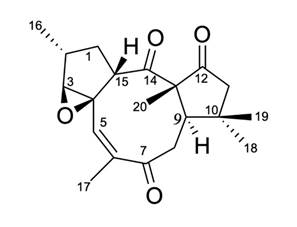
Una porción del extracto hexánico (8.6 g), se fraccionó por cromatografía en columna empacada con gel de sílice y se eluyó con mezclas de hexano-AcOEt de polaridad creciente (10:0, 9:1, 4:1, 5:5, 0:10). En las fracciones eluídas con hexano-AcOEt en proporción 4:1 se observó la presencia de un sólido blanco, el cual fue sometido a una nueva separación por cromatografía en columna, colectándose 49 fracciones de 6 mL cada una. Las fracciones 29-32 contenían ß-sitoesterol, lo cual se determinó comparando con una muestra auténtica: en las fracciones 33-37 se encontró otro sólido blanco, el cual fue identificado como citlalitriona por los métodos espectroscópicos de infra-rojo y resonancia magnética nuclear de hidrógeno y carbono 13. Cada uno de estos metabolitos secundarios fue evaluado para determinar su actividad antimicrobiana contra las tres cepas bacterianas.
Para las pruebas antimicrobianas, se disolvieron 0.1 g de extracto o los metabolitos purificados en 20 mL de dimetilsulfoxido al 10% (Salie, Eagles, & Leng, 1996), para obtener una concentración final de 5
Evaluación antimicrobiana por método de microdilución en microplaca.
La actividad antimicrobiana de los extractos o metabolitos secundarios, se probó por el método de microdilución en microplaca de acuerdo a lo descrito por Das, Tiwari, & Shrivastava (2010). En cada pozo de una microplaca se mezcalron 50 µL de cada uno de los cultivos bacterianos de Ccm, Pst y Xcv, a una absorbancia de 0.5 a 600 nm (equivalente a 1x106 unidades formadoras de colonias por mililitro); el extracto vegetal en diluciones seriadas de 200 a 20 µL (escala de 20 µL), y el medio de cultivo estéril de 0 a 180 µL (escala de 20 µL), para obtener un volúmen final de 250 µL. Como control negativo se utilizó medio de cultivo (200 µL) y la suspensión bacteriana (50 µL), como control positivo se utilizó el medio de cultivo (150 µL), la suspensión bacteriana (50 µL) y etanol grado reactivo (50 µL). Las microplacas se incubaron a 37˚C por 24 h. Posteriormente, en cada pozo se adicionaron 20 µL de 2,3,5-cloruro de tetrazolio (CTT) al 2% y se incubó a 37˚C, 110 rpm por 60 minutos. Finalmente se midió la absorbancia a 540 nm en un lector de microplacas Sinergy 2 marca BioTek (Gabrielson et al., 2002) controlado por una interfaz de análisis de datos Gen5. El porcentaje de inhibición bacteriana se calculó con la Ecuación 1, posteriormente se graficó las concentraciones de extracto contra el porcentaje de inhibición bacteriana obteniendo así una ecuación de la recta mediante una regresión lineal.
Ac = absorbancia del control negativo y Ae = absorbancia del ensayo.
Se preparó también una placa para ser usada como blanco en la medición de la absorbancia, de la manera descrita anteriormente pero con 100 ?l de caldo nutritivo (sin cultivo bacteriano).
Para calcular la Concentración Inhibitoria Media Máxima (CI50)
Se graficó la concentración de extracto vs el porcentaje de inhibición. Con la ecuación de la recta obtenida se calculó la concentración a la que la inhibición del crecimiento bacteriano fue del 50%, para obtener así la CI50, mediante la ecuación de regresión considerando coeficientes de correlación (R2) mayores a 0.90.
Los resultados se expresaron como medias ± desviación estándar. Cada ensayo se efectuó por triplicado.
Resultados
La efectividad antimicrobiana de los extractos expuestos a bacterias Cmm, Pst y Xcv se muestran en el Cuadro 1. El extracto hexánico y de acetato de etilo, muestran actividad antimicrobiana contra las tres cepas evaluadas, no así para el extracto metanólico que sólo tuvo respuesta para Pst y Xcv.
Cuadro 1 Concentración Inhibitoria Media Máxima (CI50) de extractos vegetales de J. dioica contra bacterias fitopatógenas expresado en mg mL-1.
| Extracto | CI50 (mg mL-1) | ||
|---|---|---|---|
| Cmm | Pst | Xcv | |
| Hexánico | 4.4 ± 0.92 | 0.5 ± 0.01 | 1.7 ± 0.36 |
| Acetato de etilo | 2.0 ± 0.43 | 3.5 ± 0.73 | 2.3 ± 0.52 |
| Metanólico | (-) | 5.8 ± 1.12 | 2.9 ± 0.68 |
(-): sin actividad antimicrobiana; Cmm: Clavibacter michiganensis subsp. michiganensis; Pst: Pseudomonas syringe pv. tomato; Xcv: Xanthomonas campestris pv. vesicatoria.
La mejor respuesta antimicrobiana se observó con el extracto hexánico contra Pst y Xcv respectivamente y con el extracto acetato de etilo contra Cmm.
Debido a que el extracto hexánico mostró una alta efectividad antimicrobiana contra Pst y Xcv (CI50 = 0.5 y 1.7 mg mL-1, respectivamente), fue sometió a un fraccionamiento por cromatografía en columna utilizando 300 mL de los siguientes eluyentes: n-hexano, mezclas de AcOEt-hexano de polaridad creciente (9:1, , 4:1 y 1:1 v/v) y AcOEt, las fracciones obtenidas (F1,F2, F3, F4, y F5) fueron evaluadas para determinar su actividad antimicrobiana, y se encontró que F3 presentaba una mayor actividad antimicrobiana, por lo que se separó por cromatografía en columna utilizando como eluyente mezclas de hexano/AcOEt de polaridad creciente y obteniendo un total de 42 fracciones. En las fracciones eluídas con una mezcla de hexano/AcOEt (4:1) se observó un sólido, resultando la fracción F’1 a la que se les denominó como aguas madres, y una muestra sólida cristalina a la que se le distinguió como F’2, identificada como citlilitriona. Finalmente las fracciones eluidas con la mezcla de hexano:acetato de etilo (5:5) se reunieron en la fracción nombrada como F’3. En el Cuadro 2, se puede observar que tanto las aguas madres de la fracción F’1 como la citlalitriona de la fracción F’2, mostraron valores de CI50 = 0.1 mg mL-1 contra las tres bacterias fitopatogenas Cmm, Pst y Xcv, en tanto que la fracción F’3 mostró valores de inhibición relativamente superiores sobre las tres bacterias, sin embargo, al observar su composición por cromatografía en capa delgada, se detectó que correspondía a una mezcla compleja de metabolitos secundarios que no se analizó.
Cuadro 2 Concentración Inhibitoria Media Máxima (CI50) de fracciones hexánicas de J. dioica contra bacterias fitopatógenas expresado en μL mL-1.
| Fracción | CI50 ( |
||
|---|---|---|---|
| Cmm | Pst | Xcv | |
| F’1 | 0.9 ± 0.09 | 1.0 ± 0.14 | 0.6 ± 0.02 |
| F’2 | 1.0 ±0.13 | 1.0 ± 0.11 | 1.1 ± 0.19 |
| F’3 | 1.2 ± 0.21 | 1.1 ± 0.2 | 0.7 ± 0.01 |
F’1: aguas madre; F’2: citlalitriona; F’3: mezcla compleja de metabolitos secundarios; Cmm: Clavibacter michiganensis subsp. michiganensis; Pst: Pseudomonas syringe pv. tomato; Xcv: Xanthomonas campestris pv. vesicatoria.
Al sólido cristalino de la fracción F’2, se le determinó su punto de fusión (201-203˚C), además su espectro de infrarrojo mostró bandas en 1746, 1692, 1446, 1388.5, 1347, 1156.9 y 1038.7 cm-1, que se asignaron a grupos carbonilo de cetona (R2C=O), de al menos un enlace doble (-C=C-) y de enlace C-O-C tipo éter. En su espectro de Resonancia Magnética Nuclear de 1H (RMN-1H., 400 MHz, CDCl3), se observaron los siguientes desplazamientos químicos δ: 3.30 (s, H3), 5.51 (q, J= 1.6, H5), 2.95(dd, J = 12.7, 1.8, H8α), 2.60(dd, J = 12.7, 13.13, H8β), 3.66 (dd, J= 9.5, 1.5, H15), 1.15(CH3, d, J= 7.5, H16), 1.95(CH3, d, J= 1.6, H17), 1.30(CH3, s, H18) 0.97(CH3, s, H19), 1.44(CH3, s, H20): en el espectro de Resonancia Magnética Nuclear de 13C (RMN-13C., 100 MHz, CDCl3), se observaron 20 señales, cuyos desplazamientos químicos (
Discusión
Estudios previos, revelaron que el extracto metanólico de J. dioica tiene actividad antimicrobiana para Staphylococcus aureus, Klebsiella pneumoniae, Pseudomonas aeruginosa, Escherichia coli (Serrano-Gallardo et al., 2017) Porphyromonas gingivalis (Waizel-Bucay & Martínez Rico, 2011) Bacillus cereus, Salmonella typhi, Candida labicans (Silva-Belmares et al., 2014) y antiviral (Silva-Mares et al., 2013); coincidiendo con lo encontrado en el presente trabajo en cuanto a la participación de terpenos, esteroles y metilesteroles como compuestos activos.
Por otro lado, algunos estudios señalan que los principales compuestos de un extracto son los responsables de su actividad biológica, mientras que otros concluyen que algunos componentes actúan sinérgicamente (Pitarokili, Tzakou, Loukis, & Harvala, 2003; Bakkali & Idaomar, 2008). Debido a que los extractos de plantas contienen una mezcla de varios componentes, es probable que su actividad antimicrobiana no sea atribuible a un solo mecanismo de acción, pero se sabe que los terpenos como la citlalitriona tienen la habilidad de dañar biomembranas debido a sus características lipofílicas (Lucini, Zunino, Lopez, & Zygadlo, 2006).
Los resultados obtenidos sugieren que los extractos no son selectivos a bacterias gram negativas y positivas. La actividad antimicrobiana del extracto hexánico podría atribuirse principalmente al diterpeno citlalitriona. Estos resultados dan soporte científico y abren la posibilidad para el uso de J. dioica en el control de las enfermedades producidas por las bacterias fitopatógenas Cmm, Pst y Xcv.
Conclusiones
Los extractos de J. dioica presentaron actividad inhibitoria in vitro sobre el crecimiento de bacterias fitopatógenas que afectan al cultivo de tomate.
El extracto hexánico mostró mayor actividad antimicrobiana contra Pst y Xcv y el extracto de acetato de etilo contra Cmm.
Del extracto hexánico se aisló e identificó el compuesto diterpénico citlalitriona como uno de los responsables de la actividad inhibitoria.
Estos resultados abren la posibilidad de utilizar estos extractos vegetales y el compuesto citlalitriona para el control de las enfermedades causadas por Ccm, Pst y Xcv como una alternativa al uso de antibióticos o compuestos de cobre para el control de enfermedades bacterianas del cultivo de tomate (Solanum lycopersicum).











 nueva página del texto (beta)
nueva página del texto (beta)