Introducción
El estudio de las magnolias (Magnoliaceae) de México en los últimos 25 años ha conducido a la descripción de nuevas especies, al pasar de once en 1994 (Lozano-Contreras, 1994; Vázquez-García, 1994) a más de 40 en la actualidad (Gómez-Domínguez, Pérez-Farrera, Vázquez-García, Sahagún-Godínez, & Muñiz-Castro, 2017; Vázquez-García et al., 2014); la mayoría de ellas endémicas y con limitaciones en información sobre su distribución, biología y ecología, que enfrentan serias amenazas a su permanencia (Rivers, Beech, Murphy, & Oldfield, 2016).
En particular, Magnolia mexicana (DC.) (Sección Talauma, Subsección Talauma), que se consideró la única especie de la sección Talauma en México (Lozano-Contreras, 1994), ha sido clave en el nuevo inventario de las magnolias del país, al reclasificarse algunas de sus poblaciones a Magnolia zoquepopolucae (Vázquez-García, De Castro-Arce, Muñiz-Castro, & Cházaro-Basañez, 2012), M. lopezobradori, M. sinacacolinii, M. jaliscana (Vázquez-García, Muñiz-Castro, et al., 2012), M. perezfarrerae (Vázquez-García, Gómez-Domínguez, et al., 2013), M. lacandonica (Vázquez-García, Pérez-Farrera, Martínez-Camilo, Muñiz-Castro, & Martínez-Meléndez, 2013), M. macrocarpa, M. wendtii, M. ofeliae y M. decastroi (Vázquez-García, Muñiz-Castro, et al., 2013); y por lo tanto, ha replanteado su área de distribución a poblaciones relictuales en los estados de Oaxaca, Puebla y Veracruz, (Rivers, Martínez Salas, & Samain, 2016).
Históricamente M. mexicana, y ahora sus reclasificaciones, se ha asociado al nombre náhuatl “Yoloxóchitl” (de Candolle, 1818; Lozoya, 1999; Waizel-Bucay, 2002; Micheli, 2004), y se señaló a los estados de Veracruz, Morelos y Ciudad de México como sitios de origen y distribución (de Candolle, 1818; Sessé & Mociño, 1894), que tenía concordancia con lo asentado en el Códice Durán donde se relata que durante el reinado de Moctezuma I, fueron traídos éstos árboles desde la provincia de Cuetlaxtla (actual Veracruz), a lo que hoy es Oaxtepec en el Estado de Morelos para conformar el que fue el primer jardín botánico de América (Durán, 1581; Lozoya, 1999; Ximénez, 1615), lugar de donde pudieron dispersarse por acción humana hacia Chapultepec, otro importante jardín botánico de la época precolombina, en la Ciudad de México (Vovides, Linares, & Bye, 2010).
Sin embargo, actualmente no se tiene registro de M. mexicana en inventarios florísticos de Morelos, Ciudad de México ni Estado de México (Calderón de Rzedowski & Rzedowski, 2001; Cerros-Tlatilpa & Espejo-Serna, 1998; Martínez de la Cruz, 2010; Martínez de la Cruz, Villaseñor, Aguilera Gómez, & Rubí Arriaga, 2018; Rodríguez-Jiménez, Fernández-Nava, Arreguín-Sánchez, & Rodríguez-Jiménez, 2005) que respalden los relatos históricos, pero se ha observado la presencia de dos árboles viejos y solitarios posiblemente de la especie, en los municipios de Malinalco (White Olascoaga, Juan Pérez, Cedillo Gutiérrez, & Chávez Mejía, 2013) y Zumpahuacán en el Estado de México, que también podrían tener implicaciones sobre la distribución de M. mexicana.
En este sentido, la correcta identificación de los árboles de Yoloxóchitl mexiquenses resulta fundamental, en una especie que se encuentra amenazada de acuerdo con la NOM-059-SEMARNAT-2010 (DOF, 2010) y que está catalogada como Vulnerable B1ab(iii,v), por la Unión Internacional para la Conservación de la Naturaleza (UICN) debido a la pérdida de su hábitat (Rivers, Martínez Salas, et al., 2016) y dificultad para propagarla por semilla (Osuna Fernández, 1997).
Aun cuando la caracterización morfológica ha permitido la discriminación de especies en otras magnolias (Vázquez-García, Gómez-Domínguez, et al., 2013; Vázquez-García, Muñiz-Castro, et al., 2013, 2012; Vázquez-García, Pérez-Farrera, et al., 2013), el empleo de marcadores moleculares ha probado su utilidad en este grupo por las muestras mínimas de tejido requerido y su capacidad discriminatoria entre poblaciones; tal es el caso de los marcadores RAPD (Polimorfismos de ADN Amplificados al Azar, por sus siglas en inglés), que se han mantenido vigentes, a pesar de su relativa baja reproducibilidad, por su simplicidad técnica (Kelleher & Diskin, 2018; Larekeng, Dermawan, Iswoyo, & Mustari, 2019; Sharma, Sharma, & Kumar, 2018; Weising, Nybom, Wolff, & Kahl, 2005), detección de un nivel alto de polimorfismo (Arumugam, Jayapriya, & Sekar, 2019; Casarrubias-Carrillo et al., 2003; Mondragón-Jacobo, 2003) y su utilidad en la identificación genética de individuos (Rentaría Alcántara, 2007). Así, el objetivo del presente estudio fue establecer las relaciones moleculares y morfológicas existentes entre los árboles de Yoloxóchitl, presentes en Malinalco y Zumpahuacán, Estado de México, con individuos de M. mexicana de Zongolica, Veracruz.
Material y métodos
Material vegetal
Se colectaron hojas jóvenes de dos árboles únicos maduros de Yoloxóchitl, uno en el municipio de Malinalco (18°57´7.3´´N, 99°30´2.4´´O) y otro en el municipio de Zumpahuacán (18°50´24.7´´N, 99°35´15.3´´O), Estado de México (Fig. 1); así como hojas de diez árboles de M. mexicana, cuatro de éstos en la comunidad Acontla (18°31´27.1´´N, 96°59´5.57´´O) y seis en La Quinta (18°39´6.72´´N, 96°59´47.86´´O) en Zongolica, Veracruz. Para contar con elementos de referencia, se colectaron muestras de dos árboles de M. dealbata Zucc., en la comunidad de Atempa, también en Zongolica (18°41´0.82´´N, 96°59´43.9´´O) y de cuatro árboles de M. grandiflora L., en el municipio de Tenancingo (18°58´6.22´´N, 99°36´45.84´´O), Estado de México, estos últimos se identificaron de acuerdo a sus características morfológicas según Hernánez-Cerda (1980) y Vázquez-García, Pérez-Farrera, Martínez-Meléndez, Nieves-Hernández, & Muñiz-Castro (2012).
Análisis molecular
Extracción de ADN
Se utilizó el método CTAB al 2% (Doyle & Doyle, 1987), con modificación en la adición de 0.3 g de PVP (Polivinilpirrolidona) como agente precipitador de fenoles durante el macerado (Bermúdez-Guzmán et al., 2016). La calidad del ADN se evaluó por electroforesis en geles de agarosa al 1.5%, a 90 V por 90 minutos con buffer tris-borato-EDTA (TBE) concentrado 0.5x (Fierro Fierro, 2007).
Amplificación de fragmentos RAPD
Se utilizaron 14 iniciadores RAPD (Operon Technologies Inc.) (Cuadro 1), en un juego de 18 muestras de ADN de las magnolias bajo estudio (Cuadro 2). La amplificación se realizó utilizando 11µl de MyTaqTMMix (Bioline®), 13µl de H2O destilada-desionizada libre de nucleasas Sigma®, 0.1 µmol de cebador RAPD y 2 µl de extracción final de ADN (106 ng/µl ADN) para un volumen final de reacción de 26µl. El programa de amplificación fue: desnaturalización inicial de 3 minutos a 94 °C, seguido de 35 ciclos de desnaturalización por 1 minuto a 94 °C, alineación por 1 minuto a 36 °C y extensión por 2 minutos a 72 °C; y un ciclo de extensión final de 7 minutos a 72 °C.
Cuadro 1 Secuencia de los iniciadores RAPD utilizados en este estudio.
| Núm. | RAPD | Secuencia |
|---|---|---|
| 1 | OPA6 | 5'-GGTCCCTGAC-3' |
| 2 | OPA7 | 5'-GAAACGGGTG-3' |
| 3 | OPA8 | 5'-GTGACGTAGG-3' |
| 4 | OPA10 | 5'-GTGATCGCAG-3' |
| 5 | OPA13 | 5'-CAGCACCCAC-3' |
| 6 | OPA15 | 5'-TTCCGAACCC-3' |
| 7 | OPA16 | 5'-AGCCAGCGAA-3' |
| 8 | OPB1 | 5'-GTTTCGCTCC-3' |
| 9 | OPB3 | 5'-CATCCCCCTG-3' |
| 10 | OPB10 | 5'-CTGCTGGGAC-3' |
| 11 | OPB17 | 5'-AGGGAACGAG-3' |
| 12 | OPB19 | 5'-ACCCCCGAAG-3' |
| 13 | E18 | 5'-GGACTGCAGA-3' |
| 14 | C08 | 5'-TGGACCGGTG-3' |
Cuadro 2 Muestras del género Magnolia evaluados en análisis molecular.
| Núm. | Clave | Especie | Sitio de colecta |
|---|---|---|---|
| 1 | Md1 | M. dealbata | Atempa, Zongolica, Veracruz. |
| 2 | Md2 | ||
| 3 | MS1 | M. grandiflora | Santo Desierto, Tenancingo, Edo. Mex. |
| 4 | MS2 | ||
| 5 | MC1 | Santa Ana, Tenancingo, Edo. Mex. | |
| 6 | MC2 | ||
| 7 | Mali | Magnolia sp.* | Malinalco, Edo. Mex. |
| 8 | Zum | Zumpahuacán, Edo. Mex. | |
| 9 | Mm1 | M. mexicana | La Quinta, Zongolica, Veracruz. |
| 10 | Mm2 | ||
| 11 | Mm3 | ||
| 12 | Mm4 | Acontla, Zongolica, Veracruz. | |
| 13 | Mm5 | ||
| 14 | Mm6 | ||
| 15 | Mm7 | ||
| 16 | Mm8 | La Quinta, Zongolica, Veracruz. | |
| 17 | Mm9 | ||
| 18 | Mm10 |
* Árboles de Yoloxóchitl solitarios del Estado de México para lo que está en duda su identidad específica.
Los productos amplificados se separaron por electroforesis en geles de agarosa al 1.5% en amortiguador TBE 0.5x, en cámara de electroforesis Cleaver®. Los geles corrieron durante 10 horas a 70 V. Para el análisis de los marcadores RAPD, cada banda revelada fue considerada como un locus y se marcó con 1 la presencia y con 0 la ausencia de una banda en particular.
Análisis estadístico
De los amplicones revelados en los geles con cada cebador se construyó una matriz básica de datos (MBD) y con esta información se analizó la eficiencia de cada cebador RAPD al calcular el Contenido de Información Polimórfica (PIC) (Laurentin & Karlovsky, 2007) y el Poder de Resolución (RP) (Prevost & Wilkinson, 1999).
Con el cálculo de distancia genética de Dice (Dice, 1945; Nei & Li, 1979) y el método de agrupación Neighbour-joining (Saitou & Nei, 1987), se estimó la relación entre las muestras evaluadas, al aplicar un remuestreo con reemplazo (Bootstrap) de los caracteres en la matriz de datos de 1,000 corridas, por medio del programa FreeTree (Pavlicek, Hrda, & Flegr, 1999) y se eligió el dendrograma de mayor concenso, que se visualizó por medio del programa FigTree (Page, 2001).
Análisis morfológico
Para los árboles de Yoloxóchitl del Estado de México y Veracruz, se registró información fenológica y se recabaron datos morfológicos de descriptores discriminantes entre especies de magnolias de la sección Talauma a saber: estructura del árbol (altura y número de troncos principales), hoja (presencia o ausencia de pubescencia abaxial, forma, largo del peciolo, largo y ancho de la lámina), flor (cantidad, coloración, largo y ancho de los pétalos, así como número y tamaño de los estambres) y fruto (tamaño, presencia o ausencia de pubescencia y número de carpelos); sin embargo, es necesario señalar que la cantidad de flores, frutos y hojas analizados es reducido y diferente para cada caso (Cuadro 4), debido a las restricciones puestas por habitantes en las zonas de colecta, en virtud de la importancia socio-cultural, e incluso carácter sagrado (en el caso de Zumpahuacán) que poseen estos árboles; así, no se aplicó tratamiento estadístico a los datos, el análisis se limitó a los rasgos observados y medidos.
Cuadro 3 Parámetros descriptivos de los cebadores RAPD utilizados.
| Clave | NBa | NBPb | % Polc | PICd | RPf |
|---|---|---|---|---|---|
| E18 | 12 | 12 | 100 | 0.38 | 6.88 |
| C08 | 18 | 17 | 94.4 | 0.31 | 8.55 |
| OPA6 | 14 | 13 | 92.8 | 0.35 | 7.44 |
| OPA7 | 17 | 17 | 100 | 0.41 | 10.77 |
| OPA8 | 16 | 16 | 100 | 0.35 | 8.55 |
| OPA10 | 14 | 13 | 92.9 | 0.28 | 5.66 |
| OPA13 | 20 | 18 | 90 | 0.25 | 6.66 |
| OPA15 | 25 | 21 | 84 | 0.24 | 7.77 |
| OPA16 | 14 | 13 | 92.8 | 0.32 | 2.22 |
| OPB1 | 12 | 10 | 83.3 | 0.29 | 0.66 |
| OPB3 | 15 | 12 | 80 | 0.22 | 5.11 |
| OPB10 | 10 | 7 | 70 | 0.20 | 2.11 |
| OPB17 | 9 | 8 | 88.8 | 0.35 | 0.33 |
| OPB19 | 9 | 7 | 77.7 | 0.28 | 3.22 |
| TOTAL | 205 | 184 | 4.23 | 76 | |
| Promedio | 14.64 | 13.14 | 89.05 | 0.30 | 5.42 |
| Máximo | 25 | 21 | 100 | 0.41 | 10.77 |
| Mínimo | 9 | 7 | 70 | 0.20 | 0.33 |
a Número de bandas. b Número de bandas polimórficas. c Porcentaje de polimorfismos.
d Contenido de información polimórfica. e Índice del marcador. f Poder de resolución.
Cuadro 4 Caracteres morfológicos de ejemplares de Yoloxóchitl del Estado de México y Veracruz.
| Caracteres morfológicos |
M. mexicana de Veracruz |
Magnolia sp. de Zumpahuacán |
Magnolia sp. de Malinalco |
|
|---|---|---|---|---|
| Árbol | Altura aproximada (m) | 30 | 10 | 10 |
| Número de troncos principales | 1 | 1 | 5 | |
| Hoja | Forma de la hoja | Oblongas o elípticas, base aguda | Oblongas o elípticas, base subobtusa | Oblongas o elípticas, base subobtusa |
| Pecíolo (cm) | 6.5 - 9.2 | 6.8 - 8.8 | 2.6 - 7.6 | |
| Longitud de la hoja (cm) | 17.7 - 49.5 | 11.8 - 23.8 | 8.4 - 19.5 | |
| Ancho de la hoja (cm) | 10.6 - 17 | 6.7 - 8.8 | 5.6 - 10.7 | |
| Pubescencia abaxial de la hoja | Glabra | Glabra | Glabra | |
| n* | 30 | 22 | 25 | |
| Flor | Diámetro de la flor (cm) | 18-20 | 16 | 12 - 17 |
| Perianto | 3 sépalos, 6 pétalos | 3 sépalos, 6 pétalos | 3 sépalos, 6 pétalos | |
| Tamaño de los pétalos (cm) | 7.5 - 9.8 x 3 - 6.5 | 6.5 - 7.8 x 3.2 - 4.1 | 6.5 - 8.3 x 3 - 6 | |
| Color de los pétalos | Blanco cremoso teñido de púrpura | Blanco cremoso teñido de púrpura | Blanco cremoso teñido de púrpura | |
| Número de estambres | 183 | 121-184 | 155 - 169 | |
| Tamaño de los estambres (cm) | 1.3 - 1.4 | 1.3 | 1.2 - 1.3 | |
| n | 2 | 2 | 3 | |
| Fruto | Forma del fruto | Ovoide a elipsoidal | Acorazonado | Ovoide a elipsoidal |
| Tamaño del fruto (cm) | 15 | 12** | 10** | |
| Número de carpelos | 38-50 | 39 - 40 | 35 | |
| Pubescencia del polifolículo | Ligeramente pubescente | Ligeramente pubescente | Ligeramente pubescente | |
| Longitud de la semilla (cm) | 1.4 - 1.7 | s/d | s/d | |
| n | 4 | 2 | 1 | |
| Fenología | Floración | mayo - agosto | mayo - agosto | marzo - junio |
| Fructificación (frutos maduros) | febrero - abril | febrero - abril | julio - octubre |
Notas: *n hace referencia al número de hojas, flores y frutos que se colectaron en cada caso, **Frutos inmaduros que a madurez no producen semillas.
Resultados
Efectividad de los cebadores RAPD
Con los 14 cebadores evaluados se amplificaron 205 bandas, con valores máximo y mínimo por cebador de 25 y nueve bandas respectivamente (Cuadro 3). Los cebadores OPA7, OPA8 y E18 mostraron el mayor porcentaje de polimorfismo (100%) y los cebadores OPB10 y OPB19 los más bajos (70 y 77.7 respectivamente).
Se obtuvo un valor PIC promedio de O.30, con un máximo de 0.41 y mínimo de 0.20; los cebadores con los valores PIC más elevados fueron el OPA7 (0.41), OPA8 (0.35) y E18 (0.38). También se registró un valor RP promedio de 5.42, con un máximo de 10.77 y mínimo de 0.33, los cebadores con mayor valor RP fueron el OPA7 (8.55), OPA8 (10.77) y C08 (8.55). El cebador OPA7 mostró los valores PIC y RP más elevados.
Relaciones genéticas entre las muestras de Magnolia spp.
En el dendrograma derivado del análisis de agrupamiento (Fig. 2), el empleo de las especies M. dealbata y M. grandiflora como referencia o control mostró su utilidad al separar claramente estas dos especies, con valores bootstrap del 100%, en dos conjuntos diferentes al correspondiente de “Yoloxóchitl” que agrupó todas las muestras de M. mexicana (Mm1-Mm10) con las de los árboles de Zumpahuacán (Zum) y Malinalco (Mali).
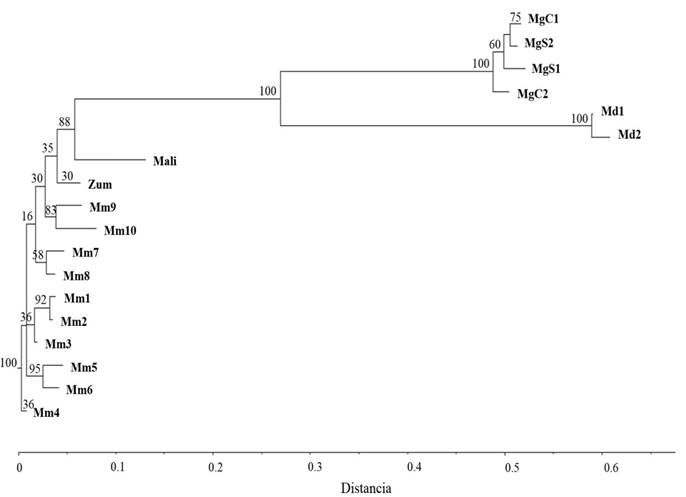
Fig. 2 Dendrograma de 18 muestras de Magnolia spp., con 14 cebadores RAPD por el método Neighbour Joining y distancia genética de Dice, los números encima de cada nodo indican valores bootstrap (1000 remuestreos).
Dentro del grupo Yoloxóchitl, se observaron los individuos de Zumpahuacán y Malinalco posicionados espacialmente al extremo del conjunto con valores bootstrap de 30 y 88%. Así mismo, se observó una similitud superior al 90% entre los individuos de Veracruz y el de Zumpahuacán, y de 87% de éstos con el correspondiente de Malinalco. La variación de similitud entre las poblaciones de Veracruz y los árboles mexiquenses fue de aproximadamente 7%.
Se observó que, dentro del conjunto formado por M. mexicana, las muestras que se colectaron en Acontla aparecen en el extremo inferior (muestras Mm4, Mm5 y Mm6), por encima de ellas las que se colectaron en La Quinta (muestras Mm1, Mm2, Mm3, Mm8, Mm7, Mm9 y Mm10) y al extremo superior de todo el grupo, las muestras del Estado de México.
Comparación morfológica de Yoloxóchitl
Se observó aproximadamente un 77% de variación morfológica entre los individuos de Yoloxóchitl provenientes de Veracruz y los del Estado de México, y sólo cuatro caracteres (pubescencia abaxial de la hoja, perianto, color de los pétalos y pubescencia del polifolículo del fruto), fueron constantes en los tres tipos de Yoloxóchitl (Cuadro 4 y Fig. 3).

Fig. 3 Comparación de hoja (a), flor (b) y fruto (c) de los árboles de Yoloxóchitl de Zongolica, Zumpahuacán y Malinalco.
El ejemplar de Zumpahuacán guarda mayor relación morfológica con M. mexicana con la presencia de un solo fuste principal, similar número de carpelos del fruto, así como similar número y tamaño de los estambres y difirió en la altura del árbol, forma de la hoja, tamaño de las hojas, tamaño de los pétalos, forma y tamaño del fruto, con igual fenología; mientras que el ejemplar de Malinalco difirió en el número de troncos principales, tamaño del peciolo, forma de la hoja, tamaño de la hoja, número y tamaño de los estambres y número de carpelos, además de fenología diferente.
Así mismo, entre los ejemplares de Malinalco y Zumpahuacán se observó variación en el número de troncos principales, tamaño del peciolo, tamaño de la hoja, número de estambres, forma del fruto, número de carpelos y diferencias fenológicas.
Discusión
Los marcadores RAPD utilizados mostraron en su mayoría valores PIC superiores a 0.25 y ninguno tuvo valores por debajo de 0.15, considerándose entonces como altamente informativos de acuerdo con Laurentin & Karlovsky (2007); además, por el porcentaje de polimorfismos detectados, los marcadores en conjunto se consideraron eficientes y útiles para la caracterización de genotipos de Magnolia spp.
Así mismo, el valor RP se utilizó como una medida de la capacidad de cada cebador para distinguir entre genotipos (Prevost & Wilkinson, 1999), por lo que, al obtener los valores RP más elevados, los cebadores E18, C08, OPA7 y OPA8 denotaron la mayor capacidad discriminante entre los genotipos de Magnolia spp., en particular, el cebador OPA7, al mostrar concordancia entre sus valores PIC y RP, sería el más recomendable para trabajar con este grupo botánico.
La habilidad observada de los RAPDs para separar muestras de acuerdo con su origen geográfico se ha reportado en otras especies (Casarrubias-Carrillo et al., 2003; Jacinto-Hernández, Garza-García, Garza-García, & Bernal-Lugo, 2014) y podría deberse a la participación de algunos genes en la adaptación a diferentes condiciones climáticas (Casarrubias-Carrillo et al., 2003); en el caso de los individuos de Zongolica, se observó la separación por origen aun cuando no son evidentes diferencias ambientales o geográficas entre los sitios de colecta; sin embargo, la existencia de factores genéticos asociados al lugar de origen ya se han reportado para la misma especie en la misma zona de estudio (Medrano-Hernández, Rodríguez de la O, Reyes-Trejo, & Peña-Ortega, 2017).
La separación en dendrograma de las muestras de M. grandiflora (sección Magnolia) y M. dealbata (sección Macrophylla) en dos grupos distantes del correspondiente al de los Yoloxóchilt evidencia que los genotipos de Veracruz y los del Estado de México pertenecen a la misma la sección botánica (Talauma). Además, la topología del dendrograma, con los grupos M. dealbata y M. grandiflora ubicados por encima del grupo Yoloxóchitl, es coincidente con estudios filogenéticos en magnolias reportados por Azuma, García-Franco, Rico-Gray, & Thien (2001) y Kim & Suh (2013), quienes sugieren para la sección Talauma del género Magnolia, una divergencia evolutiva más temprana que las secciones Magnolia y Macrophylla.
Respecto al grupo Yoloxóchitl, la alta similitud observada entre los genotipos de M. mexicana y el de Zumpahuacán indicaría que pertenecen a la misma especie aunque su posición en el dendrograma no está fuertemente respaldada por el valor bootstrap (35%), mientras que la mayor distancia observada con el individuo de Malinalco, respaldada por el valor de remuestreo (88%), podría indicar que se trata de una especie diferente, sin embargo, al no tener como referencia otras especies de la misma sección botánica no fue claro el grado de separación que se esperaría para afirmarlo, sin embargo, en un estudio mediante ISSRs realizado por Muñiz-Castro, Castro-Félix, Carranza-Aranda, Santerre Lucas, & Vázquez-García (2017), con M. pugana, M. pacifica y M. vallartensis de la sección Magnolia, encontraron una variación de sólo el 8% entre poblaciones de éstos tres taxa, similar a la encontrada en el presente estudio (7%).
La variación morfológica observada entre M. mexicana respecto al individuo de Zumpahuacán (seis caracteres) y el de Malinalco (siete caracteres), sugiere también una diferenciación a nivel específico, ya que la reclasificación a nuevas especies de algunas poblaciones de M. mexicana ha resultado de variaciones morfológicas similares; por ejemplo, la reclasificación a M. perezfarrerae refirió variación en seis caracteres (Vázquez-García, Gómez-Domínguez, et al., 2013), la reclasificación a M. lacandonica consideró cuatro caracteres (Vázquez-García, Pérez-Farrera, et al., 2013), la reclasificación a M. zoquepopolucae contempló siete caracteres (Vázquez-García, De Castro-Arce, et al., 2012) y similar número de diferencias se consideraron en el resto de especies mexicanas de la sección Talauma recientemente descritas (Vázquez-García, Muñiz-Castro, et al., 2013, 2012).
Algunos autores señalan la posibilidad de que las variaciones observadas se deban a intervención humana, como lo es la emisión de varios fustes por efecto de corte del tronco principal en edad temprana, ya documentado para M. sprengeri (Kang & Ejder, 2011); o bien, sean producto de la plasticidad fenotípica propia de una especie como respuesta adaptativa a un nuevo hábitat (Sultan, 2000). Así, si se considera que los árboles de Yoloxóchitl en el Estado de México fueron traídos directamente o son descendientes de aquellos que se presume provinieron de Veracruz, entonces los contrastes fenotípicos entre ellos podrían ser resultado de su plasticidad a la variación ambiental, toda vez que entre Malinalco, Zumpahuacán y Zongolica existen diferencias de altitud, intervalo de temperatura y nivel de precipitación pluvial de consideración (INEGI, 2009c, 2009a, 2009b).
Ejemplos de plasticidad fenotípica en magnolias se han reportado como pequeñas variaciones morfológicas en especies como M. iltisana en la que se observaron cambios en la biomasa de raíces y hojas en respuesta a variación de luz (Saldaña-Acosta, Meave, & Sánchez-Velásquez, 2009) y en M. pugana que presentó diferencias significativas en el crecimiento de plántulas bajo distintas condiciones de luz y fertilidad del suelo (García Castro, Romo-Campos, Pereira, & Gómez-Rubio, 2018); también se ha reportado variabilidad morfológica en color, tamaño y número de tépalos de las flores en M. wufengensis entre cultivares y una población silvestre (Wang et al., 2017) y variación en la forma de las hojas y coloración de las flores entre ejemplares solitarios y poblaciones tanto silvestres como cultivadas de M. sprengeri (Kang & Ejder, 2011), en este último caso, las diferencias morfológicas pueden ser tan marcadas que los autores consideran que la variación en la forma y tamaño de las hojas, así como en el número de tépalos y coloración de las flores entre árboles de una población o meta población de magnolias no debería tener valor significativo como caracter taxonómico ni ser una razón para el otorgamiento del estatus de especie o subespecie, coincidiendo con lo mencionado por Vázquez-García, Domínguez-Yescas, Pedraza-Ruiz, Sánchez-González, & Muñiz-Castro (2015) en este mismo sentido.
Sería necesario realizar experimentos de establecimiento entre las áreas de estudio para determinar hasta qué punto se puede asumir que las diferencias morfológicas encontradas, más allá de las que distinguen un género, son sólo debidas al ambiente, lo que representaría reconsiderar la reclasificación de nuevas especies; sin embargo, se ha observado que las magnolias en México presentan una marcada especiación alopátrica, en donde las diferencias ambientales o geográficas tienen gran importancia en la separación de poblaciones en especies diferentes (Cruz-Durán, Vega-Flores, & Jiménez-Ramírez, 2008; Vázquez-García, 1994; Vázquez-García et al., 2015); además, el status actual de M. mexicana como especie amenazada, sugiere que no es una especie con gran capacidad plástica, ya que de acuerdo con Sultan (2000), las especies con poca plasticidad para mantener la reproducción y crecimiento, se restringen a nichos especializados y están en particular riesgo de extinción.
Entonces, la posible ausencia de efecto de plasticidad, sugiere que, por la variación morfológica observada, los Yoloxóchitl de Malinalco y Zumpahuacán serían especies distintas a M. mexicana y a las demás especies recientemente reclasificadas de la sección Talauma, al diferir de éstas últimas en similar número de caracteres, por ejemplo, Magnolia sp. de Zumpahuacán difiere en cuatro caracteres de flor y fruto con M. zoquepopolucae (Vázquez-García, De Castro-Arce, et al., 2012) y en ocho caracteres de hoja, flor y fruto con M. jaliscana (Vázquez-García, Muñiz-Castro, et al., 2012); mientras que Magnolia sp. de Malinalco difiere en cinco y seis caracteres con estas mismas especies.
El origen de los Yoloxóchitl mexiquenses es incierto, ya que las especies de magnolias geográficamente más cercanas (M. krusei, M. vazquezii y M. guerrerensis) pertenecen a la sección Magnolia que es morfológicamente distinguible de la sección Talauma (Cruz-Durán et al., 2008; Jiménez-Ramírez, Vega-Flores, Cruz-Durán, & Vázquez-García, 2007; Vázquez-García, Muñiz-Castro, et al., 2013), de la cual no existen registros en inventarios florísticos realizados en la zona de estudio (Calderón de Rzedowski & Rzedowski, 2001; Cerros-Tlatilpa & Espejo-Serna, 1998; López Patiño, López-Sandoval, Beltrán-Retis, & Aguilera-Gómez, 2018; Martínez de la Cruz, 2010; Martínez de la Cruz et al., 2018; Rodríguez-Jiménez et al., 2005).
En concordancia con los relatos históricos, podría tratarse de ejemplares introducidos a partir de poblaciones de especies en Veracruz ya inexistentes o bien ser ejemplares únicos de especies nativas ya desaparecidas, ambas suposiciones se soportan en el hecho de que ninguno de los dos ejemplares mexiquenses analizados produce semillas viables (observación directa y com. pers. con pobladores), incapacidad que puede estar asociada a diferentes factores como la inexistencia de polinizadores específicos o autoincompatibilidad; este tipo de esterilidad de las semillas se ha observado de forma común en árboles silvestres solitarios de M. sprengeri debido a la imposibilidad de una polinización cruzada por falta de otros ejemplares cercanos de la misma especie y se sabe que no es posible la autofecundación en dicha especie aún si se trata de flores distintas del mismo árbol (Kang & Ejder, 2011), también Hirayama, Ishida, & Tomaru (2005) reportaron que se reduce grandemente la producción de semilla en M. stellata por efecto de la geitonogamia; resultados similares se reportaron también para M. obovata (Ishida, Yoshimaru, & Ito, 2003); lo anterior sugiere que los árboles de Yoloxóchitl de Malinalco y Zumpahuacán no producen semillas viables debido a la falta de polinización cruzada ante la ausencia de individuos cercanos de la misma especie.
Si se considera que las magnolias presentan marcada especiación alopátrica, que M. mexicana es una especie de estrecha capacidad plástica y que las diferencias morfológicas encontradas coinciden con aquellas que han posibilitado la reclasificación a nuevas especies, se sugiere que los árboles de Yoloxóchitl en Malinalco y Zumpahuacán pertenecen a otras especies, que, por razones de su historia particular, se encuentran aislados.
Conclusiones
La evidencia molecular obtenida indica que los árboles de Yoloxóchitl en Malinalco y Zumpahuacán pertenecen a la sección Talauma, pero, debido a la variación morfológica observada entre ellos y en relación con M. mexicana, cabe la posibilidad de que se trate de dos especies distintas aún no descritas.











 nova página do texto(beta)
nova página do texto(beta)



