Introducción
(Arreguín-Sánchez, Fernández-Nava, Palacios-Chávez, & Quiroz-García, 2001) indican que los helechos son plantas cormófitas que presentan tres tipos de ciclos de vida con predominancia del esporófito, donde el gametófito es totalmente independiente del esporófito y requieren del agua externa para su reproducción (p. 11). (Mickel & Smith, 2004) consideran que existen alrededor de 10,000 especies a nivel mundial y en México 900 (p. 1). (Mendoza-Ruíz & Pérez-García, 2009) han observado que la distribución de estas plantas está condicionada por la luz, temperatura, humedad y la tolerancia a estos elementos son los que marcan los tipos de vegetación donde se encuentran (p. 5). (Salazar-Aguilar, Arreguín-Sánchez, & Tejero-Díez, 2015), indican que en México su mayor diversidad se localiza en los bosques mesófilos de montaña, en bosques de pino-encino y en selvas altas perennifolias (p. 22). (Salazar-Aguilar, Arreguín-Sánchez, & Tejero-Díez, 2015) sostienen que el estudio de los ciclos de vida y su desarrollo morfogénico permite obtener datos para el manejo de estas criptógamas vasculares, para su cultivo comercial, preservación de los taxones, además de aportar datos de interés taxonómico o ecológico debido a que las esporas que se encuentran en los esporangios, al momento de dispersarse y caer en un medio apropiado son elementos básicos para el establecimiento del esporófito (p. 22).
(Nayar & Kaur, 1971) describen seis tipos de germinación en las esporas: Anemia, Osmunda, Vittaria, Gleichenia, Cyathea e Hymenophyllum (p. 299-301). Así también (Nayar & Kaur, 1969) consideran en los helechos isospóricos, la formación de los prótalos a través de sucesivas divisiones de las esporas para formar los siguientes tipos de desarrollo protálico: Ceratopteris, Kaulinia, Marattia, Osmunda, Aspidium, Adiantum y Drynaria (p. 180-185). (Rodríguez-Ríos, 1973) considera que la formación de anteridios y arquegonios se realiza a partir de alguna de las células del prótalo que comienzan a diferenciarse (p. 9).
(Mickel & Smith, 2004) mencionan que el género Pteris es pantropical, cuenta con alrededor de 250 especies a nivel mundial, de las cuales 60 son americanas. Se caracteriza por incluir especies terrestres, con menor frecuencia epífitas, rizomas cortos, rastreros a erectos con escamas, frondes de medianos a grandes, estípites glabros, hojas pinnadas o más divididas, láminas membranosas a coriáceas, glabras en su mayoría, soros con esporangios y parafisos marginales protegidos por un indusio continuo interno y sobre éste un margen reflejo, esporas triletes generalmente con un anillo ecuatorial (p. 533).
(Tejero-Díez & Torres-Díaz, 2012) consideran que Pteris quadriaurita presenta una amplia distribución debido a que es un taxón introducido a la República Mexicana favorecido por horticultores o por personas que la pasaron a nuestro país, escondiendo las partes reproductoras. La planta es nativa de Australia, Nueva Zelanda y Polinesia ya naturalizada en México (p. 119).
Antecedentes
(Tryon & Tryon, 1982) realizaron trabajos taxonómicos y florísticos del género Pteris considerando seis grupos: Pteris chilensis, P. deflexa, P. altissima, P. quadriaurita, P. haenkeana, P. longifolia y P. cretica (p. 335-338). En investigaciones florísticas que consideran a Pteris dentro de las áreas de estudio se encuentran las de (Smith, A. R. , 1981) p. 56-57, para Chiapas, (Mickel & Beitel, 1988) p. 320-327, para Oaxaca, además a nivel de México ha sido estudiado por (Mickel & Smith, 2004), p. 533-544. En Mesoamérica se realizó la revisión del género para la zona (Moran, 1995), p.140-144. Arreguín-Sánchez, M. L., Palacios-Chávez, R., y Quiroz-García, D. L. (1997), realizaron un trabajo palinológico que describe la morfología de las esporas de Pteris para México (p. 67-78).
Se han publicado varios estudios de la fase gametofítica del género de varias especies entre los que destacan las investigaciones de (Mehra, 1938) p. 202-210; (Crotty, 1967) p.105-117; (Cohen & Crotty, 1979) p. 179-182; (Laird & Sheffield, 1986) p. 139-143; (Gremmrich, 1988) p. 159-164; (Beri & Bir, 1993) p. 73-78; (Mendoza, Pérez-García, Reyes-Jaramillo, & Ricci, 1995) p. 51-57; (Huang, Chou, Hsieh, Wang, & Chiou, 2006) p. 261-268; (Letelier & Penailillo, 2007) p. 93-97; (Prada, Moreno, & Gabriel y Galan, 2008) p. 14-25; (Zhang, Shi, Zhang, & Jiang, 2008) p. 33-41; (Tanco, Martínez, & Bonomo, 2009) p. 10-17; (Martínez, 2010) p. 89-102; (Huang, Hsu, S-Y., Hsieh-Mei, & Chiou, 2011) p. 79-87; (Chao, Lui, Chiang, & Chiou, 2012) p. 1-7; (Martínez, Prada, Tanco, & Bonomo, 2013) p. 46-52; (Baskaran, Jeyachandran, & Meighias, 2014) p. 2350-2358; (Puspitasari, Chikmawati, & Praptosuwiryo, 2015) p. 98-104.
El propósito de este trabajo es describir y comparar el desarrollo morfogénico de los gametófitos y esporófitos jóvenes de Pteris quadriaurita en condiciones de cultivo en tres sustratos naturales (maquique, tierra de hoja y musgo), recomendando el mejor de ellos para su reproducción y en consecuencia infiriendo los aspectos positivos para el desarrollo de la planta.
Material y métodos
Trabajo de campo
El ejemplar fue recolectado en Tototla, municipio de Xochicoatlán, Hidalgo, Bosque Mesófilo de Montaña, 1680 m.s.n.m. 15 de marzo de 2013, colector B. J. Ballesteros (Fig. 1) y el ejemplar recolectado se encuentra depositado en el herbario ENCB, además se recolectaron frondes con esporas maduras que se colocaron en sobres de papel blanco.

Fig 1 Pteris quadriaurita. Izquierda, fotografía tomada en el sitio de recolecta, Tototla, municipio de Xochicoatlán, Hidalgo. Derecha, muestra de un esporófito que se obtuvo en este trabajo.
Las muestras de esporas de P. quadriaurita se tomaron de tres organismos que tenían soros maduros los que fueron colocados en sobres de color blanco para traerlos al laboratorio, además se recolectó un ejemplar para su identificación y resguardo en el herbario ENCB.
Trabajo de laboratorio
Ya en el laboratorio se identificaron los ejemplares y se contó el número de espora que contenían cinco esporangios tomados al azar, en los cuales se encontró 32 esporas por esporangio.
Después de la recolecta en campo se realizó el sembrado de las esporas con la técnica de (Montoya-Casimiro, Álvarez-Varela, Pérez-Hernández, & Arreguín-Sanchez, 2000). Las esporas se sembraron en quince frascos de vidrio de 125 ml y se utilizaron cinco por sustrato. En total, por cada sustrato se sembraron 0.03 g de material que resultó de raspar los soros, los cuales se entremezclaron en 0.5 g de arena de río esterilizada y este material se dividió por partes iguales en cada uno de los cinco frascos de cada soporte. El propósito de mezclar las esporas con la arena de río y esparcirlas en los frascos, es para qué, en las primeras etapas de desarrollo, los puntos a muestrear sean donde se encuentra la arena y ya en el microscopio estereoscópico, esta muestra en una caja de Petri y formol al 2% podamos apreciar las esporas que están germinando y el inicio de la fase gametofítica para posteriormente realizar las preparaciones fijas.
Las condiciones en que se mantuvieron los quince frascos germinadores fueron con luz natural en el invernadero a una temperatura de 20 a 25ºC y cada frasco contenía 2 ml del agua de la que se esterilizó cada sustrato. Se tomaron muestras de un frasco por sustrato cada 15 días en condiciones de asepsia, uno se quedó como testigo y los otros germinadores se abrían una vez que se hubiera agotado el material biológico del anterior, la cantidad de muestra que se tomaba cada dos semanas era la que se alcanzaba a obtener con unas pinzas de punta fina y se tomaban al azar del frasco, una muestra por cada frasco. El material se fijaba en formol al 2% por 48 horas y posteriormente se teñía con safranina acuosa. Con lo anterior se realizaron preparaciones permanentes que se montaron con una mezcla de miel de maíz, agua 1:1 y trazas de fenol, cada preparación se etiquetó con la fecha en que se fijó el material de cada soporte. La serie de preparaciones se observaron, interpretaron, se tomaron medidas y fotomicrografías tanto al microscopio óptico como en el microscopio estereoscópico. '
Cada una de las etapas correspondientes del desarrollo morfogénico como germinación, fase filamentosa, laminar y esporofítica fueron observadas y descritas de acuerdo a las características de cada una de ellas, en la fase filamentosa: largo de los filamentos, número de células y rizoides; fase laminar: gametófito joven, largo, ancho, número de rizoides, gametófito adulto, largo, ancho, forma, sexualidad, número de rizoides; anteridios y arquegonios: tamaño, forma, número de anterozoides, número de células del canal del cuello; esporófitos: tricomas, forma de los primofrondes, venación. Estas medidas se tomaron cada 15 días para determinar el rango de desarrollo con el propósito de establecer cuál de los tres soportes tenía las mejores características y condiciones para el desarrollo de la fase sexual de esta planta. Las medidas que se mencionan en las descripciones son los promedios de diez estructuras de cada fase.
La toma de muestras se suspendió el día 231 después de la siembra en que se formaron los esporófitos. Los frascos germinadores se siguieron observando tres meses después, cuando en musgo y maquique los esporófitos tenían de 1 a 6 cm de largo y en tierra de hoja seguían sin presentarse. Cuando los esporófitos jóvenes tenían más de 5 cm de largo se trasplantaron en tierra de hoja (Fig. 1). En total se elaboraron 84 laminillas de preparaciones permanentes correspondiendo a 28 laminillas por cada sustrato que fueron la base para describir los resultados (p. 328-330).
Resultados
Los esporófitos (Fig. 1) de los cuales se tomaron las esporas presentan las siguientes características generales basadas en (Mickel & Smith, 2004): Plantas terrestres, frondes grandes entre 50 cm a 2 m, láminas pinnadas-pinnatifidas a bipinnadas, glabras o con escasos tricomas, nervaduras libres, soros cubiertos por un indusio de 0.3 mm, esporangios con parafisos, esporas triletes. La especie se localiza en México, Guatemala, Belice, Honduras, Salvador, Nicaragua, Costa Rica, Panamá, Grandes Antillas, Colombia, Venezuela, Ecuador, Perú, Bolivia, Argentina, África y Asia. En México se localiza en los estados de Tamaulipas, San Luis Potosí, Jalisco, Nayarit, Colima, Michoacán, Querétaro, Morelos, Hidalgo, Guerrero, Oaxaca, Veracruz, y Chiapas. Se distribuye en el bosque mesófilo de montaña, bosques de pino-encino, en plantaciones de café (p. 542).
La cronología del desarrollo morfogénico se exponen en los Cuadros 1, 2, 3 y 4. En la Fig. 12 se muestra el concentrado del desarrollo de este taxón. (Tryon & Lugardon, 1991) describen las esporas de algunas especies de Pteris y la terminología de estos autores es la que se utilizó para describirlas en este trabajo (p. 188-191).
Cuadro 1 Resumen de los resultados del desarrollo morfogénico obtenidos en los tres soportes.
| Estadios de desarrollo | Tierra de hoja | Musgo | Maquique |
|---|---|---|---|
| Germinación | 29 | 29 | 43-97 |
| Fase filamentosa | 29-79 | 29-150 | 43 |
| Gametofito joven | 150-231 | 43-231 | 60-79 |
| Gametofito adulto | 164-231 | 79-231 | 97-178 |
| Anteridios | 150- 231 | 97-231 | 60-220 |
| Arquegonios | No se observaron | 193-231 | 150-220 |
| Apogamia | No se observaron | 220-231 | 231 |
| Esporofito | No se observaron | 231 | 231 |
Cuadro 2 Cronología del desarrollo de las fases gametofíticas y esporofíticas (soporte tierra de hoja).
| Número de días | 15 | 29 | 43 | 60 | 79 | 97 | 129 | 150 | 164 | 178 | 193 | 206 | 220 | 231 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Germinación | - | X | - | - | - | - | - | - | - | - | - | - | - | - |
| Filamento | - | X | X | X | X | - | - | - | - | - | - | - | - | - |
| Gametofito joven | - | - | - | - | - | - | - | X | X | X | X | X | X | X |
| Gametofito adulto | - | - | - | - | - | - | - | - | X | X | X | X | X | X |
| Anteridios | - | - | - | - | - | - | - | X | X | X | X | X | X | X |
| Arquegonios | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Apogamia | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Esporofito | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
Cuadro 3 Cronología del desarrollo de las fases gametofíticas y esporofíticas (soporte musgo).
| Número de días | 15 | 29 | 43 | 60 | 79 | 97 | 129 | 150 | 164 | 178 | 193 | 206 | 220 | 231 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Germinación | - | X | - | - | - | - | - | - | - | - | - | - | - | - |
| Filamento | - | X | X | X | X | X | X | X | - | - | - | - | - | - |
| Gametofito joven | - | - | X | X | X | X | X | X | X | X | X | X | X | X |
| Gametofito adulto | - | - | - | - | X | X | X | X | X | X | X | X | X | X |
| Anteridios | - | - | - | - | - | X | X | X | X | X | X | X | X | X |
| Arquegonios | - | - | - | - | - | - | - | - | - | - | X | X | X | X |
| Apogamia | - | - | - | - | - | - | - | - | - | - | - | - | X | X |
| Esporofito | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
Cuadro 4 Cronología del desarrollo de las fases gametofíticas y esporofíticas (soporte maquique).
| Número de días | 15 | 29 | 43 | 60 | 79 | 97 | 129 | 150 | 164 | 178 | 193 | 206 | 220 | 231 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Germinación | - | - | X | - | - | X | - | - | - | - | - | - | - | - |
| Filamento | - | - | X | - | - | - | - | - | - | - | - | - | - | - |
| Gametofito joven | - | - | - | X | X | - | - | - | - | - | - | - | - | - |
| Gametofito adulto | - | - | - | - | - | X | X | X | X | X | - | - | - | - |
| Anteridios | - | - | - | X | X | X | X | X | X | X | X | X | X | - |
| Arquegonios | - | - | - | - | - | - | - | X | X | X | X | X | X | - |
| Apogamia | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
| Esporofito | - | - | - | - | - | - | - | - | - | - | - | - | - | X |
Esporas
Las esporas fueron triletes de forma triangular de 52.75 µm por 48.53 µm en vista proximal, exina de 6.3 µm de grosor, vista distal rugulada y entre éstas se aprecian verrugas de 2.2 µm (Figs. 2A y 2B), laesura de 31.65 µm de largo. También se apreció en vista lateral el collar ecuatorial típico de la mayoría de las esporas de este género (Fig. 2C ).
Germinación
Las muestras de las primeras fases del desarrollo del gametófito se toman con base en la arena que se encuentra en los diferentes sustratos. En la parte del método se cita que las esporas al momento de la siembra se entremezclaron en 0.5 g de arena de río esterilizada. La presencia de la arena sobre los sustratos es la que se toma de referencia para realizar el muestreo de las primeras fases del desarrollo del gametófito. La germinación se presentó a los 29 días en musgo y en tierra de hoja (Cuadros 1, 2 y 3), en maquique a los 43 y 97 días (Cuadros 1 y 4). La germinación (Fig. 3) es de tipo Vittaria, la cual fue descrita por (Nayar & Kaur, 1971) p. 301.
Fase filamentosa
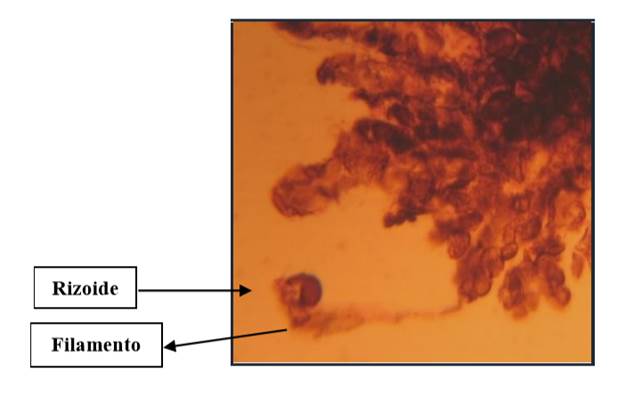
Se apreció en tierra de hoja de los 29 a los 79 días, en musgo de los 29 hasta los 150 días y en maquique a los 43 días (Cuadros 1, 2, 3 y 4), también en estas fechas se inició el desarrollo de gametófitos jóvenes (Fig. 4A , flechas). El largo de los filamentos clorofílicos osciló alrededor de los 573.3 µm de largo con 11 células. Los rizoides ventrales midieron en promedio 255 µm de largo, algunas esporas germinaron dentro del esporangio (Fig. 4B).
Gametófito joven
Esta etapa se consideró antes de la formación de la escotadura (Fig. 5) y se apreció en tierra de hoja desde los 150 hasta los 231 días (Cuadros 1 y 2), en musgo de los 43 hasta los 231 días (Cuadros 1 y 3) y en maquique se observó a partir de los 60 y hasta los 79 días (Cuadros 1 y 4). En tierra de hoja se observaron gametófitos jóvenes alargados que midieron 4 mm de largo por 2.6 mm de ancho con anteridios inmaduros (Fig. 5). En musgo los prótalos jóvenes fueron de 2 mm de largo por 2 mm de ancho y en maquique midieron 0.6 mm de largo por 0.9 mm de ancho, en todos los sustratos se observaron más de 10 rizoides ventrales por gametófito de más o menos el mismo largo que éste, encontrando también en esas fechas varios gametófitos cordados.
Gametófito adulto
El desarrollo protálico fue tipo Ceratopteris (Nayar & Kaur, 1971) p. 304, entre sus características es la diferenciación del tejido meristemático desplazado hacia uno de los lados (Fig. 6A , flecha) y ya en la madurez del prótalo, la escotadura toma la posición distal formando la típica forma cordada asimétrica (Fig. 6B).

Fig. 6 A. Meristemo en posición lateral, B. Meristemo en posición distal para formar el prótalo cordado con alas asimétricas (10X).
Se consideró gametófito adulto una vez que los prótalos tuvieron bien desarrollada la escotadura. En tierra de hoja se observó desde los 164 días hasta los 231 días (Cuadros 1 y 2), en musgo a partir de los 79 días hasta los 231 días (Cuadros 1 y 3) y en maquique a partir de los 97 hasta los 178 días (Cuadros 1 y 4). En tierra de hoja los gametófitos midieron 5 mm de largo por 3 mm de ancho, ya presentaban anteridios maduros. En musgo midieron 3 mm de largo por 2 mm de ancho, en maquique fueron más pequeños de 10 mm de largo por 11 mm de ancho y presentaban anteridios; los prótalos en los tres sustratos tenían gran cantidad de rizoides ventrales que sobrepasaban el tamaño de los mismos. La forma de los gametofitos fueron un 45% cordados (Fig. 6B) y muy pocos (5%) cordado-alargados (Figs. 7C y 7D), circulares un 10% (Fig. 7A), alargados 40% (Fig. 7B).
Gametangios
En los gametofitos se apreciaron anteridios inmaduros, otros prótalos con anteridios maduros y otros más con anteridios maduros y arquegonios inmaduros. Se encontró una relación entre forma y sexualidad, los prótalos unisexuados masculinos fueron circulares y alargados (Figs. 7A y 7B), los bisexuados fueron cordados (Fig. 6B) y cordado-alargados (Figs. 7C y 7D) y la relación de los mismos fue la siguiente: unisexuales masculinos circulares (10%) y alargados (40%), los prótalos unisexuales femeninos y bisexuados fueron cordados (45%) y cordado-alargados (5%).
Anteridios
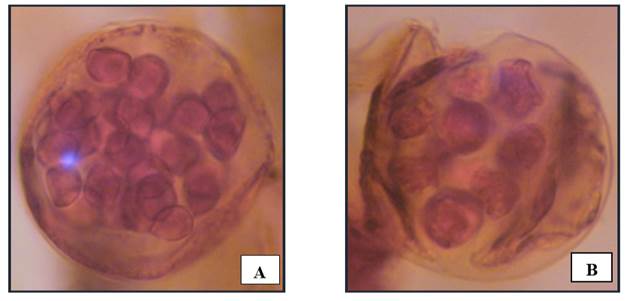
Se observaron desde los 150 hasta los 231 días en tierra de hoja (Cuadros 1 y 2), en musgo desde los 97 a los 231 días (Cuadros 1 y 3) y en maquique de los 60 a los 220 días (Cuadros 1 y 4). Los anteridios están formados por seis células, cuatro de la pared, una célula del opérculo y una célula en el pie, miden aproximadamente 54.86 µm de ancho y 52.75 largo, con 20 anterozoides (Figs. 8 A y 8B), se observaron siempre de forma esférica y se ubicaban en zonas próximas a los rizoides o entre ellos.
Arquegonios
En tierra de hoja no se desarrollaron (Cuadros 1 y 2), en musgo se apreciaron a partir de los 193 hasta los 231 días (Cuadros 1 y 3), en maquique se pudieron observar desde los 150 días hasta los 220 días (Cuadros 1 y 4). Los arquegonios de los dos sustratos, se encontraban inmaduros o, cuando se distinguía el canal del cuello, se encontraba vacío (Fig. 9).
Apogamia
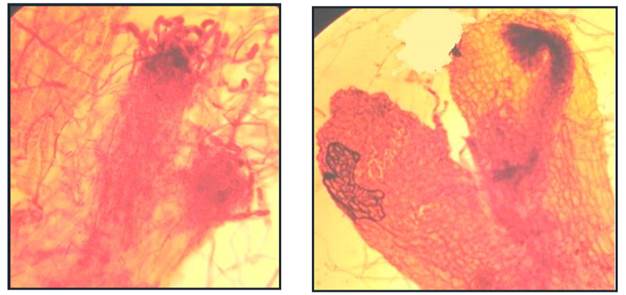
Se presentó en dos soportes, en musgo comenzó a partir de los 220 hasta los 231 días (Cuadros 1 y 3), en maquique hasta los 231 días (Cuadros 1 y 4) y en tierra de hoja no se apreció (Cuadros 1 y 2). En esta etapa, los gametófitos median 4 mm de largo por 2 mm de ancho y en la zona de la escotadura comenzó a formarse la yema apogámica acompañada por gran cantidad de tricomas, dando inicio a la formación del esporófito. En los primeros estadios esta protuberancia midió 332 µm de largo por 99.6 µm de ancho (Fig. 10A), a los 220 días seguía creciendo y a los 231 días ya medía 664 µm de largo por 232.4 µm de ancho y también se notó la formación del primofronde del esporófito (Fig. 10B).
Esporófito joven
En tierra de hoja no se formó (Cuadros 1 y 2), en musgo y maquique el esporófito se presentó a los 231 días (Cuadros 1, 3 y 4). Se observaron de uno a dos esporófitos por prótalo. El pecíolo del primofronde midió 8 mm de largo y presentaba tricomas bicelulares de 137.5 µm de largo (Fig. 11A), las láminas fueron flabeladas de 5 mm de largo y 5 mm de ancho con venación dicotómica (Fig. 11B), todavía se observaron restos del gametófito de 3 mm de ancho y 4 mm de largo. La Figura 12 muestra el concentrado de las fases gametofítica y esporofítica antes descritas.
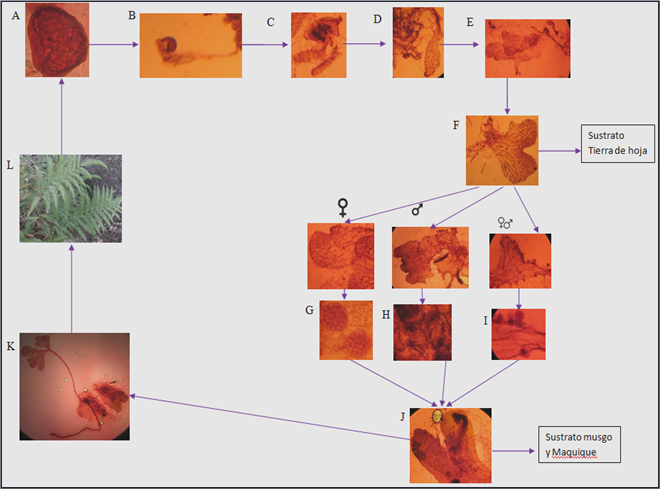
Fig. 12 Síntesis del desarrollo morfogénico de Pteris quadriaurita Retz. A. Esporas (100X). B. Germinación de la espora tipo Vittaria (40X). C. Fase filamentosa (10X). D. Gametófito joven alargado (10X). E. Desarrollo del prótalo tipo Ceratopteris (10X), F. Gametófito adulto (10X), hasta esta fase llegó el desarrollo en tierra de hoja. G. Gametófito masculino con anteridios (10X y 40X). H. Gametófito femenino con arquegonios inmaduros (10X y 100X). I. Gametófito bisexuado con anteridios maduros y arquegonios inmaduros (10X y 40X). J. Formación de esporófito apogámico (3.2X). K. Esporófito joven con lámina flabelada (1.7X). L. Esporófitos adultos de donde se tomaron las muestras de esporas.
Discusión
En el Cuadro 5 se resumen los resultados obtenidos para 27 especies de Pteris (cinco de ellas se repiten por diferentes autores); estos datos fueron publicados por siete investigadores o grupos de investigación en nueve diferentes medios bibliográficos.
Cuadro 5 Comparación del desarrollo morfogénico de los gametófitos y esporófitos de algunas especies de Pteris citadas en la bibliografía.
| Especie | Esporas | Germinación | Filamento | Tipo protálico | Gametófito joven | Gametófito adulto | Anteridio | Arque-gonio | Esporófito | Medio | Autor |
|---|---|---|---|---|---|---|---|---|---|---|---|
| P. berteroana J. Agardh. | Trilete | Tipo Vittaria, 8-10 días | 21-23 días con 3-5 células | Ceratopteris | 23-43 días | 45-160 días, cordado | 72-120 días | 65-85 días | 150 días | Thompson mo- dificado | Mendoza et al. (1995) |
| P. fauriei Hieron. var. minor (diploide) | Triletes, 64 esporas por esporangio | Tipo Vittaria | 3-7 células | Ceratopteris | 21 días | 28 días ♂ y 42 días ♀ ambos unisexuales 52 días bisexuados cordados | 28 días | 42 días | 70 días prove-nientes prótalos unisexuales y 112 días prótalos bisexuales | Medio Kingroot | Hung et al. (2006) |
| P. fauriei Hieron. var. fauriei (triploide) | Triletes, 32 esporas por esporangio | Tipo Vittaria | 3-7 células | Ceratopteris | 21 días | 28 días, cordados | 28 días | Ausente | Apogamia 42-56 días | Medio Kingroot | Hung et al. (2006) |
| P. chilensis Desv. | NM | Tipo Vittaria,10-12 días | 3-4 células, 23 a 24 días | NM | 30 días | 60-95 días, cordados | NM | Se forman antes que los ante-ridios | 115 días | Medio de Thompson | Letelier y Peñai- lillo (2007) |
| P. ensiformis Burm | Triletes con anillo ecuatorial | Tipo Vittaria 7 días | 2-25 células | Ceratopteris | 25 días | 50 días asimétrico espatulado a cordiforme, bisexuados | 90 | 90 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| Pteris excelsa Gaud. | Trilete con anillo ecuatorial | Tipo Vittaria 7-10 días | 2-22 células | Ceratopteris | 20 días | 25 días, asimétricos espatulados a cordifor-mes, bisexuados | 25 | 25 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| Pteris fauriei Hieron. | Trilete, con anillo ecuatorial | Tipo Vittaria 7 días | 2-7 células | Ceratopteris | 7-14 días | 24 días, asimétrico, espatulado a cordi-forme, bisexuados | 28-80 | 28-80 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| Pteris finotii Christ | Trilete, con anillo ecuatorial | Tipo Vittaria 4-6 días | 2-12 células | Ceratopteris | 10-40 días | 26 días, asimétrico, espatulado a cordi-forme, bisexuados | 26-60 | 26-60 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| Pteris vittata L. | Trilete, con anillo ecuatorial | Tipo Vittaria 42-3 días | 2-19 células | Ceratopteris | 7 días | 17-50 días, asimétrico, espatulado a cordiforme, bisexuados | 20-40 | 20-40 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| Pteris wallichiana Agardh | Trilete, con anillo ecuatorial | Tipo Vittaria 13 días | 2-7células | Ceratopteris | 36 días | 43 días, asimétrico, espatulado a cordi-forme, bisexuados | 36 | 36 | 35-56 días | Mezcla suelo oscuro-arena 1:1 | Zhang et al. (2008) |
| P. inermis (Rosenst.) Sota | Triletes | 6-8 días | 8-10 células | Ceratopteris | 20 días | A partir 20 a 25 días ♂ y 30-50 días ♀ uni-sexuales 120 días bisexuados, cordado | 20 días | 30-50 días | No se obtuvo | Medio de Knudson con cuatro diferentes concentraciones de giberelinas | Tanco et al. (2009) |
| P. cretica L. | Triletes y atípicas | Tipo Vittaria, 6-7 días 25% germinación asincrónica entre 30-34 días | 3-5 células | Adiantum | 14 días | 50 días cordi-formes, unisexuados masculinos | 14 días | Ausentes | Apogamia, 90 días | Knudson (modificado por Steeves et al., 1955) | Martínez (2010) |
| P. ensiformis Burm. | Triletes | Tipo Vittaria, 6 a 7 días, 30% de germinación asincrónica entre 30-40 días | 7 a 9 células | Ceratopteris | 10-14 días | Laminares, bisexuados | Protran-dria después de 30 días | 40 días | Sexual A partir de 3 meses | Knudson (modificado por Steeves et al., 1955) | Martínez (2010) |
| P. multifida Poir. | Triletes y atípicas | Tipo Vittaria, 6 a 7 días, 35% de germinación asincrónica entre 30-40 días | 3-5 células | Adiantum | 10-14 días | Laminares bisexuados | Protran-dria después de 20 días | 40 días | Sexual A partir de 3 meses | Knudson (modificado por Steeves et al., 1955) | Martínez (2010) |
| P. vittata L. | Triletes | Tipo Vittaria, 3 días, 97% de germi-nación, asincrónica entre 30-40 días | 3-5 células | Ceratopteris | Antes 10 días | Laminares bisexuados | Protran-dria después de 30 días | 40 días | Sexual A partir de 3 meses | Knudson (modificado por Steeves et al., 1955) | Martínez (2010) |
| Pteris cretica L. | Triletes | NM | NM | NM | NM | 35 días asexual, masculino, femenino, bisexuado | Produje-ron 32 esperma-tozoides (81%), asexuales 19% | Ausentes o anormales | 35 días, Apogámico | Vermiculita-turba-perlita 4:4:2 | Huang et al. (2011) |
| Pteris pellucidifolia Hayata | Triletes, algunas abortadas | NM | NM | NM | NM | 63 días asexual, masculino, femenino, bisexuado | Produje-ron 32 esperma-tozoides 46% asexual 54% mas-culinos | Ausentes o anormales | 63 días Apogámico | Vermiculita-turba-perlita 4:4:2 | Huang et al. (2011) |
| Pteris wulaiensis Kuo | Triletes | NM | NM | NM | NM | 35 días asexual, masculino, femenino, bisexuado | Produje-ron 32 esperma-tozoides, 11% asexual y 81% mas-culinos | Ausentes o anormales | 35 días, Apogámico | Vermiculita-turba-perlita 4:4:2 | Huang et al. (2011) |
| P. deflexa Link | Triletes | Tipo Vittaria | 3-5 células | Ceratopteris | NM | 30-40 días, cordado | Protan-dria | 50 días a los 60 ya maduros | Sexuales, NM tiempo | Knudson (modificado por Steeves et al., 1955) | Martínez et al. (2013) |
| P. denticulata Sw. | Colapsadas | Tipo Vittaria | Más de 15 células | Ceratopteris | Produce 1-3 ramas que son gametofitos formados a partir del primero | 30-40 días, cordado | 15-20 días protandria | 50 días, 10 días después maduros | Sexuales NM tiempo | Knudson (modificado por Steeves et al., 1955) | Martínez et al. (2013) |
| P. tristicula Raddi | Trilete | Tipo Vittaria | 6-8 células | Ceratopteris | Produce 1-3 ramas que son gametofitos formados a partir del primero | 30-40 días, cordado | 15-20 días protandria | 50 días, 10 días después maduros | Sexuales NM tiempo | Knudson (modificado por Steeves et al., 1955) | Martínez et al. (2013) |
| Pteris biaurita L. | Triletes 32 esporas por esporangio | Vittaria 10 días | 5-9 células | Ceratopteris | 22 días, cordado asimétrico | Cordado, unisexuales masculinos | 40-92 | No forma | apogámico | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al. (2015) |
| Pteris ensiformis Burm. | Triletes 64 esporas por esporangio | Vittaria después de 10 días | 2-4 células | Adiantum primeros estadios y Ceratopteris en etapas posteriores, asimétrico-cordado | 18 días, cordado-asimétrico | Unisexua-les mas-culinos y bisexuados 17% | 40-92 | No forma | sexual | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al. (2015) |
| Pteris excelsa Gaud. | Varias formas 64 esporas por esporangio | Vittaria 10 días | 5-9 células | Ceratopteris | 20 días asimétrico- cordado | Unisexua-les mascu-linos | 40-92 | No forma | apogámico | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al. (2015) |
| Pteris longipinnula Wall | Triletes 32 esporas por esporangio | Vittaria 18 días | 5-32 células | Ceratopteris | 20 días asimétrico cordado | Cordado, unisexuales masculinos y femeninos | 92 | 74-102 | apogámico | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al., (2015) |
| Pteris tripartita Sw. | Triletes 64 esporas por esporangio | Vittaria | 3-5 células, 10 días | Adiantum, cordado | 18 días | Unisexua-les mascu-linos y 27% bisexuales | 40-92 | NM | sexual | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al. (2015) |
| Pteris vittata L. | Varias formas Triletes 32 esporas por esporangio | Vittaria 10 días | 7-9 células | Ceratopteris | 16 días | Cordado, unisexua-les mascu-linos | 40 días | No forma | apogámico | Vermiculita-musgo y perlita 4:4:2 | Puspitasari et al. (2015) |
| P. quadri-aurita Retz. | Trilete 32 esporas por esporangio, con anillo ecuatorial | Tipo Vittaria, 29 días | 11 células | Ceratopteris | 150 a 231 días | 164 a 231 días, unisexuados masculinoscordados | 150-231 días | No se formaron | No se formó | Soporte tierra de hoja | Balleste-ros et al. (2016) |
| P. quadri-aurita Retz. | Trilete 32 esporas por esporangio, con anillo ecuatorial | Tipo Vittaria, 29 días | 29-150 días con 11 células | Ceratopteris | 43-231 días | 79-231 días, esfé-ricos, alar-gados y cordados, unisexuados femeninos y cordado-alargados bisexuados | 97-231 días | 193-231, inmaduros | apogamia a los 220-231 días, esporófito 231 días | Soporte musgo | Balles-teros et al. (2016) |
| P. quadri-aurita Retz. | Trilete 32 esporas por esporangio, con anillo ecuatorial | Tipo Vittaria, 43 y 97 días | 43 días con 11 células | Ceratopteris | 60-79 días | 97-178 días, esfé-ricos, alar-gados y cordados, unisexuados femeninos y cordado-alargados bisexuados | 60-220 días, protran-dria | 150-220, inmaduros | apogamia a los 231 días, esporófito 231 días | Soporte maquique | Balles-teros et al. (2016) |
En todos los casos las esporas fueron triletes, aunque en P. cretica y P. multifida se mencionan triletes y atípicas y en P. denticulata colapsadas. La germinación de las esporas en todos los taxones fue tipo Vittaria.
El Cuadro 5 muestra que los taxones fueron sembrados en diferentes medios o sustratos como vermiculita, turba y perlita en proporción 4:4:2; en medio de Thompson modificado; Medio Kingroot; Medio de Thompson; mezcla suelo oscuro-arena 1:1; Medio de Knudson con cuatro diferentes concentraciones de giberelinas y soportes de maquique, tierra de hoja y musgo. El tipo de desarrollo protálico presente en las especies de Pteris fue el tipo Ceratopteris y Adiantum.
En la bibliografía consultada no se encontró ningún estudio referente al desarrollo morfogénico de Pteris quadriaurita y al no contar, con datos de otros taxones del género que hayan sido sembradas en soportes naturales, no fue posible realizar inferencias de otras especies con la aquí estudiada, debido a que el medios o sustratos de cultivo varían los resultados del desarrollo morfogénico aun de la misma especie.
(Huang, Chou, Hsieh, Wang, & Chiou, 2006) observaron en Pteris la presencia de 64 esporas por esporangio, lo cual probaría la condición diploide de una planta aunada a la formación de anteridios y arquegonio y esporófitos de origen sexual. Estos autores también mencionan que la presencia de 32 esporas por esporangio estaría manifestando una poliploidia además de la formación sólo de anteridios y esporófitos apogámicos (p. 262-263). En Pteris quadriaurita se contaron 32 esporas por esporangio, lo que implicaría el origen poliploide de esta entidad y la formación de esporófitos apogámicos, aunque en este caso, se formaron arquegonios, la mayoría no maduraron o bien el cuello del arquegonio estaba vacío.
Así también, (Martínez, 2010) indica que es “frecuente que los especímenes apogámicos produzcan arquegonios no funcionales al determinar que las células del canal del cuello de los arquegonios colapsan, evitando de esa manera el desplazamiento de los anterozoides a la ovocélula” (p. 100). En Pteris quadriaurita se presentaron arquegonios cuyo canal del cuello estaba vacío y otros más que no alcanzaron su desarrollo.
Puspitasari (2015) cita que “no obstante que una especie tenga 64 esporas por esporangio, si éstas difieren en formas y tamaño, producen esporófitos apogámicos debido a que esta variación morfológica se explica por que se lleva a cabo una esporogénesis anormal como sucede en P. excelsa” (p. 99). Estas condiciones de esporas de diferentes tamaños y formas no se encontraron en los ejemplares recolectados de P. quadriaurita, sin embargo, es probable que esto se presente en otras poblaciones de este taxón ya que (Mickel & Smith, 2004) en la descripción de la especie mencionan la presencia de esporas triletes de diferentes tamaños (p. 542).
(Martínez, 2010) indica que en especies cosmopolitas como P. cretica la apogamia es una forma de no depender de las condiciones ambientales para su distribución (p.100). En el caso de P. quadriaurita considerada una especie de amplia distribución por (Tejero-Díez & Torres-Díaz, 2012) y que además indican, que esta planta se ha naturalizado en varias regiones del mundo (p. 120), podría pensarse que la apogamia le ha facilitado la conquista de nuevas regiones.
En Pteris quadriaurita el desarrollo del esporófito se observó en musgo y maquique a los 231 días y en tierra de hoja no se desarrollaron. Lo anterior podría explicarse con base en el trabajo de (Watson & Vázquez, 1981) quienes indican que el microhábitat es trascendental en la historia de vida de las especies y las propiedades del sustrato son importantes. Según estos autores el desarrollo apropiado del esporófito requiere de la asociación con musgos, ya que este evita la desecación y a la raíz del helecho joven le otorga agentes antimicóticos (p. 7). Con lo anterior, quizás los prótalos de P. quadriaurita en una etapa de su desarrollo requieran de la protección del musgo contra la desecación, razón por la cual obtuvimos esporófitos en musgo. En el caso del maquique que son raíces adventicias de los helechos arborescentes, es probable que estas les confieran protección, razón por la cual, también se desarrollaron esporófitos en maquique. En tierra de hoja, que se hubiera pensado fuera el sustrato idóneo para la especie sólo se formaron gametófitos unisexuados masculinos en etapas muy tempranas (protandria) y no se desarrolló el esporófito.
Aunado a lo anterior, (Martínez, 2010) indica que “el desarrollo de gametófitos unisexuados masculinos favorece el cruzamiento con reproducción sexual” (p. 99), entonces sería posible que los gametófitos que se obtuvieron en tierra de hoja sólo estuvieron destinados a la reproducción y los desarrollados en los sustratos de musgo y maquique, además de la reproducción, ambos sustratos tuvieron la función de protección.
Cabe destacar que los tres sustratos se encuentran en bosques mesófilos de montaña. Los resultados de este trabajo abren una serie de preguntas de las posibles interacciones que pueden presentarse en la naturaleza en relación a este taxón.
P. quadriaurita comparte muchos de los caracteres de las otras especies que se muestran en el cuadro 5, como germinación tipo Vittaria, desarrollo protálico tipo Ceratopteris, la presencia de gametófitos unisexuales sólo masculinos como fue en el sustrato de tierra de hoja y unisexuales masculinos, unisexuales femenino y bisexuados como se presentaron en musgo y maquique. Este taxón difiere de las otras especies por presentar gametófitos unisexuados masculinos circulares (10%) y alargados (40%), gametófitos unisexuados femeninos y bisexuados cordado-alargados (5%) y cordados (45%).
Conclusión
Los aspectos que diferencian P. quadriaurita de otras especies es la marcada relación entre la forma de los prótalos y el tipo de gametangios, los unisexuales masculinos fueron circulares y alargados, los prótalos unisexuales femeninos y bisexuados fueron cordados y cordado-alargados.
El tipo de ciclo de vida fue apogámico con la presencia de 32 esporas por esporangio y el desarrollo de arquegonios que no maduraron o bien maduraron, pero el cuello estaba vacío, estos caracteres son propios de especies poliploides.
Los sustratos que se recomiendan para el cultivo de esta especie son el musgo y el maquique, en tierra de hoja no se formaron esporófitos.











 nueva página del texto (beta)
nueva página del texto (beta)