INTRODUCCIÓN
Los manglares son comunidades vegetales halófitas, arbustivas o arbóreas, típicas de las zonas costeras tropicales y subtropicales. Estas plantas comparten adaptaciones morfológicas y fisiológicas que les permiten desarrollarse en suelos frecuentemente anaeróbicos, ricos en materia orgánica y con acentuada fluctuación hidroperiódica (Hogarth, 2007; Twilley, 1998).
La estructura de los manglares se integra por un conjunto de variables tales como la riqueza y dominancia de especies, densidad, altura y área basal, que definen los atributos ecológicos de la comunidad (Cintrón & Schaeffer, 1984; Ramos-Durón, Quiróz-Flores, Ramírez García-Armora, Lot-Helgueras, 2004). Se ha demostrado que los patrones de heterogeneidad estructural en una comunidad de mangles se relacionan estrechamente con procesos geomorfológicos ocurridos durante el Holoceno (Domínguez-Cadena, Riosmena-Rodríguez, & León-de la Luz, 2016; González-Zamorano, Lluch-Cota, & Nava-Sánchez, 2013; Torrescano & Islebe, 2006). Cada especie se adapta de forma diferente a las condiciones ambientales impuestas por la geomorfología, ocupando una zona fisiológicamente óptima en un gradiente ambiental, lo que a nivel de comunidad implica el desarrollo de características particulares de fisiografía, estructura y composición (López-Portillo & Ezcurra, 1989; Lugo & Snedaker, 1974; Méndez-Linares, López-Portillo, Hernández-Santana, Ortiz-Pérez, & Oropeza-Orozco, 2007). Sin embargo, a pesar de contarse con una amplia línea base sobre la distribución espacial de los manglares, su relación con otras variables fisicoquímicas del suelo y agua aún ha sido poco evaluada a escalas locales.
Diversos estudios han evidenciado que los impactos naturales y antrópicos, tales como huracanes, la tala selectiva, cambios de uso de suelo o alteración de la hidrodinámica, pueden afectar la estructura del manglar en periodos de tiempo relativamente cortos (Agraz-Hernández & Flores-Verdugo, 2014; Rodríguez-Zúñiga, Ramírez-García, & Gutiérrez-Granados, 2011; Smith et al., 2009; Tovilla-Hernández, de la Lanza-Espino, & Orihuela-Belmonte, 2001). Por lo tanto, la caracterización estructural de los manglares es un procedimiento indispensable en el monitoreo de estos ecosistemas. Esta información básica constituye parte de los protocolos de valoración del potencial de captura de carbono y para la rehabilitación y restauración de humedales costeros (Flores-Verdugo et al., 2007; Xiaonan, Xiaoke, Lu, & Zhiyun, 2008; Zaldívar-Jiménez et al., 2010).
Las condiciones ambientales en la costa del Pacífico mexicano presentan un marcado gradiente climático, que varía de semiárido en el norte a húmedo en el sur (Flores-Verdugo, de la Lanza-Espino, Contreras-Espinosa, & Agraz-Hernández, 2001). Las diferencias locales en la duración temporal de las estaciones lluviosa y seca, cambios de temperatura y número de ríos a lo largo de la costa Pacífica (de la Lanza-Espino, Ortiz-Pérez, & Carbajal-Pérez, 2013) han conducido a hipótesis que plantean cambios significativos en la estructura de las comunidades bióticas en función de las variaciones ambientales aún dentro de una misma región (Tapia-García, García-Abad, Carranza-Edwards, & Vázquez-Gutiérrez, 2007).
El estado de Chiapas, en el Pacífico sur mexicano, presenta una extensión de 46,804 ha de manglares (Troche-Souza et al., 2016). Al sureste del estado, en la región Soconusco, la amplitud de la planicie costera, mayores precipitaciones y abundante descarga fluvial, favorecen en los manglares un desarrollo estructural comparativamente mayor a los de otras regiones en el Pacífico mexicano (Flores-Verdugo et al., 2001). Son escasas las investigaciones realizadas sobre estructura de los manglares en Chiapas (Montes-Cartas, Castillo-Argüero, & López-Portillo, 1999; Ramírez-García & Segura-Zamorano, 1994; Tovilla-Hernández & Romero-Berny, 2012), y pocas se han enfocado a determinar las variables que definen los patrones ecológicos para cada tipo de comunidad.
Dadas las evidencias que sustentan la delineación de tipos de comunidades con rasgos estructurales específicos a escalas locales (Duke, 2006; González-Zamorano et al., 2013; Trejo-Torres, Durán, & Olmsted, 1993) y la provisión diferenciada de servicios ecosistémicos (Ewel, Twilley, & Ong, 1998), los objetivos de esta investigación fueron: i) analizar la estructura de las comunidades de manglar en el Soconusco a partir de una clasificación de enfoque fisiográfico y su respuesta a factores ambientales, y ii) determinar los rasgos físico-estructurales que caracterizan a cada grupo de manglar identificado en la clasificación.
MATERIAL Y MÉTODOS
Área de estudio
El área estudiada se localiza en la zona meridional de la región del Soconusco en el estado de Chiapas, costa del Golfo de Tehuantepec, Pacífico sur de México. Las comunidades de manglar se asocian al sistema lagunar estuarino de El Cabildo-Amatal-Gancho Murillo, con una extensión de 12 872 ha, entre las coordenadas 14° 44´ 30´´ y 14° 31´ 58´´ de latitud norte, 92° 25´50´´ y 92° 11´ 18´´ de longitud oeste (Ovalle-Estrada & Vásquez-Lule, 2009) (fig. 1). El clima de la región se caracteriza como cálido-subhúmedo con una precipitación anual de 1 578 y temperatura media de 27°C. Existe marcada estacionalidad climática con dos temporadas bien definidas: lluviosa que se extiende de mayo a noviembre, y seca de diciembre a abril (Gobierno de Chiapas, 2010). La vegetación de esta región incluye, además de manglares compuestos por cuatro especies típicas para el neotropico (Rhizophora mangle L., Avicennia germinans (L.) L., Laguncularia racemosa L. (Gaertn.), Conocarpus erectus L.), a selvas inundables de Pachira aquatica Aubl., tulares (Typha domingensis Pers.) y vegetación secundaria con componentes de selva subcaducifolia como Miconia argentea (Sw.) DC., Cynometra oaxacana Brandegee, Guazuma ulmifolia Lam. y Sabal mexicana Mart. (Breedlove, 1981; Pennington & Sarukhán, 2005). El uso del suelo adyacente es principalmente agrícola con diversos cultivos tropicales, aunque recientemente se ha presentado un acelerado desarrollo en los sectores industrial y turístico que ha ocasionado pérdida y fragmentación de manglares (Fernández, 2004; Romero-Berny, Acosta-Velázquez, Tovilla-Hernández, Schmook, & Gómez-Ortega, 2015).

Fig. 1 Localización. A) México, B) Estado de Chiapas y región del Soconusco (sombreado), C) Sistema Cabildo Amatal-Gancho Murillo. Se muestran los tipos de comunidad de manglar: (Mono Rm) Monoespecífica de Rhizophora mangle, (Mono Ag) Monoespecífica de Avicennia germinans, (Mix Pa) Mixta de Pachira aquatica, (Mix Lr) Mixta de Laguncularia racemosa, (Mix Ce) Mixta de Conocarpus erectus.
La región posee relevancia biológica y es altamente vulnerable al impacto ambiental, debido a su intensa dinámica social y productiva. En esta región se encuentran áreas con las siguientes categorías de manejo y conservación: Región Marina Prioritaria Núm. 40, Región Hidrológica Prioritaria Núm. 32, Área de Importancia para la Conservación de Aves Núm. 51, sitios RAMSAR, sitio de manglar con relevancia biológica PS27 y Zonas Sujetas a Conservación Ecológica Cabildo-Amatal y El Gancho-Murillo (Gobierno de Chiapas, 2010; Ovalle-Estrada & Vásquez-Lule, 2009).
Diseño de muestreo y caracterización estructural
La estructura de la vegetación se determinó en 40 unidades de muestreo (UM) rectangulares de m2, subdivididas en cuatro cuadrantes de 5 x 15 m (Valdéz-Hernández, 2002), y distribuidas de manera estratificada, considerando como criterios al tipo fisiográfico de manglar (cuenca o ribereño) (sensu Lugo & Snedaker, 1974) y el grado de perturbación aparente (evidencia de tala). En cada UM se midió el diámetro a la altura del pecho (DAP) con una cinta diamétrica, registrándose únicamente el de aquellos fustes que presentaron DAP ≥ 2.5 cm. Esta variable se midió del fuste a 1.5 m de altura con respecto al nivel del suelo, y para el caso de R. mangle, esta medida se tomó encima de la última raíz aérea. El diámetro de los tocones (diámetro a la altura del tocón, DAT) y árboles muertos también fue medido. La altura total y la cobertura foliar (diámetro mayor y diámetro menor de copa) fueron estimadas utilizando un hipsómetro láser (marca Haglöf). El número de plántulas fue registrado en cuatro subunidades de 1 m2 establecidas en los extremos de cada unidad. Se consideraron como plántulas a las plantas con DAP < 2.5 cm y menores a 1.3 m de altura, cuya densidad se consideró como un indicador de la regeneración potencial del manglar (Valle, Osorno-Arango, & Gil-Agudelo, 2011).
Los valores de densidad fueron estimados como el promedio de individuos ± 1 error estándar (E.E) y desviación estándar (D.E.) en 1 ha. Se calculó el área basal (AB) por tallo con la siguiente fórmula (Cintrón & Schaeffer, 1984; Pool, Snedaker, & Lugo, 1977):
La cobertura foliar (CF) por árbol se calculó asumiendo la proyección de una copa elipsoidal sobre el suelo (Villacencio-García, Espinoza-Aréchiga, Hernández-Álvarez, Gallegos-Rodríguez, & Santiago-Pérez, 2009):
La cobertura relativa del dosel (CD) fue estimada con la siguiente fórmula (Zarco-Espinosa, Valdéz-Hernández, Ángeles-Pérez, & Castillo-Acosta, 2010):
Se calcularon los valores de densidad, frecuencia y dominancia de cada especie, y se estimó el Valor de Importancia Relativa (VIR) a partir de la suma de los valores relativos de esas variables (Pool et al., 1977; Ramos-Durón et al., 2004). Las comunidades se clasificaron de acuerdo con su fisiografía (cuenca, borde y ribereño) (Lugo & Snedaker, 1974) y se describieron en función de sus parámetros estructurales promedio y composición, considerándose monoespecíficas cuando una sola especie presentó dominancia relativa ≥ 90% (Madrigal, 1994).
Caracterización ambiental
Al centro de cada UM se midieron los parámetros físico-ambientales en dos meses distintos correspondiendo a cada temporalidad (seca, febrero 2009; lluviosa, julio 2010; 80 mediciones). La salinidad intersticial (tomada entre 0-30 cm del suelo), pH y temperatura del suelo se midieron con un equipo multiparamétrico (YSI 55) y termómetro, así como el nivel de inundación con una regleta graduada. Por sitio se recolectaron dos muestras de suelo a profundidades de 0-30 cm y 30-60 cm, las cuales fueron secadas a temperatura ambiente y tamizadas a un tamaño de partícula < 2mm. Para determinar el contenido porcentual de materia orgánica en las muestras tamizadas se utilizó el método de combustión seca (375°C) y gravimetría (Ramos-Durón et al., 2004). La temperatura del aire y humedad relativa se midieron con un anemómetro portátil (marca Lutron), bajo el supuesto de que algunos factores de perturbación como la extracción selectiva, pueden conducir a cambios en estas variables dentro de un rodal (Tovilla-Hernández et al., 2001).
Análisis de datos
Se realizaron análisis de ordenación (escalamiento multidimensional-no métrico, NMDS por sus siglas en inglés) y clasificación por conglomerados (UPGMA) de los manglares sobre una matriz de Bray-Curtis para los datos de VIR transformados a raíz cuarta. La significancia de las diferencias estructurales entre cada grupo (α = 0.05) se determinó con un Análisis de Similaridad de una vía (ANOSIM por sus siglas en inglés; 9999 permutaciones). La relación entre el gradiente espacial de la ordenación y los parámetros ambientales se exploró mediante coeficientes de Pearson. Estos análisis se realizaron utilizando el paquete PERMANOVA+ para PRIMER 6 (Anderson, Gorley, & Clarke, 2008).
Las variables de densidad, área basal, altura, cobertura de copa y cobertura de dosel de cada grupo de manglar identificado fueron comparadas por separado mediante un Análisis de Varianza de una vía (ANOVA por sus siglas en inglés), a excepción de los datos de densidad de tocones y árboles muertos en pie, los cuales fueron comparados con un análisis no paramétrico de Kruskall-Wallis, al no cumplirse el supuesto de normalidad y homogeneidad de varianzas (prueba de Shapiro-Wilks). La agrupación de medias se llevó a cabo mediante pruebas post hoc de diferencias honestamente significativas (Tukey) y de comparación múltiple no paramétrica a niveles de significancia del 5% (Sokal & Rohlf, 1994). Las variables físico-estructurales y asociadas al disturbio antrópico (área basal, altura, cobertura de copa, densidad de fustes, plántulas, árboles muertos y tocones) fueron comparadas entre grupos de manglar con un Análisis de Varianza Multivariado (MANOVA por sus siglas en inglés), posterior a la verificación de los supuestos de normalidad multivariada (pruebas de Mardia). Finalmente, la exploración espacial de las relaciones lineales entre dichas variables y los grupos identificados se realizó con un Análisis Discriminante Canónico (CDA por sus siglas en inglés). La contribución de cada variable se determinó mediante coeficientes estándares jerarquizados. Estos análisis se desarrollaron con rutinas en los paquetes Vegan 2.0 y Candisc 0.5 en la interfaz de R 2.14 (Friendly & Fox, 2011; Oksanen, 2011; R Development Core Team, 2011).
RESULTADOS
Durante este estudio se midieron un total de 2 981 árboles correspondientes a siete especies; cuatro se consideran mangles verdaderos: R. mangle, L. racemosa, A. germinans y C. erectus; y tres como especies asociadas: P. aquatica, Pithecellobium dulce (Roxb.) Benth. y Coccoloba barbadensis Jacq. El 86.3% de los árboles presentaron un DAP ≤ 17.7cm, un área basal estimada de 36.5 m2ha-1, diámetro de copa promedio de 7.4 m2 y altura promedio de 15.5 m.
Clasificación y ordenación de las comunidades
En el análisis de conglomerados se distinguieron cinco grupos de manglar basados en el Valor de Importancia de las especies entre los 40 sitios muestreados: Monoespecífico de R. mangle (Mono-Rm), Monoespecífico de A. germinans (Mono-Ag), Mixto de P. aquatica, Mixto de L. racemosa (Mix-Lr) y Mixto de C. erectus (Mix-Ce). El diagrama de ordenación por NMDS mostró correspondencia espacial con los grupos identificados por los conglomerados y con un bajo valor de estrés (0.08) (fig. 2). Esto reflejó una baja variabilidad entre las unidades de muestreo clasificadas como Mono-Rm, Mono-Ag y Mix-Pa, y con un relativo traslape en las comunidades Mix-Lr y Mix-Ce, señalando una mayor heterogeneidad en su composición. El ANOSIM indicó diferencias significativas en la estructura de los manglares por grupo (R = 0.96; p = 0.001) y por pares (R > 0.71; p < 0.05).
Las variables ambientales con un mayor coeficiente de correlación con las dimensiones de ordenación NMDS fueron Salinidad (NMDS 2; R= -0.58; p < 0.0001), Nivel de Inundación (NMDS 2; R = 0.64; p < 0.0001) y contenido de Materia Orgánica 30-60 cm (NMDS 1; R = 0.5; p < 0.01), en correspondencia con el gradiente espacial que separa a los grupos Mix-Pa y Mono-Ag (fig. 2).
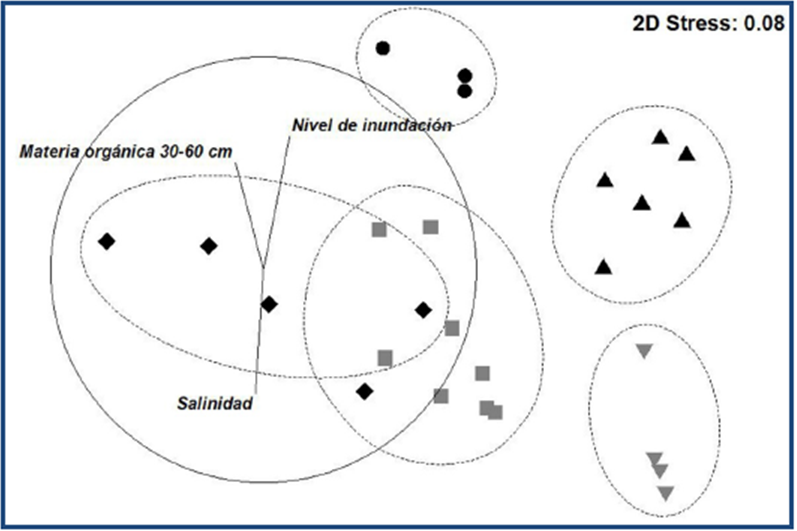
Fig. 2 Diagrama de ordenación por Escalamiento Multidimensional no Métrico para las unidades de muestreo. Las elipses punteadas representan los conglomerados identificados en la clasificación con similitud de 60%. La longitud y dirección de los vectores representa la fuerza de la correlación de tres variables significativas (Pearson > 0.5) con respecto a un circulo unitario (línea continua). Grupos: ▲ (Mono-Rm), ▼ (Mono-Ag), ● (Mix-Pa), ■ (Mix-Lr), ♦ (Mix-Ce).
En el cuadro 1 se presentan los VIR y sus componentes para cada especie por grupo. El grupo Mono-Rm comprendió 13 sitios en donde R. mangle es dominante promedio. Fisiográficamente presenta correspondencia con formaciones tipo Borde y Ribereño. En esta comunidad se aprecia un subtipo de ocho sitios con R. mangle como especie única, y cuatro subtipos con cinco sitios en donde es dominante sobre L. racemosa, A. germinans y P. aquatica. El grupo Mono-Ag agrupó a nueve sitios con A. germinans como dominante promedio, correspondiendo a una formación tipo Cuenca. En un subtipo compuesto por siete sitios A. germinans es la especie única, mientras que en dos sitios domina sobre R. mangle y L. racemosa. El grupo Mix-Pa comprendió tres sitios con mayor dominancia promedio de la especie P. aquatica, de los cuales en dos sitios R. mangle se encuentra con dominancias mayores a 20% y en uno P. aquatica se presentó como especie única. Se trata de una formación fisiográfica tipo Ribereña. El grupo Mix-Lr incluyó 10 sitios con mayor dominancia promedio de L. racemosa, presentando un subgrupo de tres sitios monoespecíficos de esta especie, separándose un sitio donde domina sobre R. mangle y A. germinans. En otros dos subgrupos de esta comunidad, cuatro sitios presentaron rodales mixtos de L. racemosa/A. germinans y dos de L. racemosa/P. aquatica. El grupo presentó formaciones fisiográficas tipo Cuenca y Borde. La agrupación Mix-Ce agrupó a cinco sitios con dominancia mayor promedio de C. erectus. Incluyó subgrupos con tres sitios monoespecíficos de C. erectus, un sitio con dominancia de esta especie sobre L. racemosa y uno mixto de C. erectus/A. germinans (dominancia proporcional 38.5%/37.8%) con presencia de L. racemosa y R. mangle (dominancias de 16% y 7.7%, respectivamente), siendo el sitio más heterogéneo del muestreo. Fisiográficamente son formaciones tipo Cuenca, aunque C. erectus se presentó también en comunidades terrestres periféricas al manglar. La distribución espacial de las UM clasificadas de acuerdo al tipo de comunidad se presenta en la figura 1.
Cuadro 1 Valores de Importancia Relativos (VIR) de cada especie por grupo.
| Tipo de comunidad/Especies | Densidad (%) | Dominancia (%) | Frecuencia (%) | VIR (%) |
|---|---|---|---|---|
| Mono-Rm Rhizophora mangle Laguncularia racemosa Avicennia germinans Pachira aquatica Total |
94.6 3.1 1.6 0.6 100 |
96.4 1.7 1.9 0.0 100 |
61.9 19 14.3 4.8 100 |
84.3 7.9 6 1.8 100 |
| Mono-Ag Avicennia germinans Rhizophora mangle Laguncularia racemosa Total |
96.1 3.7 0.2 100 |
99.8 0.2 0.0 100 |
69.2 23.1 7.7 100 |
88.4 9 2.6 100 |
| Mix-Pa Pachira aquatica Rhizophora mangle Laguncularia racemosa Pithecellobium dulce Total |
89.8 5.1 4.3 0.8 100 |
78.2 21.2 0.4 0.1 100 |
33.3 22.2 33.3 11.1 100 |
67.1 16.2 12.7 4 100 |
| Mix-Lr Laguncularia racemosa Avicennia germinans Rhizophora mangle Pachira aquatica Coccoloba barbadensis Total |
85.3 7.7 4.3 2.4 0.2 100 |
70.4 12.6 11.9 5 0.0 100 |
43.5 21.7 8.7 21.7 4.3 100 |
66.4 14 8.3 9.7 1.5 100 |
| Mix-Ce Conocarpus erectus Laguncularia racemosa Avicennia germinans Rhizophora mangle Total |
85.6 13.3 0.7 0.4 100 |
79.5 12.2 6.9 1.3 100 |
50 30 10 10 100 |
71.7 18.5 5.9 3.9 100 |
Estructura
Las mayores densidades promedio (± D.E.) de fustes se estimaron en los grupos Mix-Ce (5,069 ± 3540 ha-1) y Mix-Lr (2,967 ± 1,148 ha-1), diferentes en comparación a los otros tipos de comunidades (F = 7.2, p<0.001; fig. 3A). Los grupos Mono-Ag y Mix-Pa presentaron las mayores densidades de plántulas (2,442 ± 1,558 y 2,300 ± 636 ha-1, respectivamente) difiriendo significativamente (F = 4.3, p < 0.001; Fig. 3B) del resto de las comunidades. La mayor densidad de árboles muertos en pie se determinó en los grupos Mix-Ce (208 ± 192 ha-1) y Mix-Lr (187 ± 122 ha-1), aunque estas diferencias no fueron significativas en relación a los demás grupos (H = 3.8, n.s; Fig. 3 C). Para el caso de los árboles talados, se determinaron diferencias entre grupos (H = 9.7, p < 0.05; fig. 3D), con la mayor densidad de tocones estimada en Mix-Ce (831 ± 629 ha-1). Los valores de área basal difirieron significativamente entre comunidades (F = 6.8, p < 0.001; fig. 3E), mostrando la prueba post hoc una mayor afinidad entre los grupos Mono-Rm (48.6 ± 22.2 m2 ha-1), Mono-Ag (32.5 ± 11.4 m2 ha-1) y Mix-Lr (41.4 ± 30.9 m2 ha-1), siendo estos los valores más altos. En términos de altura máxima de los árboles, esta se encontró en Mix-Lr (22 ± 7.1 m), en afinidad con las alturas estimadas en Mono-Rm, Mono-Ag y Mix-Pa, difiriendo significativamente (F = 3.7, p < 0.05; fig. 3F) de las Mix-Ce. La cobertura foliar presentó diferencias entre grupos (F = 4.3, p < 0.01; fig. 3G), encontrándose la mayor en Mix-Pa (16.6 ± 12.3 m2), en correspondencia con la mayor cobertura relativa de dosel para esta misma comunidad (100%), con diferencias respecto a los otros grupos (F = 4.9, p < 0.01; fig. 3H).

Fig. 3 Variación estructural de los grupos de manglar. Valores promedio ± 1 E.E. de A) Densidad de fustes, B) Densidad de plántulas, C) Densidad de árboles muertos en pie, D) Densidad de tocones, E) Área basal, F) Altura, G) Cobertura foliar, H) Cobertura relativa del dosel. Para cada panel, letras diferentes indican diferencias significativas para cada variable entre tipos de comunidad (p ≤ 0.05).
Variables ambientales y su relación con la heterogeneidad estructural
Con respecto a las condiciones físico-ambientales promedio para las dos estaciones climáticas, se observó que la salinidad fluctuó entre 26.7 ± 16.8 ups, en sitios con comunidades Mono-Ag, y 0.7 ± 0.6 ups en aquellos con comunidades Mix-Pa (fig. 4A). Así mismo, el mayor valor promedio de inundación (55.2 ± 32.4 cm) se presentaron en este grupo, en contraste con el menor (6.2 ± 3.1 cm) en sitios de Mix-Ce (fig. 4B). Los valores de pH fluctuaron entre 7 ± 0.1 (Mix-Pa) y 7.4 ± 0.7 (Mix-Ce; fig. 4C). La temperatura del aire al dentro de los sitios varió de 31.7 ± 3.7°C en Mix-Ce a 29.1 ± 2.5°C en Mix-Pa (fig. 4E). La mayor humedad relativa (75.9 ± 5.5%) se registró dentro de los sitios de Mono-Rm, mientras que la menor (69 ± 0.9%) fue en Mix-Ce (fig. 4G). Los mayores porcentajes de materia orgánica en el suelo se encontraron en Mix-Pa (32.1 ± 9.6% de 0-30 cm y 23.6 ± 9.5% de 30-60 cm; fig. 4D); encontrándose los porcentajes más bajos en Mix-Ce (7.7 ± 0.7% de 0-30 cm) y Mono-Ag (4.6 ± 4.4% de 30-60 cm; fig. 4H).

Fig. 4 Variables ambientales en las agrupaciones de manglar en la región sur del Soconusco, Chiapas, México. A) Salinidad, B) Nivel de inundación, C) pH, D) Porcentaje de materia orgánica (0-30 cm), E) Temperatura del aire, F) Temperatura del suelo, G) Humedad relativa, H) Porcentaje de materia orgánica (30-60 cm). Línea continua indica valores de la temporada seca. Línea punteada indica valores de la temporada lluviosa.
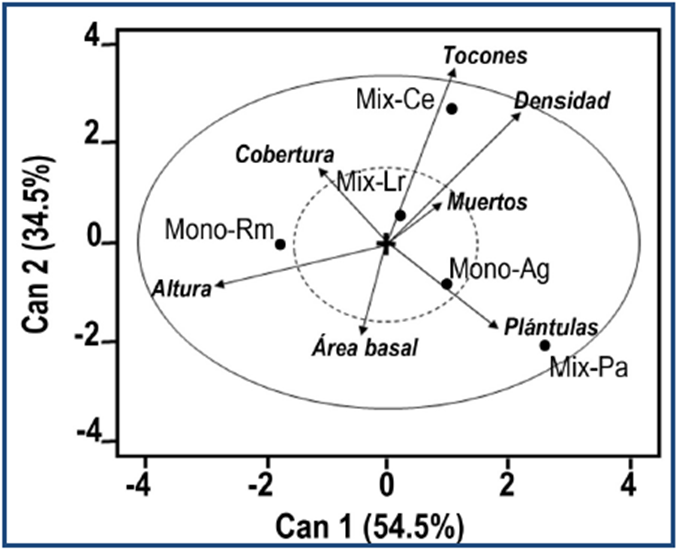
El MANOVA permitió corroborar significativamente la separación espacial entre las agrupaciones de manglar (T de Pillai, F = 3.04, p < 0.0001), con lo que se justificó la exploración del patrón multivariado con el CDA. El CDA mostró que en dos funciones discriminantes se explica el 89% de la varianza total. Los coeficientes estandarizados (> 0.5) reflejaron una mayor importancia relativa de las variables Área basal, Altura y Diámetro de copa para la primera función; mientras que para la segunda función la variable de mayor contribución fue la de impacto antrópico Densidad de tocones (cuadro 2). En el diagrama de la ordenación se observó que los centroides para los grupos Mix-Pa y Mono-Ag se encontraron definidos por la Densidad de plántulas, mientras que el grupo Mix-Ce presentó relación espacial con las densidades de tocones y fustes. Para el caso del grupo Mono-Rm, se encontró mejor definida por la Altura. Es notable la relación inversa que presentan las variables Cobertura de dosel y Área basal con las variables asociadas a impacto antrópico Densidad de plántulas y Densidad de tocones, respectivamente (fig. 5).
Cuadro 2 Resumen de resultados del Análisis Discriminante Canónico y contribución de las variables estructurales a las funciones expresada en coeficientes estandarizados. *Variables que contribuyen más a la caracterización de los tipos de comunidad.
| Función canónica | Valor característico | Proporción | Correlación canónica (λ) | p > F | |
|---|---|---|---|---|---|
| Valor | Acumulada | ||||
| Función 1 | 2.204 | 54.54 | 54.54 | 0.089 | 0.001 |
| Función 2 | 1.394 | 34.50 | 89.05 | 0.286 | 0.001 |
| Variables estructurales | Coeficientes estandarizados | ||||
| Función 1 | Función 2 | ||||
| Densidad de fustes | 0.305 | 0.268 | |||
| Área basal | 0.878* | 0.359 | |||
| Densidad de tocones | 0.209 | 0.925* | |||
| Densidad de árboles muertos | -0.411 | -0.418 | |||
| Densidad de plántulas | 0.402 | -0.209 | |||
| Altura | -0.945* | 0.369 | |||
| Cobertura de dosel | -0.761* | 0.277 | |||
DISCUSIÓN
Las clasificaciones en comunidades de manglar se han basado a partir de dos enfoques principales: fisiográfico-estructural y geomorfológico (Lugo & Snedaker, 1974; Thom, 1984). Como se demuestra en este estudio, los rasgos diferenciales de dominancia y composición permiten delinear agrupaciones locales de manglares que favorecen su manejo regional y la valoración de sus servicios ecosistémicos (Duke, 2006; Ewel et al., 1998; González-Zamorano et al., 2013; Trejo-Torres et al., 1993; Urrego, Polanía, Buitrago, Cuartas, & Lema, 2009).
En esta región se encontraron las cuatro especies de mangles más comunes para México (Pennington & Sarukhán, 2005), presentes en distinto grado de dominancia en los cinco tipos grupos identificados. Las marcadas diferencias en su estructura, pueden indicar un traslape de requerimientos ambientales y tolerancia a cierto grado de estrés ambiental (Upkong, 1995). La interrelación de variables como la inundación, salinidad, fertilidad y la saturación del suelo define gradientes ambientales en las áreas intermareales que dirige una zonación o estratificación en la distribución de los manglares, patrón que cuenta con una sólida evidencia experimental (Bunt, 1996; Krauss et al., 2008). Desde un enfoque ecofisiológico, los mangles pueden superponerse en su rango de tolerancia a la interacción de factores ambientales o al estrés por impacto antrópico, favoreciendo la distribución de especies en un nicho funcional estrecho (Ball, 1988; Barnuevo & Asaeda, 2018). Estos paradigmas sustentan el resultado obtenido en nuestro estudio, que demuestra la conformación de comunidades de manglar diferenciables en composición, dominancia y estructura en respuesta a las condiciones ambientales.
Se ha demostrado que las especies típicas de mangles presentes exhiben diferentes requerimientos ambientales en respuesta a su historia evolutiva, coexistiendo mediante un uso diferenciado de los recursos disponibles en el suelo bajo marcados gradientes de salinidad (Krauss et al., 2008). Por ejemplo, mientras que R. mangle puede desarrollarse con éxito ecológico en salinidades cercanas a 35%, A. germinans puede encontrar un óptimo desarrollo en ambientes hipersalinos; por otro lado, aunque L. racemosa prefiere sitios menos salinos, su gran plasticidad fenotípica le permite colonizar una mayor diversidad de ambientes incluyendo los sujetos a perturbación. Para el caso de C. erectus, la especie tiende a distribuirse en hábitats con menor influencia mareal, periféricos al manglar y en contacto con la vegetación terrestre (Agudelo et al., 2015; Montes-Cartas et al., 1999; Urrego et al., 2009).
En este estudio, las especies A. germinans y R. mangle presentaron mayor tendencia a formar rodales monoespecíficos, probablemente como una adaptación intrínseca a condiciones ambientales específicas (López, Barreto, & Conde, 2011). Mientras R. mangle tolera mejor los suelos con mayor grado de anoxia, A. germinans prospera en depresiones propensas a la hipersalinidad (Arreola-Lizárraga, Flores-Verdugo, & Ortega-Rubio, 2004). En este estudio se observó que en sitios con una alta dominancia de R. mangle, prevalecen condiciones de menor salinidad, lo que puede reflejar una mayor frecuencia de inundación y menor evaporación (Agudelo et al., 2015; Strauch, Cohen, & Ellmore, 2012). Hacia el interior de la planicie costera, la variación microtopográfica, permite el desarrollo de A. germinans en cuencas de inundación somera, con una amplitud de marea reducida e incremento de salinidad por mayor tasa de evaporación. L. racemosa presentó una mayor plasticidad de desarrollo en rangos variantes de salinidad e inundación, y una mayor tendencia a formar rodales mixtos con elevado desarrollo estructural.
En este estudio se observó que el grupo Mono-Rm presenta atributos estructurales similares a los señalados por Tovilla-Hernández & Romero-Berny (2012) en comunidades afines descritas en la zona de Panzacola-El Hueyate al centro del Soconusco (área basal: 45 m2 ha-1; altura: 22 m; densidad: 2 352 fustes ha-1). En contraste, los mismos autores describen rodales arbustivos de R. mangle en el istmo sur de Tehuantepec, Oaxaca, localizados a poco más de 250 km al norte del Soconusco, y que presentan bajo desarrollo estructural (área basal: 4.32 m2 ha-1; altura: 4.18 m; densidad: 2 701 fustes ha-1). Para el caso de los grupos monoespecíficos de A. germinans, en este estudio se presentan valores estructurales más altos, aunque en menores densidades. Por ejemplo, a lo largo del Pacífico mexicano se ha registrado rangos de área basal de 11.9-16.9 m2 ha-1 y alturas medias de 4.5-7 m en ambientes semiáridos; y áreas basales de 12.5-29.6 m2 ha-1 y alturas de 7.5-8.8 m en localidades sub-húmedas (Flores-Verdugo, González-Farías, Segura-Zamorano, & Ramírez-García, 1992). Estos patrones pueden reflejar árboles de mayor tamaño en menor densidad y altas densidades de plántulas, indicando rodales maduros, y en respuesta a sitios menos inundados en donde la salinidad puede ser mayor (Cintrón & Schaeffer, 1984; Rodríguez-Ramírez, Nivia-Ruíz, & Garzón-Ferreira, 2004). Los sitios de Mix-Lr presentaron altos valores en las variables de densidad, área basal y altura, similares en composición y estructura a los manglares de la zona de Manialtepec, Oaxaca (área basal: 49.1 m2 ha-1; altura: 17.3 m; densidad: 2,367 fustes ha-1) (Tovilla-Hernández & Romero-Berny, 2012). Debido a los altos requerimientos de luz de la especie, las mayores densidades en L. racemosa, han sido asociadas a procesos de sucesión posteriores a disturbios como la apertura de claros (Jiménez & Soto, 1985; McGowan et al., 2010; Montes-Cartas et al., 1999). Para los grupos Mix-Ce, se encontraron elevadas densidades, en concordancia con los bosques descritos en el estado de Guerrero (Tovilla-Hernández & de la Lanza-Espino, 1999), quienes registran plantas jóvenes de esta especie con DAP de entre 5 y 20 cm.
El manglar con alta dominancia de P. aquatica se presenta en áreas restringidas del Soconusco, sin que se haya encontrado un tipo de comunidad similar al norte de esta región en la costa del Pacífico. Respecto a su estructura, Montes-Cartas et al. (1999) encontraron comunidades de R. mangle-P. aquatica con elevado desarrollo en la Reserva de la Biósfera La Encrucijada, aproximadamente a 20 km al noroeste de los sitios de este estudio, con alturas promedio de entre 20 y 30 m, rasgo probablemente asociado a un menor estrés por salinidad. En el Golfo de México P. aquatica se ha registrado como un componente más común de la vegetación de manglar. En Laguna Chica, Veracruz, se describen asociaciones de P. aquatica y manglar con área basal de 47.44 m2 ha-1, altura promedio de 12 m y densidad de 2 400 fustes ha-1 (Infante-Mata, Moreno-Casasola, Madero-Vega, Castillo-Campos, & Warner, 2011). En el Soconusco la distribución de esta especie parece asociarse a ambientes de baja salinidad (0-1.7 ups). En el Golfo de México se han registrado comunidades de P. aquatica-R. mangle en condiciones de hasta 18.7 ups de salinidad superficial, aunque esto no necesariamente puede indicar estrés a nivel de raíces (Infante-Mata, Moreno-Casasola, & Madero-Vega, 2014). Es evidente que P. aquatica comparte diversas adaptaciones biológicas y ecológicas con los manglares, mismas que favorecen su desarrollo en sitios con inundación permanente, los mecanismos que le permiten tolerar la salinidad aún son poco conocidos.
Como se ha analizado en otras áreas de manglar, se observa un gradiente abiótico, siendo determinantes la salinidad y el nivel de inundación, análisis que respalda la hipótesis de una respuesta estructural en manglares a variaciones de microtopografía e hidroperiodo (Flores-Verdugo et al., 2007; Méndez-Linares et al., 2007), o a cambios en el régimen anual de precipitación por periodos prolongados (Agraz-Hernández et al., 2015). Otra variable correlacionada puede ser el carbono, almacenado en forma de materia orgánica en suelos de manglar. El mayor porcentaje se obtuvo en muestras de suelo de 0-30 cm en grupos de Mix-Pa, aunque el carbono puede ser más significativo a nivel de rizoma a profundidad media (> 30 cm). En relación con otras comunidades forestales asociadas a humedales, esto puede deberse a una elevada producción de hojarasca y un mayor tiempo de inundación durante todo el año, lo cual limita la descomposición de materia orgánica por una baja difusión de oxígeno (Whiting & Chanton, 2001).
El pH en áreas de manglar normalmente se mantiene en valores ligeramente básicos, situación observada en este estudio. Es particularmente de interés el seguimiento de la humedad relativa y la temperatura del aire. Tovilla-Hernández et al. (2001) registraron para un periodo anual, un aumento de 11°C en la temperatura y menor humedad dentro de un manglar a causa de la deforestación, demostrando que las condiciones ambientales locales pueden ser modificadas por un agente de perturbación. No obstante, es necesario tener en cuenta que estas variables pueden presentar marcadas fluctuaciones a lo largo del día, por lo que se recomienda estandarizar su medición.
Con respecto a algunos patrones estructurales, se ha demostrado que la altura y el área basal muestran una relación inversa con la salinidad. Estos atributos disminuyen progresivamente con el incremento de la salinidad y un decrecimiento en la disponibilidad de nutrientes (López et al., 2011; Lugo & Snedaker, 1974). El bajo aporte de agua dulce implica una menor cantidad de nutrientes y la acumulación de sales en el sedimento, aspectos reflejados en la estructura de las comunidades. Montes-Cartas et al. (1999) encontraron variación en la composición y altura de los manglares en un gradiente latitudinal: los manglares de la costa norte de Chiapas con menor aporte de escorrentías presentan menor desarrollo estructural que los de la costa sur, en donde prevalece una mayor precipitación y número de ríos que drenan hacia la costa.
Una variable de perturbación en este estudio que presenta relación significativa con la comunidad Mix-Ce es la densidad de tocones. Tovilla-Hernández & De la Lanza-Espino (1999) registran que es una especie sobreexplotada en México. Los mismos autores señalan que las especies con mayor preferencia de uso son C. erectus, L. racemosa y en menor grado R. mangle. Su amplio uso como leña o material de construcción conduce a una tala selectiva. Por ejemplo, en el sistema lagunar de Alvarado, Veracruz, el elevado número de mangles extraídos ha conducido a alteraciones en la dominancia del bosque (Rodríguez-Zúñiga et al., 2011). Sin embargo, se reconoce que los efectos a largo plazo de la remoción de individuos en la estructura del manglar aún son poco conocidos. A pesar de la implementación de diversos instrumentos legales para reducir el consumo de madera de mangle (Gobierno de Chiapas, 2010), su uso es extenso y poco regulado.
La estimación de la densidad de plántulas permitió una aproximación al proceso de regeneración natural. Este proceso se relaciona con la cantidad de luz que penetra al sotobosque, y, según la especie, puede afectar la sobrevivencia de las plántulas (Duke, 2001). La luz puede estar relacionada con la cobertura relativa del dosel, la caída de árboles muertos y la extracción selectiva. En este trabajo se encontró relación entre la cobertura del dosel y la densidad de plántulas. Estas dos comunidades presentan las mayores densidades de plántulas registradas en este estudio. La mayor densidad de plántulas se encontró en grupos de Mix-Ag, la cual presentó un dosel cerrado (92.2%). Pinto-Nolla (1999) indica que A. germinans presenta un mayor crecimiento de plántulas establecidas durante el primer año, y en cierto grado intolerante a grandes cantidades de luz, presentando un mejor desarrollo bajo el dosel cerrado. Los grupos Mix-Lr y Mix-Ce presentaron los doseles menos cerrados para el área de estudio (< 76.5%). Así mismo presentan menor densidad de plántulas, asumiéndose en parte como una consecuencia del impacto por extracción. Se ha mencionado que L. racemosa presenta tasas más altas de germinación y sobrevivencia bajo condiciones de luz, lo que puede reflejar un mayor éxito en competencia interespecífica (Blanco, Estrada, Ortiz, & Urrego, 2012; Pinto-Nolla, 1999).
El grupo Mix-Pa, desarrolla un dosel completamente cerrado y alta densidad de plántulas. Se ha demostrado que P. aquatica es una especie de alta plasticidad fenotípica, adaptable a condiciones de alta y baja intensidad lumínica; pudiendo las plántulas presentar menor desarrollo, pero alta sobrevivencia bajo condiciones limitadas de luz (Infante-Mata & Moreno-Casasola, 2005).
En la mayoría de los grupos de manglar identificados en este estudio, se encontraron bajas densidades de árboles muertos en pie. Jiménez y Soto (1985) señalan que la tasa de mortalidad natural en mangles maduros, al igual que en la mayoría de los árboles tropicales, es muy baja. Los factores naturales que influyen en la mortalidad de los manglares, son la competencia intraespecífica, herbivoría, enfermedades endémicas y senescencia. Es un proceso denso dependiente y que afecta a propágulos, plántulas y árboles con distinto grado de madurez, aunque se ha observado que la mayor mortalidad ocurre en plántulas y arbolado joven. Otro tipo de mortalidad natural es causada por fenómenos meteorológicos, tales como tormentas y huracanes que pueden provocar eventos de mortalidad masiva, afectando principalmente a comunidades tipo cuenca (Smith et al., 2009).
De manera general, se considera que la región del Soconusco está sujeta a diversos impactos, como la contaminación por residuos sólidos, aguas residuales y agroquímicos, además de la deposición y sedimentación de cuerpos de agua como consecuencia de la erosión y transporte de sedimentos de áreas deforestadas en la cuenca media y alta. A pesar de la presencia de áreas naturales protegidas, la falta de un plan de gestión y regulación del uso de recursos, tiene una influencia determinante en la degradación de la vegetación. Se considera importante considerar las características estructurales de cada tipo de manglar, a fin de diseñar una zonificación apropiada de las áreas protegidas acorde con su dinámica espacial, y proponer medidas de rehabilitación y restauración de ecosistemas y otras medidas de mitigación de impactos. Es conveniente establecer un control permanente de los bosques de manglares y promover el desarrollo de políticas que fortalezcan la gestión integrada de la cuenca costera del estado de Chiapas.











 text new page (beta)
text new page (beta)