Introducción
El chile fue una de las primeras plantas domesticadas y cultivadas en el hemisferio este; se han encontrado cropolitos de algunas semillas y fragmentos de chile desde 9000 años a. c. (MacNeish, 1964, Long, 1986 , Bosland, 1999).
Los chiles provienen de las plantas del género Capsicum de la familia solanaceae, el clima y tipo de suelo permiten desarrollar una gran cantidad de variedades, lo que provoca que sea difícil una clasificación. Actualmente existen varias especies como C. pubescens, C. chinense, C. pendulum, C. mínimum, C. frutenscens y C. annuum , con más de 50 variedades. En México la clasificación admitida considera solo dos especies:
I. C. annuum , con seis variedades:
1. C. annuum L. var. conoides Miller.
2. C. annuum L. var. acuminatum Fingerh.
3. C. annuum L. var. longumSendt.
4. C. annuum L. var. grossumSendt.
5. C. annuum L. var. abbreviatumFingerh.
6. C. annuum L. var. ceraciformeMiller.
II. C. frutescens: con una variedad:
C. frutescens var. baccatum.
Los chiles secos del género Capsicum annuum L. son ricos en carotenoides estos pertenecen al grupo de los isoprenoides o terpenoides, se originan de una molécula de cinco átomos de carbono llamada isopreno.
Esta molécula en su forma reactiva, isopentil pirofosfato (IPP), se condensa con su propio isómero, dimetilalil pirofosfato (DMAPP) para producir el geranil pirofosfato (GPP), posteriormente el farnesil pirofosfato (FPP) y por último el geranilgeranil pirofosfato (GGPP) (Delgado Vargas F, 2003). Cada una de las unidades se unen conforme a un patrón cabeza-cola hasta antes de la formación de GGPP, la cual se origina de la unión cola-cola de dos moléculas de GPP para formar un compuesto de 40 átomos de carbono con el orden invertido en el centro (Delgado Vargas F, 2003), el cual forma al fitoeno, primer carotenoide incoloro, producido en la ruta. Posteriormente la insaturación de la cadena hidrocarbonada produce dobles enlaces conjugados, lo que le proporciona a la molécula la capacidad de absorber luz de ciertas longitudes de onda y provocar la pigmentación en los organismos o tejidos que los contienen. El licopeno es el precursor biosintético de la mayoría de los carotenoides cíclicos. La conversión de licopeno a β- caroteno es mediante la enzima β-licopeno-ciclasa (LCY-B) la cuál cataliza la formación de anillos β-ionona en los extremos de la molécula (Cunningham et al., 1996).
La ciclación del licopeno es un punto importante en la regulación de la ruta de la biosíntesis de los carotenoides. La formación del ciclo en ambos extremos de la molécula del licopeno produce los α-, β -, ε -, carotenos. La reacción de ciclación es catalizada por las enzimas β- o ε- licopeno ciclasa (P.A, 1995).
Si la enzima β-licopeno actúa en ambos lados de la molécula se forma el β-caroteno, siendo este el precursor de las xantofilas: zeaxantina, violaxantina y anteraxantina. Las xantofilas se producen cuando uno o más átomos de oxígeno en grupos ceto, hidroxi, epoxi, entre otros se introducen a la molécula del caroteno (Cunningham F X, 2001). Los anillos ε difieren de los β en la posición del doble enlace dentro del ciclohexano; es común encontrar anillos modificados en plantas. (Pecker et al., 1996). Para finalizar existe otro grupo de carotenoides los bicíclicos que presentan un anillo β y un anillo ε en su estructura. Estos anillos son frecuentes en plantas, algas y animales precursores de varias xantofilas, como la luteína (P.A, 1995, Chappell, 1995, Cunningham et al., 1996, Ronen et al. 1999).
El chile Ancho presenta una forma triangular, con un hundimiento del pericarpio en la unión con el pedicelo (cajete pronunciado), los frutos tienen una longitud promedio de 12 cm de largo y de ancho de 6.5 cm, es un fruto con cuatro lóculos o venas; esto se puede observar haciendo un corte transversal en el fruto en el cuál se observa un número de espacios llamados lóculos separados por venas (placenta) que van desde del centro al pericarpio (Salud, 2007). Se cultiva en los estados de Zacatecas, Durango, San Luis Potosí, Guanajuato. Se emplea en la preparación de diferentes moles y colorantes; en fresco se le conoce como chile poblano. (Secretaría de Agricultura, Ganadería, Desarrollo Rural, 2016).
El chile Pasilla es un fruto largo de forma cilíndrico y ondulado, con epidermis lisa o ligeramente rugosa, de 12 cm a 35 cm de largo y de 2 cm a 4 cm de ancho, presentan de dos a cuatro lóculos. De color verde oscuro brillante. Generalmente de ápice puntiagudo, ocasionalmente curvo (Salud, 2006, 2007).
La cosecha de chile se hace manualmente cuando se destina a la deshidratación. En general se van cortando a medida que los frutos se cortan a medida que cambian de color verde a rojo; en el caso del chile pasilla y mulato, se cortan cuando cambian de color verde a café oscuro. Los chiles son secados de dos formas secado en paseras modificadas y/o en hornos secadores.
a) El secado en hornos secadores: Se realiza con calor artificial en un túnel largo de cemento con dos entradas y dos salidas; en el centro se encuentra otro túnel con una cámara a lo largo del cuarto y un quemador de diésel o de gas en un extremo. Los chiles son transportados a los túneles en carros con bastidores o recipientes con fondo de malla de alambre; el secado se realiza a temperaturas entre 60 y 80°C con un tiempo de 30 a 40 horas para la extracción del agua. Posteriormente se lleva a cabo un enfriado de los chiles siendo depositados en un piso de cemento y son rociados con agua potable con el fin de evitar la pérdida excesiva de agua y lograr el buen manejo de empaque.
b) El secado en “paseras” se colocan los chiles al sol acomodados en un lugar plano con un ligero declive para evitar encharcamientos en caso de lluvia. Posteriormente se extiende una capa de paja o ramas secas y se colocan los frutos recién cosechados lo anterior se realiza para permitir el paso de aire y eliminar el exceso de humedad con esto se evita que los frutos se dañen por hongos. Una vez seca la parte superior, el chile se voltea para que la parte inferior también reciba los rayos del sol. El secado bajo este método dura de 10 a 20 días, dependiendo de la intensidad del sol y la temperatura. Mediante este método los frutos son de mayor calidad y tienen mejor precio.
Secado en pasera modificada en este método los frutos son cubiertos con polietileno y se colocan piedras o bloques en las orillas del polietileno a un metro de distancia. Esta operación permite la circulación del aire por debajo del polietileno disminuyendo la humedad de manera paulatina en los frutos. Posteriormente los frutos son volteados con menos frecuencia se exponen dos veces por cada cara por un período de 8 a 10 días. Mediante esta técnica se ahorra la mitad de tiempo y más de la mitad de la mano de obra, con respecto al método anterior y evita la descomposición de frutos. Los frutos secados mediante este proceso presentan mejor calidad en sabor y color con un sobreprecio más del 5 al 10% (Bravo Lozano, et al, 2006).
Se ha reportado el uso del chile ancho y pasilla en moles por su alto contenido de azúcares entre 6.5- 5.10 g/L. Glucosa (0.1 g chile ancho y 0.08 g en chile pasilla), Fructuosa (0.09 g/L en chile ancho y 0.05 g/L en chile pasilla). Existen otros componentes importantes en los chiles secos que tienen un alto valor en el mercado internacional los carotenoides y los capsaicinoides presentes en la oleorresina (Bravo Lozano, et al., 2006).
En la presente investigación se evaluará la presencia de carotenoides α, β caroteno y criptoxantina en chile ancho y pasilla (Capsicum annuum L.) en muestras de 10 años y recientes con calidad diferente; variedades empleadas en la cocina mexicana mediante cromatografía de líquidos en fase normal (HPLC).
Material y métodos
Materia prima: Chile ancho y pasilla.
Muestras control (CA, CP) de 10 años: Chiles enteros ancho (CA) y pasilla (CP) de la marca comercial “San Lázaro®” fueron almacenados a temperatura ambiente, al vacío y en oscuridad por un período de 10 años y con especificaciones de calidad de acuerdo a la Secretaría de Salud, 2006.
Muestras: Se compró la misma marca “San Lázaro®” para las muestras recientes y tipos de calidad: comercial y extra para ambos chiles (SL) chile ancho, (PF) chile pasilla especificaciones según la Secretaría de Salud, 2006.
Calidad Comercial chile ancho (CC): Chiles enteros, sanos, medianos y grandes, color rojo claro a oscuro uniforme. No presenta decoloración, rugosos, sin manchas, quemaduras, raspaduras ni deformaciones.
Calidad Extra chile Ancho (CE): Chiles enteros, sanos, grandes, forma acorazonada o triangular, color rojo claro a rojo oscuro uniforme, sin decoloración, rugosos, sin manchas, quemaduras, raspaduras ni deformaciones.
Calidad Comercial pasilla (PC): Chiles enteros, sanos, grandes y medianos, color negro uniforme, no presenta decoloración, rugosos, sin manchas, quemaduras, raspaduras ni deformaciones.
Calidad Extra (PE): Chiles enteros, sanos, grandes, color negro uniforme, no presenta decoloración, rugosos, sin manchas, quemaduras, raspaduras ni deformaciones (Secretaria de Salud, 2006).
Se seleccionó un kilogramo de cada especie en estudio libre de daños. A los chiles se les eliminó las semillas y el tallo del pericarpio. Posteriormente fueron cortados en pequeños trozos, se mezclaron y se tomaron 10 g de muestras representativas de cada chile: ancho y pasilla esto fue realizado por duplicado.
Preparación del extracto.
Las muestras fueron extraídas en 125 mL con acetato de etilo, en ausencia de luz durante una semana y a temperatura ambiente. Posteriormente se filtró el extracto con papel Whatman® núm. 2 y evaporó a 35°C en un rotavapor (Buchi R II No.137884). El extracto crudo obtenido fue guardado en viales color ámbar a -4°C.
Separación de carotenoides.
Se pesaron 100 mg del extracto crudo, se fraccionaron en silica 500 mg/8 mL en una columna con hexano obteniéndose siete fracciones por incremento gradual de polaridad usando acetato de etilo. Las fracciones fueron guardadas en viales de color ámbar y a -4°C. Las fracciones se analizaron en cromatografía en fase normal HPLC, empleando una columna de silicagel Nucleosil 100-5 µm C18, 3.9 X 300 mm, Waters Division of MILLIPORE con una mezcla hexano:acetona (30:70), flujo 1 mL/min, una longitud de onda de 450 nm. En un cromatógrafo marca Waters 1525 con detector UV-arreglo de diodos. Por duplicado y se obtuvieron diferentes tiempos de retención.
Preparación de los estándares
Los estándares de carotenoides β-Caroteno®, α-Caroteno®, β-criptoxantina®, α-Criptoxantina®, trans-β-8-Apocarotenal®, zeaxantina®, cis-Zeaxantina® Luteína®, Luteoxantina, Astaxantina®, Violaxantina y Neoxantina (Merck-Aldrich). Se inyectaron de manera individual 20 µL de cada estándar en fase normal HPLC, en una columna de silicagel Nucleosil 100-5 µm C18, 3.9 X 300 mm, Waters Division of MILLIPORE en una mezcla hexano:acetona (30:70), flujo 1 mL/min, a una longitud de onda de 450 nm. En un cromatógrafo marca Waters 1525 con detector UV-arreglo de diodos. Se obtuvieron los tiempos de retención de los estándares de carotenoides. Posteriormente se realizó una mezcla de todos los estándares y se inyectaron bajo las mismas condiciones anteriormente descritas.
Relación de tratamientos
Se formularon ocho tratamientos (por duplicado) cada tratamiento con 20 µL de extracto crudo. Se consideraron los tiempos de retención de cada uno de los tratamientos y sus estándares. Control chile ancho CA (T1), marca San Lázaro SL (T2), calidad comercial ancho CC (T3) y calidad extra ancho (CE) (T4), control chile pasilla CP (T5), marca San Lázaro pasilla PF (T6), calidad comercial pasilla PC (T7), calidad extra pasilla PE (T8). Las variables de respuesta a evaluar fueron los carotenoides descritos en el párrafo anterior en cada uno de los tratamientos.
Análisis de la información
El análisis de los datos se realizó mediante un Análisis de Varianza (ANOVA) con una comparación de medias por Tukey (α= 0.05) con un diseño de bloques completamente al azar para determinar si existe diferencia significativa en los carotenoides presentes en los controles con edad de 10 años y las muestras más recientes en función de sus tiempos de retención mediante el programa Statistical Analysis System (SAS V8).
Resultados y discusiones
La figura 2 muestra los tiempos de retención (Tr) correspondientes a la separación de los estándares de carotenoides: A) β-Caroteno (4.4), B) α-Caroteno (5.2), C) β-Cripoxantina (8.3), D) α-Criptoxantina (8.8), E) trans-β-Apo-8-carotenal (9.2), F) Zeaxantina (12.3), G) cis-Zeaxantina (13.4), H) Luteína (17.3), I) Luteoxantina (17.9), J) Astaxantina (18.5), K) Violaxantina (19.5) y L) Neoxantina (20.7) mediante fase directa HPLC.
La figura 3 muestra los tiempos de retención de los carotenos de la muestra de chile ancho 10 años A) β-Caroteno (4.8), B) α-Caroteno (5.0), C) β-Criptoxantina (8.2), E) trans-β-Apo-8-carotenal (9.3), H) Luteína (17.5), J) Astaxantina (19.54), K) Violaxantina (20.4).
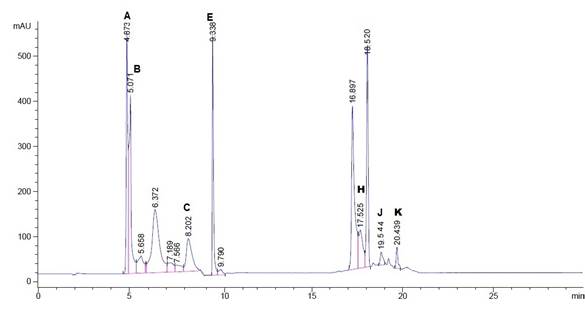
Fig. 3 Cromatograma del chile ancho de 10 años a 450 nm. A) β-Caroteno, B) α-Caroteno, C) β-Criptoxantina E) trans-β-Apo-8-carotenal, H) Luteína, J) Astaxantina y K) Violaxantina.
En ambas muestras de chile ancho con 10 años (fig. 3) y recientes (fig.4) se encontró la presencia de carotenoides β-Caroteno, α-Caroteno y β-Criptoxantina. En estos frutos la maduración se produce por la síntesis de pigmentos carotenoides responsables del color amarillo-naranja. El licopeno es el principal precursor de los carotenoides cíclicos y la conversión de licopeno a β-Caroteno es mediante la enzima β-licopenasa ciclasa (LCYB), la cual cataliza la formación de anillos β-ionona y α-ionona en los extremos de la molécula (Cunningham et al.,1996, Del Villar et al. 2007). La ciclación del licopeno es importante para la formación del ciclo en ambos extremos de la molécula para producir los α, β o ε carotenos.

Fig. 4 Cromatograma del chile ancho reciente a 450 nm. A) β-Caroteno, B) α-Caroteno, C) β-Criptoxantina E) trans-β-Apo-8-carotenal, H) Luteína y L) Neoxantina.
Las muestras de chile ancho que estudio (Collera et al. 2005) en fase normal encontró que el principal carotenoide fue el β- caroteno y la actividad provitamina A fue más elevada en el chile ancho (335 µg RE/100 g.d.w). En esta investigación se halló similitud con los resultados registrados por Collera se observó la presencia de β- caroteno y β- criptoxantina precursores de la vitamina A en muestras de chile ancho de hace 10 años y en las recientes.
La figura 4 muestra los tiempos de retención de los carotenos de la muestra de chile ancho reciente A) β-Caroteno (4.8), B) α-Caroteno (5.0), C) β-Criptoxantina (8.2), E) trans-β-Apo-8-carotenal (9.3), H) Luteína (17.5), L) Neoxantina (20.4).
En ambas figuras 3 y 4 también se observa la formación de xantofilas: Luteína, Astaxantina, Violaxantina y Neoxantina. Estos carotenoides se producen por la enzima β- licopeno ciclasa que actúa en ambos extremos de la molécula formando el β- caroteno el cuál es precursor de estas xantofilas pigmentos de coloración rojo. Las xantofilas se producen cuando uno o más átomos de oxígeno en grupos ceto, hidroxi, epoxi, entre otros, se introducen a la molécula del caroteno (Cunningham et al.,1996, Ronen et al., 1999). Su presencia es normal e importante como antioxidantes.
En las figuras 3 y 4 se observa la presencia de trans-β-Apo-8-carotenal el cuál es un producto de la degradación del β- caroteno. La formación de este carotenoide se debe a la oxidación del gran número de dobles enlaces conjugados que contiene produciendo: la pérdida del color, lesiones físicas del tejido en los frutos, a la extracción de los carotenoides en disolventes orgánicos así como también la exposición del fruto al calentamiento intenso en presencia de aire durante el proceso de secado en las paseras, en paseras modificadas o en los hornos de secado provocando reacciones de isomerización cis-trans (Mínguez et al., 1996).
La figura 5 muestra los tiempos de retención de los carotenos de la muestra chile pasilla de 10 años A) β-Caroteno (4.1), E) trans-β-Apo-8-carotenal (9.3), F) Zeaxantina (12.4).
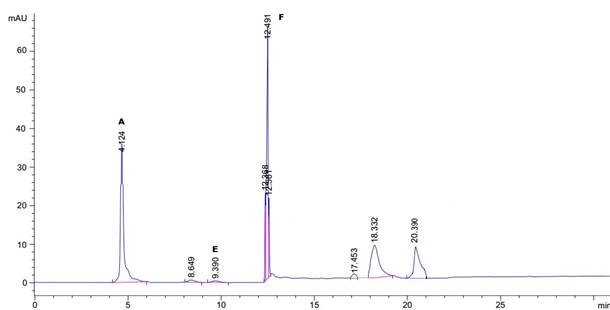
Fig. 5 Cromatograma de chile pasilla de 10 años a 450 nm A) β-Caroteno, E) trans-β-Apo-8-carotenal, F) zeaxantina.
Las muestras de chile pasilla con edad de 10 años fig. 5 y en las muestras recientes fig. 6 se encontró la presencia del β-Caroteno como precursor de la vitamina A. (Wall etal., 2001) demostró mediante TLC y HPLC fase directa que el chile pasilla contiene bandas verdes asociadas al contenido de clorofila, bandas amarillas al β-caroteno y rojas-naranjas β-criptoxantina, así como también violaxantina. A diferencia del chile ancho las muestras de chile pasilla de 10 años y recientes cuando maduran se produce la degradación de clorofilas adquiriendo tonalidades de café/negra esto se debe al tipo de chile (Roca, M. y Mínguez Mosquera, 2006), y al proceso de secado que favorece la extracción de estos pigmentos por el rompimiento y destrucción de la pared celular (Cruz García, et al., 1997, Chuah et al., 2008, Bernharrdt y Schlich, 2006), así como también a la destrucción de complejos carotenoides-proteínas por la desnaturalización produciendo la liberación de los carotenoides (Rodríguez Amaya, 1997). (Roca y Mínguez 2006) estudiaron la degradación de clorofilas en 5 variedades de chile (Capsicum annuum) por 3 meses y observaron que las variedades que maduran hasta el color rojo pierden su contenido de clorofilas y las variedades que maduraban hasta el color café mantenían niveles altos de clorofila por más tiempo.
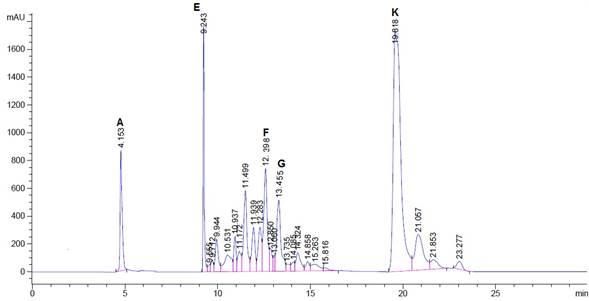
Fig. 6 Cromatograma de chile pasilla reciente a 450 nm A) β-Caroteno, E) trans-β-Apo-8-carotenal, F) Zeaxantina, G) cis-Zeaxantina y K) Violaxantina.
(Cortez García, 2011) encontró que muestras de chile pasilla tratadas térmicamente pierden significativamente (p < 0.05) más carotenoides rojos (xantofilas) que amarillos (zeaxantina, cis-zeaxantina) lo cual indica que las xantofilas son más sensibles al tratamiento térmico. En nuestro estudio en los cromatogramas de la fig. 5 de chile pasilla de 10 años solo se observaron los tiempos de retención para los carotenoides amarillos: β-Caroteno y zeaxantina. Sin embargo, en las muestras de chile pasilla recientes se observaron la presencia de más carotenoides amarillos como la zeaxantina y su respectivo isómero cis y β-Caroteno. Así como la formación de violaxantina y el isómero trans-β-Apo-8-carotenal y de otros carotenoides que no se identificaron.
La figura 6 muestra los tiempos de retención de los carotenos de la muestra chile pasilla reciente A) β-Caroteno (4.1), E) trans-β-Apo-8-carotenal (9.2), F) Zeaxantina (12.3), G) cis-zeaxantina (13.4) y K) Violaxantina (19.8).
En el cuadro 2 se muestra el perfil de carotenoides de cada uno de los tratamientos y los tiempos de retención de los carotenoides obtenidos en cada tratamiento en los chiles ancho de 10 años y recientes con calidad diferente y pasilla de 10 años y reciente con calidad diferente. Destaca el porcentaje de área para el testigo chile ancho de 10 años (CA) del 94.32% el cual presentó mayor contenido de carotenoides. Este porcentaje representa un factor muy importante considerando que en México el consumo anual de chile de 15.7 Kg y el segundo productor en el mundo en producir 2, 294,400 ton de cihle (Secretaría de Agricultura, Ganadería, Desarrollo Rural, 2016).
Cuadro 2 Perfil de carotenoides en cada tratamiento.
| Carotenos | Tratamiento | |||||||
| T 1 (CA) | T 2 (SL) | T 3 (CC) | T 4 (CE) | T 5 (CP) | T 6 (PF) | T 7 (PC) | T 8 (PE) | |
| β -Caroteno | 4.67a | 4.62a | 4.67a | 4.58a | 0d | 4.09c | 4.20cb | 4.52ab |
| α-Caroteno | 5.57ab | 5.71a | 5.16b | 5.54ab | 0c | 0c | 0c | 0c |
| β-Cripoxantina | 8.20a | 8.19a | 8.22a | 8.18a | 0b | 0b | 0b | 0b |
| α-Criptoxantina | 8.81bc | 8.87ab | 8.93a | 8.91ab | 0d | 8.73c | 0d | 0d |
| trans-β-Apo-8-carotenal | 9.38a | 9.71a | 9.51a | 9.44a | 9.47a | 9.46a | 9.51a | 0b |
| zeaxantina | 0c | 0c | 0c | 0c | 12.22b | 12.39ab | 12.48a | 12.38ab |
| cis-Zeaxantina | 0b | 0b | 0b | 0b | 12.44a | 12.43a | 12.46a | 12.70a |
| Luteina | 17.43a | 17.43a | 0b | 0b | 17.45a | 0b | 0b | 0b |
| Luteoxantina | 0b | 0b | 0b | 0b | 18.39ab | 18.33a | 0b | 0b |
| Astaxantina | 19.54a | 0b | 0b | 0b | 0a | 0b | 0b | 0b |
| Violaxantina | 20.72a | 0c | 20.39b | 0c | 20.39b | 0b | 0b | 0b |
| Neoxantina | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Suma %Area | 94.32 | 54.53 | 56.88 | 36.65 | 90.36 | 43.15 | 24.94 | 25.08 |
*a,b,c medias con diferentes letras en el mismo renglón son significativamente diferentes (p≤0.05). *Diferencias entre tratamientos. (T1) Control chile ancho de 10 años CA, Marca San Lázaro SL ancho reciente (T2), calidad comercial ancho reciente CC (T3) y calidad extra ancho reciente (CE) (T4), control chile pasilla de 10 años CP (T5), marca San Lázaro pasilla reciente PF (T6), calidad comercial pasilla reciente PC (T7), calidad extra pasilla reciente PE (T8).
El contenido de carotenoides en los chiles en la industria alimentaria, farmacéutica y cosmética es usado en diferentes presentaciones: en extractos secos, moles y oleorresinas así como también el color de los chiles es un criterio de selección de calidad (Gómez-García M. del R. y Ochoa-Alejo N., 2013).
La presencia de carotenoides se debe al tipo de secado del chile ancho en las paseras en el cuál se mejora la biodisponibilidad alterando la pared celular y separando los carotenoides de las proteínas facilitando su liberación y la absorción de los carotenoides en vitamina A (Clevidence et al., 2000). (Wall M., 2001) y colaboradores reportaron que en la cosecha de frutos de chile ancho durante 1996 el β caroteno fue de (510 µg/) y los carotenoides totales de (4093 µg/g) y en 1997 hubo incrementos en el β caroteno (785 µg/g) y carotenoides totales (5830 µg/g).
Sin embargo, en las muestras recientes con calidad diferente mostraron una disminución en el contenido de carotenoides entre el 56.88-36.65% la causa probablemente fue el control de los parámetros de calidad demeritando los carotenoides.
(López López et al.,2015) y (Kanner, et al., 1997) demostraron que los chiles secados sobre las paseras acumulan más pigmentos y las variedades de ancho y pasilla presentaron los niveles más altos de β-caroteno aproximadamente 10 g de estos chiles secos exceden las cantidades diarias recomendadas (RDA) para la transformación de vitamina A basada únicamente en β-caroteno.
El análisis de varianza (ANOVA) mostró diferencias significativas (α = 0.05) en los tratamientos T2 (SL), T3 (CC) muestras recientes de chile ancho con la presencia del α- caroteno. El tratamiento T3 (CC) mostró diferencia significativa en el contenido de α-Criptoxantina y Violaxantina en chile ancho. En comparación con (Collera Zúñiga et al., 2005) se encontró la presencia del α-caroteno en las muestras analizadas de hace 10 años y las muestras recientes marca San Lázaro (SL) y Calidad Comercial (CC). De los 50 carotenoides presentes en la dieta del ser humano solo cinco o seis pueden ser detectados en el plasma (α- y β-caroteno, β-criptoxantina, licopeno, luteína y zeaxantina) y únicamente α-β-caroteno y β-criptoxantina poseen actividad provitamina A (Grune et al., 2010). En lo que respecta a los carotenoides α-Criptoxantina y Violaxantina en el tratamiento de la muestra calidad comercial del chile ancho T3 (CC) se encontró la presencia de ambos carotenoides esto se debió a la oxidación del β-caroteno con actividad de la provitamina A (Mínguez Mosquera et al., 1996).
El porcentaje de área de chile pasilla fue del 90.36% el contenido de carotenoides es menor en este chile debido a la degradación de clorofilas (Roca, M. y Mínguez Mosquera, 2006) estudiaron la degradación de clorofilas en 5 variedades de chile (Capsicum annum) por 3 meses y encontraron variedades que maduraban hasta el color café y mantenían niveles altos de clorofila por más tiempo. El perfil de carotenoides en cada tratamiento mostrados en el cuadro 2 para el chile pasilla se observó que en el tratamiento T6 (PF) mostró que existen diferencia significativa en α-Criptoxantina aunque este carotenoide presenta una actividad menor como provitamina A que el β-Caroteno (Oliver, J. y Palou, 2000). El tratamiento T7 (PC) mostró diferencia significativa en la concentración de zeaxantina. En otros estudios se encontró que la zeaxantina y luteína son componentes esenciales en la pigmentación macular del ojo además de la relación que existe entre la ingesta y la reducción del riesgo de degeneración macular (Gómez García M.R. y Ochoa Alejo N, 2013), (Botella Pavia, P. y Rodriguez-Concepción, 2006).
Conclusiones
En las muestras de chile ancho con 10 años y reciente se encontró la presencia de carotenoides: α-Caroteno, β-Caroteno y β-Criptoxantina estos dos últimos importantes precusores de la vitamina. Además de las xantofilas Luteína, Astaxantina, Violaxantina y Neoxantina y el trans-β-Apo-8-carotenal producto de la oxidación del β-Caroteno.
En lo que respecta al chile pasilla con 10 años y reciente los carotenoides que se identificaron fueron: zeaxantina y su respectivo isómero cis-zeaxantina compuestos esenciales en la pigmentación macular del ojo además de la relación que existe entre la ingesta y la reducción del riesgo de degeneración macular.











 nueva página del texto (beta)
nueva página del texto (beta)




