Introducción
El Lago de los Reyes Aztecas en San Pedro Tláhuac, se ha venido deteriorando por las descargas de agua residual que recibe de las casas habitación que se encuentran a la orilla de este lago y el aporte de agua residual procedente de las plantas de tratamiento del Cerro de la Estrella en Iztapalapa, (1.6 m3/s, y 1.2 m3/s), San Luis Tlaxialtemalco y San Lorenzo Tezonco. El agua tratada es conducida a través del conducto subterráneo del canal de Garay y la avenida Tláhuac hasta los canales de la zona de Cuemanco y Tlaltenco de no ser así, los canales estarían secos debido a que los manantiales y ríos que alimentaban los lagos de la cuenca están desviados hacia la zona urbana del Valle de México (Ortiz y Ortega, 2007).
San Pedro Tláhuac es una de las diez y seis delegaciones de la Ciudad de México y se localiza al sureste de la capital mexicana entre los 19° 18’ 15” de latitud Norte y 99° 03’ 15” de longitud Oeste. Tiene una superficie de 8 534.62 hectáreas, que corresponde al 5.75% del territorio de la Ciudad de México, a una altitud de 2 240 m s.n.m. El área que ocupa se corresponde con lo que originalmente fue la superficie de los lagos de Chalco y Xochimilco. De estos cuerpos lacustres, solo se conserva un sistema de canales que corre entre las chinampas de los pueblos de Tláhuac, Mixquic y Xochimilco. En la actualidad, este sistema de lagos, canales y ciénegas, forma parte de la cuenca del río Pánuco, a la que quedó ligado a través de las obras hidráulicas realizadas en el norte del valle de México a partir del siglo XVII. Este drenaje lleva las aguas de la cuenca al río Tula, tributario del Pánuco que desemboca en la vertiente del golfo de México junto al puerto de Tampico (Yañez, 2009). El Lago de los Reyes Aztecas, se encuentra en el barrio los Reyes. Este barrio se encuentra en una zona lacustre que constituye un espejo de agua de aproximadamente 1.9 hectáreas; el más extenso del sistema de canales y chinampas de Tláhuac. Se ubica en la cabecera delegacional, San Pedro Tláhuac; posee un rico ecosistema de flora y fauna. Bordeado por terraplenes altos con árboles de ahuejote (Salix bonplandiana) es sin duda el lugar turístico más importante de la jurisdicción, ya que en él se pueden realizar paseos por trajinera a lo largo del lago y disfrutar del Museo Vivo que se encuentra dentro de la zona chinampera. (INAFED, 2010).
Con respecto a la habilidad que tienen las hidrófitas para absorber los elementos del agua considerados como contaminantes, las mismas se han empleado en la detección y remoción de sustancias en efluentes de aguas residuales domesticas (Bolaños et al., 2008).
El uso de las hidrófitas en tratamientos secundarios y terciarios de aguas residuales, ha demostrado ser eficiente en la remoción de una amplia gama de sustancias, como los ortofosfatos y otros contaminantes (Celis et al., 2005).
El tratamiento de efluentes con hidrófitas libre flotadores cumple con los estándares deseados para generar agua con fines de riego agrícola o uso público urbano en embalses naturales y artificiales, de acuerdo a la NOM-001 (Norma Oficial Mexicana. NOM-001-SEMARNAT, 1996).
Las macrófitas flotantes ha demostrado eficiencias de remoción significativamente altas en todos los constituyentes de las aguas residuales, a escala real y a escala laboratorio, siendo el lirio acuático (E. crassipes) la macrófita que más se ha estudiado. Con esta especie en cuanto a la remoción de fosforo se alcanzó un valor máximo de 91.7% (Martelo y Lara, 2012).
En la cuenca del río Parismina al este de Costa Rica través de la implementación de sistemas de tratamientos dominados por Pistia stratiotes L. (lechuga de agua) y Eichhornia crassipes Mart. Solms (lirio acuático), se obtuvo una remoción de fosfatos del 92% (Nahlik y Mitsch, 2006).
Diversas investigaciones han reportado que Lemna gibba puede remover fósforo en un rango de 14 a 99%. Así mismo, esta planta acuática puede ser una buena fuente de proteínas y almidones, pudiendo utilizarse eventualmente para obtener productos de valor agregado como alimento para animales de granja y producir etanol (Sutton y Ornes, 1975; Körner et al., 1996; Körner y Vermaat, 1998).
Harvey y Fox en la Universidad de la Florida, ensayaron con Lemna minor en la remoción de fósforo, obteniendo un 67% (Harvey y Fox, 1973).
Del agua residual de la Extractora Río Manso en Ecuador, se removió fósforo en un 86.77% con Lemna minor y con Eichhornia crassipes se obtuvo un 96.34% (Ornela y Sánchez, 2016).
Al desarrollar una alternativa para mejorar la calidad y dispersión del efluente sin diluir, Leon y Chaves (2010), usando Lemna aequinoctiales obtuvieron una remoción de ortofosfatos del 97.3%.
Finalmente (Bedoya et al., 2014), utilizando dos macrófitas enraizadas emergentes reportaron que se removió un 97.2% de fósforo con Typha latifolia y un 95.9% con Cyperus papyrus.
Por su parte, el fósforo (P) es uno de los macronutrientes esenciales que junto con el nitrógeno y el potasio, las plantas requieren para completar su ciclo vital (Bonilla, 2008). Los valores de fósforo total reportados en la literatura para el caso de aguas continentales muestran un rango de 5 a 500 μg/L (Allen, 1989). Sin embargo, cuando el contenido de fósforo total rebasa los 100 μg/L para el caso de ambientes lénticos, se vuelve un contaminante. (Castro y Melgar, 2005).
Las aguas residuales de origen doméstico contribuyen a incrementar el contenido de fósforo total en los ambientes lóticos y lénticos, debido a que un detergente puede contener hasta un 28% de fósforo (Shock y Shock, 2012). En las zonas rurales, los lixiviados provenientes de las zonas ganaderas (estiércoles) y agrícolas (fertilizantes) elevan sustancialmente el contenido de fósforo en ríos, lagos y humedales. Al incrementarse el contenido de fósforo en el medio acuático, se estimula en forma exponencial el crecimiento de algas (Manahan, 2010). Cuando las algas concluyen su ciclo vital, la biomasa vegetal se deposita en el fondo del cuerpo de agua, se mineraliza por la acción de los microorganismos acuáticos y se provoca un aumento rápido en la demanda de oxígeno, propiciando que el medio tienda hacia la anaerobiosis. A este proceso se le denomina eutrofización (Shock y Shock, 2012).
Por su parte, las hidrófitas, son plantas que viven generalmente dentro de cuerpos de agua. La presencia de hidrófitas en una diversidad de hábitats, es fundamental en el equilibrio y el desarrollo de la vida acuática, por ser productores primarios del ecosistema, inician la cadena alimenticia en la que intervienen numerosos microorganismos y macroorganismos; como elemento central de la vegetación dominante, pueden vivir en diferentes tipos de hábitats acuáticos como charcas, arroyos, lagos, laguna y ríos. (Lot et al., 2004).
En este estudio se eligieron las hidrófitas nativas del Lago de los Reyes más abundantes durante el ciclo anual.
Lemna gibba L., es una hierba acuática libremente flotadora, frondas solitarias o en grupos de 4, obovadas a elípticas, de 2.3 a 5.6 mm de largo por 1.5 a 4.5 mm de ancho, las frondas pueden encontrarse casi sin tejido esponjoso en el envés y entonces vistas de perfil dan el aspecto de ser casi planas o bien presentar tal tejido bien desarrollado hasta de 4 mm de espesor, lo que le confiere aspecto giboso, con cavernas muy grandes, frondas de color verde amarillento; fruto alado, obovado; semillas 1 a 4. Nombres comunes: aclasole, chichicastle, amoyo, chilacastle, lenteja, lentejilla de agua. Ampliamente distribuida en el Valle de México. Vive en ambientes dulceacuícolas tranquilos o de ligero movimiento, manantiales, zanjas, lagunas, lagos, canales, etc.(Rzedowski y Rsedowski, 1990).
Ceratophyllum demersum L. Planta sumergida, hasta de 30 cm de largo; tallos muy ramificados formando masas a modo de cordones foliosos horizontales en el fondo y verticales hacia la superficie del agua, flexuosos y contiguos; hojas hasta 12 en un verticilo, por lo general de 1.5 a 2 cm de largo, finamente divididas, variables en largo y ancho, así como en lo aserrado de las divisiones, con frecuencia sobre los dientes del borde se notan cilios translucidos; flor masculina de cerca de 2 mm de largo; flor femenina de cerca de 5 mm de largo; fruto un aquenio comprimido elipsoide, de 4 a 7 mm de largo. Crece en aguas tranquilas, canales, lagos, zanjas, etc. Habita en regiones templadas y tropicales. Nombres comunes: cola de zorro y lama de agua. (Rzedowski y Rsedowski, 1990).
Berula erecta (Hudson) Coville., hierba enraizada, emergente, de 20 a 80 cm de alto, estolonífera; tallos ascendentes o erectos; laminada pinnada; inflorescencia en umbelas compuestas, terminales y axilares; flores blancas; fruto subgloboso, pardo. Habita en el margen de arroyos o canales hasta 25 cm de profundidad. Nombre común: berro de agua. (Bonilla y Novelo, 1995).
Hydrocotyle ranunculoides L., f., hierba enraizada, emergente, de 5 a 25 cm de alto; tallos rastreros o flotantes; láminas reniformes, no peltadas, palmatilobadas, con lóbulos crenados; inflorescencia en umbelas simples; flores dispuestas en verticilos, pediceladas, amarillas; fruto comprimido lateralmente, suborbicular o elíptico transversalmente, verde. Habita en el margen de los lagos, arroyos y canales, flotante en lugares de aguas someras o bien, enraizada hasta 15 cm de profundidad en sedimentos saturados de agua. Nombre común: paragüitas (Bonilla y Novelo, 1995).
Polygonum punctatum Elliot., planta emergente, de 30 cm a 1.5 m de alto, glandulosa; tallo rizomatoso, erecto; hojas estipuladas, lanceoladas a oblongo-lanceoladas; ócreas sin cilios; inflorescencia paniculada; flor actinomorfa, verdosa a blanco-verdosa, perianto conspicuamente punteado con glándulas, estambres 8; aquenio lenticular, trígono, negro. Habita en zonas pantanosas y en los márgenes de lagos y canales, hasta 50 cm de profundidad. Nombres comunes: chilillo, achilillo, tripa de pollo (Bonilla y Novelo, 1995).
Objetivo
El objetivo de este trabajo fue estimar la eficiencia de remoción de ortofosfatos en un ambiente controlado utilizando cinco diferentes especies de hidrófitas, agrupadas en tres asociaciones de dos especies.
Material y métodos
Agua y vegetación. Las muestras de agua y las hidrófitas se colectaron en un transecto con cinco estaciones a lo largo del Lago de los Reyes Aztecas. En cada estación las muestras de agua se colectaron a 20 cm de profundidad y se depositaron en recipientes de polipropileno para ser transportada al laboratorio; la ubicación de los sitios de muestreo se determinó utilizando un GPS 12 marca Garmin. Estación 1, (19° 15' 59" de latitud Norte y 99° 00' 26" de longitud Oeste); Estación 2, (19° 15' 59" de latitud Norte y 99° 00' 40" de longitud Oeste); Estación 3, (19° 16' 4" de latitud Norte y 99° 00' 43" de longitud Oeste); Estación 4, (19° 16' 10" de latitud Norte y 99° 00' 37" de longitud Oeste); Estación 5, (19° 16' 13" de latitud Norte y 99° 00' 31" de longitud Oeste).
Las hidrófitas: Berula erecta, Ceratophyllum demersum, Hydrocotyle ranunculoides, Lemna gibba y Polygonum punctatum especies nativas del lago, se colectaron manualmente, transportándolas en una hielera al laboratorio.
Diseño experimental. El bioensayo se montó en el laboratorio de Ecotoxicología de la Universidad Autónoma Metropolitana Unidad Iztapalapa (fig. 1). Se utilizaron seis recipientes de plástico de 30.5 x 15.5 x 10 cm, a las que se les agregaron dos litros de agua de una sola estación a la vez, sin ningún sustrato. Se pesaron 35 g de cada una de las especies seleccionadas para cada asociación, y se distribuyeron al azar por duplicado en las palanganas. Primera asociación Lemna gibba con Ceratophyllum dermesum, segunda asociación Berula erecta con Lemna gibba y tercera asociación Polygonum punctatum con Hydrocotyle ranunculoides, por cada asociación se puso un control sin plantas, al cual solo se le puso 500 ml de la muestra de agua de la estación correspondiente, se mantuvieron con un fotoperiodo luz/oscuridad de 12/12, a temperatura ambiente.

Fig. 1 Bioensayo en el laboratorio de Ecotoxicología de la Universidad Autónoma Metropolitana Unidad Iztapalapa.
Para cuantificar la concentración de ortofosfatos se utilizó el método colorimétrico del ácido ascórbico recomendado por Standard Methods for the Examination of Water and Wastewater (APHA, AWWA, y WPCF, 2017).
Se determinaron los ortofosfatos en las muestras de cada estación al inicio del bioensayo, a los tres, seis, diez y quince días de haber montado el experimento. Se eligieron los días de muestreo con base en bioensayos previos en los que comprobamos que en este lapso de tiempo es cuando se observan diferencias significativas en la remoción de ortofosfatos. La eficiencia de remoción se obtuvo en porcentajes de la relación de los valores iniciales menos los valores finales entre los valores iniciales por 100.
Análisis estadísticos. Finalmente, a los resultados obtenidos se les aplicó una prueba de las medianas de Kruskal-Wallis para observar las diferencias significativas entre las asociaciones y días de muestreo, y en su caso una prueba de comparaciones múltiples para datos no paramétricos a una probabilidad de error p ≤ 0.05. En todos los casos se utilizó el programa Statistica 7.0 (NCSS, 2004).
Resultados
En la tabla 1 se muestran las concentraciones promedio iniciales y finales de ortofosfatos para cada asociación de hidrófitas monitoreadas en nuestro experimento.
Tabla 1 Eficiencia de remoción de ortofosfatos de cada una de las estaciones de muestreo y de las asociaciones de plantas.
| Asociaciones de Hidrófitas | Estación | Concentración inicial de H 2 PO 4 de cada estación (mg/L) | Concentración final de H 2 PO 4 de cada estación (mg/L) | Eficiencia de remoción de cada estación (%) | Eficiencia de remoción promedio por asociación de hidrófitas (%) |
|---|---|---|---|---|---|
| 1 | 0.8 | 0.1 | 85 | ||
| L. gibba | 2 | 1.0 | ≤ 0.01 | 100 | |
| con | 3 | 0.9 | 0.2 | 78 | 87.8 |
| C. demersum | 4 | 0.8 | 0.1 | 86 | |
| 5 | 1.0 | 0.1 | 90 | ||
| 1 | 0.8 | 0.1 | 83 | ||
| B. erecta | 2 | 1.0 | 0.1 | 90 | |
| con | 3 | 0.9 | 0.1 | 89 | 87.4 |
| L. gibba | 4 | 0.8 | 0.1 | 88 | |
| 5 | 1.0 | 0.1 | 88 | ||
| 1 | 0.8 | 0.1 | 86 | ||
| P. punctatum | 2 | 1.0 | 0.1 | 89 | |
| con | 3 | 0.9 | 0.1 | 89 | 88.3 |
| H. ranunculoides | 4 | 0.8 | 0.1 | 88 | |
| 5 | 1.0 | 0.1 | 90 | ||
Al inicio del experimento (fig. 2), no se observaron diferencias significativas en la remoción de ortofosfatos entre las tres asociaciones de hidrófitas (H (2;30) = 0.19; P = 0.9067).
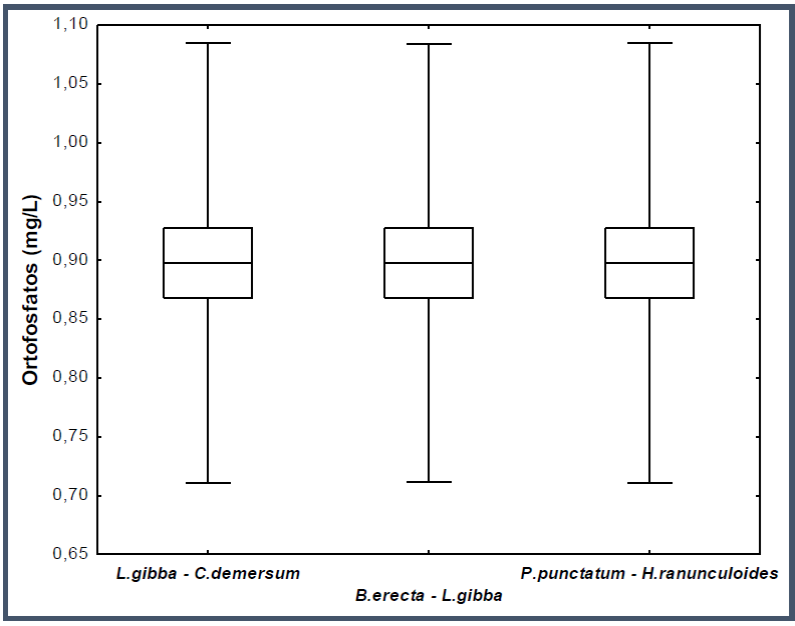
Fig. 2 Diagrama de caja y bigote de la remoción de ortofosfatos de cada asociación de hidrófitas al inicio del experimento.
Se determinó la existencia de diferencias significativas en la concentración de ortofosfatos para cada asociación de hidrófitas a partir del tercer día de iniciado el experimento (H (2;30) = 14.05; P < 0.0009). La asociación P. punctatum-H. ranunculoides (fig. 3), mostró una mayor remoción de ortofosfatos, seguida por la asociación L. gibba-C. demersum, quedando en último lugar B. erecta-L. gibba.
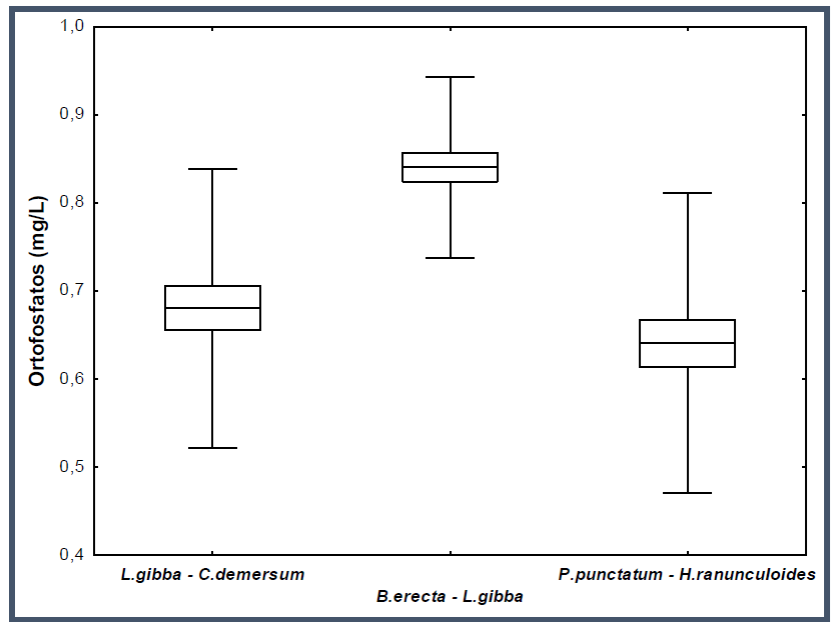
Fig. 3 Diagrama de caja y bigote de la remoción de ortofosfatos de cada asociación de hidrófitas al tercer día del experimento.
La tendencia en la eficiencia de remoción de ortofosfatos observada al tercer día, se acentuó al sexto día de iniciado el experimento (H (2;30) = 25.84; P < 0.0001). La asociación P. punctatum-H. ranunculoides (fig. 4), removió el 80% de ortofosfatos iniciales, L. gibba-C. demersum 63% y B. erecta-L. gibba 15%.
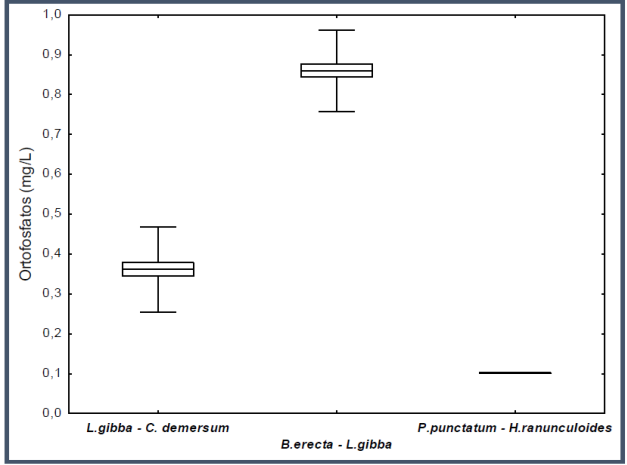
Fig. 4 Diagrama de caja y bigote de la remoción de ortofosfatos de cada asociación de hidrófitas al sexto día del experimento.
Al décimo día de iniciado el experimento, la asociación B. erecta-L. gibba mostró una acelerada remoción de ortofosfatos (fig. 5), ya que removió casi el 85% de la concentración inicial, seguida de L. gibba-C. demersum con 83% y por último P. punctatum-H. ranunculoides con 82%.
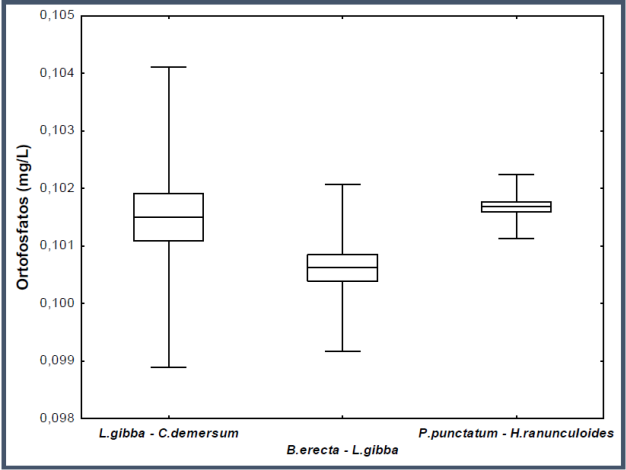
Fig. 5 Diagrama de caja y bigote de la remoción de ortofosfatos de cada asociación de hidrófitas al décimo día del experimento.
Al decimoquinto día del experimento (fig. 6), no se observaron diferencias significativas en la remoción de ortofosfatos entre las tres asociaciones de hidrófitas (H (2;30) = 2.75; P = 0.2521), debido a que la eficiencia para remover ortofosfatos fue muy similar.
Discusión
Las tres asociaciones de hidrófitas mostraron una elevada remoción de ortofosfatos la cual fue superior al 87%. Nuestros resultados se encuentran en el rango de remoción de fósforo que han obtenido diversos autores para otras asociaciones de hidrófitas (Sutton y Ornes, 1975;Körner et al., 1996; Körner y Vermaat, 1998).
Así mismo, es importante destacar la remoción constante de ortofosfatos que a lo largo del tiempo mostró la asociación C. demersa con L. gibba, comportamiento no observado en las otras dos asociaciones. La tasa de absorción de nutrientes minerales esenciales está determinada por factores internos y externos; para el caso de nuestra observación, podemos sugerir que el crecimiento exponencial que normalmente muestran las poblaciones de lemnáceas cuando se encuentran en un medio rico en nutrientes minerales esenciales y la forma de vida (libre sumergida) de C. demersa que le permite tener una gran área de absorción, sean dos factores importantes que promueven una constante absorción de fósforo. Sin embargo, la asociación P. punctatum con H. ranunculoides mostró para todos los días del experimento los valores promedio más altos de remoción de ortofosfatos, suponemos que tal comportamiento está relacionado con el hecho de que ambas especies poseen raíces bien desarrolladas que les permiten absorber eficientemente los ortofosfatos.
Conclusiones
Las tres asociaciones de hidrófitas mostraron una semejante remoción de ortofosfatos al final del experimento, destaca la remoción constante a lo largo del tiempo mostrada por la asociación C. demersa con L. gibba y la eficiente absorción de ortofosfatos observada al sexto día del experimento en la asociación P. punctatum con H. ranunculoides, por lo que se recomienda utilizarlas en tratamiento terciario para mejorar la calidad del agua del Lago de los Reyes Aztecas.











 nueva página del texto (beta)
nueva página del texto (beta)



