Introducción
( Mickel, J. & Smith, 2004) mencionan que México tiene una alta riqueza de licofitas y helechos compuesta por 124 géneros y 1,008 especies. (p. 1). Autores como (Christenhusz, Zhang, & Schneider, 2011) consideran que a nivel mundial se presentan 45 familias y 280 géneros (p. 8) siendo una de las familias más numerosas las Polypodiaceae con 64 géneros (p. 18-19). (Moran, 1995) indica “que las Polypodiaceae es una familia grande y diversa no puede ser definida por la presencia de una sola característica. Sin embargo, varias características están muy relacionadas; por ejemplo, numerosas especies tienden a presentar rizomas rastreros, escamosos, dorsiventrales, con hojas dispuestas en dos series en la superficie dorsal. Las hojas están articuladas a filopodios cortos y caen en la madurez sin dejar rastro. Los soros son a menudo amplios y redondeados con esporas monoletes”. (p. 333). De acuerdo con (Mickel, J., & Beitel, 1988), p. 8-9 y (Mickel, 1992), p. 128-129 dividen a la familia Polypodiaceae en dos subfamilias: Polypodioideae con los géneros Campyloneurum, Niphidium, Plecuma, Phlebodium y Polypodium y la Pleopeltoideae con Pleopeltis y Microgramma, además se incluye a Pleopodium constituido por híbridos de Polypodium x Pleopeltis. (Christenhusz et al., 2011) dividen a la familia en cinco subfamilias considerado al género Pleopeltis en Polypodioideae (p. 18-19).
(Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003) indican que “Pleopeltis comprende helechos epífitos con hojas simples o pinnatífidas. Es esencialmente un género americano, la mayoría de las especies se encuentran en México, por lo que podría pensarse que ha sido un centro de diversificación importante” (p. 321). (Mickel, J. & Smith, 2004) citan para México a P. angusta, P. astrolepis, P. conzattii, P. crassinervata, P. macrocarpa, P. mexicana, P. polylepis y P. revoluta. Los taxones se encuentran en altitudes desde los 150 hasta los 3100 m en zonas abiertas de las selvas altas perennifolias y bosques templados de Quercus (p. 368-469).
(Smith, A. R. & Tejero-Díez, 2014) encontraron evidencias provenientes de estudios morfológicos, citológicos y de secuenciación de genes en Polypodiaceae que proporcionaron información que implicaba que el género Pleopeltis requería redefinirlo con el propósito de incluir otros géneros y especies de la familia que presentan escamas peltadas en las hojas tales como algunas secciones de Polypodium y taxones de Dicranoglossum, Microphlebodium, Neurodium y Pseudocolysis. Después de revisar todas las especies de Polypodiaceae y de acuerdo con las evidencias morfológicas, los autores mencionados, reconocieron que varios taxones de los grupos antes referidos pertenecen a Pleopeltis. Con la redefinición de Pleopeltis, ahora comprende 90 especies. En particular P. astrolepis es un taxón que no sufrió cambios nomenclaturales (p. 45-48).
Antecedentes
Entre las publicaciones que aportan datos relacionados con la fase sexual del género Pleopeltis destacan, (Atkinson, 1964) mencionando el tipo de desarrollo protálico tipo Kaulinia para la subfamilia Pleopeltidoideae (p. 184). (Bhattacharyya, A. K. & Sen, 1992) mencionan los tiempos de desarrollo de cuatro especies de Pleopeltis desde el inicio del filamento, del meristemo para formar la escotadura, la formación de los tricomas, además de anteridios y arquegonios (p. 71). (Hooper, A. E. & Haufler, 1997) estudiaron la diversidad genética y la reproducción de seis taxones de Pleopeltis (Polypodiaceae) encontrando altos niveles de polimorfismo en las poblaciones y bajas tasas de autofecundación (p. 1668-1672). (Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003) mencionan como tipos de germinación Vittaria y Pleopeltis, con gametófitos de forma cordada, unisexuales o bisexuales sin la formación de esporófitos (p. 321). (Viviani, D., Santos, M. & Randi, 2009) describen la formación de esporófitos en cultivo de la especie Pleopeltis lepidopteris (p. 739).
La justificación de este estudio se basa en las observaciones realizadas por este grupo de trabajo durante salidas al campo por más de 10 años en sitios como el Valle de México, el estado de Hidalgo y el estado de Morelos, donde paulatinamente se aprecia la desaparición o reducción de varias poblaciones de especies de helechos epífitos, debido posiblemente al cambio climático y/o a la contaminación que ocurre en varias zonas debido a asentamientos humanos y a la construcción de corredores industriales, razón por la cual, el propósito del presente estudio es describir el desarrollo morfogénico de los gametófitos y de los esporófitos de Pleopeltis astrolepis en condiciones de cultivo en dos sustratos naturales (maquique y tierra de hoja) como una forma de conocer la biología reproductiva de esta especie y su eventual cultivo o reintroducción.
Material y método
Los esporófitos de los cuales se tomaron las esporas para el seguimiento del desarrollo morfogénico se muestran en (Lámina 1, Fig. 12), en el sitio de recolecta se presentó como planta epífita. (Mickel, J. & Smith, 2004) indican que se distribuye en Estados Unidos de América (Florida), Belice, Bolivia, Brasil, Colombia, Costa Rica, El Salvador, Grandes Antillas, Guatemala, Guyana Francesa, Honduras, México, Nicaragua, Panamá, Perú, Trinidad y Tobago, Venezuela. En México se ha recolectado en los estados de Campeche, Chiapas, Coloma, Guerrero, Hidalgo, Jalisco, Michoacán, Nayarit, Oaxaca, Querétaro, San Luis Potosí, Tabasco, Veracruz y Yucatán (p. 470-471).
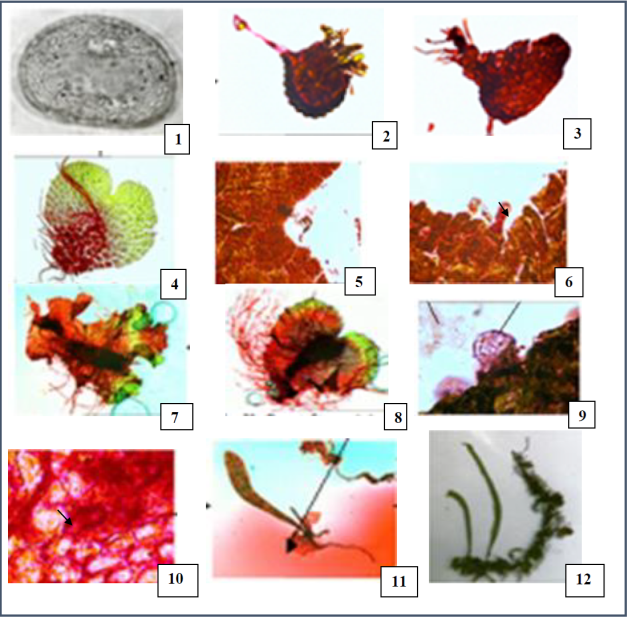
LAMINA 1 Etapas del desarrollo morfogénico de P. astrolepis: 1. Espora. 2. Esporangio con esporas en germinación emergiendo los filamentos. 3. Gametófito joven o fase espatulada. 4. Gametófito maduro o cordado. 5. Detalle de la escotadura. 6. Tricoma glandular del margen del gametófito. 7. Gametófito cordado-lobado bisexuado. 8. Gametófito cordado bisexuado. 9. Anteridio con anterozoides. 10. Arquegonio. 11. Esporófito joven con restos de gametófito. 12. Esporófito adulto que sirvió de base para el estudio morfogénico.
La recolecta se realizó en el municipio de San Bartolo Tutotepec, en el estado de Hidalgo en las coordenadas 20° 40’12” de latitud Norte 98° 20’09” de longitud Oeste, a una altitud de 1,000 m en un bosque mesófilo de montaña. Los helechos se recolectaron el 18 de septiembre de 2001, son plantas epífitas que crecen sobre tallos de encinos (Quercus) y se tuvo especial cuidado de que estos ejemplares fueran fértiles y presentaran los soros maduros. En sobres de papel blanco se colocaron muestras de láminas foliares con soros y además se recolectó un ejemplar completo de la planta que se herborizó. El ejemplar de referencia se encuentra depositado en el Herbario (ENCB) del Instituto Politécnico Nacional y se identificó con literatura especializada como la de (Smith, 1981) p. 284-289; (Mickel, J., & Beitel, 1988) p. 339-343; (Moran, 1995) p. 346-349 y (Mickel, J. & Smith, 2004) p. 467-475.
El material recolectado se colocó en sobres de papel blanco y se dejaron durante 15 días en un lugar seco y oscuro. Posteriormente se realizó la siembra según la técnica de (Montoya-Casimiro, M. C., Álvarez-Varela, R., Pérez-Hernández, S., & Arreguín-Sánchez, 2000), para ello se utilizaron frascos de vidrio de 150 ml, en los cuales se depositó una capa de piedra de río, barro molido, un círculo de mosquitero y encima de este, a cinco frascos se les colocó maquique molido y a otros cinco tierra de hoja. Posteriormente en cada frasco se sembró 0.2 g de esporas y los frascos germinadores se cubrieron con una bolsa de plástico sujeta con alambre de cobre. De los cinco frascos de cada sustrato donde se propagaron las esporas, en cuatro de ellos se tomaron muestras del desarrollo morfogénico y uno quedó como testigo. Cada 15 días se tomaron muestras y se elaboraron preparaciones permanentes fijando las estructuras en formol al 2% por 48 hrs, posteriormente se tiñeron con safranina, el montaje se realizó con una mezcla de maíz-agua 1:1 y trazas de fenol y se sellaron con barniz transparente, las laminillas se etiquetaron (p. 328-330). Con esta serie de preparaciones se realizó el seguimiento del desarrollo morfogénico llevando una bitácora.
El experimento se suspendió una vez que los esporófitos tenían alrededor de 5 cm de altura. Con base en las preparaciones fijas se describieron las diferentes etapas del desarrollo, las medidas que se citan en las descripciones corresponden a las mínimas y máximas y entre paréntesis el promedio entre estos extremos (no tratándose de media estadística). Para la toma de fotomicrografías se eligieron las mejores preparaciones que se tomaron en un microscopio compuesto xiophot 1 Zeiss, con cámara digital ZVS- 47DE y estereoscópico Stemi SAV- Zeiss con cámara digital SONY DXC ISIA (640x 480 líneas) y el programa de captura y procesamiento de imágenes KS-400 ZEISS.
Resultado
Esporas: Son de color café claro, monoletes, de forma elipsoidal de 40(42)57 µm de largo, por 25.3(35.6)42.2 µm de profundidad, exina es de 5.1 µm de grosor, nexina de 1 µm, sexina de 2.3 µm y perina de 1.8 µm de grosor, ornamentación granular a verrugada. (lám. 1, fig. 1).
Germinación y fase filamentosa: Las esporas se sembraron el 29 de abril del 2002 y las primeras etapas de la germinación comenzaron a los 15 días después de la siembra, momento en que se veían células que iban emergiendo de la cabeza del esporangio, esto se continuó observando hasta los 36 días en maquique y 52 días en tierra de hoja, posteriormente se apreciaron filamentos constituidos de 7 a 10 células, cada filamento midió entre 170(261.8)527 µm de largo. Los filamentos presentaron rizoides unicelulares hialinos, que midieron 93.5(102)127.25 µm de largo, los cuales se extrajeron de los esporangios para la observación (lám. 1, fig. 2).
Gametófito joven, fase espatulada o fase laminar: Esta etapa se consideró cuando aún no se termina de formar la escotadura del prótalo. El desarrollo correspondió al tipo Drynaria descrito por (Nayar, B.K., & Kaur, 1971), p. 340-341. Se obtuvo a los 106 días en maquique y a los 149 días en tierra de hoja, los gametófitos midieron 56(68.2)120 µm de largo por 25(28.7)42.5 µm de ancho, se observan numerosos rizoides unicelulares, hialinos y cortos distribuidos hacia la parte proximal de los prótalos de 17(28)34 µm de largo (lám. 1, fig. 3). En esta etapa comienza una gran actividad celular hacia el extremo distal donde se empiezan a diferenciar las células del meristemo.
Gametófito adulto o cordado: Esta fase se consideró cuando se tiene bien diferenciada la escotadura formando un gametófito cordado. Para este mismo periodo se encontraron gametófitos en distintas etapas de desarrollo de 0.8(1.2)1.5 mm de largo por 0.9(2)3 mm de ancho (lám. 1, fig. 4). La escotadura midió en promedio de 0.3 mm de ancho (fig. 5) y en el margen se apreció la formación de tricomas glandulares evidentes formados por dos células (lám, 1, fig. 6). Los rizoides fueron más largos, delgados y abundantes. Esta etapa se encontró a los 240 días en maquique y en tierra de hoja a los 300 días.
También se localizaron gametófitos cordados-lobulados (lám. 1, fig. 7) formados por 2 a 6 lóbulos, midieron de 1.1(1.3)1.6 mm de largo por 1(3)4 mm de ancho, presentaron tricomas glandulares, marginales constituidos por dos células. Los rizoides son numerosos, hialinos y unicelulares. En ambos gametófitos cordados y cordados-lobulados se presentaron gametangios.
Gametangios: Se diferenciaron en la porción central del prótalo que comenzó a engrosarse formando un cojinete en donde fue posible observar rizoides y gametangios. En la zona cercana a la escotadura se apreciaron arquegonios y hacia los rizoides los anteridios (lám. 1, fig.8).
Anteridios: Se formaron a partir de los 240 días en maquique y a los 330 días en tierra de hoja, son de forma esférica, de 42 µm de diámetro, por cada anteridio se localizaron de 18 a 35 anterozoides maduros (lám. 1, fig. 9). Se distribuyen de la zona de los rizoides, hacia el margen del gametófito.
Arquegonios: Se observaron arquegonios maduros a partir de los 240 días en maquique y a los 330 en tierra de hoja, son de forma elíptica a ovalada, midieron 46 µm de largo por 39 µm de ancho (lám.1, fig. 10). Se distribuyeron de la parte central hacia la escotadura del gametófito. Los anteridios y arquegonios se mezclan en la parte central de los prótalos. Se pudieron contar de 5 a 13 arquegonios por gametófito, encontrando muchos más anteridios.
Esporófito: Los primeros esporófitos emergieron a los 341 días en maquique y en tierra de hoja a los 400 días, encontrándose aun restos del gametófito. Por cada prótalo se obtuvieron uno o dos esporófitos que midieron de 9(13.5)16 mm de largo por 1(1.3) 2 mm de ancho, la lámina es entera, con un pecíolo muy corto que es un rasgo característico de la especie, venación dicotómica y presencia de escamas (lám. 1, fig. 11). En la lámina 1, figura 12 derecha se muestra el esporófito adulto recolectado en el campo del cual se obtuvieron las muestras de las esporas.
Discusión
Se elaboró el cuadro l que compara los resultados de este trabajo con los datos de la bibliografía consultada. Con base en este cuadro se encontró que en todas las especies las esporas son monoletes, el tipo de ornamentación presente fue la lisa, granulosa, verrugada o tuberculada. El tiempo de germinación se presentó entre los 5 y los 15 días dependiendo de los taxones y el medio de cultivo o sustrato. El menor tiempo de germinación se obtuvo en Pleopeltis percusa en medio de Moore y el mayor tiempo en P. astrolepis en sustratos de tierra de hoja y maquique. Los tipos de germinación citados fueron el Pleopeltis y Vittaria. El número de células del filamento varió de 2-3 hasta 7-10.
Cuadro 1 Comparación del desarrollo morfogénico en diferentes especies de Pleopeltis (se citan en orden alfabético de las especies).
| Especie | Tipo de espora | Ornamenta-ción de la espora | Germinación (días) y tipo | Número de células del filamento | Fase laminar o gametófito joven (días) | Gameto-fito adulto o cordado (días) | Forma del gametofito y desarrollo protalico | Presencia de tricomas en el gametofito | Sexo del gametofito | Aparición de gametangios (días) anteridios/ arquegonios | Esporofito (días) | Medio de cultivo | Referencia bibliográfica |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P. angusta Humb. & Bonpl. ex Willd. | monolete | lisas a levemente tuberculadas | 7-12 Tipo Pleopeltis | 2-3 | 7 | 47 | cordiforme-espatulados tipo Ceratopteris | N/M | unisexuado femenino | NF/47 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al, (2003). |
| P. astrolepis (Liebm.) Fournier | monolete | lisas a levemente tuberculadas | 7-12 Tipo Vittaria | 2-5 | 12-45 | 60 | cordiforme espatulado, tipo Drynaria | N/M | unisexuado femenino | NF/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al, (2003). |
| P. astrolepis (Liebm.) Fournier | N/M | N/M | 5 | N/M | 11 | 30 | cordados- alargados | Sí | bisexuado | 27/34 | No se observa | Moore | Bhattacharyya & Sen (1992) |
| P. astrolepis (Liebm.) Fournier | monolete | verrugosa y granulosa | 15 germinación de las esporas dentro de los esporangios | 7 a 9 | 106 | 240 | cordados y cordados- lobulados, tipo Drynaria | Sí | bisexuado | 240/240 | 341 | maquique | (presente estudio) |
| P. astrolepis (Liebm.) Fournier | monolete | verrugosa y granulosa | 15 germinación de las esporas dentro de los esporangios | 7 a 10 | 149 | 300 | cordados y cordados- lobulados tipo Drynaria | Sí | bisexuado | 330/330 | 400 | tierra de hoja | (presente estudio) |
| P. crassinervata (Fée) T. Moore | monolete | lisas a levemente tuberculadas | 7-12 Tipo Vittaria | 2-5 | 12-45 | 60 | cordiforme, tipo Drynaria | N/M | unisexuado, femeninos y masculinos | 50-130/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al. (2003). |
| P. lepidopteris (Langsd. & Fisch) de la Sota | monolete | papilado granular | 15 | 4-7 | 15 | 45 | cordiforme Tipo Drynaria | Sí | unisexua-dos | no fueron observados anteridios/60 y 120 | 283 y 343 | Sol. Nutritiva de Mohr (1956) | Viviani et al. (2009) |
| P. macrocarpa (Willd.) Kaulf. | N/M | N/M | 6 | N/M | 10 | 30 | cordados- alargados | Sí | bisexuado | 27/30 | no se observa | Moore | Bhattacha-ryya y Sen (1992) |
| P. macrocarpa (Willd.) Kaulf. | monolete | lisas a levemente tuberculadas | 7-12 tipo Vittaria | 2-7 | 12-45 | 60 | cordiforme, tipo Ceratopteris | N/M | unisexuado, femeninos y masculinos | 50-130/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al. (2003). |
| Pleopeltis mexicana (Fée) Mickel & Beitel | monolete | lisas a levemente tuberculadas | 7-12 tipo Pleopeltis | 2-5 | 12-45 | 60 | cordiforme espatulado, tipo Ceratopteris | N/M | unisexuado, femeninos y masculinos | 50-130/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al. (2003). |
| P. pleopeltifolia (Raddi) Alston | N/M | N/M | 6 | N/M | 11 | 30 | cordados- alargados | Sí | bisexuado | 29/36 | no se observa | Moore | Bhattacha-ryya y Sen (1992) |
| Pleopeltis percusa (Cav.) Hook. | N/M | N/M | 5 | N/M | 9 | 30 | cordados- alargados | Sí | bisexuado | 27/30 | no se observa | Moore | Bhattacha-ryya y Sen (1992) |
| P. polylepis (Roemer ex Kunze) T. Moore | monolete | lisas a levemente tuberculadas | 7-12 tipo Vittaria | 2-4 | 12-45 | 60 | cordiforme reniforme, tipo Drynaria | N/M | unisexuado femenino | NF/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al. (2003). |
| P. revoluta (Spreng. ex Willd.) A. R. Smith | monolete | lisas a levemente tuberculadas | 7-12 tipo Vittaria | 2-4 | N/M | N/M | cordiforme, tipo Drynaria | N/M | unisexuado femenino | NF/40-130 | NF | Thompson modificado por Klekowski (1969) | Reyes-Jaramillo et al. (2003). |
N/M No se menciona; NF no se forman.
La fase laminar o gametófito joven se obtuvo a partir de los 9 y hasta los 149 días (cuadro 1). Los gametófitos adultos o cordados se obtuvieron entre los 30 y 60 días en esporas cultivadas en medios nutritivos de Thompson modificado por Klekowski, medio de Moore y medio de Mohr modificado. Esta misma fase de desarrollo se inició entre los 240 y 300 días en la especie de estudio, la primera fecha en maquique y la segunda en tierra de hoja.
La forma de los prótalos varió según los taxones de cordado-espatulado, cordado-alargado, cordado-reniforme, cordado y cordado-lobulado, en la especie de estudio se encontraron los cordados y cordados-lobulados. Los tipos de desarrollo protálico citados para los taxones del cuadro 1 fueron Drynaria y Ceratopteris y en este trabajo fue tipo Drynaria.
En varias especies (cuadro 1) se describe la presencia de tricomas en el margen del gametófito y en cuanto a la sexualidad se han encontrado tres variantes: bisexuados, unisexuados femeninos y masculinos, y unisexuados solo femeninos. En el presente trabajo los prótalos fueron bisexuados y con tricomas marginales.
La formación de gametangios masculinos según las especies del cuadro 1 fue a partir de los 27 y hasta los 330 días y los femeninos de los 34 a los 330 días. El desarrollo de los esporófitos jóvenes se menciona solo en P. lepidopteris cuyas esporas se cultivaron en medio de Mohr modificado y se obtuvieron entre los 283 y 343 días. En el presente trabajo se desarrollaron en maquique a los 341 días y en tierra de hoja a los 400 días, obteniéndose gran cantidad de esporófitos en ambos sustratos, por lo que es la segunda especie de Pleopeltis en que se producen esporófitos bajo condiciones de cultivo.
La posible explicación de que esta planta se haya desarrollado 60 días más rápido en maquique que en tierra de hoja, podría deberse a que es una planta recolectada en un bosque mesófilo de montaña y además es epífita. El tipo de vegetación donde existe este elemento es en este tipo de vegetación debido a la presencia de helechos arborescentes, y es sabido que el maquique es el material idóneo para plantas epífitas, razones por las que se considera que el desarrollo del esporófito fue más rápido en este sustrato.
Al comparar los datos de P. astrolepis descritos por (Bhattacharyya, A. K. & Sen, 1992), p. 71; (Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003), p. 325 y los obtenidos en el presente trabajo se encontraron varias diferencias: los autores antes citados mencionan tiempos de germinación de 5 a 12 días, en el presente estudio se presentó a los 15 días. El desarrollo protálicos fue más corto, entre los 11 y 45 días, en este trabajo, los periodos fueron de 106 a 149 días. La germinación de las esporas en P. astrolepis en este trabajo fue dentro de los esporangios, característica que no se cita en otras investigaciones. (Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003) mencionan que pasaron los esporangios a través de un tamiz para eliminar restos de los mismos y de hojas, para sembrar solo esporas (p. 322).
Los autores de la presente investigación consideran que esto pudo influir en la formación de los esporófitos, al permanecer las esporas en el interior de los esporangios en las primeras etapas de germinación, obtienen quizás de esta forma protección contra las inclemencias ambientales y posiblemente con los restos del tapete o tejido nutricio pudieron asegurar el desarrollo de los prótalos hasta alcanzar la madurez sexual y la consecuente formación del esporófito. Es notorio que en la especie de estudio todas las esporas germinaron dentro del esporangio.
En el análisis de resultados que se muestra en el cuadro 1, P. astrolepis se describe con gametófitos bisexuados según (Bhattacharyya, A. K. & Sen, 1992), p. 69 y unisexuados femenino (Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003), p. 326; en el presente trabajo se encontraron prótalos bisexuados. La explicación a esta discrepancia de resultados puede deberse al medio o sustrato ocupado en el laboratorio, aunque al tratar de exponer estas diferencias con base en las condiciones naturales de los prótalos, quizás las respuestas están vinculadas al hábito de crecimiento epífitico de las especies de Pleopeltis.
Los prótalos de los helechos epífitos que crecen entre el musgo, líquenes y otras plantas vasculares situadas en troncos y ramas de los forófitos tienen interacciones intraespecíficas complejas, (Shorina, 2001), p. 164-167; (Chiou, W. L., 2002), p. 65, (Farrar, D. E., Dassler C., 2008), p. 222-230 y su existencia está ligada a los fenómenos de longevidad, multiplicación vegetativa y dioecia-alogámia (genogámia); (Ranker, 1992); (Haufler, C. H., Windman, M. D. & Rabe, 1995), p. 131, (Salazar-Aguilar, S., Arreguín-Sánchez, M. L. & Tejero-Díez, 2015), p. 36, indican que de esta forma se incrementan las oportunidades para las interacciones de poblaciones originadas de diferentes esporófitos, aunque también autores como (Andrews, 1993) observó autofecundación en P. astrolepis (p. 106).
Con los resultados del presente trabajo y los obtenidos a partir de la revisión bibliográfica, es posible explicar características tales como la longevidad de las esporas al continuar dentro de los esporangios, las primeras etapas de la germinación, desarrollo de los filamentos clorofílicos y la presencia de prótalos bisexuados, podrían aseguran la autofecundación, además de una alogamia o reproducción cruzada que es la idónea para que se efectúe la recombinación genética.
Los prótalos unisexuados de P. astrolepis citados por (Reyes-Jaramillo, I., Pérez-García, & Mendoza-Ruiz, 2003) pueden asegurar una dioicia-alogámia (p. 326), sus resultados son semejantes a los de (Viviani, D., Santos, M. & Randi, 2009) para P. lepidopteris en el sentido que describen solo prótalos femeninos (p. 739) y la formación de esporófitos no apogámicos, lo que implicaría el desarrollo de un número muy reducido, de gametófitos unisexuados masculinos o bien bisexuados, y de esta forma, se promovería una fertilización cruzada. Es probable que los procesos de diferenciación sexual en los prótalos puedan estar relacionados con la autofertilización y la genogamia como lo indican (Hooper, A. E. & Haufler, 1997), p. 1668-1669 para otros taxones de Polypodiaceae epífitos.
La multiplicación vegetativa en las especies de Pleopeltis pudiera ocurrir a través de los rizomas. La formación de esporófitos apogámicos no se menciona en ninguno de los taxones del cuadro 1, tampoco se ha observado reproducción vegetativa de los gametófitos que es otra de las adaptaciones que se encuentran en Polypodiaceae epífitas, que es un mecanismo para asegurar la longevidad del prótalo. (Bell, 1992) asume que la apogamia se presenta como una respuesta a los medios de cultivo, aunque también puede indicar la presencia de individuos de origen híbrido o poliploides (p.S 124, S126).
(Bhattacharyya, A. K. & Sen, 1992) refieren que en Pleopeltis no observaron esporófitos y los arquegonios son pocos en número, muchos de ellos abortan y tienen las células del canal del cuello y célula ventral anormales; en los arquegonios normales, el cuello está doblado y obstruyen la fertilización. También existe la tendencia a producir tantos anteridios como arquegonios abortados y así, son pocos los cigotos que se producen a través de fertilización entre gametos (p. 71 y p. 74). (Hooper, A. E. & Haufler, 1997) hacen referencia a la dificultad de obtener esporófitos en condiciones de laboratorio, nunca se ha visto que produzca esporófitos en el laboratorio, incluso después de un año de crecimiento y riego regular (p. 1671). Al respecto se considera que la formación de gametangios abortivos puede presentarse en algunas etapas sexuales de algunas especies del género para evitar la autofertilización, y considerando nuevamente el microhábitat de los organismos epífitos, estos eventos podrían estar ligados a la interacción entre gametófitos vía anteridiógenos y a la transferencia de anterozoides (Dassler, 1995), p. 134-135; (Farrar, D. E., Dassler C., 2008), p. 236; (Salazar-Aguilar, S., Arreguín-Sánchez, M. L. & Tejero-Díez, 2015) p. 34 y 36).
(Nayar, B. K. & Kaur, 1969) mencionan que en la subfamilia Pleopeltoideae el desarrollo protálico es tipo Kaulinia, sin embargo, los datos obtenidos en la presente investigación y los citados en la bibliografía, indican que este tipo de desarrollo no se ha observado en las especies de Pleopeltis hasta ahora estudiadas (p. 182).
Finalmente, las características de desarrollo morfogénico más destacables en P. astrolepis son: germinación de las esporas dentro del esporangio, desarrollo protálico tipo Drynaria, gametófitos cordados y cordado-lobulados, bisexuados, formación de esporófitos en condiciones de laboratorio en un periodo comprendido entre 341 y 400 días y la obtención de gran cantidad de esporófitos.
Conclusiones
Al comparar los datos del desarrollo morfogénico de P. astrolepis con los de otros autores se encontraron varias diferencias con respecto al tiempo de germinación, formación de prótalos jóvenes, adultos y la sexualidad de los mismos, explicando estas discrepancias con base en las condiciones de laboratorio y en especial, a aspectos ecológicos de los prótalos de plantas epífitas.
Las características del desarrollo morfogénico de P. astrolepis son la germinación de las esporas dentro del esporangio, desarrollo protálico tipo Drynaria, gametófitos cordados y cordado-lobulados, bisexuados y formación de abundantes esporófitos entre los 341 en maquique y 400 días en tierra de hoja.
Es la segunda vez que se logra el desarrollo del esporofito de una especie de Pleopeltis en condiciones de cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)


