Introducción
Existen interrelaciones de las especies bióticas entre sí y con su ambiente circundante. Las plantas y animales tienen una distribución geográfica y se reconocen patrones de asociación espacial llamadas comunidades (Nicolson, 2013; Alcaraz, 2013). Para que ocurra este proceso de ensambladura de las especies hay primero un proceso de dispersión desde la reserva local de especies, acoplado con su tolerancia a los factores abióticos y a las interacciones bióticas después del establecimiento (Kraft y Ackerly, 2014). Se reconoce también que las especies vegetales siguen una distribución espacial que corresponde con las diversas condiciones bióticas y abióticas, lo que les permite desarrollarse y reproducirse, ya que usan de manera óptima los recursos disponibles (luz, agua, nutrientes etc.) (Díaz et al., 2012). Esto permite que estas unidades naturales de plantas puedan ser objetos de estudio de la geografía, ya que son entidades espaciales discretas con linderos discernibles (Nicolson, 2013).
Varios estudios han abordado el efecto que tiene el gradiente topográfico en la distribución de la vegetación (Sternberg, y Shoshany, 2001; Gong et al, 2008; Salehi, Esfandiarpour, y Sarshogh, 2011; Maren et al., 2015). En la sierra Lihue Calel de La Pampa, Argentina, la variabilidad ambiental inducida por los cambios topográficos se consideró importante en la distribución de la vegetación, no obstante, la escasa magnitud de la elevación de esa sierra (Mazzola et al., 2008). También la distribución y degradación de la vegetación está vinculada con la topografía del terreno y puede usarse para diseñar estrategias de conservación y rehabilitación de áreas naturales dañadas; por ejemplo, López et al. (2003) describieron 13 unidades ambientales y 10 tipos de comunidades vegetales en la Subcuenca de Zapotitlán Salinas, Puebla; estas unidades fueron explicadas por la diversidad de geoformas, litología y suelos, vinculadas a su vez con procesos geológicos como plegamientos y tectonismo regional.
La Joya Honda, uno de los siete maares que se encuentran en el estado de San Luis Potosí, es una estructura volcánica de circunferencia elíptica constituida principalmente de rocas calizas. Esta estructura se ha estudiado por sus singulares procesos geológicos; sin embargo, no se han realizado estudios relacionados con la descripción y cartografía de las comunidades vegetales con base en su gradiente topográfico. Al respecto, solo existe un estudio florístico realizado por Calderón de R. (1957), quien en su tesis “Vegetación del Valle de San Luis” incluyó una descripción florística de este lugar. Aunque la zona carece del estatus de área natural protegida (ANP), actualmente las autoridades municipales están considerando la posibilidad de incluirla en la lista de las ANP estatales (Instituto de Geología UASLP, 2011); sin embargo, también está en marcha un proyecto para utilizarla como zona ecoturística. Lo anterior justifica la realización de trabajos de este tipo dado el riesgo de deterioro que esto implicaría.
A la fecha se carece de estudios detallados sobre la ecología de las comunidades vegetales de esta estructura volcánica. Por ello, se considera que este estudio es una primera contribución en este tema. El objetivo es analizar los patrones de distribución de las comunidades vegetales del maar de la Joya Honda vinculados con los gradientes topográficos de pendiente y exposición.
Área de dstudio
La Joya Honda se localiza 35 km al NE de la ciudad de San Luis Potosí, entre los paralelos 22º 15’ y 22º 35’ de latitud N y los meridianos 100º 30’ y 100º 45’ (fig. 1), en las inmediaciones del poblado Estación Ventura, perteneciente al municipio de Soledad de Graciano Sánchez.
El clima del área de estudio es seco templado con lluvias en verano (BSokw). La temperatura media anual va de 12 a 18°C. La temperatura media en el mes más frío es de 3°C, mientras que la temperatura media del mes más caliente es de 18°C. La amplitud de precipitación total anual es de 300 a 400 mm (INEGI, 2002).
El cráter tiene un eje menor de 900 m y un eje mayor de 1300 m. Su altitud varía entre 2 020 m y 1 720 m. Este volcán estalló hace 1.1 millones de años sobre calizas del Cretácico altamente plegadas y defectuosas, en una serie de erupciones magmáticas y freatomagmáticas que produjeron una compleja secuencia de depósitos piroclásticos de tobas volcánicas y brechas (Labarthe, 1978; Saucedo et al., 2017). Dentro del cráter afloran las formaciones sedimentarias Cuesta del Cura y La Peña. La primera presenta rocas calizas color gris oscuro en estratos delgados a medianos, microcristalinas, interestratificadas con bandas y lentes de pedernal negro con estratificación ondulante. La segunda consiste de rocas calizas color gris oscuro a claro en estratos de medianos a gruesos, y contiene zonas de rocas calizas finamente estratificadas y cantidades variables de lutitas (Labarthe et al., 1982).
Es interesante destacar que el eje mayor de la elipse que forma el cráter tiene una dirección ENE-OSO, lo que produce dos amplias zonas de ladera: una orientada principalmente hacia el norte, noroeste y noreste, con frecuente umbría y mayor humedad, y la otra hacia el sur, suroeste y sureste, con intensa radiación solar y menor humedad. La inclinación de la pendiente es muy abrupta desde el inicio del descenso hasta la base detrítica del piedemonte donde se produce una disminución gradual de la inclinación la cual concluye en una zona de acumulación aluvial en el centro del cráter. Este gradiente se relaciona con la profundidad del suelo, el cual parte desde suelos con un horizonte A de poco espesor y frecuentes afloramientos calizos (leptosol lítico, de acuerdo con FAO, 2006), hasta suelos profundos y sin afloramientos en el centro de la estructura volcánica. A falta de un estudio detallado de la variación de la temperatura y humedad en la superficie del terreno, se puede hipotetizar que el centro del cráter funciona como un receptor, tanto de escorrentías en el verano, como de aire frío en el invierno; ambos hechos, consecuencia del drenaje natural de estos fluidos desde las laderas circundantes.
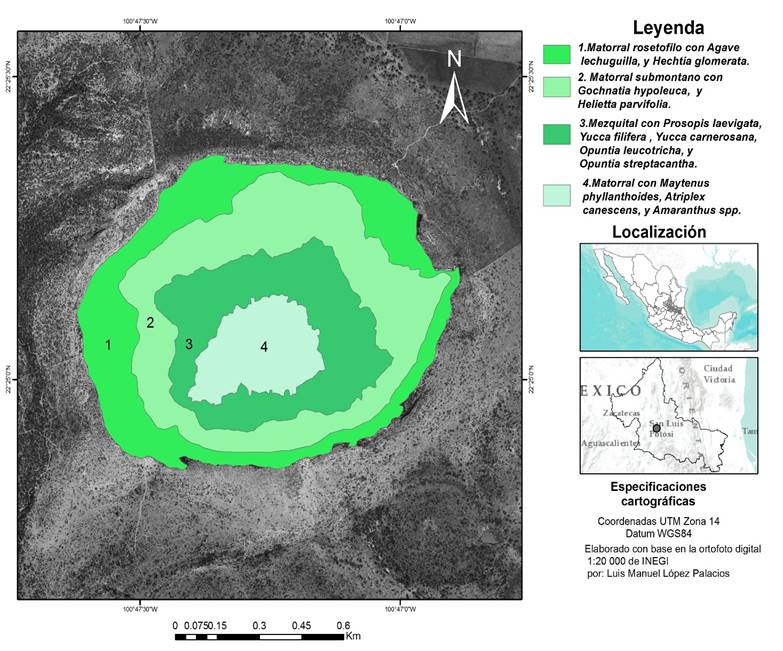
Material y métodos
Se llevó a cabo la búsqueda y análisis de la información acerca del área de estudio, en tesis, trabajos, anuarios estadísticos, revistas y periódicos; además se revisó información cartográfica analógica y digital como fotografías aéreas, ortofotos y mapas temáticos; con base en ello se identificaron preliminarmente, de acuerdo con INEGI (2015), las comunidades vegetales que circundan las laderas del cráter (fig. 2) y se definieron las zonas de muestreo (fig. 3). Esta información se plasmó en un mapa de unidades de vegetación y paisaje basado en indicadores como cobertura y uso, relieve y drenaje (fig. 2). En el sentido del descenso al cráter, el primer tipo preliminarmente identificado fue el matorral desértico rosetófilo; el segundo fue el matorral submontano con Gochnatia hypoleuca y Helietta parvifolia; el tercero fue el mezquital, con Prosopis laevigata, Yucca filifera, Opuntia streptacantha y O. leucotricha y el cuarto fue un matorral de características halófilas con Maytenus phyllanthoides, Amaranthus hybridus y Atriplex canescens. Con excepción de la zona de matorral desértico rosetófilo, cuyas condiciones escarpadas lo impidieron, en cada uno de los tipos de vegetación preliminarmente identificados se realizó un muestreo sistemático; a partir de un primer punto inicial, definido aleatoriamente, se establecieron sitios de muestreo cada 60 m en el matorral de Maytenus, cada 90 m en el área de mezquital, y cada 120 m en el matorral submontano. Las diferentes distancias se fijaron en función de la longitud del área muestreada, y de las dificultades de acceso. Así, se definieron 33 sitios de muestreo distribuidos a lo largo de los tres tipos de vegetación preliminarmente definidos (fig. 3). En cada uno de ellos se establecieron transectos en banda (Ramírez, 2006), de 30 m por 4 m, alineados por su segmento largo de forma perpendicular a la pendiente; cada transecto se dividió en seis parcelas de 20 m2. En cada parcela se midió la cobertura de cada individuo arbustivo registrado; los estratos herbáceos y rasantes no se registraron dado que fueron poco conspicuos en las laderas durante la época de muestreo.
Para identificar con precisión a las especies presentes en las parcelas se efectuaron recolectas de especímenes botánicos; esta recolecta se amplió en la medida de lo posible hacia las rutas de acceso a los sitios de muestreo con el fin de identificar algunas especies presentes pero que no aparecieron en las unidades de muestreo. Para la recolecta botánica se siguió la metodología de Lot y Chiang (1986). Los especímenes fueron identificados en el herbario Isidro Palacios (SLPM) del Instituto de Investigación de Zonas Desérticas de la UASLP. La información obtenida se analizó y con base en ella, se rectificaron los datos de campo y la cartografía preliminar realizada durante el reconocimiento inicial.
Para analizar los atributos estructurales de la vegetación se realizó un análisis multivariable (Vega, 2011), para ordenar y clasificar las especies y parcelas muestreadas; para ello, se generaron dos matrices (una para datos de frecuencia y otra para cobertura, respectivamente), con 33 sitios de muestreo y 41 especies registradas en los rectángulos. Estas se procesaron mediante el software PC ORD versión 4.20 (Medrano, 2010), y sus programas DECORANA (el cual desarrolla el método de Análisis Factorial de Correspondencia Desprovisto de Tendencia) y TWINSPAN (Método de Análisis de Clasificación Bidireccional o de Doble Vía Basado en Especies Indicadoras). Ambos métodos son complementarios, ya que DECORANA realiza una ordenación indirecta de las especies y los sitios de muestreo, de manera que busca inferir sobre la relación existente entre ambos en el área geográfica estudiada (Medrano, 2010). La información multidimensional se presenta de manera simplificada en dos o tres ejes, y el número de ejes a analizar se determina con el valor de R2 obtenido con base en la Distancia Relativa Euclideana. TWINSPAN clasifica tanto las especies como los sitios de muestreo en grupos mediante subdivisiones dicotómicas sucesivas (Hill, 1979; Mateucci y Colma, 1982 citado por Lozada et al., 2006).
RESULTADOS Y DISCUSIÓN
Con base en las recolectas y observaciones botánicas efectuadas tanto en las parcelas de muestreo como en los senderos de acceso al sitio, se registraron 87 especies, pertenecientes a 67 géneros y 30 familias (Anexo 1). En un trabajo previo en la zona (anexo 2), la Maestra Graciela Calderón de Rzedowski había recolectado 48 especies pertenecientes a 45 géneros y 19 familias (Calderón de R., 1957). Así entonces, al integrar ambas listas, corregir sinonimias y eliminar duplicados, la lista estimada asciende a 106 especies, 71 géneros y 41 familias. Las familias mejor representadas son Compositae, Cactaceae, Leguminosae, Amaranthaceae, Asparagaceae, Poaceae, Bromeliaceae, Euphorbiaceae, Rosaceae, Rutaceae y Solanaceae.
Los resultados del análisis multivariable se presentan a continuación.
Ordenación. Las gráficas de ordenación, por especies y por sitios, se muestran en las figuras 4, y 5. Con base en la determinación de R2 obtenida con la Distancia Relativa Euclideana, se determinó analizar los ejes 1 y 2 porque son los que explican en mayor medida la variación de los datos de ordenación de las parcelas y las especies.
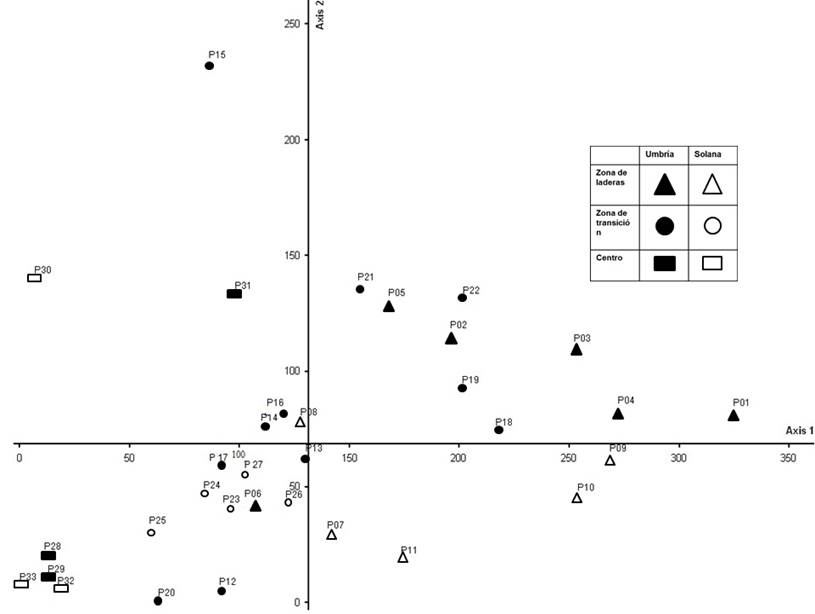
Fig. 4 Ordenación DECORANA de los sitios de muestreo de vegetación de la Joya Honda con base en la matriz de cobertura.

Fig. 5 Ordenación DECORANA de las especies obtenidas en los sitios de muestreo de la matriz de cobertura.
Del análisis de las dos matrices de cobertura (sitios y especies) se puede inferir un ordenamiento asociado en primer lugar con el gradiente topográfico (Eje 1) (fig. 4), y en segundo con el efecto de exposición (Eje 2) (fig. 4). Así, en el primer eje se puede apreciar una ordenación que parte de las parcelas (señaladas con triángulos) ubicadas en las laderas escarpadas; en el centro de ese eje, se presentan las parcelas situadas en pendientes moderadas (círculos), y finalmente en el extremo izquierdo aparecen las parcelas localizadas en el centro del cráter (rectángulos). En el Eje 2 la parte superior es dominada por parcelas propias de la zona de umbría, situada al sur del cráter (marcadas con color negro), en tanto que en la parte inferior predominan las parcelas localizadas en la zona de solana, ubicadas en la parte norte del cráter (caracteres sin relleno). Es interesante observar que el efecto de exposición es más marcado en las parcelas de laderas escarpadas, pero que presenta inconsistencias en las parcelas ubicadas en laderas intermedias o en el centro del cráter (12, 20, 28, 29 y 30); estas inconsistencias podrían estar relacionadas con variaciones en la pendiente o con un menor efecto en relación con la distancia a las paredes verticales.
En la parte de la derecha del gráfico (fig. 5) están ordenadas, en el extremo, Esenbeckia berlandieri y Helietta parvifolia, las cuales representan a dos de las especies destacadas del matorral submontano; en especial E. berlandieri se ubica en las laderas más umbrías. Helietta parvifolia, es una de las especies leñosas que predominan en suelos rocosos profundos con una inclinación de 10-30°, relativamente ricos en nutrientes con un régimen de agua favorable, y un rápido ritmo de crecimiento que la puede llegar a hacer dominante dentro de las comunidades vegetales del matorral submontano (Foroughbakhch, 2003). Otras especies ubicadas por el programa de ordenación en ese extremo son Bursera fagaroides y Gochnatia hypoleuca; esta última suele presentarse de forma conspicua en laderas calizas (González, 2012), en ecotonos con matorral desértico rosetófilo y en áreas aledañas al matorral desértico micrófilo. También aquí se ubican Astrolepis sinuata, helecho frecuente en laderas calizas y pedregosas (Velázquez M., 2010), e Hibiscus martianus una malvaceae frecuente en matorrales xerófilos (Fryxell, 1993); en conjunto, estas especies se distribuyen en las laderas calizas pedregosas y con buen drenaje del cráter de la Joya Honda, donde se establece el matorral submontano. El programa de ordenación muestra enseguida a varias especies, dentro de las cuales se puede señalar a Opuntia rastrera, Myrtillocactus geometrizans, Agave salmiana, Croton cortesianus e Iresine schaffneri, todas ellas propias de un ambiente ecotonal entre laderas escarpadas y pie de monte; en este caso, entre matorral submontano y mezquital. Es posible que M. geometrizans, especie sensible a las heladas, encuentre en las laderas un ambiente que le permita eludir los embolsamientos de aire congelante que se presentan en el fondo del cráter durante el invierno; en este sentido, Meagher (2007) reporta para San Miguel de Allende, el efecto perjudicial que causó la fuerte helada sobre M. geometrizans, así como el estado más saludable de las poblaciones de ladera en comparación con aquellas situadas en geoformas planas. En el caso de O. rastrera, la disposición horizontal de sus cladodios le permite obtener agua y nutrientes de las escorrentías que fluyen ladera abajo.
Las especies Celtis pallida, Yucca decipiens, Yucca carnerosana, Opuntia streptacantha, Prosopis laevigata y Opuntia leucotricha, están ordenadas en el centro del gráfico (fig. 5); estas corresponden a una comunidad de mezquital, situada en una zona de pendiente ligeramente inclinada sobre el piedemonte del cráter, expuesta al sol durante la mayor parte del día, excepto en los sitios ubicados en la parte sur que son más umbríos. La distribución de dichas especies suele coincidir con suelos profundos de origen aluvial que se encuentran en las partes bajas de cerros calizos (Calderón de R., 1957). Prosopis laevigata tiene una alta capacidad de propagación vegetativa, lo que le permite una rápida captura de recursos; asimismo es capaz de propagarse después de un disturbio y colonizar suelos muy erosionados (García et al., 2012). Y. carnerosana es una especie propia de laderas suaves o fuertes con suelos pedregosos calizos, en tanto que Y. decipiens prospera sobre suelos profundos y bien drenados (Granados y López, 1998). La distribución de las poblaciones de Yucca spp., dentro del cráter muestra una marcada afinidad por la zona de solana; esto explica su ubicación en la parte inferior del gráfico de ordenación de especies (fig. 5), coincidente con la zona de solana del gráfico de ordenación de sitios (fig. 4). Dentro del mezquital es frecuente observar a los individuos arbóreos de P. laevigata, casi siempre de baja altura, alternando con individuos de Opuntia streptacantha y O. leucotricha; estas especies son las más importantes en el matorral de Opuntia conocido como “nopalera” el cual se asocia con suelos derivados de rocas volcánicas y se distribuye en la parte central de Zacatecas y zonas adyacentes de San Luis Potosí (Rzedowski, 1978).
En el extremo izquierdo del gráfico se aprecian Opuntia robusta, Cylindropuntia tunicata, Atriplex canescens, Koeberlinia spinosa, Maytenus phyllanthoides, Dicliptera peduncularis, Berberis trifoliolata y Sporobolus wrightii, especies correspondientes a un matorral abierto, con predominio de herbáceas anuales (principalmente de la familia Amaranthaceae), situado en el centro del cráter, en terreno plano con suelos aluviales profundos bien desarrollados. Es interesante destacar que la presencia de Prosopis laevigata se reduce abruptamente y que M. phyllanthoides se convierte en el arbusto predominante; este arbusto de hojas perennes, ocasionalmente un árbol pequeño, se distribuye en áreas costeras del Océano Pacífico y del Golfo de México y crece en las dunas o pantanos y en las márgenes de las áreas de manglar (Moo et al., 2014). Algunas poblaciones observadas de esta especie se ubican en la llanura de Rioverde y en las estribaciones de la sierra de Catorce, pero a la fecha se carece de registros en el entorno cercano al maar de la Joya Honda. Es posible que su presencia en este sector del cráter esté asociada con especies propias de ambientes salinos como A. canescens y S. wrightii, lo cual puede indicar cierta adaptación a condiciones salinas estacionales o a embolsamientos de aire congelante en la parte más baja de esta geoforma. Opuntia robusta es una cactácea arbustiva perenne de 0.5-1.0 m de altura, que crece aislada o en asociación con otras especies (Pimienta et al., 2003); por ejemplo, en comunidades vecinas suele asociarse con Prosopis laevigata, Berberis trifoliolata y Koeberlinia spinosa. Además, es una especie eficiente en la retención de agua en sus cladodios durante los períodos de estrés hídrico (Snyman, 2004). Se ha observado ocupando los claros que, de manera natural o por disturbio, se abren en los mezquitales del exterior del cráter. Otras especies propias de ambientes perturbados son Dicliptera peduncularis y Cylindropuntia imbricata.
Clasificación. La matriz arreglada para cobertura obtenida del programa TWINSPAN se presenta en la figura 6.
En la parte superior de la matriz se encuentran los sitios de muestreo, a la derecha están las especies registradas y en las partes inferior e izquierda se muestran las clasificaciones dicotómicas de sitios y especies, respectivamente. Con base en los datos de la matriz arreglada y de la hoja de salida de TWINSPAN se presenta el dendrograma que muestra la clasificación de sitios en función del atributo de cobertura. Los diferentes conjuntos y subconjuntos se generaron en función de la afinidad marcada (especies indicadoras) o moderada (especies preferenciales) por cada sitio, de acuerdo con el atributo considerado.
En el dendrograma se muestran los dos primeros niveles de clasificación de los sitios de muestreo en función de sus especies indicadoras1. Las correspondientes agrupaciones de los sitios de muestreo nuevamente evidencian el gradiente topográfico como el factor que los define. Así entonces, el Conjunto 2 está constituido por los sitios ubicados en la parte plana con suelos profundos del centro del cráter, en tanto que el Conjunto 1 comprende a los sitios ubicados en las laderas. En este conjunto, el programa señala como especies indicadoras del Conjunto 1 a Agave salmiana, Dalea minutifolia y Jatropha dioica, y como especies preferenciales2 importantes a Gochnatia hypoleuca, Opuntia streptacantha y O. leucotricha. En el segundo nivel de clasificación, el Conjunto 1 es dividido en dos subconjuntos que reflejan, en lo general, una separación por el grado de inclinación de la pendiente. Así, el Subconjunto 1.1 corresponde a los sitios ubicados en las pendientes más escarpadas muestreadas, y el Subconjunto 1.2 agrupa a los sitios de pendientes más moderadas. En esta división Gochnatia hypoleuca se muestra como una especie indicadora del subconjunto1.1, en tanto que Maytenus phyllanthoides lo es para el subconjunto 1.2. En este último subconjunto, también destacan, pero como especies preferenciales, las ya señaladas O. leucotricha, y O. streptacantha. En el subconjunto 1.1, el programa, fuera de G. hypoleuca no alcanza a destacar a otras especies, aunque señala a Painteria elachistophylla, Astrolepis sinuata, Helietta parvifolia, Echinocactus platyacanthus y Esenbeckia berlandieri con un nivel de importancia menor como especies preferenciales. Lo anterior define con claridad a las especies que caracterizan a las comunidades de la zona de laderas con pendientes fuertes. El programa solo destacó a Prosopis laevigata como especie indicadora del subconjunto 2.2, el cual representa a las comunidades ubicadas en la zona centro. Con menor nivel de importancia señala a especies preferenciales como Opuntia leucotricha, Atriplex canescens, Koeberlinia spinosa y Cylindropuntia imbricata. El subconjunto 2.1, es constituido por un solo sitio que se destaca por la ausencia de P. laevigata. Conviene señalar que, aunque la presencia de Maytenus phyllanthoides es destacada en los miembros de este conjunto, el programa la señala como una especie no preferencial, es decir, que no marca tendencia para la subdivisión.
Los datos obtenidos, tanto en el análisis de ordenación como de clasificación, confirman la cartografía preliminar y revelan la influencia de la pendiente y exposición, y de sus efectos concomitantes sobre cantidad e intensidad de la radiación solar, y humedad y profundidad del suelo, en la distribución de las comunidades vegetales; los patrones observados muestran la importancia en el sector con pendientes fuertes de Gochnatia hypoleuca y Helietta parvifolia. En el pie de monte destacan Opuntia leucotricha, Opuntia streptacantha, Celtis pallida y Prosopis laevigata. En el centro del cráter se presenta un matorral abierto de P. laevigata y de Maytenus phyllanthoides el cual fue claramente distinguido por el programa de clasificación desde la primera división. En relación con la exposición, destaca la afinidad de Yucca carnerosana y Y. decipiens con el área más expuesta a la radiación solar. Se observaron ocho sitios no concordantes con el patrón de pendiente (6, 7, 8, 11, 18, 19, 21 y 22), la mayor parte de los cuales se presentan en la porción centro-occidental del cráter, y probablemente correspondan a comunidades ecotonales semejantes a las ya referidas en el análisis de ordenación.
Conclusiones
Las plantas registradas en La Joya Honda corresponden a 87 especies, 67 géneros y 30 familias. Si a estas se añaden las registradas por Calderón en 1957 la lista estimada ascendería a 106 especies, 71 géneros y 41 familias. Las familias mejor representadas son Compositae, Cactaceae, Leguminosae, Amaranthaceae, Asparagaceae, Poaceae, Bromeliaceae, Euphorbiaceae, Rosaceae, Rutaceae y Solanaceae.
Los análisis de ordenación y de clasificación basados en el atributo cobertura muestran un patrón de distribución de las especies vegetales asociado con su posición topográfica, lo que confirma, aunque no de forma contundente, la cartografía preliminar. La cobertura vegetal de la Joya Honda se distribuye de acuerdo con la variación del perfil topográfico del paisaje, en función de la altitud asociada a las geoseries del relieve local, y a la intensidad y persistencia de la radiación solar (solana y umbría).Esto genera hipótesis a probar en estudios subsecuentes en relación con los efectos del gradiente creciente de profundidad de suelo a lo largo de 300 m de descenso, y del flujo estacional del agua y de corrientes de aire cálido y frío sobre las laderas. Por otra parte, el factor exposición (el cual explica el gradiente expresado en el segundo eje del análisis de ordenación) debe ser sujeto a estudios más precisos que detallen la relación de las comunidades vegetales con la variación en irradiancia entre solsticios.
Finalmente, bajo un contexto de escaso disturbio humano, dadas las dificultades de acceso al cráter en el pasado reciente, la flora registrada y las comunidades analizadas apuntan a que este lugar ha funcionado en dos sentidos, igualmente interesantes: a) Como un hábitat relictual de especies que no se encuentran en sus cercanías (p.ej. Maytenus phyllanthoides). Y b) como una reserva de especies abundantes en el entorno, las cuales han colonizado, con diverso grado de éxito, variadas pendientes y exposiciones. Así entonces, su expresión zonal, en forma de comunidades diferenciadas, refleja tanto las interacciones bióticas como las respuestas de las especies a los factores abióticos.











 nueva página del texto (beta)
nueva página del texto (beta)