Introducción
La Isla Guadalupe, es muy particular debido a su ubicación geográfica y aislamiento del continente; así como por su origen geológico, factores que han influido en su en su singularidad biológica y biogeográfica, en especial por su grado de endemismo en plantas vasculares (León de la Luz et al., 2003). Rzedowski (1978) reconoce la Provincia de Isla Guadalupe, mientras que Moran (1996) la refiere como un desplazamiento de la Provincia Florística de California debido a las semejanzas florísticas con las islas del Canal de California (California Channel islands) y noroeste de Baja California. El paisaje vegetal de Isla Guadalupe fue impactado por la introducción -a mediados del siglo XIX- de cabras ferales, las cuales fueron erradicadas en el año 2007, dando paso a la recuperación de las comunidades vegetales y su composición florística. En la parte sur se encuentran tres islotes adyacentes en donde las cabras no estuvieron presentes: Toro, Zapato y Morro Prieto, conservando sus comunidades vegetales originales, en condiciones casi prístinas (León de la Luz et al., 2003; Oberbauer, 2005). Isla Guadalupe y sus islotes fueron declarados Reserva de la Biosfera, el 25 de abril de 2005.
Las comunidades vegetales de la isla constituyen una variante de la transición mediterránea-desierto, al contar con un importante carácter mediterráneo determinado por la combinación de una significativa proporción de lluvias de invierno con un determinante efecto de las nieblas costeras potenciado por su elevada topografía (Galán de Mera y Vicente-Orellana, 2007; González et al., 2010). El conocimiento de la flora ha sido bien referenciada por diferentes autores desde la llegada de Edward Palmer en 1875, pasando por el estudio más completo de la flora de la isla desarrollado por Moran (1996). En tiempos más recientes otros estudios han contribuido a su componente florístico (Rebman et al., 2002; León de la Luz et al., 2003; Junak, 2005; Garcillán et al., 2008). Sin embargo, las comunidades vegetales han sido poco descritas (Meling, 1985; Moran, 1996, León de la Luz, et al., 2003; Oberbauer, 2005, 2006).
La descripción de los matorrales costeros y desérticos del sur de California, y península de Baja California, han sido documentados por Axelrod (1978), Westman (1981, 1983a, 1983b) y Delgadillo (1998). Mientras que aplicando el método fitosociologico, estos matorrales han sido analizados ampliamente por Delgadillo (1995) y Peinado et al. (1994a, 1994b, 1995a, 1995b, 1997a, 1997b, Peinado et al.,2005). Aplicando la escala de cobertura-abundancia de Braun-Blanquet en matorrales peninsulares e insulares, y sin un análisis fitosociológico, solo se tienen las referencias de Flores-Palacios et al. (2009) para la Isla Socorro, México y Romero-López et al. (2006) para El Mogote, Baja California Sur.
El presente trabajo documenta por primera vez la estructura de la vegetación de los matorrales en Isla Guadalupe, años después del impacto ejercido por las cabras asilvestradas sobre estas comunidades vegetales. Conjuntamente se incluye la elaboración de un dendrograma para su clasificación.
Material y Métodos
Sitio de estudio
Isla Guadalupe, es de origen volcánico, se encuentra localizada en el Océano Pacífico Oriental, dentro de la región biogeográfica del Pacífico Norte Templado, a 260 km al poniente de las costas de la Península de Baja California en las coordenadas geográficas 29° latitud norte y 118° 16' longitud oeste (fig. 1), marcando el límite de la Zona Económica Exclusiva del país en la región (Aguirre-Muñoz et al., 2010). Debido a su ubicación está influenciada por la fría corriente de California que genera niebla, vientos fríos y precipitaciones en invierno. El patrón de vientos es controlado por el centro de Alta Presión del Pacífico Norte (Castro et al., 2005), con dirección predominante del noroeste.
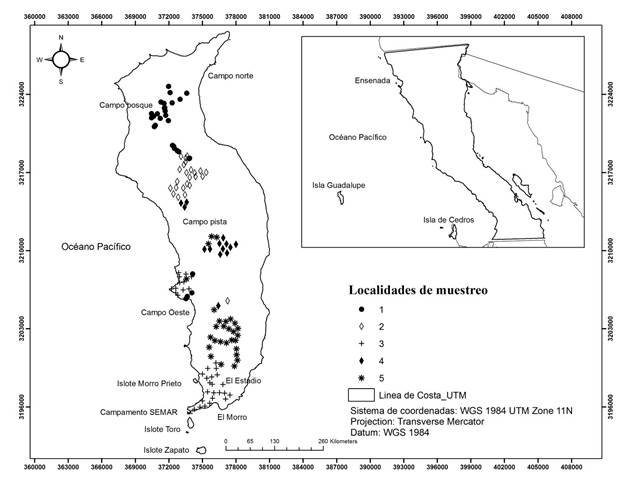
Fig. 1 Ubicación de la Reserva de la Biosfera Isla Guadalupe, México. Se indican la distribución de las localidades de muestreo
El clima es similar al de la costa occidental de Baja California, con características de desértico a templado-seco (Aguirre-Muñoz et al., 2003); aunque, existe variación en el clima, en la llamada punta sur de la isla, en donde se presenta la mayor aridez con una precipitación anual de 120 mm y una temperatura media mensual de 17-19°C (León de la Luz et al., 2003). En la parte central (Campo Pista) se han registrado temperaturas entre 8 a 32°C y una humedad relativa muy amplia de 5 a 95% (Aguirre-Muñoz et al., 2013), mientras que en la parte norte de la isla, la precipitación es mayor (Moran, 1996; Castro et al., 2005), por estar más expuesta a los vientos y debido a su mayor elevación. Además, la frecuente presencia de niebla y nubes bajas muy densas provenientes del noroeste, producen un tipo de lluvia débil situación que favorece a la vegetación en tiempos de sequía.
Toma de datos
Para el estudio de la vegetación se realizaron muestreos por relevés (inventarios) durante la primavera (marzo y abril) de 2013 y 2014. En cada relevé se registró la cobertura vegetal de cada especie de acuerdo a la escala de Braun-Blanquet [r: un solo individuo; +: más individuos, cobertura muy baja; 1: 5%; 2: 5-25%; 3: 25-50%; 4: 50-75% y 5: 75-100%]. Se realizaron 130 relevés de 10 x 10 (100 m2), con una distancia de separación de 250 m y 500 m (fig. 1). El tamaño y forma de los relevés se basó en el concepto del área mínima para matorrales propuestos por la UNESCO (1973) y adaptadas por (Grossman et al., 1998).
En cada relevé se registró, fecha, altitud (m), pendiente en grados (°), exposición/orientación, tipo de sustrato, porcentaje de cobertura vegetal, y componente florístico total (perennes y anuales); sin embargo, para el análisis de cada comunidad se consideraron solo las especies perennes. Las coordenadas se registraron en el sistema Universal Transversal Mercator (UTM) con geoposicionador (GPS) y marcándose cada vértice para su posterior análisis (anexos).
La nomenclatura de las especies es de acuerdo con Rebman et al., (2016), Tropicos.org. y The Plant List, y para la tipificación de los matorrales se siguió la propuesta por Oberbauer (2005). El material colectado para la determinación de las especies está depositado en el Herbario BCMEX de la Facultad de Ciencias, Universidad Autónoma de Baja California.
Análisis de datos
En donde:
ISJ = Índice de Semejanza de Jaccard,
a = número de especies exclusivas de la comunidad
a, b = número de especies exclusivas de la comunidad
b, y c = número de especies en común
El número total de especies expresado en porcentaje (Badii et al., 2007).
El dendrograma fue realizado con el programa STATISTICA 12 (StatSoft, 2014), en el cual se utilizó como medida de similitud la distancia de Euclidiana y el método de Ward como algoritmo de agrupamiento (Ward, 1963).
Resultados
El análisis de las comunidades de matorral, a partir de los muestreos, permitió identificar cinco asociaciones vegetales, las cuales están definidas por la presencia por especies características, constantes y dominantes, por lo que se han nombrado de acuerdo a lo anterior.
Clasificación
Se realizó un análisis de conglomerados (clúster) con base en una matriz de similitud (tabla 1), misma que constó de 20 especies identificadas a partir de los inventarios, dando lugar a la construcción de un dendrograma (fig. 2) con un nivel de corte de 1.3, que permitió distinguir la formación de dos grupos principales. El primero está constituido por las asociaciones: Sphaeralcea sulphurea-Perityle incana y Sphaeralcea sulphurea-Lupinus niveus (SSPI y SSLN), a las cuales se les denominó como los "matorrales norteños" con similitud de 23% (0.23) y comparten casi el 30% de las especies correspondientes a los inventarios en sus sitios de muestreo.
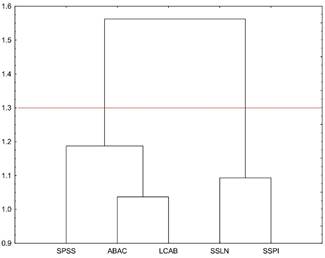
Fig. 2 Análisis de clasificación de las asociaciones del matorral de Isla Guadalupe. En el dendrograma se muestran los grupos formados (de derecha a izquierda) con base en la similitud entre las especies por localidad de muestreo. Se muestran las abreviaciones de cada asociación: (SSPI) Sphaeralcea sulphurea-Perityle incana; (SSLN) Sphaeralcea sulphurea-Lupinus niveus; (LCAB) Lycium californicum-Atriplex barclayana; (SPSS) Sphaeralcea palmeri-Sphaeralcea sulphurea y (ABAC) Atriplex barclayana-Ambrosia camphorata.
El segundo conglomerado consta de dos subgrupos, denominados "matorrales sureños": el primero está integrado por las asociaciones de Atriplex barclayana-Lycium californicum (ABLC) y Ambrosia camphorata-Atriplex barclayana (ACAB), con una distancia de 1.1 en la cual se muestra que las localidades 3 y 5 (tabla 1) presentan la mayor relación de semejanza con el 27% (0.27) de su composición florística, además de ser localidades geográficamente cercanas. El último subgrupo corresponde a la asociación de Sphaeralcea palmeri-Sphaeralcea sulphurea (SPSS), misma que comprende el matorral del "centro de la isla", se observa ligeramente separada con respecto a las otras asociaciones y resultó ser florísticamente pobre en especies perennes; sin embargo, obtuvo un valor de semejanza de 11% (0.11) con el sitio 5, al compartir las especies más abundantes y dominantes en sus asociaciones.
Descripción de las asociaciones
1. Sphaeralcea sulphurea-Perityle incana
Especies características: Perityle incana, Sphaeralcea sulphurea, Lupinus niveus y Senecio palmeri.
Matorral cuyo estrato arbustivo está dominado casi equitativamente por las especies endémicas sufrutescentes (0.50-1m) Perityle incana y Sphaeralcea sulphurea. Esta asociación se encuentra localizada en las partes altas sobre un rango altitudinal entre 966 m y 1275 m. Se puede observar en los acantilados y laderas rocosas en la cara este de la isla, así como en sitios protegidos con pendientes suaves a abruptas (5-75°); en el caso de P. incana, también está presente en arroyos de Campo Oeste y Punta Sur de manera esporádica. Las especies que componen esta asociación se presentan en suelos poco profundos tipo litosoles y adenosoles; estos últimos contienen fragmentos de vidrio volcánico y de lava expulsada durante las erupciones, con densidad muy baja y alta capacidad de retención de fosfatos y agua disponibles para las plantas (Medina et al., 2010). Los inventarios de esta asociación son florísticamente homogéneos, aunque con pocas especies (1-4); además, en algunas localidades es posible encontrar a Senecio palmeri y Lupinus niveus, formando parches densos con coberturas del 60 al 80%. (tabla 2, inventario 24 y 111). Se considera a P. incana y S. palmeri como remanentes del matorral de Artemisia californica. Actualmente, S. sulphurea es una especie con distribución amplia en la isla, desde la parte media al extremo norte, aunque en esta zona ya no es tan abundante. Las especies acompañantes más frecuentes de esta asociación son S. palmeri, L. niveus, Malva occidentalis y Dichelostemma capitatum (geófito).
2. Sphaeralcea sulphurea-Lupinus niveus
Especies características: Sphaeralcea sulphurea y Lupinus niveus.
Matorral tipo sufrutescente de 0.5-1 m de altura, dominada por las especies Sphaeralcea sulphurea y Lupinus niveus. Se localiza en partes altas de la isla entre los 900 m y 1207 m de altitud, en suelos de tipo adenosoles y litosoles (Monte Augusta y laderas expuestas al noreste, principalmente). Es la comunidad en la que se registró el menor número de especies. En esta asociación S. sulphurea es la especie más abundante, particularmente se le puede encontrar en las laderas del lado oeste, pero con porcentaje de cobertura inferiores (tabla 3, inventario 65 y 127) a los observados para L. niveus, a la cual se le observa como una especie dominante con coberturas del 65-75% (tabla 3, inventarios 31 al 33). La asociación está conformada por pocas especies subarbustivas, entre las cuales es posible encontrar como especies acompañantes a S. palmeri y Malva occidentalis, además de especies herbáceas como Acmispon grandiflora, Calystegia macrostegia subsp. macrostegia, Ceanothus arboreus, Dichelostemma capitatum, Lupinus bicolor y Phacelia phyllomanica.
3. Lycium californicum-Atriplex barclayana
Especies características: Atriplex barclayana, Lycium californicum, Deinandra greeneana subsp. greeneana y Sphaeralcea palmeri.
Asociación caracterizada por la dominancia de especies nativas, como Atriplex barclayana y Lycium californicum. En el caso de A. barclayana es posible encontrar poblaciones cercanas a la zona costera de la isla por debajo de los 300 m, crece bien en suelos arcillosos como vertisol y cuenta con una frecuencia de 100% en los inventarios correspondientes a esta asociación, lo que es equivalente al 26% de todos los inventarios realizados (tabla 4). La comunidad es muy interesante desde el punto de vista florístico y fisionómico, al reunirse características tanto edáficas como climáticas que han determinado la presencia de las especies que dominan la comunidad. Un ejemplo es la mezcla de especies sufrutescentes y suculentas; además de la presencia importante de comunidades de líquenes, en suelo, sobre rocas y plantas (e. g. Euphorbia misera). La asociación se presenta en dos zonas de la isla, al sur (mesa sur) y al oeste (campo oeste) con un rango altitudinal similar entre 70 m y 288 m. La topografía en estas zonas ha permitido la diversidad florística y distribución sobre los suelos de tipo litosoles principalmente, aunque especies de Deinandra también están presentes en arroyos, con suelos más profundos y con buen drenaje. Las especies acompañantes son: Ambrosia camphorata, Mammillaria blossfeldiana var. shurliana, Deinandra greeneana subsp. greeneana, D. palmeri y Baeriopsis guadalupensis. En esta asociación convergen elementos dominantes de otras comunidades del norte (Perityle incana y Senecio palmeri) y del sur (Sphaeralcea palmeri).
4. Sphaeralcea palmeri- Sphaeralcea sulphurea
Especies características: Sphaeralcea sulphurea y Sphaeralcea palmeri.
Asociación caracterizada por la dominancia de especies endémicas sufrutescentes como S. sulphurea y S. palmeri. Es la comunidad con mayor extensión geográfica y se localiza en la parte central de la isla entre 537 m y 973 m, en suelos de tipo vertisol pélico. Es comunidad con abundancia de pastos y herbáceas, en su mayoría exóticos como especies de los géneros Avena, Bromus y Vulpia (tabla 5).
Especies acompañantes a esta asociación son: Ambrosia camphorata y Cylindropuntia prolifera, así como algunas herbáceas como Dichelostemma capitatum, Acmispon argophyllus var. argenteus, Dodecatheon clevelandii, Triteleia guadalupensis y Eschscholzia sp.
5. Atriplex barclayana-Ambrosia camphorata
Especies características: Ambrosia camphorata y Atriplex barclayana.
Asociación dominada por especies sufrutescentes menores de 50 cm, de tonalidad glabra y blanquecina con tolerancia a la sequía, y forman parte importante del componente de la flora de zonas áridas y mediterránea de Baja California. Se localiza en la parte sur a una altitud entre 174 y 608 m, en suelos de tipo litosol y vertisol. Ambrosia camphorata es referida por Moran (1996), como una especie dominante en varios sectores de la parte meridional de la isla.
En el caso de Atriplex barclayana es posible encontrar poblaciones cercanas a la zona costera por debajo de los 300 msnm, crece bien en suelos salinos, alcalinos y con escasa precipitación (tabla 6).
Especies acompañantes de esta asociación, como Lycium californicum, Malva occidentalis, Sphaeralcea palmeri y Mammillaria blossfeldiana var. shurliana.
Composición florística
Se registraron 75 taxones distribuidos en 30 familias y 55 géneros de los cuales 30 corresponden a sufrutescentes, 43 herbáceas y 2 geófitos (apéndice 1). Con respecto a las familias, Asteraceae (14 taxones) y Fabaceae (8 taxones) fueron las más dominantes, siendo endémicas Deinandra greeneana subsp. greeneana, Deinandra palmeri y Perityle incana, y en la segunda Lupinus niveus, Acmispon argophyllus var. argenteus y Trifolium palmeri.
Las especies con mayor abundancia fueron: Atriplex barclayana (15%), Sphaeralcea sulphurea (13%), Lycium californicum (11%), Ambrosia camphorata (10%), Lupinus niveus (9.1%) y Sphaeralcea palmeri (9%), que representan el 56.1 % del total de las especies perennes encontradas en los matorrales. Otras especies acompañantes son: P. incana (6%), Senecio palmeri (3%), D. greeneana subsp. greeneana (3%) y L. guadalupensis (1%), y por último Dichelostemma capitatum (16%), una de amplia distribución.
Discusión
Las asociaciones vegetales descritas constituyen comunidades de porte arbustivo bajo tipo xerófilo costero; se distribuyen en forma discontinua y actualmente es el tipo de vegetación más representativo y con mayor abundancia en la isla. Esta formación vegetal se considera una variante del matorral costero del noroeste de la Península de Baja California y sur de California. Varios autores han hecho propuestas orientadas a tipificarlo (tabla 7), tal es el caso de Oberbauer (2006), quien lo clasifica como matorral desértico marítimo y matorral de Artemisia, aparentemente extinto, y que posiblemente tenia amplia cobertura.
En el matorral del sur, es común la presencia de plantas afines a suelos salinos (Atriplex barclayana) y arcillosos (Ambrosia camphorata), ambos característicos de zonas áridas de la península; según Oberbauer (2005), posiblemente estas especies formaron parte del componente florístico del matorral de Artemisia. Por su parte, Meling (1985) dividió los matorrales de Isla Guadalupe en matorral de Atriplex-Sphaeralcea, matorral de Ambrosia-Atriplex y matorral de Hemizonia-Atriplex. Los matorrales más norteños están formados por elementos que alguna vez fueron parte el componente del chaparral, como Ceanothus arboreus y C. cf. greggii var. perplexans, actualmente ambas especies son comunes en áreas afectadas por incendios (Monte Augusta y bosque de ciprés) (tabla 2).
De acuerdo con Rzedowski (1978), la diversidad y las condiciones estructurales del matorral pueden cambiar considerablemente de un año a otro. Mientras que Van Vuren (1987) y Coblentz (1978), refieren se ha demostrado que a partir de la eliminación de la presión por herbívoros, la vegetación puede presentar una rápida recuperación, tal es el caso de las comunidades del matorral en Isla Guadalupe, que indican una recuperación en el incremento de la abundancia-cobertura a partir de muestreos sistemáticos (GECI, datos ined.; y observaciones personales). Así, las comunidades del norte (localidades 1 y 2) presentan cambios en estructura y composición florística a partir de la erradicación del ganado caprino. Las comunidades del sur (localidades 3 y 5) mantienen una aparente uniformidad en su estructura, cobertura promedio de 59% debido a la presión de ramoneo de las cabras. En cambio, en las comunidades centrales (4), se observa un aumento en presencia y cobertura de arbustos nativos.
Las asociaciones del norte de la isla., Sphaeralcea sulphurea-Perityle incana (tabla 2), han sido referidas por Oberbauer (2006) como elementos remanentes de matorral de Artemisia y del chaparral. No obstante, 11 especies perennes (Ceanothus arboreus, C. cf. greggii var. perplexans, Perityle incana, Sphaeralcea sulphurea, Lupinus niveus, Senecio palmeri, Gambelia speciosa, Malva occidentalis, Malosma laurina y Pseudognaphalium sp.) que se encuentran colonizando y ampliando su distribución actual, se contraponen con los resultados de Meling (1985), quien refiere que en esta zona existía dominancia de herbáceas, en su mayoría anuales y la notable ausencia de arbustos nativos. Estos resultados permiten inferir que las comunidades norteñas se encuentren en una etapa de sucesión de tipo secundaria o intermedia, en la que sus elementos formaban parte de la composición y estructura original de los matorrales (Moran, 1996).
La asociación Sphaeralcea sulphurea-Lupinus niveus (tabla 3), comprende una de las más dinámicas, ya que su estructura ha mostrado cambios, particularmente aumento en la cobertura vegetal y abundancia de arbustos nativos, durante los años de muestreo (obs. pers.). Si bien S. sulphurea está presente en otras asociaciones, en esta es una especie de tipo preferencial, debido a su abundancia y mayor dominancia que en el resto de las comunidades. Esta es otra zona (también localizada al norte de la isla) que presenta evidencia de los impactos provocados por las cabras al localizarse en un área de refugio y pastoreo siendo la asociación con la menor diversidad.
Al sur de la isla Lycium californicum-Atriplex barclayana (tabla 4), es una asociación que se aproxima con una de las variantes del matorral (Atriplex-Sphaeralcea) referido por Meling (1985), mientras que Oberbauer (2006) menciona que es una de las comunidades más interesantes debido a su composición florística dada por una mezcla de sufrutescentes y suculentas. Lo interesante de esta asociación radica en que en las localidades muestreadas (al oeste y sur de la isla), las comunidades presentan características fisionómicas, edáficas y climáticas similares; además de la presencia de líquenes sobre las rocas. Meling (1985), describe un matorral de Hemizonia (D. greeneana subsp. greeneana) y Atriplex, y que en el presente estudio corresponde a la asociación Lycium californicum-Atriplex barclayana. De igual manera, Oberbauer (2006) reconoce a esta comunidad como parte del matorral de la Mesa de Guadalupe y del matorral de islotes, existiendo ahí grandes áreas en donde la vegetación parece intacta.
En el centro de la isla, la asociación de Sphaeralcea palmeri- Sphaeralcea sulphurea permite inferir que el género Sphaeralcea (con sus dos especies) están ampliando su distribución. De acuerdo a Oberbauer (2006), aparentemente esta comunidad estaba representada, antes de la introducción de la cabra asilvestrada, por un bosque de Juniperus californica mezclado con matorral de Artemisia, siendo estas las comunidades las más modificadas. Por otro lado, Meling (1985) refiere que esta comunidad presentaba una composición florística y una estructura dominada de pastos y herbáceas y una notable ausencia de cobertura arbustiva, lo que contrasta con la abundancia y dominancia actual, donde se cuenta con una cobertura de al menos 53.2%.
En el sur de la isla se encuentran la asociación Atriplex barclayana-Ambrosia camphorata fue anteriormente referida por Oberbauer (2006) con el nombre de matorral desértico marítimo; actualmente dominada por A. camphorata y A. barclayana, que de acuerdo con Meling (1985) constituye una variante del matorral costero que se extendía desde la porción sur hasta la parte media de la isla por el este, como un matorral de Ambrosia-Artemisia-Atriplex. Esta zona de la isla, junto con la llamada Mesa de Guadalupe, actual zona de distribución de la asociación Lycium californicum-Atriplex barclayana, son las principales áreas en donde la vegetación se considera relativamente intacta. Lo anterior se infiere con base en las observaciones de Moran (1996) y Meling (1985) quienes desde sus primeras visitas mencionan que estas comunidades por al menos 30 años no ha mostrado evidencias de reemplazo o cambios en composición florística.
Conclusiones
Se analizan por primera vez las comunidades del matorral de Isla Guadalupe identificándose a nivel de asociaciones, mismas que están relacionadas con la región Californiana mediterránea y con la zona de transición mediterránea-desértica tropical del norte de Vizcaíno.
En general, el análisis indica que hay una notable respuesta homeostática positiva del ecosistema insular a favor de la recuperación de sus comunidades vegetales originales, gracias a la erradicación de la cabra asilvestrada. Sin embargo, una de las zonas más impactadas por las cabras, es donde se encuentra ubicada la asociación Sphaeralcea palmeri-Sphaeralcea sulphurea para la cual será necesario implementar acciones de restauración activa tales, recuperación de suelos y voleo de semillas. Estas comunidades se encuentran en etapa de sucesión secundaria, por lo que es muy importante realizar monitoreo que permita evaluar la recuperación del matorral. Finalmente, los resultados del presente estudio muestran que, posterior a la eliminación de las cabras de Isla de Guadalupe, la vegetación actual está teniendo una respuesta favorable en cuanto a su abundancia composición florística y estructura original.











 nueva página del texto (beta)
nueva página del texto (beta)



