Introducción
Vanilla planifolia Jacks. ex Andrews (Orchidaceae), es una orquídea endémica de Centroamérica y el sur de México que es comercializada por su capacidad de producir vainillina (4-hidroxi-3-metoxibenzaldehído), compuesto obtenido de las vainas o cápsulas y que se ha transformado en uno de los saborizantes naturales más importantes y caros del mundo (Geetha & Shetty, 2000; Bory et al., 2008; Osorio, 2012; Salazar-Rojas et al., 2012; Gamboa-Gaitán, 2014). La vainillina se utiliza como saborizante natural en la industria alimentaria, farmacéutica y de cosméticos, entre otros (Kalimuthu et al., 2006; Sreedhar et al., 2007; Chandran & Puthur, 2009; Greule et al., 2010). Muchas tecnologías utilizadas en el cultivo de la vainilla son de carácter tradicional, lo que genera un rendimiento bajo en las cosechas, esto debido a la carencia de semillas mejoradas y a la irregularidad de la siembra. Adicionalmente, existen otros problemas asociados al cultivo de esta especie que causan pérdidas económicas, relacionados principalmente con el control de enfermedades transmitidas por el suelo, tales como la pudrición de tallos y raíces causadas por el patógeno fúngico Fusarium oxysporum (Pinaria et al., 2010). En la actualidad la utilización de la vainilla natural es poco viable debido a su alto costo, una circunstancia que debería cambiar con el fin de generar mejores condiciones sociales y productos más saludables con un mayor valor agregado.
Generalmente la vainilla es propagada por medio de esquejes, que al ser colectados de la planta madre provoca en esta un retraso en el crecimiento, el desarrollo y la producción. Además, este proceso solo puede realizarse a pequeña escala debido a la exposición que sufre la planta donadora a enfermedades (Pinaria et al., 2010). La propagación sexual de la vainilla por otra parte, tiene como principal limitante la escasa o nula capacidad de germinación de las semillas (Torres-González et al., 2011). Por estas razones, es difícil cubrir la demanda de plantas por medio de esta técnica, por lo que la micropropagación se ha presentado como una técnica que permite solventar la escasez de propágulos (George & Ravishankar, 1997, Geetha & Shetty, 2000; Giridhar et al., 2001; Kalimuthu et al., 2006; Sreedhar et al., 2007; Ramos-Castella et al., 2014).
Se han desarrollado diferentes metodologías de micropropagación para V. planifolia, muchas de estas metodologías están enfocadas a la producción de brotes y PLBs (protocorm like bodies) a partir de ápices, nodos y yemas axilares (Divakaran, et al., 2006; Kalimuthu et al., 2006; Gantait et al., 2009; Zuraida et al., 2013; de Oliveira et al., 2013; Jing et al., 2014; Ramos-Castella et al., 2014; Jadid et al., 2015, Biradar et al., 2016; Ayele et al., 2017), por medio de microestacas (Kononowicz & Jarrick, 1984; Geetha & Shetty, 2000), o bien a partir de ápices radicales (Philip & Nainar, 1988a y 1988b; Pierik, 1990, Zuraida et al., 2013); en tanto que otras metodologías han generado la inducción de callos, en general con porcentajes bajos de formación, como un medio para la reproducción clonal y obtención de plantas de esta especie (Davidonis & Knorr, 1991; Janarthanam & Seshadri, 2008; Tan et al., 2011; Palama et al., 2010).
George & Ravishankar (1997) determinaron que la combinación de medio líquido y medio sólido favorece la multiplicación de brotes en V. planifolia. En la etapa de iniciación, colocaron brotes axilares en un medio Murashige y Skoog (MS) sólido suplementado con 2 mg/L de Bencil Amino Purina (BAP) y 1 mg/L de Ácido Naftalenacético (ANA) durante 13 semanas, obteniendo un promedio de 5.7 brotes por explante. Los brotes formados se transfirieron en una segunda etapa de propagación a un medio MS líquido suplementado con 1 mg/L de BAP y 0.5 mg/L de ANA y por un periodo de 2 a 3 semanas, con lo cual se obtuvo un promedio de 7 brotes por explante, los cuales posteriormente fueron subcultivaron en medios sólidos.
El objetivo principal de esta investigación fue el desarrollo de una metodología de micropropagación eficiente, rápida y a gran escala para V. planifolia, así como inducir y generar estructuras vegetales que por sus características de totipotencia, indiferenciación y capacidad de regeneración, permitan el desarrollo e implementación de técnicas biotecnológicas modernas para el mejoramiento genético no tradicional de esta especie.
Material y métodos
Producción de raíces como material para la micropropagación de vainilla en medio líquido
Para incrementar la cantidad de raíces utilizadas en los ensayos, se colocaron microestacas con raíces provenientes de materiales in vitro en medios de cultivo líquido bajo condiciones estériles. En los siguientes subcultivos se diferenciaron las microestacas por su madurez fisiológica en “material maduro con raíz” y “brote nuevo con raíz”, esto con el propósito de determinar cuál explante genera una mayor cantidad de brotes y raíces. El material maduro con raíz corresponde a las microestacas originales, en tanto que el material llamado brote nuevo con raíz, corresponde a los brotes generados a partir de las microestacas originales. Durante los primeros tres subcultivos, se utilizó el medio de cultivo líquido que contiene las sales básicas de MS (Murashige y Skoog, 1962), suplementado con 1 mg/L de bencil aminopurina BAP (Sigma-Aldrich, St. Louis, MO, USA) y 30 g/L de sacarosa a un pH de 5.7. En el cuarto subcultivo se eliminó el regulador de crecimiento BAP con el fin de promover la producción de raíces. La etapa de propagación y formación de raíces se realizó en oscuridad y se utilizó un agitador orbital Hotech® a 1200 rpm (revoluciones por minuto), los cultivos se incubaron a 25 ± 1 °C.
Las variables evaluadas fueron el número de brotes mayores a 3 cm de longitud obtenidos por explante (material maduro con raíz y brote nuevo con raíz). Además, se determinó el número promedio de raíces mayores a 3 cm de longitud formados en cada brote.
Efecto de la luz, consistencia del medio de cultivo y dos reguladores de crecimiento en la formación de precallos de Vanilla planifolia
Para efecto de este trabajo de investigación, el término precallo hace referencia a la formación de un abultamiento transitorio que se genera a partir de los ápices radicales de vainilla que fueron expuestos a diferentes reguladores de crecimiento durante un periodo menor a 4 semanas. Para la inducción de los precallos de vainilla, se trabajó con explantes de secciones terminales de raíz de aproximadamente 5 mm de longitud, provenientes de un sistema de propagación en medio líquido.
Las pruebas para evaluar el efecto de la luz sobre las terminales de raíz se realizaron en el cuarto de crecimiento del Laboratorio de Biotecnología de Plantas de la Escuela de Agronomía del Instituto Tecnológico de Costa Rica, el cual está bajo un fotoperiodo de 16 h luz. Como fuente de luz se emplearon lámparas de luz fluorescente con una irradiancia de 27 µmol m-2 s-1. Los tratamientos realizados en medio sólido que necesitaron de oscuridad fueron cubiertos de tal forma que no estuviesen expuestos a la luz. Por su parte, los tratamientos realizados en medio líquido bajo condiciones de oscuridad, fueron colocados en un gabinete aislado de la luz. Los cultivos se incubaron a 25 ± 1 °C y a una humedad relativa del 90% en el cuarto de crecimiento.
El efecto de la consistencia del medio de cultivo se evaluó midiendo el crecimiento de los precallos de vainilla en los medios de cultivo sólidos y líquidos. La formación de los precallos de vainilla se evaluó colocando los ápices radicales de forma invertida (geotropismo negativo) en el respectivo medio sólido, tal como se menciona en Philip & Nainar (1988a). Para la prueba en medio líquido no se toma en cuenta el efecto del geotropismo negativo de las raíces por la consistencia evidente de este medio. A los medios de cultivo sólidos se les agregó 5.7 g/L de agar-agar (J. T. Baker, Xalostoc, Edo de México, México) como gelificante y a los medios de cultivo líquidos no se les adicionó el gelificante. Las pruebas en medios líquidos se realizaron bajo agitación constante a 110 revoluciones por minuto (rpm) con la ayuda de un agitador orbital de plataforma marca Hotech®, modelo 721-2T (Hotech Instruments Corp., New Taipei City, Taiwán). El medio de cultivo basal sólido suplementado con 1 mg/L de BAP se utilizó como testigo debido a que se ha utilizado rutinariamente en el Laboratorio de Biotecnología de Plantas (Escuela de Agronomía, Instituto Tecnológico de Costa Rica, Sede San Carlos), para la inducción de PLBs (protocorm like bodies), esto de acuerdo a la metodología descrita por Philip & Nainar (1988a). A todos los medios de cultivo se les agregó 30 g/L de sacarosa y 1 g/L de caseína hidrolizada CH (Phyto Technology Laboratories, Shawnee Mission, Kansas, USA) a un pH de 5.7. Los medios de cultivo se esterilizaron en una autoclave por un periodo de 30 min.
Para obtener el precallo apropiado de vainilla en términos de su morfología y porcentaje de formación, se realizaron variantes de los tratamientos experimentales utilizando los reguladores de crecimiento BAP y 2,4-D (Sigma-Aldrich, St. Louis, Missouri, USA). Los tratamientos experimentales utilizados se indican a continuación. Tratamiento 1: medio sólido, en presencia de luz y 1 mg/L de BAP. Tratamiento 2: medio sólido, en oscuridad y 1 mg/L de BAP. Tratamiento 3: medio sólido, en presencia de luz y 0.5 mg/L de 2,4-D. Tratamiento 4: medio sólido, en oscuridad y 0.5 mg/L de 2,4-D. Tratamiento 5: medio sólido, en presencia de luz y 1 mg/L de 2,4-D. Tratamiento 6: medio sólido, en oscuridad y 1 mg/L de 2,4-D. Tratamiento 7: medio sólido, en presencia de luz y 1.5 mg/L de 2,4-D. Tratamiento 8: medio sólido, en oscuridad y 1.5 mg/L de 2,4-D. Tratamiento 9: medio líquido, en presencia de luz y 1 mg/L de BAP. Tratamiento 10: medio líquido, en oscuridad y 1 mg/L de BAP. Tratamiento 11: medio líquido, en presencia de luz y 0.5 mg/L de 2,4-D. Tratamiento 12: medio líquido, en oscuridad y 0.5 mg/L de 2,4-D. Tratamiento 13: medio líquido, en presencia de luz y 1 mg/L de 2,4-D. Tratamiento 14: medio líquido, en oscuridad y 1 mg/L de 2,4-D. Tratamiento 15: medio líquido, en presencia de luz y 1.5 mg/L de 2,4-D. Tratamiento 16: medio líquido, en oscuridad y 1.5 mg/L de 2,4-D. La unidad experimental para los tratamientos que crecieron en medio sólido consistió de frascos de cristal pequeños de 120 ml, con 5 terminales de raíz por frasco y con 8 repeticiones. En los tratamientos en medio líquido se utilizaron matraz Erlenmeyer de 125 mL, en los cuales la unidad experimental estuvo constituida por 10 terminales de raíz por Erlenmeyer, con cuatro repeticiones. El porcentaje de formación de los precallos de vainilla se determinó a las cuatro semanas cuantificando la presencia de esta estructura como resultado del cambio producido en el ápice de la raíz, con respecto al total de ápices de raíces sembradas. Estos experimentos para la inducción de precallos se repitieron al menos dos veces.
Propagación masiva de V. planifolia por medio de la inducción y crecimiento de precallos
La propagación masiva de Vanilla planifolia a partir de los precallos tipo 9 se realizó subcultivando estas estructuras vegetales conjuntamente con los brotes y plántulas generados a partir de la misma, a través de varios ciclos de multiplicación consecutivos en el medio de cultivo MS líquido suplementado con 1 mg/L BAP y 1 mg/L de caseína hidrolizada, bajo condiciones de agitación ya sea en luz como en oscuridad. Los precallos bajo condiciones de oscuridad, fueron colocados en un gabinete aislado de la luz. Debido a la capacidad observada que presentan los precallos para formar una gran cantidad de brotes (formación de PLBs), que al crecer vuelven a formar raíces, las que posteriormente vuelven a formar precallos en el mismo ciclo de cultivo en medio líquido, repitiendo esa misma secuencia durante varios ciclos consecutivos de cultivo; se realizaron varios ciclos de multiplicación consecutivos utilizando todo el material vegetal existente en el medio de cultivo, con diferentes estadios de desarrollo.
Posteriormente, para favorecer la multiplicación y regeneración de las plantas, se cambiaron las condiciones de crecimiento a un medio líquido MS sin regulador de crecimiento y con 1 g/L de caseína hidrolizada bajo condiciones de luz y agitación constante.
Los cultivos se incubaron a 25 ± 1 °C y a una humedad relativa del 90% en el cuarto de crecimiento. Los medios de cultivo líquidos se colocaron en agitación constante a 110 rpm utilizando un agitador orbital de plataforma Hotech® a 1200 rpm, modelo 721-2T (Hotech Instruments Corp., New Taipei City, Taiwán). El fotoperiodo utilizado para la condición de luz fue de 16 h y como fuente de emisión se emplearon lámparas fluorescentes con una irradiancia de 27 µmol m-2 s-1.
Formación de callos protocórmicos de V. planifolia
Como resultado de la investigación realizada, se propone el nombre de callo protocórmico para caracterizar la formación de una estructura indiferenciada que presenta una alta capacidad regenerativa y que conduce a la formación de PLBs. Como material de partida para inducir la formación de callos protocórmicos se utilizaron los precallos clasificados previamente como tipo 9, formados a los 15 y 30 d en un medio líquido MS básico suplementado con 1 mg/L de BAP (Sigma-Aldrich, St. Louis, Missouri, USA) y 1 g/L de caseína hidrolizada (Phyto Technology Laboratories, Shawnee Mission, Kansas, USA), en condiciones de oscuridad.
Para evaluar el efecto de dos reguladores de crecimiento sobre la formación de los callos protocórmicos de Vanilla planifolia, se utilizó el medio de cultivo que contiene las sales básicas MS, suplementado con 30 g/L de sacarosa, 1 g/L de caseína hidrolizada (Phyto Technology Laboratories, Shawnee Mission, Kansas, USA) y diferentes concentraciones de los reguladores de crecimiento BAP (Sigma-Aldrich, St. Louis, Missouri, USA) y 2,4 diclorofenoxiacético (Sigma Chemical Co., St. Louis, MO, USA), en condiciones tanto de luz como de oscuridad. El tratamiento número 1 contenía 0.5 mg/L de 2,4-D y el cultivo se realizó en presencia de luz. Tratamiento 2 medio de cultivo con 0.5 mg/L de 2,4-D en condiciones de oscuridad. Tratamiento 3 medio de cultivo con 1 mg/L de 2,4-D en presencia de luz. El tratamiento 4 contenía 1 mg/L de 2,4-D en condiciones de oscuridad. Tratamiento 5, medio de cultivo con 1.5 mg/L de 2,4-D en presencia de luz. Tratamiento 6, medio de cultivo con 1.5 mg/L de 2,4-D en oscuridad. Tratamiento 7, medio de cultivo con 3 mg/L de 2,4-D en presencia de luz. Tratamiento 8, medio de cultivo con 3 mg/L de 2,4-D en oscuridad. Tratamiento 9, medio de cultivo con 1 mg/L de BAP en condiciones de oscuridad. Los medios de cultivo fueron ajustados a un pH de 5.7. Como agente gelificante se utilizó 5.7 g/L de agar-agar (J. T. Baker, Xalostoc, Edo de México, México). Los ápices radicales utilizados como explantes en los tratamientos con luz, crecieron en un cuarto de crecimiento el cual tenía un fotoperiodo de 16 h luz. Como fuente de luz se emplearon lámparas de luz fluorescente con una irradiancia de 27 µmol m-2 s-1. Los tratamientos que necesitaron de oscuridad fueron cubiertos de tal forma que no estuvieran expuestos a la luz. Los cultivos crecieron en el cuarto de crecimiento a 25 ± 1 °C y una humedad relativa del 90%.
Adicionalmente, para evaluar el desarrollo y persistencia en el tiempo de los callos protocórmicos de vainilla, los precallos tipo 9 formados en los pretratamientos previos de 15 y 30 d, se subcultivaron cada cuatro semanas en los medios de cultivo correspondientes a cada uno de los tratamientos evaluados. Se realizaron dos evaluaciones para determinar la formación y crecimiento de los callos protocórmicos a partir de los explantes utilizados, una a las 8 semanas y otra a las 16 semanas. Las variables evaluadas fueron el porcentaje de formación del callo protocórmico y el volumen final de cada callo protocórmicos. El volumen promedio de los callos en cada uno de los tratamientos experimentales se determinó sumergiendo cada callo en una probeta volumétrica graduada a un volumen conocido. Posteriormente, se saca el callo de la probeta y se calcula la diferencia de volumen, promediando el volumen de los 15 callos tomados como muestra para cada uno de los tratamientos. La unidad experimental para el pretratamiento de 15 d estaba constituida de 5 ápices radicales por cada frasco de vidrio pequeño y seis repeticiones. Para los pretratamientos de 30 d la unidad experimental estaba formada también por cinco ápices radicales por cada frasco de vidrio pequeño utilizado con cinco repeticiones.
El modelo estadístico  , con un diseño factorial 22 aleatorizado, en donde A es el efecto del factor del regulador de crecimiento, T es el efecto dado por el factor luz y oscuridad, A x T corresponde al efecto de la interacción entre los factores reguladores de crecimiento y condición de luz-oscuridad, y Ɛ es el efecto debido al error experimental. Los resultados obtenidos en los diferentes tratamientos experimentales fueron validados estadísticamente por medio de un análisis de varianza (ANOVA), seguidos de una prueba de Tukey para la comparación de medias, utilizando el paquete estadístico Minatab 17.2.1 (Minitab Inc., Pennsylvania, USA).
, con un diseño factorial 22 aleatorizado, en donde A es el efecto del factor del regulador de crecimiento, T es el efecto dado por el factor luz y oscuridad, A x T corresponde al efecto de la interacción entre los factores reguladores de crecimiento y condición de luz-oscuridad, y Ɛ es el efecto debido al error experimental. Los resultados obtenidos en los diferentes tratamientos experimentales fueron validados estadísticamente por medio de un análisis de varianza (ANOVA), seguidos de una prueba de Tukey para la comparación de medias, utilizando el paquete estadístico Minatab 17.2.1 (Minitab Inc., Pennsylvania, USA).
El fenotipo apropiado de callo protocórmico se determinó tomando en consideración características tales como la presencia de tejidos indiferenciados, tamaño, capacidad regenerativa, color y apariencia general. Tomando como base estas características fenotípicas, se determinó cual tratamiento experimental es el que genera el mayor número de callos protocórmicos con las características más adecuadas.
Regeneración y aclimatación de las plantas de vainilla propagadas in vitro
La regeneración o conversión de las plántulas de vainilla obtenidas a partir de los precallos y callos protocórmicos se realizó en frascos Erlenmeyer de 500 mL utilizando un medio de cultivo líquido MS sin reguladores de crecimiento y suplementado con 20 g/L de sacarosa y 1 g/L de caseína hidrolizada. La regeneración de las plantas de vainilla en este medio líquido se realizó en condiciones de agitación continua a 110 revoluciones por minuto (rpm) utilizando un agitador orbital Hotech® modelo 721-2T (Hotech Instruments Corp., New Taipei City, Taiwán) y en presencia de luz. También se regeneraron plántulas de vainilla utilizando los mismos componentes del medio de cultivo descrito anteriormente, pero en un sustrato gelificado en frascos de vidrio al agregar 5.7 g/L de agar-agar (J. T. Baker, Xalostoc, Estado de México, México). Como fuente de luz se emplearon lámparas de luz fluorescente con una irradiancia de 27 µmol m-2 s-1 y un fotoperiodo de 16 h. Las plántulas de vainilla regeneradas tanto en el medio líquido como en el medio de cultivo sólido crecieron en un cuarto de crecimiento con una temperatura constante de 25 ± 1°C y una humedad relativa del 90%.
La aclimatación de las plantas regeneradas bajo condiciones in vitro se realizó en un invernadero a temperatura ambiente (23.8°C y una humedad relativa de 82.75%), con periodos de aspersión de agua cada 12 h por 5 min. Para la aclimatización de las plantas de vainilla se probaron tres sustratos diferentes, fibra de coco, arena y un sustrato formulado con un 40% de tierra, 40% de abono orgánico (lombricomposta) y un 20% de materia orgánica seca (aserrín o fibra de coco). Por cada kilogramo de la mezcla preparada anteriormente, se le agregaron 200 gramos de cal granulada y la mezcla se dejó “madurar” por aproximadamente 1 semana.
Resultados y discusión
Producción de raíces como material vegetal para la micropropagación de vainilla en medio líquido
La producción de raíces se generó de forma directa a partir de las microestacas o bien mediada por la proliferación de brotes en primera instancia seguida de la formación de raíces. Al colocar las microestacas de V. planifolia provenientes de plántulas in vitro en el medio de cultivo MS suplementado con 1 mg/L BAP en oscuridad, se obtuvo una tasa de multiplicación promedio para el primer subcultivo de 2.86 brotes por explante, durante un período de crecimiento de 2 meses (fig. 1A). En esta etapa de crecimiento los brotes producidos mostraron poca altura y tenían una apariencia etiolada. De igual forma se observa un incremento en la generación de brotes por explante a los cuatro meses de 4.78 brotes por explante, para el “material maduro con raíz” (segundo subcultivo). Por el contrario, al utilizar como explantes los “brotes nuevos con raíz” se obtuvieron 3.08 brotes por explante. Así en los dos primeros subcultivos realizados se observó una respuesta positiva de los explantes en términos de producción de brotes.
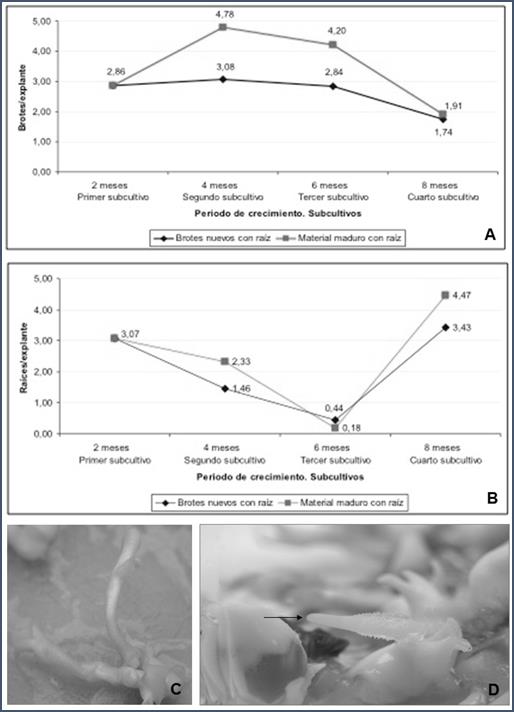
Fig. 1 Medios de cultivo para la inducción de brotes y raíces a partir de microestacas de Vanilla planifolia. (1-A). Promedio de brotes por explante obtenidos para cada subcultivo en los medios de cultivo MS líquidos. Los 3 primeros subcultivos fueron suplementados con 1 mg/L BAP, el cuarto subcultivo no contenía reguladores de crecimiento. (1-B). Promedio de raíces por explante obtenidos para cada subcultivo. El periodo de crecimiento por cada subcultivo es de 2 meses. Los 3 primeros subcultivos contenían MS líquido suplementados con 1 mg/L BAP en oscuridad, el cuarto subcultivo se realizó sin regulador de crecimiento. (1-C). Brotes formados a partir de las microestacas. (1-D). Raíces formadas a partir de los brotes inducidos y directamente de las microestacas.
Al observar los resultados del tercer subcultivo (seis meses), la cantidad de brotes por explante decae en el “material maduro con raíz” y en los “brotes nuevos con raíz” a 4.20 y 2.84 brotes por explante respectivamente (fig. 1A). Algunos autores como Mehrotra et al. (2007) han relacionado esta disminución en la formación de brotes en los materiales propagados en medios de cultivo líquido con el fenómeno de hiperhidricidad, el cual puede causar pérdidas en la multiplicación. No obstante, para el caso concreto de esta investigación, este fenómeno de hiperhidricidad no se observó de forma generalizada durante el proceso de micropropagación.
Al agrupar las microestacas de vainilla de acuerdo al origen o tipo de explante utilizado, el tipo de explante “material maduro con raíz” generó brotes directamente a partir de la microestaca original (imagen no mostrada). En tanto que el tipo de explante “brotes nuevos con raíz”, que corresponde a un brote nuevo, tiende a forma una estructura etiolada que presenta una ligera elongación de su tallo y hojas (fig. 2B).
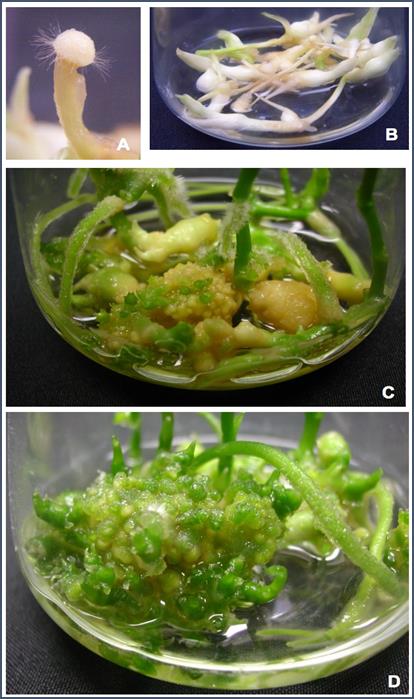
Fig. 2 Propagación masiva de vainilla en medio líquido MS suplementado con 1mg/L de BAP y 1 g/L de caseína hidrolizada. (2-A). Precallo inducido a partir de ápices radicales de V. planifolia. (2-B). Crecimiento obtenido de las microestacas con raíces después de dos meses de cultivo en condiciones de oscuridad. (2-C y 2-D). Formación y regeneración de brotes a partir de los precallos inducidos en oscuridad y posteriormente subcultivados en el mismo medio de cultivo sin reguladores de crecimiento y en presencia de luz.
Las diferencias observadas en la producción de brotes entre los dos tipos de explantes evaluados podrían estar relacionados con lo descrito por Styer & Chin (1983) quienes establecieron que el estado fisiológico de la planta donante del explante (planta madre), concretamente los requerimientos nutricionales y de reguladores de crecimiento de plantas con diferentes edades, influye significativamente en su capacidad morfogénica. Otra posible explicación para las diferencias observadas en el número de brotes generados entre los explantes, se debe a que se observaron raíces en el explante “material maduro con raíz” que presentan la formación de una estructura a la cual le hemos dado el nombre de precallo (fig. 2A). Dicha estructura se caracteriza por la presencia de un abultamiento de apariencia indiferenciada, que se genera a partir de los ápices radicales de vainilla y que posteriormente conduce a la formación de PLBs. A diferencia de la figura 1D en donde se observa el desarrollo de una raíz normal, en la figura 1C se muestra la formación de brotes en algunas raíces con precallo. En esos brotes se observa la formación de un tallo con la presencia de lo que parecen ser pelos radicales, a partir presumiblemente de la diferenciación de las raíces con precallo.
Para el cuarto subcultivo realizado a los 8 meses, se observa un descenso pronunciado en la producción de brotes para los explantes del “material maduro con raíz” y “brotes nuevos con raíz”, 1.91 y 1.74 brotes/explante respectivamente, generando así un promedio de brotes muy similar entre ambos tipos de explante (fig. 1A). Esto se debe a que en el cuarto subcultivo se decidió eliminar el regulador de crecimiento del medio de cultivo MS básico suplementado con 1 g/L de (CH), lo cual evidencia que el uso del BAP a una concentración de 1 mg/L propicia en gran medida la formación de brotes. La intención de realizar el cuarto subcultivo sin regulador de crecimiento, fue propiciar la formación de raíces en los explantes de vainilla, ya sea para los “brotes nuevos con raíz” o material “maduro con raíz”.
Geetha & Shetty (2000) reportaron la obtención de 8 a 10 brotes de vainilla por microestaca, variando la composición de los medios de cultivo utilizando 1 mg/L de BAP, durante un periodo de tres a cuatro meses, con subcultivos cada 4 semanas. También se ha informado que a partir de la utilización de nudos axilares se han obtenido un máximo de 6 brotes de vainilla por explante, en medio de cultivo básico MS sólido suplementado con 2 mg/L de ácido indol-3-acético (AIA), 0.5 mg/L de kinetina y 0.5 mg/L de BAP (Kalimuthu et al., 2006).
Trabajos como los de Philip & Nainar (1986), así como el de Philip & Padikkala (1989), reportaron que en cultivos in vitro de Vanilla planifolia se puede revertir la tendencia natural del meristemo radical para favorecer e inducir la producción de brotes. Esto ocurre probablemente debido a que el centro quiescente de los meristémos radicales cambia para formar meristemos apicales, de modo que se llegan a formar brotes múltiples. Estos autores mencionan que realizaron pruebas utilizando ápices de raíces aéreas en un medio MS líquido, suplementado con 2 mg/L de ácido indol-3-acético (AIA) y 0.2 mg/L de kinetina. A los 3 meses de cultivo, la caliptra se parte, exponiendo pequeñas protuberancias esféricas. Al repetir la prueba bajo las mismas condiciones en medio sólido, el ápice radical formó varias ramificaciones, a partir de los cuales se desarrollaron nuevos ápices, produciendo posteriormente múltiples brotes. Después de un periodo aproximado de nueve meses de cultivo, se generaron plántulas con tallos, hojas y raíces bien formados. Cada explante de raíz formó de 5 a 40 plántulas y un 94% de los explantes generaron múltiples plántulas directamente de la zona meristemática sin una interfase de callo, circunstancia que de acuerdo a los autores reduce al mínimo la posibilidad de cambios epigenéticos. En este sentido, en un estudio realizado por Sreedhar et al. (2007) utilizando técnicas de marcadores moleculares, no se encontraron variaciones somaclonales en materiales de V. planifolia propagados in vitro durante un periodo de 10 años.
En la figura 1B se muestran los resultados para la formación de raíces de las mismas microestacas de Vanilla planifolia in vitro colocadas en el medio de cultivo MS suplementado con 1 mg/L BAP en oscuridad. Se puede observar a partir de la figura 1B, que los valores promedio para el número de raíces formadas por explante disminuye paulatinamente a partir del primer, segundo y tercer subcultivo, a diferencia del cuarto subcultivo en el cuál se observa un aumento en la producción de raíces. Lo anterior se puede explicar al tener en cuenta que los tres primeros subcultivos contaban con la presencia de BAP en el medio de cultivo, lo cual ejerció una acción inhibitoria en la formación de raíces (George et al., 2008), mientras que en el cuarto subcultivo se suprimió dicho regulador de crecimiento. Al eliminar el BAP durante el cuarto subcultivo, se incrementó la cantidad de raíces para los explantes de “material maduro con raíz” y “brotes nuevos con raíz”, 4.47 y 3.43 raíces por explante respectivamente. Con los datos presentados anteriormente, al eliminar el regulador de crecimiento del sistema en el cuarto subcultivo, se logró producir una mayor cantidad de raíces. En otro estudio realizado con vainilla in vitro, la mayor cantidad de raíces por brote que obtuvieron George & Ravishankar (1997) fue de 3.6 raíces por explante, en un medio de cultivo sólido con la mitad de las sales de un MS suplementado con 2% de carbón activado. Autores como George et al. (2008) mencionan que en ocasiones más de un subcultivo en un medio libre de citoquininas puede ser necesario para que se dé la generación de raíces. No obstante, el medio y condiciones de cultivo utilizados en este estudio para la inducción de raíces en Vanilla planifolia, permitió el desarrollo de raíces largas y bien formadas. De acuerdo a las figuras 1A y 1B, el número de raíces por explante va disminuyendo paulatinamente a partir del segundo y tercer subcultivo, mientras que se incrementa el número de brotes por explante, efecto que sin embargo disminuye drásticamente en el cuarto subcutivo al eliminar el BAP. Por lo tanto, la presencia de BAP en el medio de cultivo y su eliminación tuvo un efecto inverso con respecto a la producción de brotes y a la formación de raíces.
Mehrotra et al. (2007) determinaron además que el contacto directo de los explantes con el medio de cultivo líquido, podría estimular y facilitar la absorción de nutrientes mejorando así el crecimiento de las raíces. Según lo mencionado por estos autores, el crecimiento y la tasa de multiplicación de brotes y raíces en medios líquidos se incrementa también por la aireación, debido a que el movimiento continuo del medio proporciona el suficiente suministro de oxígeno al tejido, lo cual lleva en última instancia a un crecimiento más rápido.
Efecto de la luz, consistencia del medio de cultivo y dos reguladores de crecimiento en la formación de precallos de V. planifolia
Para efectos de esta investigación, se definió como precallo a la formación de un abultamiento que se generó a partir de los ápices radicales de vainilla que estuvieron expuestos a los reguladores de crecimiento 2,4-D en distintas concentraciones (0.5 mg/L, 1 mg/L y 1.5 mg/L) y BAP (1 mg/L), tanto en medio líquido como en medio sólido y en presencia o ausencia de luz (fig. 3). Estas estructuras inducidas en presencia del regulador de crecimiento BAP son transitorias, debido a que, si los precallos formados permanecen en el mismo medio de cultivo de referencia con 1 mg/L de BAP, después del segundo subcultivo estos tienden a diferenciarse para generar una estructura de apariencia similar a los PLBs. Al modificar las condiciones de cultivo y el medio de cultivo los precallos formados pueden tomar dos vías diferentes, formar PLBs o bien callos protocórmicos, estos últimos se definirán y describirán posteriormente. Philip & Nainar (1988a) constataron que al sembrar ápices de raíz de vainilla en un medio líquido MS suplementado con 2 mg/L de AIA y 0.2 mg/L de kinetina durante un periodo de 30 días, se generó la desintegración de la caliptra y el número de células en la región del centro quiescente se incrementa considerablemente dando como resultado una estructura de aspecto semiesférico que presenta un ensanchamiento en el área del ápice.
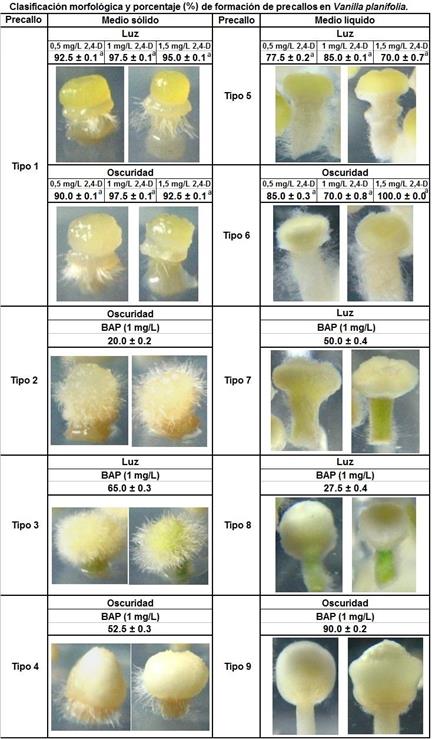
Fig. 3 Clasificación morfológica y porcentaje de formación de los diferentes tipos de precallos observados en Vanilla planifolia en función de los componentes y condiciones físicas del medio. Los valores indicados se presentan como medias ± SE (Error Estándar). Letras diferentes indican diferencias significativas entre los tratamientos evaluados dentro de cada tipo de precallo clasificado, basado en un análisis de varianza (ANOVA), seguido de una prueba de diferencias de medias (Tukey, p < 0.05).
Se observó una gran diversidad morfológica en los precallos de vainilla formados, los cuales fueron agrupados en nueve tipos diferentes con las mismas características morfológicas descriptivas (fig. 3).
Como se observa en la figura 3, se diferenciaron cuatro tipos de precallos que crecieron en el medio MS sólido. El precallo tipo 1 se formó en este medio sólido básico bajo condiciones de luz y oscuridad, suplementado con el regulador de crecimiento 2,4-D en las concentraciones de 0.5 mg/L, 1 mg/L y 1.5 mg/L. Bajo condiciones de luz el tratamiento con 1 mg/L de 2,4-D fue el que presentó el mayor porcentaje de formación con 97.5% ± 0.1, no obstante, no se observaron diferencias significativas entre estos tratamientos con p < 0.05. Con respecto a los precallos tipo 1 que se formaron en oscuridad con las distintas dosis del regulador de crecimiento 2,4-D, el mayor porcentaje de formación de esta estructura se obtuvo nuevamente en la concentración de 1 mg/L con 97.5% ±0.1, no obteniéndose diferencias significativas (p < 0.05) con respecto a los otros dos tratamientos. Este tipo de precallo presenta en forma general un abultamiento en el ápice radical con una pequeña masa traslúcida por debajo del abultamiento principal y con presencia de pelos radicales. Se considera que son pelos radicales por el origen del explante, el cual proviene de terminales de raíz de V. planifolia in vitro. Este mismo precallo tipo 1 en luz muestra una ligera coloración amarillenta y en oscuridad por lo general es ligeramente más blanquecina. El precallo tipo 2 se generó en un medio básico MS sólido con el regulador de crecimiento BAP a 1 mg/L, bajo condiciones de oscuridad con un 20% ±0.2 de formación de esta estructura. Este precallo presenta un abultamiento semiesférico irregular en el ápice radical, con una coloración blanca traslucida y con abundantes pelos radicales. El precallo tipo 3 presentó un porcentaje de formación del 65% ± 0.3, se desarrolló en el medio básico MS sólido con el regulador de crecimiento BAP a 1 mg/L y bajo condiciones de luz. El mismo se caracterizó por presentar un abultamiento semiesférico homogéneo del ápice radical con una coloración blanco-cremosa y la presencia abundante de pelos radicales. Así mismo, el precallo tipo 4 se formó en un medio MS sólido básico suplementado con el regulador de crecimiento BAP a 1 mg/L y bajo condiciones de oscuridad (52.5% ± 0.3 de formación). Esta estructura presenta un abultamiento semiesférico homogéneo del ápice radical de color blanco y con una ligera presencia de pelos radicales en la base del abultamiento.
En la figura 3 se pueden observar también cinco tipos de precallos diferentes formados en medio líquido. El precallo tipo 5 se generó utilizando un medio MS líquido básico en luz y en presencia del regulador de crecimiento 2,4-D a 0.5, 1 y 1.5 mg/L. En el medio suplementado con 1 mg/L de 2,4-D se obtuvo el mayor porcentaje de formación con un 85% ± 0.1. No obstante, este tratamiento no muestra diferencias significativas con respecto a los tratamientos a 0,5 mg/L y 1.5 mg/L de 2,4-D para la formación del precallo tipo 5, con p < 0.05. El precallo tipo 5 se caracterizó por presentar un abultamiento semiesférico aplanado compacto de coloración amarillenta sin presencia de pelos radicales, no obstante, se observa la presencia de estos últimos en la base de dicha estructura. La formación del precallo tipo 6 se presentó bajo condiciones de crecimiento en oscuridad, en el medio MS líquido básico suplementado con el regulador de crecimiento 2,4-D. El porcentaje de formación mayor se observó para la dosis de 1.5 mg/L de 2,4-D en el medio de cultivo, con un 100% ± 0. Las tres concentraciones del regulador de crecimiento 2,4-D que mostraron la formación del precallo tipo 6 no mostraron diferencias significativas en la formación de esta estructura (p < 0.05). El precallo tipo 6 se caracterizó por presentar un abultamiento aplanado irregular del ápice radical de color blanquecino y no cuenta con la presencia de pelos radicales, aunque se observaron estructuras similares a pelos radicales en la base no diferenciada de esa misma estructura. Los explantes de ápice radical que se colocaron en condiciones de luz y en un medio MS líquido básico con el regulador de crecimiento BAP a 1 mg/L, formaron un 50% ± 0.4 de precallos tipo 7. Estos precallos presentaron un abultamiento semiesférico aplanado de color blanquecino sin pelos radicales y la parte de la raíz no diferenciada se mantiene de color verde con una ligera presencia de lo que parecen ser pelos radicales. Por otra parte, se obtuvo un 27.5% ± 0.4 de formación para los precallos tipo 8, los explantes crecieron también bajo condiciones de luz en un medio de cultivo MS líquido básico suplementado con 1 mg/L del regulador de crecimiento BAP. Esta estructura se caracterizó por presentar un abultamiento semiesférico homogéneo de color blanquecino, sin la presencia de pelos radicales. La parte de la raíz original presenta una coloración verdosa con una ligera presencia de estructuras similares a pelos radicales. Por último, se obtuvo un 90% ±0.2de formación para el precallo tipo 9. Esta estructura presentó un abultamiento compacto de forma generalmente esférica, de color blanco y sin la presencia de pelos radicales. Este precallo se formó en el medio básico MS líquido suplementado con el regulador de crecimiento BAP a 1 mg/L y en condiciones de oscuridad.
Al valorar las características para el precallo tipo 9 descritas en la figura 3, se considera que este reúne las condiciones más favorables para los fines de esta investigación, dado que, al ser una estructura indiferenciada, de buen tamaño, de crecimiento homogéneo y sin la presencia de pelos radicales, el mismo podría ser un material de partida apropiado para el establecimiento de metodologías de propagación masiva de vainilla. Sin embargo, en principio cualquier precallos formado en los distintos tratamientos experimentales podría ser utilizado también como material de partida para el establecimiento de metodologías de propagación masiva de vainilla o bien para la inducción de callos.
Propagación masiva de V. planifolia por medio de la inducción y crecimiento de precallos
Aunque se obtuvieron diferentes tipos de precallos con altos porcentajes de formación en algunos de los medios de inducción utilizados, por sus características el precallo tipo 9 fue el que se utilizó para optimizar la metodología de propagación masiva de Vanilla planifolia a partir de estas estructuras vegetales (fig. 2A). La formación de raíces con precallo se presentó entre el primer y segundo subcultivo, iniciando este proceso de transformación de la raíz a precallo entre las primeras cuatro a cinco semanas. Después de varios ciclos de multiplicación consecutivos (subcultivos) de los precallos tipo 9, conjuntamente con los brotes y plántulas producidos a partir de esa misma estructura vegetal, en el medio de cultivo MS líquido suplementado con 1 mg/L BAP y 1 mg/L de caseína hidrolizada y bajo condiciones de agitación tanto en luz como en oscuridad, se obtuvo una tasa de multiplicación masiva de plantas de V. planifolia a partir de los precallos originales, lo anterior debido a la capacidad que presentan estas estructuras para formar una gran cantidad de brotes (formación de PLBs), los que posteriormente a su vez forman raíces, las cuales seguidamente vuelven a formar nuevamente precallos en el mismo ciclo de cultivo en medio líquido. Secuencia de multiplicación masiva que se repite durante varios ciclos continuos de subcultivo, al menos cuatro ciclos consecutivos de producción masiva ascendente.
Posteriormente, a partir de la formación de estas estructuras y para favorecer la multiplicación de brotes y regeneración de las plantas, se cambiaron las condiciones de crecimiento a un medio líquido MS sin regulador de crecimiento y con 1 g/L de caseína hidrolizada bajo condiciones de luz o bien de oscuridad en agitación continua. La diferencia observada en ambos casos es la formación de tejido verde fotosintético en los materiales propagados en condiciones de luz. En las figuras 2C y 2D se observa la formación progresiva de una gran cantidad brotes a partir de los precallos de V. planifolia generados a su vez a partir de las terminales de raíz.
Las plántulas obtenidas a partir de los materiales de vainilla propagados fueron cultivadas una vez más en presencia de luz en el medio de cultivo básico MS sólido y líquido sin reguladores de crecimiento y suplementado con 1 g/L de caseína hidrolizada para su posterior aclimatación. El fotoperiodo utilizado para la regeneración de las plantas fue de 16 h. Las plantas obtenidas a las 6-8 semanas a partir del precallo formado originalmente, tenían entre 7 y 10 cm de altura, con tallos de 0.41 cm de diámetro en promedio, entre 3 y 4 hojas, con raíces bien formadas (fig. 6B). Es importante resaltar que bajo las condiciones de propagación y regeneración optimizados para V. planifolia en este trabajo de investigación, el periodo de tiempo para la obtención de plántulas de un tamaño promedio de 10 cm para la aclimatación fue en total de aproximadamente 3-4 meses, lo cual redujo a la mitad el tiempo necesario para la obtención de plántulas para aclimatar, en comparación con la metodología tradicional de multiplicación por microestacas en medio sólido. Estos resultados permiten la utilización de esta metodología como un medio para la propagación masiva de plantas de V. planifolia. En esta metodología de propagación masiva mediada por la formación y regeneración de precallos, también se podrían utilizar algunos de los tipos de precallos indicados en la figura 3.
Formación de callos protocórmicos de V. planifolia
En la figura 4 se pueden observar algunas de las diferentes estructuras tipo callo formadas al colocar los precallos tipo 9 en los tratamientos indicados en las figuras 5A, 5B, 5C y 5D. Debido a que estas estructuras son indiferenciadas, presentan una alta capacidad de regeneración y se pueden mantener en este estado de desarrollo por un periodo de tiempo considerable (durante los cuatro meses de evaluación); aunado al hecho de que en condiciones de regeneración tienden a formar estructuras similares a PLBs, caracterizadas a su vez por la presencia abundante de brotes, proponemos el nombre de callo protocórmico para hacer referencia a este tipo de estructuras. Este callo protocórmico tiene una apariencia similar al callo descrito por Palama et al. (2010), quienes a pesar de haberlo obtenido por medio de una metodología diferente y utilizando semillas inmaduras de vainilla como explante, llamaron a esta estructura con un nombre similar, callo protocormo (protocorm callus). Los análisis histológicos realizados por estos autores mostraron la formación de callos embriogénicos y callos embriogénicos/organogénicos. Al respecto, no obstante, George et al. (2008) mencionan que en ocasiones el tipo de callo obtenido, así como el grado de diferenciación celular y su capacidad de regeneración a nuevas plántulas dependen del origen y la edad del tejido elegido como explante.

Fig. 4 Callos protocórmicos de Vanilla planifolia inducidos en los tratamientos con 2,4-D. Evaluación realizada a las 8 y 16 semanas de crecimiento.
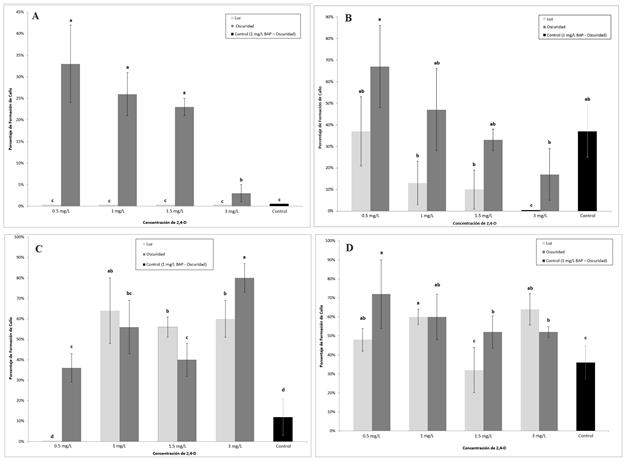
Fig. 5 Inducción de callos protocórmicos de Vanilla planifolia en los diferentes tratamientos experimentales con el regulador de crecimiento 2,4-D en medio sólido. (5-A). Callos protocórmicos de vainilla obtenidos para la prueba con un tratamiento previo de 15 días de los ápices radicales en medio líquido MS + 1 mg/L BAP y 1 g/L caseína hidrolizada en oscuridad. Periodo de evaluación a las 8 semanas de crecimiento. (5-B). Callos protocórmicos de vainilla obtenidos con un pretratamiento de 15 días de los ápices radicales en medio líquido MS + 1 mg/L BAP + 1 g/L caseína hidrolizada en oscuridad. Periodo de evaluación a las 16 semanas de crecimiento. (5-C). Callos protocórmicos de vainilla obtenidos en los diferentes tratamientos, con un tratamiento previo de 30 días de los ápices radicales en medio líquido MS + 1 mg/L BAP + 1 g/L caseína hidrolizada en oscuridad. Para el periodo de evaluación de ocho semanas de crecimiento. (5-D). Formación de callos protocórmicos de vainilla en los tratamientos experimentales para la prueba con un pretratamiento de 30 días de los ápices radicales en un medio líquido MS suplementado con 1 mg/L BAP + 1 g/L caseína hidrolizada en condiciones de oscuridad. La evaluación se realizó a las 16 semanas de crecimiento. Letras diferentes indican diferencias significativas basado en un análisis de varianza (ANOVA), seguido de una prueba de diferencias de medias (Tukey, p < 0.05).

Fig. 6 Regeneración y aclimatación en invernadero de plantas de Vanilla planifolia. (6-A). Secuencia de regeneración in vitro de plantas de V. planifolia a partir de callos protocórmicos. (6-B). Plántulas individuales regeneradas a partir de precallos y callos protocórmicos de V. planifolia. (6-C). Plantas propagadas en fase de invernadero.
Los callos formados en los tratamientos mostrados en la figura 5A-D difieren en apariencia, color, textura, grado de diferenciación y potencial morfogénico (resultados no mostrados). Lo cual es consistente con el hecho de que la inducción de estas estructuras vegetales se realizó tanto en condiciones de luz como de oscuridad en las diferentes concentraciones de 2,4-D utilizadas. Las zonas clorofílicas presentes en algunos de los callos que se formaron en presencia de luz, así como otras estructuras etioladas que presentan diferentes grados de organización, podrían constituir brotes iniciales en desarrollo durante la formación de los PLBs en la superficie de los callos, en concordancia con lo descrito en el estudio de Palama et al. (2010).
Los ápices radicales de vainilla con 15 d de pretratamiento en medio líquido MS suplementado con 1 mg/L de BAP y 1 g/L de caseína hidrolizada colocados en los tratamientos indicados en la figura 5A, mostraron diferencias significativas en la formación de callos protocórmicos con respecto al control de referencia para todos los tratamientos en oscuridad, esto a las ocho semanas de evaluación (p < 0.05). El mayor porcentaje de formación de callos protocórmicos se obtuvo en el tratamiento de 0.5 mg/L de 2,4-D (p < 0.05). Este último tratamiento fue el que mostró también a las 8 semanas el mayor volumen promedio en los callos protocórmicos formados, con 0.12 mL (p < 0.05).
Para la prueba de 15 d de pretratamiento de los ápices radicales en medio líquido MS suplementado con 1 mg/L de BAP y con 1 g/L de caseína hidrolizada, se puede observar a partir de la figura 5B que, aunque algunos de los tratamientos en oscuridad muestran un mayor porcentaje de formación de callos protocórmicos, no hay diferencias significativas con respecto al tratamiento control de referencia (p < 0.05), esto a las 16 semanas de evaluación. El mayor volumen promedio generado por estos callos protocórmicos fue de 0.25 mL para el tratamiento de 1 mg/L de BAP en oscuridad (tratamiento de referencia o control), con p<0.05. No obstante, este no formó la mayor cantidad de callos de tipo protocórmico (37%), en comparación con el tratamiento de 0.5 mg/L de 2,4-D en oscuridad con un 67% de formación.
Al evaluar el porcentaje de formación de los callos protocórmicos de vainilla a la octava semana de crecimiento (fig. 5C), esto para la prueba de 30 d de tratamiento previo de los ápices radicales en el medio líquido MS suplementado con 1 mg/L de BAP y con 1 g/L de caseína hidrolizada, todos los tratamientos evaluados a excepción del tratamiento de 0.5 mg/L de 2,4-D en luz, mostraron un mayor porcentaje de formación de callos protocórmicos con respecto al tratamiento considerado como control (1 mg/L de BAP), tanto en condiciones de luz como de oscuridad (p < 0.05). El tratamiento que presentó el mayor porcentaje de formación de callos protocórmicos fue el de 3 mg/L de 2,4-D en oscuridad, con un 80%. No obstante, el tratamiento de 1 mg/L de 2,4-D en luz, aunque presentó un porcentaje de formación de callos protocórmicos de un 64%, no tiene diferencias significativas con respecto al tratamiento de 3 mg/L de 2,4-D en oscuridad (p < 0.05). Por otra parte, cabe mencionar que en el tratamiento de 0.5 mg/L de 2,4-D en condiciones de luz no se observó la formación de callos protocórmicos (fig. 5C). El volumen promedio de los callos protocórmicos formados fue mayor para el tratamiento de referencia o control (0.43 mL, con p < 0.05). No obstante, el porcentaje de callos protocórmicos formados para este tratamiento fue de tan solo el 12%.
Los porcentajes de formación de callos protocórmicos para todos los tratamientos mostrados en la figura 5D a las 16 semanas de evaluación fueron mayores en relación con el tratamiento considerado como control, excepto para el tratamiento de 1.5 mg/L de 2,4-D en luz (p < 0.05). Todos los ápices radicales utilizados como explantes de partida fueron sometidos a un tratamiento previo de 30 d en medio MS líquido suplementado con 1 mg/L de BAP y 1 g/L de caseína hidrolizada en oscuridad. El tratamiento experimental que mostró el mayor porcentaje de formación de callos protocórmicos fue el de 0.5 mg/L de 2,4-D en condiciones de oscuridad. No obstante, de acuerdo a la prueba de Tukey para comparación de medias, ese tratamiento no difiere significativamente de los tratamientos de 0.5 mg/L de 2,4-D en luz, 1 mg/L de 2,4-D tanto en luz como en oscuridad, ni del tratamiento de 3 mg/L de 2,4-D en condiciones de luz, con p<0.05. El crecimiento de los callos protocórmicos formados para este periodo de evaluación, en términos del volumen promedio obtenido en los diferentes tratamientos utilizados, no mostró diferencias significativas al aplicar el análisis de varianza (p < 0.05). No obstante, el tratamiento que presentó el mayor volumen fue el medio suplementado con 0.5 mg/L de 2,4-D y 1 g/L de caseína hidrolizada bajo condiciones de oscuridad, con 0.57 mL.
Cabe resaltar que el pretratamiento de 30 d de los ápices radicales en un medio líquido MS suplementado con 1 mg/L BAP + 1 g/L caseína hidrolizada en condiciones de oscuridad, fue el que propició una mayor formación de callos protocórmicos. Lo anterior en comparación con el pretratamiento previo de 15 d de las terminales de raíz bajo las mismas condiciones y medio de cultivo.
A pesar de que el mayor porcentaje de formación de callos protocórmicos se observó a las 8 semanas de evaluación en el medio de cultivo básico suplementado con el regulador de crecimiento 2,4-D a 3 mg/L en oscuridad, con un 80% de formación (p < 0.05), esto para los callos formados a partir del tratamiento previo de 30 d de los ápices radicales en medio MS líquido suplementado con 1 mg/L de BAP y 1 g/L de caseína hidrolizada. A las 16 semanas de evaluación la cantidad de callos protocórmicos formados en ese mismo medio de cultivo no se mantuvo y por el contrario su presencia disminuyó hasta alcanzar un 52%, con p<0.05 (Figuras 5C y 5D). Por lo anterior, y debido a que el objetivo del ensayo fue mantener el callo protocórmico en esa condición el mayor tiempo posible, el tratamiento suplementado con 0.5 mg/L de 2,4-D bajo condiciones de crecimiento en oscuridad y 30 d de pretratamiento previo de los ápices radicales fue el que mostró el mayor porcentaje de formación de callos protocórmicos a las 16 semanas de evaluación, con un 72%, p < 0.05 (fig. 5D).
Por otra parte, al considerar los datos obtenidos para la presencia de pelos radicales en los callos protocórmicos durante las evaluaciones realizadas entre la semana 8 y la 16, se puede observar una disminución de estas estructuras al transcurrir el tiempo de cultivo, incluso no se observa la presencia de pelos radicales en la mayoría de los tratamientos avaluados a la semana 16.
A partir de los resultados obtenidos y tomando en consideración las características fenotípicas de los callos mostrados en la figura 4, se determinó que los callos protocórmicos más adecuados como material biológico de partida para realizar procesos de mejoramiento genético no tradicionales en Vanilla planifolia, son aquellos que presentan las características de crecimiento regular a mediano, con el tipo de callo indiferenciado homogéneo y compacto. Otras características como color y presencia de pelos radicales se consideraron menos relevantes, debido a que se observó que al transcurrir el tiempo de cultivo (para las evaluaciones realizadas hasta la semana 16), los callos cambian en su mayoría a un color cremoso y con una ausencia casi total de pelos radiales. En relación con este último punto, se considera que debido a que el explante proviene de las terminales radicales de vainilla, las prolongaciones observadas corresponden probablemente a pelos radicales, no obstante, es necesario realizar estudios histológicos de estas estructuras para constatar esta hipótesis.
Regeneración y aclimatación de las plantas de vainilla propagadas in vitro
Todos los precallos y callos protocórmicos colocados en el medio de regeneración formaron un gran número de plántulas en un periodo de tiempo muy corto, aproximadamente tres y cuatro meses respectivamente para plantas de 10 cm de altura (figs. 6B y 6C). La producción de brotes y subsecuentemente de PLBs se generó probablemente por medio de un proceso de organogénesis indirecta. Adicionalmente, en la figura 6A se muestra la secuencia de regeneración de plantas de V. planifolia a partir de un callo protocórmico. Aunque la aclimatación de todas las plantas de vainilla en el invernadero fue satisfactoría en todos los sustratos utilizados, los mejores resultados se obtuvieron en el sustrato formulado con un 40% de tierra, 40% de abono orgánico (lombricomposta), un 20% de materia orgánica seca (aserrín o fibra de coco) y 200 g de cal granulada por kilo de mezcla, sustrato que además mostró buenos resultados en ensayos preliminares en cuanto a campo en relación con las variables de vigor y crecimiento (fig. 6C). El 93% del total de plantas regeneradas sobrevivió al proceso de aclimatación en el invernadero antes de ser trasladadas al campo.
Conclusiones
Como resultado directo de esta investigación se desarrolló una metodología de micropropagación de vainilla a gran escala eficiente y rápida, mediada por la inducción de una estructura transitoria, totipotente e indiferenciada a la cual se le dio el nombre de precallo, con lo cual se redujo también considerablemente el tiempo para la obtención de plántulas aclimatadas. La metodología de organogénesis indirecta desarrollada permite adicionalmente la propagación masiva de V. planifolia a partir de un solo explante (ápice radical) o genotipo particular y en un periodo de tiempo muy corto en comparación con las metodologías de propagación existentes actualmente. Se redujo a tan solo tres meses en promedio el tiempo para obtener un gran número de plantas de vainilla de 10 cm, en comparación con los 7 a 8 meses que se requieren al utilizar la metodología de micropropagación en medio sólido por medio de microestacas, que produce un número limitado de plantas. Adicionalmente, la producción masiva de V. planifolia a partir de precallos permite la autopropagación continua de brotes y plántulas de forma exponencial a través de varios ciclos de multiplicación consecutivos, al menos cuatro ciclos continuos para efectos de esta investigación. Lo anterior es posible debido a la capacidad que presentan estas estructuras para formar una gran cantidad de brotes (formación de PLBs), los que a su vez forman raíces, las cuales vuelven a formar precallos en el mismo ciclo de cultivo en medio líquido.
Se determinó que el medio de cultivo MS líquido suplementado con 1 mg/L de BAP, 1 g/L de caseína hidrolizada y 30 g/L de sacarosa bajo condiciones de oscuridad con agitación constante, fue el más apropiado para la propagación masiva de V. planifolia mediada por la formación de precallos (90% ±2 de formación a partir de los ápices radicales). Correspondiendo este medio de cultivo con la formación de los precallos clasificados como tipo 9.
Por otra parte, se lograron establecer las condiciones y metodologías para la formación de una estructura indiferenciada y totipotente que presenta un alto potencial regenerativo, inducida a partir del precallo tipo 9. Esta estructura se mantuvo en este estadio de desarrollo durante los cuatro meses de evaluación y le hemos dado el nombre de callo protocómico debido a que en condiciones de regeneración forma estructuras similares a los PLBs, caracterizadas a su vez por la presencia abundante de brotes, constituyendo por lo tanto un proceso de organogénesis indirecta. El mayor porcentaje de formación de callos protocórmicos se observó en el medio de cultivo básico suplementado con el regulador de crecimiento 2,4-D a 0.5 mg/L bajo condiciones de crecimiento en oscuridad, con un 72% (p < 0.05) para el mayor periodo de evaluación (16 semanas).
Debido a las características asociadas a los callos protocórmicos formados en V. planifolia y en virtud de su alta capacidad de regeneración y aclimatación, estas estructuras ofrecen un gran potencial para ser utilizadas también como material vegetal para la propagación masiva de esta especie.
El desarrollo de metodologías de producción masiva para Vanilla planifolia Jacks. ex Andrews, eficientes y rápidas, así como la formación de estructuras vegetales con características de totipotencia, indiferenciación y alta capacidad de regeneración, podrían favorecer el desarrollo de programas enfocados el mejoramiento genético no tradicional de esta especie tropical utilizando técnicas biotecnológicas modernas.
El hecho de que la vainilla sea una planta epífita y trepadora, le permite sujetarse bien a árboles de apoyo e inclusive a cualquier tipo de superficie natural o artificial, característica que posibilita el establecimiento de cultivos de esta especie en bosques en regeneración, áreas sometidas a régimen forestal o bien en plantaciones forestales formalmente establecidas. Debido a lo anterior, la vainilla se considera un cultivo ecológico, por lo que la posibilidad de establecer cultivos comerciales en estas áreas podría convertirse en una alternativa importante, no solo por el valor comercial de la vainilla natural en el mercado, sino también por el valor agregado obtenido en áreas destinadas a la conservación y reforestación.











 nueva página del texto (beta)
nueva página del texto (beta)


