Introducción
La superficie territorial de Yucatán es de 4 337 900 ha (Sánchez y Rebollar, 1999), de las cuales: 8.58% tienen selva mediana subcaducifolia, 4.6% selva baja caducifolia, 2.95% manglar, 1.7% selva mediana subperennifolia y 0.17% duna costera; en general, más del 80% del territorio original se considera como perturbado. Las principales especies arbóreas presentes en estas áreas son: Bursera simaruba (L.) Sarg., Lysiloma latisiliquum (L.) Benth., Caesalpinia gaumeri Greenm., Gymnopodium floribundum Rolfe, Leucaena leucocephala (Lam.) de Wit. y Piscidia piscipula (L.) Sarg. (Flores & Espejel, 1994; Rzedowski, 2006; Durán & García, 2010), de las cuales no se les ha estudiado su fenología.
La distribución temporal de los eventos del ciclo de vida de las especies vegetales, es denominada como fenología. Este tipo de estudios en las especies forestales, permiten entender las relaciones entre el ambiente físico y las comunidades animales; también ayudan a planear la recolección de semillas y la reforestación con especies nativas (Newstrom et al., 1994; Brenes y D’Stefano, 2001), además de la implementación de actividades silvícolas (Vílchez et al., 2004).
Algunos autores coinciden en que los patrones temporales, vegetativos y reproductivos de las plantas, son influidos por factores bióticos, abióticos o geográficos (Rathcke y Lacey, 1985; Newstrom et al., 1994). Por ejemplo, la defoliación en Eleaeagia uxpanapensis Lorence tiene lugar cuando la temperatura incrementa (Brenes y D’Stefano, 2001), mientras que la fructificación y el renuevo de hojas en Schizolobium parahyba (Vell.) Blake aumenta durante el periodo de precipitación pluvial (Pineda-Herrera et al., 2012). Recientemente, los cambios en la fenología (por ejemplo: floración) han sido utilizados para predecir el efecto del cambio climático sobre la distribución de las especies vegetales, principalmente en las regiones templadas del planeta (Price y Waser, 1998; Gordo y Sanz, 2005). Particularmente, en la península de Yucatán, las tendencias actuales en la disminución de la precipitación (menor a 12 mm por año) y la presencia de sequías catalogadas de moderadas a severas, hacen necesario este tipo de estudios, para generar la información que sustente las estrategias de mitigación del cambio climático, en especies sustanciales para la apicultura como Gymnopodium floribundum Rolfe, actividad económica de gran importancia en esta parte del país (Márdero et al., 2012).
En las zonas templadas y en el trópico seco, la floración y la producción de frutos de numerosas especies arbóreas, se desarrolla en torno a la estación seca (Borchert et al., 2004; Mantovani et al., 2004; Ayma-Romay y Sanzetenea, 2008). Algunos autores, sugieren que la escasez de precipitación estimula la formación de estructuras florales, la defoliación y el rebrote de hojas (Aguilar, 2004; Pino y Mosquera, 2004). En contraste otros estudios revelan que, en los bosques húmedos tropicales con más de 3 000 mm de precipitación anual, los factores abióticos no son determinantes para el comportamiento fenológico (Boyle y Bronstein, 2012). Haugaasen y Peres (2005) registraron la relación negativa de temperaturas mínimas con la producción, tamaño y maduración de frutos. De igual modo, en Norte, Centro y Sudamérica, se reportan correlaciones significativas y negativas entre la precipitación con la floración, así como positivas con la fructificación (Ibarra et al., 1991; Bendix et al., 2006; Zárate et al., 2006; O’Brien et al., 2008; Solis et al., 2009), África y Asia (Van Shaick, 1986; Bollen y Donati, 2005).
G. floribundum (tzitzilché en lengua maya), con un periodo de floración de octubre a junio (Alfaro, Ortiz & González, 2010; CICY, 2017), aporta el 48% de néctar a la actividad apícola del estado de Yucatán y en conjunto con Viguiera dentata (Cav. Spreng.) suministran el 90% (Echazarreta et al., 1997). Con base en el contenido de humedad, azúcares reductores totales, sacarosa, acidez libre, hidroximetilfurfural, actividad de la diastasa, actividad de la invertasa y sólidos insolibles en agua, la miel de tzitzilché es de mejor calidad en comparación con la obtenida de otras especies vegetales (Ramírez-Cervantes et al., 2000; Moguel-Ordóñez et al., 2005). G. floribundum es un árbol que crece hasta 12 m de altura, su arquitectura se ajusta al modelo Champagnat debido a la superposición de los ejes mixtos ortótropos y a que las ramas cuelgan en forma de péndulo; presenta inflorescencias de tipo panículas racemosas, que se desarrollan en forma acrópeta y se estructuran en filotaxia helicoidal; las flores son trímeras y hermafroditas; las hojas son alternas, con forma obovada a oval-elíptica (Interián-Ku et al., 2009).
Caesalpinia gaumeri Greenm (kitimché en maya), por sus características mecánicas y de resistencia a la pudrición natural de su madera (Interián-Ku et al., 2011), se utiliza para la construcción rústica de casas estilo maya (en especial como horcones y cargueros), así como para leña y carbón (Levy-Tacher y Hernández-Xolocotzi, 1994). Presenta inflorescencias en racimos con posición axilar, de desarrollo acrópeto y filotaxia helicoidal; las flores son amarillas zigomorfas con manchas color naranja en el pétalo central y son hermafroditas; las primeras defloran y caen y sólo las apicales se transforman en fruto. El modelo arquitectónico de esta especie es el Troll, debido a que su eje principal es de crecimiento simpódico e indeterminado con ejes plagiotrópicos que se superponen de manera continua (Interián-Ku et al., 2009). Las hojas son compuestas bipinnadas y dispuestas en espiral, los foliolos son sésiles, alternos u opuestos, el periodo de floración es de marzo a mayo. Los frutos son vainas de 6 a 7 cm de largo, aplanadas de color pardo amarillento y brillante, mismos que maduran de abril a junio (Pennington y Sarukhán, 2012).
Dada la importancia para la región de estas dos especies arbóreas, el presente estudio consistió en registrar los diferentes eventos fenológicos: foliación, floración y fructificación para identificar su asociación con variables climáticas como temperatura, humedad relativa y precipitación, en una comunidad del sur del estado de Yucatán.
Material y métodos
Área de estudio
El estudio se llevó a cabo en una selva baja caducifolia, con aproximadamente 60 años de edad serial sucesional, denominada en maya nukuch k’aax, con escasa perturbación humana (árboles con más de 11 m de altura), ubicada en el predio particular “San Manuel” (20° 23’ 46’’ de latitud Norte, 89° 26’ 19’’ longitud Oeste y una altitud de 24 m s.n.m.) en el municipio de Dzan, Yucatán, a 90 km al sur de Mérida. De acuerdo con el sistema climático de Köppen modificado por García (1988; 2004), el clima en la zona es AW1(w): cálido subhúmedo con lluvias en verano y una precipitación invernal menor al 5% del total anual. La precipitación media mensual es menor de 70 mm en la estación seca (noviembre-abril) y superior a 100 mm en la lluviosa (agosto-octubre), con un valor acumulado de 1 200 mm por año. La temperatura promedio anual es de 26°C y la del mes más frío es mayor a 18°C. La humedad relativa promedio del año es de 64%. Los suelos de acuerdo a May-Acosta y Bautista (2005) y Bautista et al. (2015), en su mayoría son cambisol y leptosol, los cuales presentan de 1 a 30% de su superficie con exposición rocosa y de 0 a 23 cm de profundidad.
Unidades de muestro y selección de individuos
En el área de estudio, se establecieron de forma aleatoria seis unidades de muestreo (UM) de 10 x 20 m, de acuerdo con la metodología propuesta por White y Hood (2004), donde se identificaron y marcaron todos los individuos sanos de C. gaumeri y G. floribundum, posteriormente, se seleccionaron ocho por clase de tamaño por especie con base en la clasificación propuesta por Interián-Ku et al. (2009): brinzales (<1.5 m de altura), latizales (≥1.5 m de altura y hasta 2.5 cm de diámetro medido a 1.3 m sobre el suelo) y fustales (>2.5 cm). En total se eligieron 24 árboles por cada especie estudiada en las seis unidades de muestreo. Las dos primeras clases, se tomaron en cuenta para registrar sobre todo el porcentaje de cobertura de hojas y, con ello, determinar si son caducifolias desde estas etapas.
Registro de datos
Durante dos años (octubre 2006-septiembre 2008), se registraron bimestralmente, en porcentaje la presencia de hojas (rebrotes y maduras), floración (brotes y antesis) y fructificación (frutos maduros e inmaduros). El registro fenológico se hizo de acuerdo con la escalada sugerida por Camacho y Orozco (1998): 0 = cobertura nula, 1 = cobertura de hasta 3%, 2 = cobertura de 34 a 66%, y 3 = cobertura mayor al 66%. El porcentaje de la cobertura en la copa fue determinado con ayuda de binoculares para facilitar su observación. Posteriormente, la frecuencia de la floración se clasificó de acuerdo con la propuesta de Newstrom et al. (1994) en continua, que ocurre todo el año y sólo cesa esporádicamente; subanual, se presenta más de un ciclo por año; anual, un ciclo por año y supra anual, un ciclo en más de un año.
En el sitio de observación se colocó un termómetro de temperaturas máxima y mínima, un higrómetro de reloj para cuantificar humedad relativa y un recipiente con perímetro y profundidad conocidos para recolectar la precipitación pluvial por cada evento. Los datos de temperatura (oC) máxima y mínima del aire se registraron por las mañanas todos los días y fueron utilizados para calcular el promedio mensual. La humedad relativa (%) se registró por las mañanas (antes de las 8:00 h), tardes (13:00-14:00 h) y noches (antes de las 20:00 h) para obtener los promedios diarios y promedios mensuales. La precipitación se midió en cada evento con una probeta de plástico de dos litros y se obtuvo el volumen total mensual y anual.
Análisis de datos
Con la información registrada sobre: porcentajes de cobertura foliar, floral y de fructificación; temperatura y humedad relativa promedio mensual, así como precipitación acumulada mensual, se construyeron gráficas en la hoja de cálculo Excel, con el fin de observar las tendencias de estas variables en el tiempo. También, se realizó un análisis de varianza de dos vías y comparación de medias (Tukey α ≤ 0.05) para la variable porcentaje de cobertura foliar (con registros bimestrales por un periodo de dos años), con la finalidad de encontrar diferencias estadísticas entre clases de tamaño (primer factor), individuos (repeticiones) y mediciones en el tiempo del porcentaje de cobertura de hojas (segundo factor); previa transformación de los datos porcentuales con la fórmula arco seno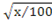 (Steel y Torrie, 1980). Además, se realizó un análisis de correlación simple entre los porcentajes, de cobertura foliar, floral y de fructificación con los datos climáticos (temperatura promedio mensual, humedad relativa promedio mensual y precipitación acumulada mensual), para identificar la asociación existente entre estas variables. Para todos los análisis estadísticos, se utilizó el paquete estadístico SAS versión 8.0 (SAS Institute, 1999).
(Steel y Torrie, 1980). Además, se realizó un análisis de correlación simple entre los porcentajes, de cobertura foliar, floral y de fructificación con los datos climáticos (temperatura promedio mensual, humedad relativa promedio mensual y precipitación acumulada mensual), para identificar la asociación existente entre estas variables. Para todos los análisis estadísticos, se utilizó el paquete estadístico SAS versión 8.0 (SAS Institute, 1999).
Resultados
La precipitación en la zona de estudio disminuyó en los meses de diciembre a mayo (91 mm) e incrementó de junio a noviembre (809 mm), con un periodo crítico de enero a mayo (62 mm), durante el cual, también se registró una disminución de la humedad relativa del aire (61%) y de la temperatura media mensual (25°C). Con respecto al comportamiento fenológico de las dos especies en estudio, se puede mencionar que, durante los periodos más húmedos, la cobertura foliar aumentó (80%) y en la época seca disminuyó (55%). La floración alcanzó valores de cobertura de 55% para G. floribumdum y 30% para C. gaumeri. En cuanto a la fructificación, solo se observó en C. gaumeri con una cobertura de 10 a 25%, en los meses de enero a abril (fig. 1).
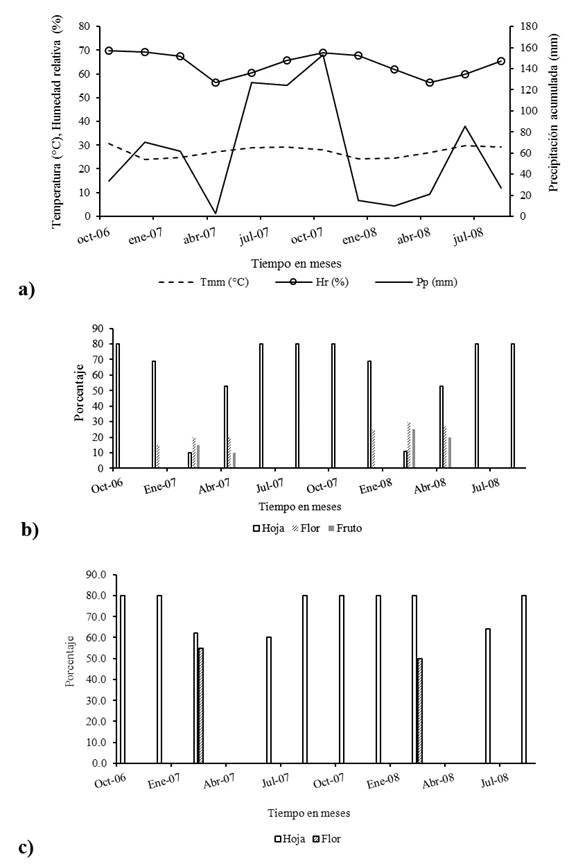
Fig. 1 a) Comportamiento de elementos climáticos y fenológicos de b) G. floribumdum y c) C. gaumeri en Dzan, Yucatán. Tmm = temperatura media mensual, Hr = humedad relativa, Pp = precipitación acumulada.
De acuerdo con el análisis de varianza, existen diferencias altamente significativas (P ≤ 0.001) para el porcentaje de cobertura foliar para las mediciones en el tiempo en ambas especies, y entre las clases de tamaño en C. gaumeri (cuadro 1).
Cuadro 1 Cuadrados medios del análisis de varianza para el porcentaje de cobertura de hojas en G. floribundum y C. gaumeri en Dzan, Yucatán.

gl = grados de libertad; ** = P ≤ 0.01; ns = no significativo.
C. gaumeri se defolia desde el mes de octubre y hasta el mes de febrero, justo cuando G. floribundum inicia esta fenofase. También es importante resaltar que entre clases de tamaño en C. gaumeri, los fustales son los primeros en defoliar seguidos por los brinzales y latizales, caso contrario con lo observado en G. floribundum. Los meses con mayor cobertura foliar (80%) fueron de mayo a noviembre (época lluviosa, 809 mm), tanto para G. floribundum como para C. gaumeri, mientras que para los meses de diciembre-abril (época seca 91 mm) disminuyó a 55%, llegando hasta 0% en el mes de enero en C. gaumeri, diferencia que se confirma con la comparación de medias (Tukey, P ≤ 0.05; fig. 2).

Fig. 2 Cobertura foliar por clases de tamaño en el tiempo. Valores con letras iguales no son estadísticamente diferentes (Tukey, P ≤ 0.05). DMSH para G. floribumdum = 11.51 y para C. gaumeri = 11.43.
Entre clases de tamaño sólo se encontraron diferencias significativas (Tukey, P ≤ 0.05) en C. gaumeri, especie en la que los latizales tuvieron el mayor porcentaje de cobertura foliar y los brinzales el menor (cuadro 2).
Cuadro 2 Valores promedio del porcentaje de cobertura foliar entre clases de tamaño en G. floribumdum y C. gaumeri en Dzan, Yucatán.
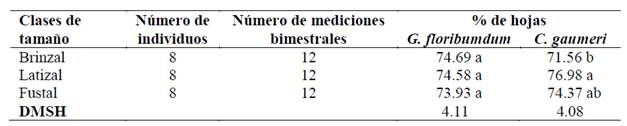
DMSH = diferencia mínima significativa honesta. Valores seguidos por letras iguales no son estadísticamente diferentes (Tukey, P > 0.05).
La floración en ambas especies fue anual (un evento por año) y alcanzó la cobertura máxima en los meses de febrero y marzo, lo que coincidió con la disminución tanto de la cobertura foliar como de la humedad relativa del ambiente y de la temperatura media mensual, tal y como se observa en la figura 1.
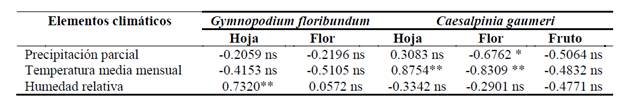
Se encontró que la cobertura foliar se correlaciona de manera positiva y altamente significativa (P ≤ 0.01) con la humedad relativa en el caso de G. floribundum, y con la temperatura media mensual para el caso de C. gaumeri. En cuanto a la cobertura floral, se encontró una correlación negativa y altamente significativa (P ≤ 0.01) con la temperatura media mensual y negativa significativa (P ≤ 0.05) con la precipitación parcial solamente en C. gaumeri (cuadro 3).
Discusión
La estacionalidad de la precipitación en la zona de estudio, se puede clasificar como modal, de acuerdo a lo sugerido por Ortiz (1987), lo cual implica una disminución en los meses de diciembre a mayo y un incremento de junio a noviembre. También se registró un periodo crítico en los meses de enero a mayo con poca precipitación (0 a 6 mm de marzo a abril) en los dos años que duró el trabajo, a la par de una diminución en la temperatura media mensual, reflejados en un decremento de la humedad relativa del aire; se observa sincronía entre la defoliación y la floración de G. floribundum y C. gaumeri con el comportamiento de los elementos climáticos del lugar, fenómeno similar a lo reportado para G. floribundum por Valdez-Hernández et al. (2010) en el norte del estado de Yucatán y para Bursera simaruba (L.) Sarg, Cochlospermum vitifolium (Willd.) Speng. y Spondias purpurea L. por Reich y Borchert (1984), en una selva tropical seca en Costa Rica.
Pennington y Sarukhán (2005) indican que la mayoría de las especies arbóreas de las selvas bajas caducifolias, pierden sus hojas totalmente por periodos de cinco a siete meses; caso contrario con lo registrado para G. floribundum y C. gaumeri para la zona de estudio, puesto que la mayor parte del tiempo (10 meses, de mayo a febrero) la cobertura foliar fue de 55% a 80%, y sólo para el caso de C. gaumeri alcanzó valores de 0% en el mes de enero. Estas diferencias se deben, principalmente, a las condiciones edáficas y climáticas tal y como fue demostrado por Simei et al. (2016) en plantaciones de Cordia dodecandra en el estado de Yucatán, puesto que, siendo una especie netamente caducifolia, los individuos que recibieron riego durante todo el año no defoliaron completamente, atribuyéndolo a las condiciones de humedad presentes en el suelo y el ambiente debido al riego.
Varios estudios indican que en lugares con baja disponibilidad de agua en el ambiente, las especies vegetales han desarrollado estrategias para mantener este vital líquido en sus tejidos y resistir la sequía, tales como: reducción del crecimiento diamétrico (Reich y Borchert, 1984), disminución de la densidad estomática, baja transpiración cuticular, presencia de tricomas reflejantes (Buttery et al., 1993; Van Rensburg et al., 1994; Acosta-Díaz et al., 2004), pérdida de hojas o reducción de sus dimensiones, cambios en la estructura interna del tejido fotosintético, cantidad y distribución del parénquima en empalizada y esponjoso (Niyogi, 2000; Larcher, 2003; Peñuelas y Munné-Bosch, 2005; Tanaka et al., 2008); mecanismos necesarios para asegurar la supervivencia de la especie en periodos desfavorables (López et al., 2005; Taiz y Zeiger, 2002). Al respecto, Interián-Ku et al. (2014), reporta para C. gaumeri en el mismo lugar de estudio, un crecimiento diamétrico hasta de 0 cm durante el periodo de sequía y un máximo de 0.7 cm en periodo lluvioso, aspectos ampliamente correlacionados. En este caso, es evidente que las dos especies en estudio, pierden parte de sus hojas, 45% para G. floribundum y hasta 100% para C. gaumeri, en la época con nula precipitación y menor humedad relativa.
Con respecto a la clasificación de la floración para ambas especies estudiadas se puede considerar como anual, puesto que el evento tiene lugar durante el periodo seco de cada año, comportamiento que coincide con lo reportado para Acacia gaumeri, Bursera simaruba, Diospyros cuneata y G. floribundum, especies que crecen en las selvas del estado de Yucatán, México (Valdez-Hernández et al., 2010), así como Ruizterania esmeraldae, Ruizterania retusa, Vochysia crassifolia, Vochysia ferruginea, Vochysia obscura, Vochysia tetraphylla y Vochysia venezuelana en Venezuela (Rodríguez y Sanoja, 2008). De acuerdo con estos últimos autores, la presencia de flores en la época seca del año, favorece la maduración de los frutos al final del período, así como la dispersión de las diásporas por el viento, además de la germinación y establecimiento de las plántulas al inicio del periodo de lluvias. Otros autores, explican que la disminución en cobertura de hojas y la aparición de flores durante la época seca, es una necesidad para atraer polinizadores o para contribuir al balance fitohormonal entre el follaje y las yemas florales; dejándose la dispersión de frutos y semillas para la época húmeda (Newstrom et al., 1994; Villasana y Suarez, 1997; Adler y Kielpinski, 2000; Vílchez et al., 2008).
A pesar de la importancia de la floración masiva, vistosa y con gran cantidad de néctar para atraer polinizadores, que de manera natural garantizan la presencia de frutos y semillas, en G. floribundum, no se encontraron frutos, lo que coincide con lo reportado por Ramírez (2014). Este comportamiento de individuos con floración sin fructificación, fue reportado por García y Di Stefano (2005) en Sideroxylon capiri (A. DC.) Pittier (Sapotaceae) y lo atribuyen a las variaciones en el fotoperiodo relacionadas con la posición de los individuos en la estructura vertical del dosel. No obstante, se han encontrado otros mecanismos que explican mejor este fenómeno, tales como los rebrotes de las raíces o tallos cercanos al árbol de mayor edad, como una adaptación de estas especies a zonas con quemas frecuentes (Nasi, Dennis, Meijaard, Applegate y Moore, 2002), como es el caso de Ulex minor (Fabaceae) reportada por Herrera (1987). Esta adaptación puede explicar el comportamiento reproductivo de G. floribundum, puesto que la práctica de la agricultura de roza-tumba-quema en la península de Yucatán, se ha realizado desde la época prehispánica, 2 500 a 800 a.C (González, 1986; Hammond, 1986; González, 2005).
El desfasamiento de la defoliación en el tiempo entre las especies estudiadas y dentro de las clases de tamaño en C. gaumeri, es explicada por la posición que ocupa cada una en el estrato vertical; G. floribundum es propio del estrato intermedio y C. gaumeri del superior. En este sentido Canham (1989) y Romo (2005) indican que los individuos propios del dosel superior crecen lentamente y cuando se encuentran en estratos inferiores, sus reacciones fenológicas suelen ser tardías, sobre todo en las especies consideradas como “maderas duras”, característica reportada para C. gaumeri por Interián-Ku et al. (2011), siendo las condiciones micro-climáticas entre el estrato vertical las que mejor explican este comportamiento. En este sentido Chenet al. (1993) y Davies-Colleyet al. (2000), refieren que el interior de un bosque es más sombrío, menos ventoso, más frío y más húmedo que el exterior tanto en zonas templadas como en zonas cálidas en diferentes latitudes del planeta. Promis et al. (2010) reportaron el mismo fenómeno para Nothofagus pumilio en Chile.
La correlación positiva encontrada entre la humedad relativa con la cobertura foliar en G. floribundum, indica que estos dos eventos están asociados, de tal manera, que en la época de mayor humedad relativa se esperaría observar la mayor cantidad de hojas y, por el contrario, en la de menor humedad relativa disminuye la presencia de hojas. En cuanto a C. gaumeri, la cobertura foliar se asocia positivamente con la temperatura media mensual y la precipitación parcial, en tanto que la cobertura floral se asoció negativamente con esta última variable climática, lo que indica que en las épocas de menor precipitación se presenta la floración; estrategia seguida por las especies vegetales, sobre todo silvestres, para atraer polinizadores y asegurar el éxito de la germinación de las semillas y establecimiento posterior de las plántulas en el periodo lluvioso, como sugieren Newstrom et al. (1994), Villasana y Suárez (1997), Adler y Kielpinski (2000) y Vílchez et al. (2008).
Conclusiones
Gimnopodium floribundum defolia y florece de manera sincrónica en la época seca anualmente, con una cobertura floral máxima en el mes de febrero. La cobertura foliar varia significa-tivamente en el tiempo, pero no entre clases de tamaño y está asociada positivamente con la humedad relativa: es mayor en los meses lluviosos y menor en la época seca. No se registró fructificación en esta especie, y dada su importancia para la actividad apícola de la región, es necesario continuar con el estudio de este caso en particular.
Caesalpinia gaumeri defolia, florece y fructifica de manera sincrónica en la época seca anualmente, con una cobertura floral máxima en los meses de febrero a marzo. La cobertura foliar entre clases de tamaño, varía significativamente en el tiempo y está asociada positivamente con la temperatura media mensual: es mayor en la época lluviosa y llega a defoliarse por completo en el mes de enero. La floración está asociada negativamente con la precipitación parcial y la temperatura media mensual. La fructificación alcanzó su máxima cobertura de enero a abril.











 nueva página del texto (beta)
nueva página del texto (beta)