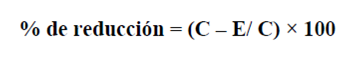Introducción
El género Bursera comprende más de 100 especies distribuidas en América tropical, desde el Sur de Estados Unidos hasta Sudamérica; el centro de diversidad del género se localiza en México en la vertiente del Pacífico (Rzedowski y Guevara 1992) con dominancia en la Cuenca del Balsas (Guízar y Sánchez, 1991) y especialmente en las selvas bajas caducifolias (Rzedowski, 1981). Las especies de Bursera son generalmente árboles o algunas veces arbustos, de hoja decidua; constituyen un elemento característico en México, donde habitan en altitudes entre 0 y 1800 m. El género se divide en dos secciones: la sección Bursera (cuajiotes), de corteza exfoliante, y la sección Bullockia (copales) de corteza no exfoliante (McVaugh y Rzedowski, 1965).
Los árboles del género Bursera producen resinas y exudados que son utilizados en ceremonias religiosas; en la medicina tradicional emplean cataplasmas para contrarrestar infecciones bacterianas y procesos inflamatorios (Abad et. al., 1996; Sosa et. al., 2002). Extractos de otras partes vegetativas de algunas especies de burseras han mostrado propiedades antiinflamatorias, antioxidantes y analgésicas (Bah et. al., 2014; Columba-Palomares et. al., 2015; Gigliarelli et.al., 2015; Parrales et. al., 2012).
El perfil químico del género incluye triterpenos (Peraza-Sánchez, et. al., 1995; Syamasundar y Mallavarapu, 1995), sesquiterpenos, lignanos y flavonoides (Becerra et. al., 1999; Souza et. al., 1989; Nakanishi et. al., 2003; Cárdenas et. al., 2012).
Los flavonoides son compuestos de naturaleza fenólica y se caracterizan por su fuerte actividad antioxidante (Pérez-Trueba, 2003), propiedad importante que se aprovecha de las plantas para proteger a los organismos de los radicales libres, los cuales tienen una función fisiológica en los mecanismos de señalización celular, la eliminación de gérmenes, entre otras acciones, pero son inestables y extremadamente reactivos, se combinan inespecíficamente en la mayoría de los casos, por lo que pueden dañar a la diversidad de moléculas integrantes de la estructura celular (Freeman y Crapo, 1982; Basaga, 1989).
Investigaciones sobre diversas fuentes de antioxidantes naturales contribuye al conocimiento y aprovechamiento razonable de las especies productoras, como es el caso de las especies del género Bursera (Hernández et. al., 2002; Bah et.al., 2014), pues poco se ha descrito sobre sus componentes fenólicos, en particular de los flavonoides.
Métodos
Material biológico
El material vegetal se recolectó en los estados de Puebla y Guerrero, México. Las hojas de cada especie se prepararon para su secado total y molienda. Ejemplares de cada una de las especies fueron herborizados y depositados en los herbarios de la Universidad Autónoma de Puebla y de la Facultad de Ciencias, UNAM, México. Se determinaron taxonómicamente con los siguientes números de vouchers: Bursera aptera (HUAP11772), Bursera aloexylon (HUAP11770), Bursera bipinnata (FCME130010), Bursera copallifera (FCME130611), Bursera grandifolia (HUAP11769), Bursera glabrifolia (HUAP11773), Bursera lancifolia (HUAP11771), Bursera longipes (HUAP11779), Bursera morelensis (HUAP11780), Bursera simaruba (HUAP11775), Bursera submoniliformis (HUAP11777), Bursera vejar-vazquezii (FCME130609) y Bursera velutina (HUAP11776).
Obtención de extractos
El material vegetal seco y molido se extrajo con una disolución de metanol-agua (80:20) (Harborne, 1988; Xu et. al. 2007). Los extractos secos se obtuvieron separando los disolventes mediante destilación a presión reducida empleando un rotavapor (Büchi R205).
Cromatografía en capa fina, derivatización y detección de flavonoides
Se empleó una placa de vidrio (10 x 20 cm) recubierta de gel de sílice (0.25 mm) con indicador de fluorescencia UV 254 nm (Macherey-Nagel, Art. núm. 809 023), la cual fue activada, calentando a 100°C durante 60 min.
Los extractos y los estándares (quercetina, rutina, naringenina, naringina, apigenina y apiin, Sigma-Aldrich), se disolvieron en metanol a la concentración de 5 mg/mL y 1 mg/mL, respectivamente, 10 μL se aplicaron con el automuestreador ATS4 (CAMAG) en bandas de 2.3 mm espaciadas por 6.8 mm.
La placa se desarrolló en una cámara (CAMAG) previamente saturada por el vapor de la fase móvil (acetato de etilo: ácido fórmico: ácido acético: agua, 100:11:11:26), con una distancia de desarrollo de 8 cm. El cromatograma se obtuvo por triplicado, uno reservado como control. Una réplica fue tratada por aspersión sucesiva de los reactivos RPN (ácido 2-amino-etil éster difenilbórico 1% m/v en metanol) y PEG (polietilenglicol 4000 a 5% m/v en metanol). La placa se visualizó a una longitud de onda de 365 nm, se observó la fluorescencia característica de flavonoides (Wagner et. al., 1996). El cromatograma se fotografió, bajo luz UV a 256nm, con una cámara digital Canon y la imagen se analizó con el software VideoScan® ver.1.02.00 (CAMAG) para cuantificar el número de manchas en cada muestra y asignar los valores de Rf. La segunda réplica se reservó para el método autobiográfico de la reducción del DPPH.
Evaluación preliminar de la capacidad antioxidante
Método espectrofotométrico
En este estudio se empleó la metodología descrita por Domínguez, et. al., (2005) con algunas modificaciones. Se realizó un ensayo de cernimiento con tres repeticiones por cada concentración (10,100 y 1000 ppm) de cada uno de los extractos, en dos eventos independientes. Se utilizó como blanco la disolución estándar de DPPH y como control positivo alfa-tocoferol.
El ensayo se realizó en placas de 96 pozos. Se colocaron 50 µL de cada extracto para tener en pozo concentraciones finales de 10, 100 y 1000 ppm. En seguida se adicionaron 150 µL de disolución etanólica de DPPH (2,2difenil-1-picril-hidrazil, Sigma-Aldrich) 133.33 µM (concentración final 100 µM). Las placas se incubaron a 37°C durante 30 minutos en la oscuridad y con agitación. Posteriormente se midió la absorbancia de cada pozo a 515 nm en un lector de microplacas marca Bio-Tek modelo ELx-808. La actividad sobre el DPPH se expresa como porcentaje de reducción y se calculó con la fórmula:
en donde
C = Absorbancia del DPPH 100 µM
E = Absorbancia de la mezcla DPPH 100 µM + muestra
Método autobiográfico (TLC-DPPH)
La segunda réplica de la cromatoplaca se derivatizó con DPPH (0.2% en metanol) mediante inmersión por 3 segundos (Kowalska et al. 2013). Se fotografió después de 30 minutos del tratamiento con DPPH, y se analizaron las imágenes con el programa de VideoScan® como se indicó antes, para comparar los Rfs de las bandas correspondientes a flavonoides previamente identificados y que mostraron actividad antioxidante.
Resultados
Las condiciones empleadas en la extracción hidroalcohólica de las hojas de las trece especies de burseras favorece la obtención de extractos ricos en compuestos fenólicos. La separación cromatográfica y posterior derivatización permitieron observar, bajo luz UV a 365 nm, un patrón de coloración indicativo de una diversidad de flavonoides en todas las especies estudiadas. Cada extracto mostró un perfil característico que indica diferencias entre las especies de acuerdo los valores de Rf (tabla 1), los cuales fueron comparados con los valores de los estándares de flavonoides (tabla 2).
Tabla 1. Valores de Rf obtenidos para cada extracto por VideoScan®. Bandas reactivas del cromatograma derivatizado con el revelador RPN-PEG (véase clave numérica en tabla 2).

Tabla 2. Flavonoides detectados en los extractos de hoja de trece especies del género Bursera por comparación con los flavonoides de referencia.
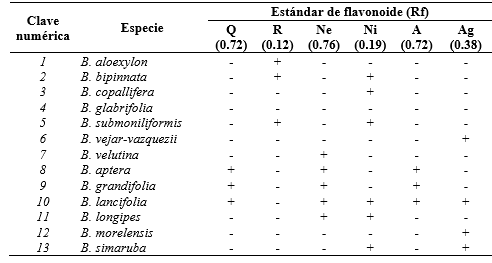
Q: quercetina (flavonol), R: rutina (glucósido de flavonol), Ne: naringenina (flavanona), Ni: naringina (glucósido de flavanona), A: apigenina (flavona) y Ag: apiin (glucósido de flavona). (+): Presente, (−): Ausente
El perfil cromatográfico correspondiente a las bandas fluorescentes de los flavonoides, concuerda con la autobiografía de la actividad antioxidante obtenida con el DPPH, siendo las bandas con Rf 0.12 y 0.72 las más reductoras, este desplazamiento corresponden a los estándares rutina y quercetina/apigenina.
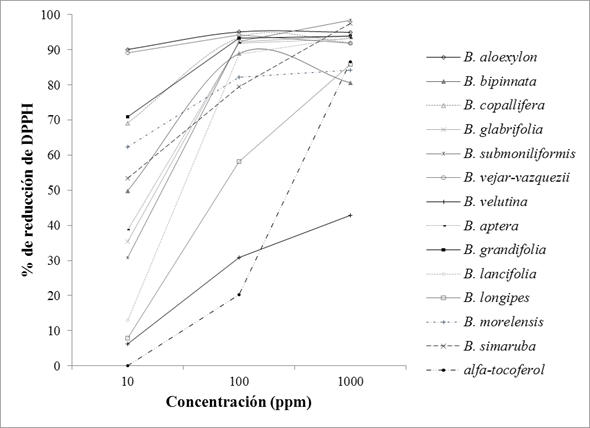
En el ensayo in vitro con tres concentraciones de cada extracto, se mostró para la mayoría de ellos una significativa captación del radical DPPH en comparación con el alfa-tocoferol. El porcentaje de reducción del DPPH aumenta conforme se incrementa la concentración de los extractos de 10 a 100 ppm, algunos siguen incrementando su acción en 1000 ppm, para otros se mantiene o disminuye ligeramente la actividad. Ordenados de mayor a menor: en la concentración de 10 ppm los extractos más activos fueron los de B. aleoxylon, B. vejar-vazquezii (sección Bullockia), B. grandifolia y B. morelensis (Sección Bursera), los cuales lograron reducir más del 50% de la concentración del DPPH; para las especies B. bipinnata, B. glabrifolia, B. submoniliformis (Sección Bursera), B. aptera, B. lancifolia y B. longipes (Sección Bursera) se requieren más de 10 ppm pero menos de 100 ppm para reducir el 50% del radical; para B. velutina (Sección Bullockia) es necesario una concentración mayor de 1000 ppm para lograr el mismo efecto (tabla 3 y fig. 1).
Tabla 3. Actividad antioxidante de los extractos hidroalcohólicos de hoja de trece especies del género Bursera.
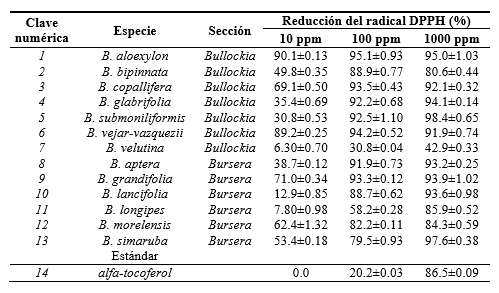
Los datos representan el promedio (± DE) de duplicados analizados individualmente por triplicado.
Discusión
La detección de flavonoides en trece especies de burseras, que se agrupan en Bursera o Bullockia (Rzedowski, 2004) contribuyó con los perfiles que caracterizan la distribución de este tipo de compuestos en las muestras recolectadas en Puebla y Guerrero. Se observó en los extractos de las hojas de estas plantas mexicanas, la presencia de rutina, preferentemente en las especies de la sección Bullockia y de quercetina, naringenina y apigenina en las especies de la sección Bursera.
Existen otros flavonoides constituyendo los extractos de estas especies analizadas, pero sólo se identificaron con estándares los ya mencionados y los resultados obtenidos indican una congruente relación con la capacidad antioxidante entre las secciones del género, pues las más activas pertenecen a Bullockia (B. aloexylon y B. vejar-vazquezii), especies que a 1a concentración de 10 ppm alcanzan el 90% de reducción del DPPH, superando la acción del alfa-tocoferol a 100 ppm.
Es conocida la riqueza de fenoles en el género, particularmente de los fenilpropanoides y flavonoides, metabolitos que se han identificado en algunas especies del género Bursera y a cuya presencia se atribuye las actividades antioxidante y antiinflamatoria (Ruiz-Terán, et.al., 2008; Parrales, et.al., 2012; Bah, et.al., 2014), pero son escasos los trabajos que muestran comparativamente la actividad antioxidante en relación con la presencia de estos compuestos fenólicos en burseras de ambas secciones. Los resultados nos invitan a averiguar más al respecto, incluyendo en el análisis algunas variables ambientales que son relevantes para la producción de estos metabolitos secundarios.
Conclusiones
Las burseras recolectadas en los estados de Puebla y Guerrero contienen flavonoides cuyo potencial de protección contra los procesos oxidativos, indica la conveniencia de la caracterización completa y cuantificación de los antioxidantes presentes en las especies más activas de este trabajo.











 nueva página del texto (beta)
nueva página del texto (beta)