Introducción
En las zonas neotropicales, las palmas son elementos conspicuos de la vegetación en términos de su riqueza, diversidad y endemismo (Henderson et al., 1995; Henderson, 2002). Esta forma de vida se caracteriza por su crecimiento particular con troncos leñosos individuales y coronas terminales, las cuales pertenecen al orden de las Arecales y la Familia Arecaceae (Dransfield et al., 2008). Las palmas son usualmente gregarias y localmente abundantes (Caballero-Nieto et al., 2001; Arroyo-Rodríguez et al., 2007), llegando a formar asociaciones vegetales distinguibles y en ocasiones definidas como un tipo de vegetación, los palmares.
Los palmares son definidos como un grupo de comunidades similares entre sí, cuya fisonomía está dominada por diversas especies de palmas, las cuales les confiere una estructura y patrones fenológicos característicos (sensu Rzedowski, 1978). Estos sistemas fueron reconocidos por Miranda y Hernández-X (1963) como uno de los 32 tipos de vegetación de México, clasificándolos en función a la forma de sus hojas, en dos tipos: las pinatífidas representados por Scheelea spp. y en abanico, como las de Sabal spp.
Existe controversia sobre el origen de los palmares; algunos autores los consideran como comunidades secundarias, derivadas de las actividades antropogénicas sobre la selva alta perennifolia, selva mediana subperennifolia, subcaducifolia y selvas secas, los cuales se forman como una fase sucesional de estos ecosistemas, en donde las palmas son favorecidas y/o mantenidas para uso humano (Challenger, 1998). Por el contrario, otros autores señalan que existen palmares, que se desarrollan de manera natural y persisten sin influencia humana (Rzedowski, 1978; Gómez-Pompa, 1980; Pennington y Sarukhán, 1998). El origen incierto de los palmares y su distribución restringida contribuyen en la confusión al momento de definirlos en estudios de vegetación, por lo cual muchas veces son referidos simplemente como “otros tipos de vegetación” o “vegetación favorecida por la perturbación”. Tales denominaciones que asumen su estado “alterado”, dificultan el desarrollo de estrategias de conservación, ya que dan por entendido que son sitios de escasa importancia en términos de diversidad vegetal y justifica fácilmente su cambio de uso de suelo.
Actualmente, en México se reportan 222 300 ha cubiertas por palmares, lo que equivale al 0.061% del total de la superficie del territorio nacional (Challenger y Soberón, 2008) y presentan tasas de cambio sumamente altas. Un análisis reciente muestra que los palmares primarios han disminuido en un 92% su cobertura (Sanchez-Colón et al., 2008), incluso los palmares referidos como “inducidos” han disminuido en un 6.2% entre 1993 a 2002, dando paso principalmente a zonas ganaderas.
Uno de los sitios donde se ha referido a los palmares como una vegetación primaria está ubicado en la planicie costera del centro de Veracruz, dentro de una franja de sitios inundables que se extienden desde el norte del río Papaloapan hasta el Puerto de Veracruz (Gómez-Pompa,1980; Penington y Sarukhán, 1998). Esta zona está conformada principalmente por tierras bajas de suelos arenosos e inundables, dominada fisonómica y estructuralmente por Sabal mexicana Mart. Estas palmas sirven frecuentemente de forofitos de árboles hemiepífitos del género Ficus, los cuales forman una asociación notable y característica en este palmar (López y Dirzo, 2007). A nivel de paisaje, la zona presenta un mosaico heterogéneo de elementos donde confluyen desde palmas y árboles aislados hasta manchones de vegetación de galería, todo esto inmerso en una matriz de pastizales ganaderos. Además se han registrado algunos sitios con remanentes de vegetación conservada, con palmas de sabal de gran talla (López y Dirzo, 2007). Una característica muy particular que presenta esta zona es la formación de manchones ó “parches de vegetación” rodeadas de pastizales, estos ¨parches” se encuentran formadas principalmente por palmas de Sabal mexicana (López y Dirzo, 2007), las cuales son comparables a los “domos” de vegetación registrados en algunas llanuras inundables dominadas por palmas en Sudamérica (Correâ et al., 2012).
A pesar de la importancia biológica de estos palmares y de que están amenazadas por las actividades humanas, existen pocos análisis exhaustivos sobre su diversidad florística. Los escasos estudios realizados han analizado el impacto del cambio de uso de suelo y ganaderización sobre algunos componentes de la diversidad vegetal (López y Dirzo, 2007), así como su potencial de regeneración (Hernández, 2010) y la eficiencia de las palmas de Sabal como forofitos de la flora epífita de la zona (Aguirre et al., 2010). En este estudio presentamos un listado de las especies leñosas más conspicuas de un palmar de Sabal mexicana, que se encuentra al sur del estado de Veracruz, así como algunas características de estructura de vegetación. Además para cada especie describimos el tipo de dispersión, su estrategia de establecimiento y su estatus de conservación con base en la NOM-059-ECOL-2010 (SEMARNAT, 2010). Esta información contribuirá directamente al conocimiento florístico de estas comunidades, así como para su revaloración como sitios de retención y conservación de diversidad vegetal en las zonas tropicales de México.
Métodología
Área de Estudio
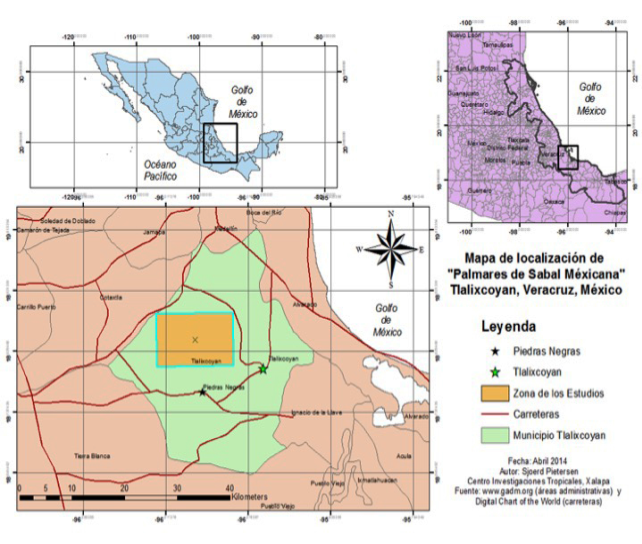
El área de estudio es un palmar ubicado en la parte central de la planicie costera del Golfo de México: 18°50'28.08" - 18°51'7.08" N, y 96°1'58.74" - 96°4'42.30" O. Se localiza aproximadamente a 16 km de la costa en dirección noreste y a 25 km en dirección suroeste del sistema de lagunas de Alvarado, dentro del municipio de Tlalixcoyan, Veracruz (18°49’ N, 96°05’ W) (fig. 1). La elevación promedio sobre el nivel del mar es de 10 m. Estos palmares están enclavados dentro de una franja que ha sido reportada como una zona de asociación primaria, la cual se extiende desde el norte del río Papaloapan hasta el Puerto de Veracruz y entre Paso del Toro y Alvarado (Pennington y Sarukhán, 1998; fig.1).
Colecta de datos
El levantamiento botánico se realizó de noviembre de 2012 a diciembre de 2013. Debido a que la estructura de los palmares está dominada por “parches de vegetación”, previamente se definieron cinco tamaños de parches, en función de su estado sucesional (Juárez, 2014): i) zonas abiertas, ii) áreas de 1-25 m2, iii) de 26-100 m2, iv) de 101-500 m2 y v) parches mayores a 500 m2. Después de un recorrido prospectivo, se seleccionaron 12 parches de cada tamaño y en cada una de ellos se estableció un cuadro de muestreo de 10 x 10 m, ubicados en parte central. En cada cuadro se registraron todas las especies leñosas mayores a 1 cm de diámetro, en el caso de las lianas se registraron solo las que enraizaron dentro del cuadro. De manera complementaria, en cada parche de vegetación se tomaron datos de altura máxima (mediante una mira estadimétrica) y cobertura de dosel mediante un densitómetro (modelo GRS). Para complementar el listado florístico se colectaron ejemplares de las plantas en fase reproductiva más conspicuos fuera de los cuadros de muestreo. Cada espécimen fue colectado y herborizado para su identificación se utilizaron claves taxonómicas especializadas y por consulta de ejemplares de herbario (XAL), así como fototipos en el herbario virtual del Missouri Botanical Garden (Tropicos.org, 2015).
Para determinar las características estructurales de la vegetación del sitio, se calculó el índice de valor de importancia relativa (IVIr), el cual resulta de la suma ponderada de los valores relativos de abundancia, frecuencia y área basal de cada especie en los 60 cuadros muestreados.
La abundancia relativa de una especie se calculó dividiendo el número de individuos de la especie entre el número total de individuos, multiplicado por 100.
La frecuencia relativa de una especie es el número de sitios en los que se encontró la especie dividido entre el total de sitios en los que se observó cada una de las especies, multiplicado por 100. El área basal de cada especie se calculó a partir de la suma del área basal de todos los individuos de la especie, dividido entre la suma del área basal de todos los individuos de todas las especies, multiplicado por 100. Así, el valor acumulado de todas las especies será de 300% (Matteucci y Colma, 1982). Finalmente, para analizar la diversidad alfa de la zona, se calculamos el índice de diversidad de Shannon (H’), así como la equidad (E ́) agrupando cada categoría de tamaños de parche.
Análisis de Datos
Como procedimiento para validar el esfuerzo de muestreo de vegetación se analizaron las curvas de acumulación de especies (muestreo sistemático), mediante los estimadores no paramétricos de Chao-1 calculados con el software EstimateS versión 9 (Chao et al., 2009; Codwell, 2013). Posteriormente se realizó el ajuste de datos al modelo de Clench E(S) = ax /1 + bx.
Este modelo asume que la probabilidad de encontrar una nueva especie aumentará (hasta un máximo) conforme más unidades de muestreo se integren y proyecta la riqueza total de un sitio (Soberón y Llorente, 1993; Chao, 2005).
Finalmente para situar el palmar de Sabal mexicana en el contexto de los patrones generales de riqueza en el Neotrópico, se realizó un ejercicio de estimación de las especies potenciales en el sitio, basada en una función lineal que predice el número de especies en relación a valores conocidos de precipitación anual (PTA) riqueza = 0.0488 (PTA)+10.2 (Gentry, 1988) donde 1302.2 mm es la precipitación para nuestra zona de estudio.
Para el contraste del índice de diversidad alfa se utilizó el procedimiento de iteración Bootstrap (Solow, 1993), con lo cual estimamos las potenciales diferencias estadísticas entre los valores de diversidad de cada tamaño de parche. Asimismo, para las variables de altura máxima, cobertura del dosel y riqueza de especies se realizaron comparaciones mediante pruebas de Kruskal-Wallis.
Resultados
Para la zona de estudio se registraron 122 especies pertenecientes a 84 géneros y 44 familias, de las cuales 111 fueron registradas mediante el muestreo y 11 mediante las colectas libres (cuadro1). Las familias mejor representadas fueron: Fabaceae (11 spp.), Moraceae (10 spp.) y Asteraceae (7 spp.), dos de ellas fueron registradas solo en el muestreo libre: Poaceae y Verbenaceae. En general, los géneros más ricos fueron: Ficus (5 spp.), Smilax (4 spp), Passiflora, Pithecellobium, Sideroxylon y Solanum (cada una con 3 spp.; cuadro 1). Las especies más abundantes fueron: Sabal mexicana, Cocoloba barbadensis, Randia armata y Pithecellobium dulce.
Cuadro 1. Listado de especies registradas en el palmar de sabal. Forma de vida: arbusto (Ar), árbol (Ab), bejuco (Bj), Herbacea (Hb); Foliación: perennilofia (P), caducifolia (C); tipo de dispersión: zoocoria (Z), anemocória (A), barocória (B); y estrategia de establecimiento: heliófila (H), humbrófila (U). Categoría de riesgo según la NOM-059-SEMARNAT-2010: A amenazada, Pr sujetas a protección especial.
| Familia | Especie | Forma de vida | Foliación | Dispersión | Estrategia de Establecimiento |
|---|---|---|---|---|---|
| Acanthaceae | Blechum brownei Juss. | Hb | P | A | H |
| Achatocarpaceae | Achatocarpus nigricans Triana | Ar | C | A | H |
| Amaranthaceae | Celosia sp. | Hb | C | A | H |
| Anacardiaceae | Tapirira mexicana Marchand | Ar | P | Z | H |
| Anonnaceae | Annona glabra L. | Ar | P | A | H |
| Apocynaceae | Forsteronia viridescens S.F. Blake | Bj | P | Z | H |
| Matelea pilosa (Benth.) Woodson | Bj | P | A | H | |
| Sarcostemma elegans Decne. | Hb | P | A | H | |
| Tabernaemontana alba Mill. | Ar | P | Z | H | |
| Thevetia peruviana K. Schum. | Ab | P | Z | H | |
| Arecaceae | Sabal mexicana Mart. | Ar | P | Z | H |
| Ageratum sp 1 | Hb | P | A | H | |
| Ageratum sp 2 | Hb | P | A | H | |
| Baccharis trinervis Pers. | Ab | P | A | H | |
| Baltimora recta L. | Hb | P | A | H | |
| Hidalgoa ternata La Llave | Bj | P | A | H | |
| Mikania cordifolia (L. f.) Willd. | Bj | P | A | H | |
| Mikania odoratissima Urb. | Ab | P | A | H | |
| Bignoniaceae | Arrabidaea sp. | Bj | P | A | H |
| Crescentia cujete L. | Ar | P | B | H | |
| Parmentiera aculeata (Kunth) Seem | Ar | P | B | H | |
| Tabebuia rosea (Bertol.) A. DC. | Ar | C | A | H | |
| Boraginaceae | Cordia alliodora (Ruiz & Pav.) Oken | Ar | P | A | H |
| Cordia stellifera I.M. Johnst | Ar | P | A | H | |
| Burseraceae | Bursera simaruba (L.) Sarg | Ar | C | Z | H |
| Cactaceae | Acanthocereus tetragonus (L.) Hummelinck | Ab | N/A | Z | H |
| Hylocereus undatus (Haw.) Britton & Rose | Epífitas | N/A | Z | H | |
| Opuntia sp. | Ab | N/A | Z | H | |
| Capparaceae | Capparis acutifolia Sweet. | Ab | C | A | H |
| Celastraceae | Crossopetalum parviflorum (Hemsl.) Lundel | Ab | P | A | H |
| Hippocratea sp. | Bj | P | A | H | |
| Maytenus trichotomus Turcz. | Ab | P | A | H | |
| Zinowiewia sp. | Ab | P | A | H | |
| Zinowiewia tacanensis Lundell | Ab | P | A | H | |
| Connaraceae | Rourea glabra Kunth | Bj | P | A | H |
| Rourea schippii Standl. | Bj | P | A | H | |
| Convolvulaceae | Ipomoea variabilis (Schltdl. & Cham.) Choisy | Bj | C | A | H |
| Dilleniaceae | Davilla kunthii A. St.-Hil. | Bj | P | A | H |
| Tetracera volubilis L. | Bj | P | A | H | |
| Dipentodontaceae | Perrottetia sp | Ab | P | A | H |
| Ebenaceae | Diospyros verae-crucis (Standl.) Standl. | Ar | P | Z | H |
| Erythroxylaceae | Erythroxylum areolatum L. | Ab | P | A | H |
| Euphorbiaceae | Adelia barbinervis Schltdl. & Cham. | Ar | C | A | H |
| Croton suberosus Kunth | Ar | P | A | H | |
| Fabaceae | Abrus precatorius L. | Bj | C | Z | H |
| Bauhinia sp | Ar | P | A | H | |
| Calliandra grandiflora (L'Hér.) Benth. | Ab | P | A | H | |
| Dalbergia brownei (Jacq.) Schinz | Ar | P | A | H | |
| Lonchocarpus rugosus Benth. | Ar | P | A | H | |
| Piscidia piscipula(L.) Sarg. | Ar | C | A | H | |
| Pithecellobium dulce (Roxb.) Benth | Ar | P | Z | H | |
| Pithecellobium hymenaeifolium (Humb. & Bonpl. ex Willd.) Benth. | Ar | P | Z | H | |
| Pithecellobium pachypus Pittier | Ar | P | Z | H | |
| Senna sp. | Ab | P | A | H | |
| Vachellia cornigera (L.) Seigler & Ebinger | Ar | C | Z | H | |
| Vachellia pennatula (Schltdl. & Cham.) Seigler & Ebinger | Ab | C | Z | H | |
| Lauraceae | Nectandra salicifolia (Kunth) Nees | Ar | P | Z | H |
| Malvaceae | Guazuma ulmifolia Lam. | Ar | P | Z | H |
| Malvaviscus arboreus Cav. | Ab | P | Z | H | |
| Sida trisulcata Jacq. | Ab | P | A | H | |
| Meliaceae | Trichilia sp. | Ar | P | Z | H |
| Moraceae | Ficus aurea Nutt. | Ar | P | Z | H |
| Ficus lundellii Standl. | Ar | P | Z | H | |
| Ficus obtusifolia Kunth | Ar | P | Z | H | |
| Ficus pertusa L. f. | Ar | P | Z | H | |
| Ficus americana Aubl. | Ar | P | Z | H | |
| Ficus trigonata L | Ar | P | Z | H | |
| Maclura tinctoria (L.) D. Don ex Steud. | Ar | P | Z | H | |
| Pseudolmedia sp | Ar | P | Z | H | |
| Trophis mexicana (Liebm.) Bureau | Ar | P | Z | H | |
| Trophis racemosa (L.) Urb. | Ar | P | Z | H | |
| Myrtaceae | Eugenia capuli (Schltdl. & Cham.) Hook. & Arn. | Ar | P | Z | H |
| Myrciaria floribunda (H. West ex Willd.) O. Berg | Ar | P | Z | H | |
| Nyctaginaceae | Neea stenophylla Standl. | Ar | C | Z | H |
| Pisonia aculeata L. | Ar | C | A | H | |
| Ochnaceae | Ouratea lucens (Kunth) Engl. | Ar | P | A | H |
| Passifloraceae | Passiflora rubra L. | Bj | C | Z | H |
| Passiflora serratifolia L. | Bj | C | Z | H | |
| Passiflora sexflora Juss. | Bj | C | Z | H | |
| Turnera diffusa Willd. | Ab | P | A | H | |
| Polygonaceae | Coccoloba barbadensis Jacq. | Ar | P | Z | H |
| Primulaceae | Jacquinia pungens A. Gray | Ab | P | Z | H |
| Rhamnaceae | Condalia velutina I.M. Johnst. | Ab | P | A | H |
| Rubiaceae | Alibertia edulis (Rich.) A. Rich. ex DC. | Bj | P | Z | H |
| Chiococca alba (L.) Hitchc. | Bj | P | A | H | |
| Psychotria erythrocarpa Schltdl. | Ar | P | Z | H | |
| Randia armata (Sw.) DC | Ar | C | Z | H | |
| Randia monantha Benth. | Ar | P | Z | H | |
| Randia sp. | Ab | C | Z | H | |
| Rutaceae | Zanthoxylum caribaeum Lam. | Ar | C | Z | H |
| Zanthoxylum limoncello Planch. & Oerst. | Ar | C | Z | H | |
| Salicaceae | Casearia tacanensis Lundell | Ar | P | Z | H |
| Pleuranthodendron lindenii (Turcz.) Sleumer | Ar | P | Z | H | |
| Xylosma flexuosa (Kunth) Hemsl. | Ar | C | Z | H | |
| Xylosma panamensis Turcz. | Ab | C | Z | H | |
| Sapindaceae | Paullinia clavigera Schltdl. | Bj | C | A | H |
| Sapotaceae | Sideroxylon lanuginosum Michx. | Ab | P | Z | H |
| Sideroxylon palmeri (Rose) T.D. Penn. | Ab | P | Z | H | |
| Sideroxylon tenax L. | Ab | P | Z | H | |
| Smilacaceae | Smilax aristolochiaefolia Mill. | Bj | C | Z | H |
| Smilax domingensis Willd. | Bj | C | Z | H | |
| Smilax moranensis M. Martens & Galeotti | Bj | C | Z | H | |
| Smilax vanilliodora F.W. Apt | Bj | C | Z | H | |
| Solanaceae | Cestrum sp. | Ab | P | A | H |
| Solanum nigrum L. | Ab | P | Z | H | |
| Solanum rudepannum Dunal | Ab | C | Z | H | |
| Solanum tampicense Dunal | Ar | P | Z | H | |
| Thymelaeaceae | Daphnopsis americana (Mill.) J.R. Johnst. | Ar | P | A | H |
| Vitaceae | Cissus sp | Bj | P | A | H |
| Zamiaceae | Zamia furfuracea Aiton Pr | Ab | P | B | H |
| Zamia loddigesii Miq.A | Ab | P | B | H |
En cuanto al muestreo sistemático nuestra evaluación mostró un déficit del 18% para el estimador Chao-1. Los límites superiores calculados para riqueza fueron cercanos a los límites inferiores para ambas versiones del estimador Chao-1 (límite inferior = 120; límite superior = 176; promedio = 136). Por otro lado, el modelo paramétrico de Clench predice una asíntota a las 137 especies; sin embargo, a partir del cuadro 70, se espera tener un registro por cada cuatro cuadros, este comportamiento se incrementa hasta indicarnos que se necesitan hacer 100 cuadros más para encontrar tan solo una especie extra. De acuerdo con la función de Gentry (1988), el número de especies proyectado fue de 73 spp., el cual es menor al obtenido en los muestreos de la zona (111 spp.). El valor estimado es mayor que al número de especies encontradas en los tamaños de 26-100 m2 (61 spp.) y es superado por las especies registradas en los parches entre 101-500 m2 (75 spp.).
En términos de la fisonomía de los parches de vegetación, encontramos diferencias en la cobertura de dosel entre los parches de vegetación muestreados (H = 37.81; P < 0.001). En general existe una tendencia el incremento de la cobertura con el tamaño del parche. El análisis post-hoc indicó diferencia significativa entre los parches mayores a los 26 m2 contra los dos iniciales (P < 0.001). El resto de combinaciones no mostraron diferencias estadísticamente significativas. En términos de riqueza también existe la misma tendencia mostrando diferencias significativas entre etapas (H = 42.3; P < 0.001). El análisis post-hoc indicó diferencias entre los parches por arriba de los 101m2 con el resto (P < 0.001). En términos de diversidad se observa una relación positiva entre la diversidad y tamaño del parche resultado con diferencias significativas cada par de manera ascendente (Delta = -0.05, P > 0.05) (cuadro 2).
Cuadro 2. Métricas asociadas a los sitios de muestreo en función al tamaño de los parches de vegetación, entre paréntesis se muestra desviación estándar.
| Categoría de Parche | Cobertura Dosel (%) |
Riqueza (# Spp) |
Diversidad (Shannon) |
Equidad |
|---|---|---|---|---|
| Zonas abiertas | 0 (0) | 3.3 (1.4) | 2.13 | 0.8 |
| Áreas de 1-25 m2 | 33.9 (21.9) | 7.3 (3.6) | 3.14 | 0.84 |
| Áreas de 26-100 m2 | 45.7 (17) | 11.1 (3.9) | 2.93 | 0.77 |
| Áreas 101-500 m2 | 59.2 (18.4) | 19.1 (5.3) | 2.99 | 0.72 |
| Parches mayores a 500 m2 | 63.8 (16) | 19.4 (6.2) | 3.31 | 0.76 |
Al calcular los valores de importancia relativos (IVIr) encontramos que tan solo cuatro especies Sabal mexicana, Coccoloba barbadensis, Randia armata y Pithecellobium dulce constituyen el 50% del IVI total para la zona (fig. 2), siendo la primera especie el elemento más conspicuo y representando casi un tercio del IVIr total del sitio, sobre todo por su contribución en el area basal. Seguidas de estas tres especies tenemos a Vachellia cornigera, Jacquinia pungens, Opuntia sp., Xylosma flexuosa, Diospyros verae-crucis y Daphnopsis americana todas ellas de características heliofilas las cuales en conjunto suman el 13% del IVIr total. Las 20 especies con el IVIr más alto logran acumular el 80% del total, mientras que las restantes especies (91) completan el 20% restante (fig. 2).

Fig. 2. Índice de valor de Importancia Relativo (IVIr) para las especies registradas en los 60 cuadros de muestreo. Las barras apiladas muestran el valor conjunto de abundancia, frecuencia y área basal relativa.
En general, la forma de vida predominante fueron los árboles, los cuales representaron el 46% del total (51spp.), seguidos por los arbustos con el 27% (30 spp.), bejucos 21% (23 spp.) y sólo se registraron seis hierbas (fig. 3). De las especies registradas, el 88% fueron de estrategia de establecimiento heliófila, mientras que el 12% restante eran típicas umbrófilas. El 52% (58 spp.) del total tuvieron una dispersión zoócora, seguidas por las anemócoras 43% (48 spp.) y finalmente las barocoras (5% spp.) (fig. 3).
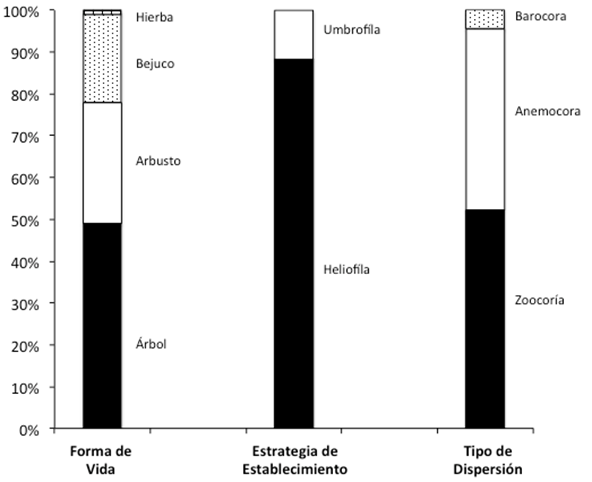
Fig. 3. Representación porcentual de forma de vida, tipo de dispersión y estrategia de establecimiento de las especies encontradas en el palmar dominado por Sabal mexicana.
Finalmente, para la zona registramos dos especies que se encuentran en NOM-059-ECOL-2010 (SEMARNAT, 2010): Zamia loddigesii en bajo la categoría de “amenazada” y Zamia furfuracea como sujeta a protección especial. Al situar el palmar de Sabal mexicana en el contexto de los patrones generales de riqueza en el Neotrópico, la predicción de la función de Gentry fue de 73 especies con DAP≥ 1cm.
Discusión
El reconocimiento de la diversidad vegetal de sitios cuyos rasgos fisonómicos no son interpretados como zonas bien conservadas o aquellos de distribución restringida, es quizás uno de los retos contemporáneos para la botánica, debido a la fuerte presión antrópica a los que están actualmente sometidos (Hobbs et al., 2009; Kareiva y Marvier, 2012). Los palmares de Sabal mexicana del sur de Veracruz resguardan una considerable diversidad vegetal (122 spp.), independiente de su origen antrópico y/o natural, lo cual es difícil de definir debido al histórico manejo en el área dirigido al aprovechamiento de Sabal mexicana.
Datos de sitios en Latinoamérica con precipitación entre 1200 y 1500 mm presentan entre 53 y 69 especies (Gentry, 1988) resalta la riqueza de los Llanos de Venezuela con un registro de 59 especies siendo un sitio inundable y dominado por palmas de Copernica tectorumpa (Gentry, 1988 Putz y Holbrook, 1989). Estos hallazgos nos señalan que a pesar de los fuertes impactos antrópicos en la zona estudiada, aún se sigue manteniendo una importante diversidad vegetal, incluso mayor de la que esperamos en función de la precipitación. Este análisis sitúa al palmar de Sabal como un sistema que obedece a los grandes patrones de riqueza vegetal en el Neotrópico predichos por Gentry, situándolo con afinidad a selvas tropicales secas y secas inundables.
La riqueza específica registrada en este estudio se encuentra en los valores promedios que registraron Trejo y Dirzo (2002) en 20 sitios de selvas secas de México (con 0.1 ha cada uno) registraron en promedio 74 especies (± 23 spp.). El registro de especies del presente estudio fue mayor en comparación con otros trabajos previos en la zona (con metodologías de muestreo similares). Por ejemplo, Hernández (2010) reportó 58 spp. (31 familias), mientras que López y Dirzo (2007) reportan 81spp. (45 familias). Estas diferencias radican en el hecho de que estos últimos autores se enfocaron en el contraste de la matriz antropizada contra las zonas conservadas, mientras que Hernández (2010) caracterizó principalmente la vegetación secundaria. Además, en el presente estudio se consideró una gran parte los elementos del paisaje, con lo que logramos registrar un mayor número de especies.
Este trabajo se presenta como un referente de la diversidad florística de la zona, debido a que los estimadores ocupados predicen un déficit en el registro de la riqueza relativamente bajo. Para el caso de la curva general, los modelos predicen alrededor de un 18% más de las especies registradas, esto se ve aún más claro en los valores de Chao 1.
No obstante, estos estimadores son extremadamente sensibles a especies que aparecen en una o dos muestras (singletons y doubletons), cuya frecuencia en nuestros registros fue alta (22 y 10 spp. respectivamente) y por lo cual se puede explicar la “carencia” de especies en el muestreo. Si bien la sensibilidad de los estimadores a especies únicas puede explicar el déficit (tanto totales como por etapa). El modelo de Clench predice que después de 4 000 cuadros de muestreo se alcanzaría una riqueza de 137 especies. Esto es logísticamente muy complicado, pero con las colectas fuera de los cuadros de muestreo se lograron registrar 122 especies, un valor cercano a predicho por todos los estimadores utilizados. Por estas razones consideramos que el listado florístico presentado por este estudio es una muestra significativa de la flora presente en la zona, que debe completarse a través de estudios con un enfoque estrictamente florístico, tomando muestreos todo el año, con relieves y condiciones contrastantes, así como considerar todos los variantes de vegetación presentes en la zona.
En este trabajo las familias mejor representadas fueron Fabaceae, Moraceae y Asteraceae. En general, estas familias son las que dominan taxonómicamente los bosques que han pasado por algún proceso de antropización como la de roza, tumba y quema (Ceccon et al., 2002; Levy et al., 2006) y sitios tropicales algún tipo de manejo (Romero-Duque et al., 2007). Algunos autores han señalado que la presencia y dominancia de la familia Fabaceae en algunos tamaños de parches de Sabal y bosque primario, puede favorecerse por su gran capacidad de reproducirse a partir de rebrotes, así como una gran capacidad de fijar nitrógeno (Godínez-Ibarra y López-Mata, 2002).
Estas características podrían ser relevantes para las fabaceas registradas en los palmares estudiados, debido a que los suelos son oligotróficos y las condiciones de establecimiento son muy estresantes (Hernández, 2010). También la presencia de esta familia puede estar influenciada por la resistencia de las semillas al fuego (Miller y Kauffman, 1998). Otro punto interesante es la predominancia de especies heliófilas con estructuras para resistir el ramoneo por el ganado y estrés hídrico, como espinas y hojas esclerófilas (e.g. Vachellia cornigera, Jacquinia pungens, Randia spp.), lo cual favorece su establecimiento y desarrollo en zonas con una alta actividad ganadera y manejo por fuego. Este patrón de regeneración contrasta con los sistemas tropicales típicos, en donde el contingente de plantas postdisturbio son típicamente pioneras de hoja ancha, lo cual se manifiesta claramente en los IVIr (fig. 2).
En términos de cobertura de dosel, se muestra un incremento que va desde 1% en las etapas iniciales, hasta un 59 y 63.8% en los espacios mayores a los 101 m2. Este aumento en la cobertura del dosel es de gran importancia, ya que permite el establecimiento de especies tolerantes a la sombra y de lento crecimiento, típicas de zonas de vegetación madura. La diversidad mostró este mismo patrón, siendo mayor en la etapa sucesional avanzada y reduciendo su valor hacia la etapa inicial. Estos resultados son comparables con los encontrados por Hernández (2010) quien reporto una diversidad mayor para el bosque primario comparado con los parches de vegetación aislados.
De las especies registradas el 59% tienen afinidad al bosque tropical seco (e.g. Jacquinia pungens, Tabebuia rosea, Erythroxylum areolatum) y alrededor del 33% de especies comparten afinidad bosque tropical húmedo (e.g. Ficus spp, Trophis spp, Pseudolmedia spp.) y el 4% son propias de zonas áridas (Acanthocereus tetragonus, Opuntia spp, Hylocereus spp.). Estas afinidades concuerdan con lo señalado por López y Dirzo (2007).
Un género que fue relevante en la zona en términos fisonómicos fue Ficus spp., del cual fueron registradas cinco especies. Este grupo ha sido frecuentemente referido como clave para los ecosistemas tropicales, por su papel como fuente de alimento para la comunidad de vertebrados (Terborgh, 1986), así como importante para los procesos de regeneración (Guevara y Laborde, 1993; Galindo-González et al., 2000). Estos árboles se establecen tomando como forofito a las palmas de Sabal mexicana y debido a su constante oferta de siconos son un fuerte atrayente de fauna dispersora (Milton et al., 1982). Esto explica parcialmente la alta presencia de plantas zoocoras, las cuales representan más del 50% de total de las especies. Estas asociaciones Sabal-Ficus, así como la presencia de Cocoloba barbadensis (otra especie zoocora) aumentan la probabilidad de llegada de semillas y detonando procesos de sucesión.
Asimismo, la zona es depositaria de dos especies de cícadas protegidas por la NOM-059-ECOL-2010 (SEMARNAT, 2010). Actualmente, la distribución natural de ambas se ha reducido dramáticamente y sus poblaciones se encuentran aisladas y con densidades bajas, en fragmentos de vegetación y zonas de acahual (Vovides y Nicolalde-Morejón 2010a, 2010b). El caso de Z. furfuracea es particularmente relevante debido a que es endémica para el estado de Veracruz, distribuyéndose en dunas costeras y palmares de la planicie costera veracruzana, entre Alvarado y Coatzacoalcos (Vovides y Nicolade-Morejon, 2010b). Esto remarca la importancia de los palmares estudiados para el mantenimiento de las poblaciones de las especies de Zamia registradas y de las especies vegetales asociadas a este tipo de vegetación.
Conclusión
Los resultados evidenciaron numerosas particularidades florísticas y ecológicas que en conjunto nos permiten identificarla como un tipo de vegetación. Entre las particularidades de la zona destacan: a) la riqueza de especies (122 especies), que es incluso mayor que la riqueza de muchas zonas tropicales secas (c.f. Trejo y Dirzo, 2002), b) la alta presencia de especies heliófilas, con adaptaciones antiforrajeo y dispersión zoocora y c) la particular dominada por Sabal mexicana, que sirve de hospedero de al menos cinco especies de Ficus hemiepífitos.
Este estudio pone en evidencia la riqueza florística que resguarda el “Palmar de Sabal”, que lo convierte en un ambiente particular y potencial escenario de investigación en botánica y ecología. Además contribuye en el estudio de ambientes comúnmente referidos como “alterados” o quizás promovidos por el hombre, lo cuales son cada vez más comunes en nuestro país, esto nos plantea nuevos retos en materia de estudio y conservación de los palmares en México.











 nueva página del texto (beta)
nueva página del texto (beta)