Introducción
La falta de información necesaria para germinar las semillas de varias especies nativas ha impedido su uso con fines de reforestación, reintroducción o restauración, a pesar de que existe el interés entre los pobladores e instituciones que tratan de obtener plantas leñosas (Martínez-Pérez et al., 2006). La difícil germinación de las semillas en especies de plantas ornamentales, como las palmas, puede retrasar la producción; se ha encontrado que la germinación de estas plantas es un proceso gradual, que puede durar largos periodos de tiempo (semanas o meses) dependiendo de la especie ( Potvin et al., 2003), la frescura de la semilla (Daquinta et al., 1996) y de la latencia fisiológica de la especie, que es causada por un mecanismo que inhibe el metabolismo del embrión impidiendo que éste se desarrolle y ocurra la germinación (Baskin et al., 1998). Para diversas especies de palmas, se ha considerado que son varios los factores que determinan, en mayor medida, su respuesta germinativa como la inmadurez del embrión, la cubierta de la semilla, las condiciones de luz así como el manejo al que se someten las semillas (Orozco-Segovia et al., 2003).
Muchas palmas no se propagan de forma vegetativa y la germinación de sus semillas es lenta y heterogénea, dando como resultado problemas en la emergencia de las plántulas (Yang et al., 2007). Por ello, se han utilizado varios métodos para aumentar el porcentaje de germinación, entre ellos la escarificación térmica (Nagao et al., 1980); deshidratación e hidratación por diferentes periodos (Rubio-Neto et al., 2012), utilización de reguladores del crecimiento (Pérez et al., 2008), escarificación y retiro de la pulpa de las semillas (Moussa et al., 1998), cultivo in vitro de embriones aislados (Tzec-Sima et al., 2006), han sido utilizados para tratar de superar los problemas causados por la latencia en algunas especies de palmas. Por otro lado, se han realizado estudios de germinación en embriones de las palmas Acrocomia aculeata (Monteiro et al., 2012); híbridos de Elaeis guineensis x E. oleifera (Angelo et al., 2011); Bactris major y Desmoncus orthacanthos (Tzec-Simá et al., 2006); Chamaedorea geonomiformis, C. nationsiana y C. pinnatifrons (Suchini, 2007).
Calyptrogyne ghiesbreghtiana (Linden & H. Wendland) es una especie catalogada en las Normas Oficiales Mexicanas NOM-059-ECOL-2001 y NOM-059-SEMARNAT-2010, como amenazada en territorio mexicano. Es una palma acaulescente o con tallo no mayor a 1 m de alto, con hojas irregularmente pinnadas con 4-12 segmentos, 35-50 cm de largo, largamente acuminadas, en ocasiones falcadas; vainas de 20-30 cm de largo; peciolo 10-40 cm de largo; raquis 60-80 cm de largo. Inflorescencia interfoliar erecta o ascendente de 1-1.5 m de largo, en espiga. Fruto ovoide, negro o púrpura en la madurez, hasta 15 mm de largo por 8 mm de diámetro; semilla ovoide, 8-10 mm de largo, 6-7 mm de diámetro. Su distribución en México fue reportada para los estados de Chiapas y Veracruz, y desde Guatemala hasta Panamá en Centroamérica (Quero, 1994).
En Tabasco se reportó la existencia de esta especie (Centurión et al., 2008), utilizada como material de construcción principalmente para el techado de casas rústicas, siendo muy apreciada por su larga durabilidad. Estos autores también reportaron que las hojas se colectan para adornar las iglesias en las festividades religiosas. Se usa además como planta de ornato en jardines interiores. Desde el punto de vista económico, las semillas se comercializan en los viveros y las plantas pequeñas tienen demanda como planta de interiores por su crecimiento definido y pequeño.
Debido a que no se cuenta con suficiente literatura disponible hasta la fecha respecto a la utilización de tratamiento químico, o alguna estrategia diferente, para tratar de optimizar la germinación en guanito de taliz (C. ghiesbreghtiana), el objetivo del presente estudio fue evaluar el efecto de algunas sustancias químicas en la germinación de sus semillas así como la aplicación de la técnica de rescate de embriones cigóticos para la reproducción de la especie.
Métodos
Las semillas de C. ghiesbreghtiana (Linden & H. Wendl.) H. Wendl. (Arecaceae), fueron recolectadas en la comunidad El Chinal ubicada a los 17°58′00′′ latitud N, 92°05′00′′ longitud W, colindante con el municipio de Teapa, Tabasco, tomando directamente las semillas con la testa de color oscuro de 20 individuos de la palma. Posteriormente, fueron trasladadas al laboratorio, cubiertas con hojas de platanillo (Heliconia latispatha Benth; Heliconiaceae) para evitar la deshidratación durante el traslado y fueron inmediatamente procesadas. Las semillas fueron seleccionadas por sus característi cas físicas de peso, longitud y diámetro central.
El pericarpio y exocarpio del fruto fueron removidos después de colocar las semillas en agua destilada por seis horas en agitación constante (100 rpm). Las semillas se desinfectaron superficialmente por inmersión en alcohol al 70% por un minuto, después se colocaron por una hora en una solución de hipoclorito de sodio al 2.5%, adicionado de Tween-20 al 0.1% (Sigma-Aldrich®) en un agitador orbital a 100 rpm por 25 minutos. Las semillas desinfectadas fueron enjuagadas tres veces con agua destilada estéril (Angelo et al., 2011). Al inicio de cada experimento se realizó una prueba de viabilidad para cada experimento, utilizando cloruro de 2,3,5- trifeniltetrazolio (TTZ) al 1% por 12 horas a una temperatura de 30°C en oscuridad, evaluando la proporción de embriones teñidos conforme a las recomendaciones de Moreno, 1984.
Germinación en semillero
Los tratamientos empleados fueron: inmersión en solución de H2O2 al 0.3% (Jiménez et al., 1996), KNO3 al 0.02% (Bradbeer, 1994), GA3 al 1% (Nagao et al., 1980) y remojo en agua destilada (Jiménez et al., 1996); cada uno de los tratamientos se aplicó por un periodo de 24 h y se incluyó como testigo del experimento semillas con epicarpio remojadas en agua por 24 h. Las semillas tratadas fueron colocadas en charolas plásticas conteniendo sustrato comercial Promix®, en condiciones de fotoperiodo natural bajo techo y aplicando riego dos veces por semana. La emergencia de la radícula se empleó como indicador de la germinación por lo que las semillas se revisaron cada tres días; el seguimiento continuó hasta que la mayoría de las semillas presentó germinación (Martínez-Pérez et al., 2006). Se utilizaron 30 semillas por tratamiento con tres repeticiones.
Germinación de semillas in vitro
Las semillas fueron desinfectadas al realizar una inmersión en una solución de NaClO al 1.5%, adicionado de Tween 20 al 0.1% por 25 minutos. Seguidamente, las semillas se lavaron con agua destilada estéril, dentro de la cámara de cultivo, y se sembraron directamente cinco semillas en cada uno de 10 frascos de vidrio con boca ancha conteniendo 20 ml de medio MS (Murashige y Skoog, 1962) adicionado de sacarosa al 3%, sin reguladores del crecimiento y solidificado con Phytagel® (2 g L-1). El pH del medio fue ajustado a 5.8 con una solución de NaOH 1N previo a la esterilización por 20 min a 120°C y 105 Kpa. Se emplearon en total 50 semillas por repetición y se realizaron tres repeticiones. Se registró la emergencia del tallo y radícula cuando alcanzaron aproximadamente 2 mm de longitud.
Germinación in vitro de embriones cigóticos
Para extraer los embriones, las semillas se desinfectaron y después se partieron cuidadosamente a la mitad con la ayuda de pinzas mecánicas, por ser el endospermo de consistencia dura. Se separó el pequeño embrión del endospermo utilizando un bisturí estéril y colocandolo directamente sobre cajas Petri conteniendo 20 ml de medio MS, adicionado de sacarosa al 3%, sin reguladores de crecimiento y solidificado con Phytagel® (2 g L-1). El pH del medio fue ajustado a 5.8 con una solución de NaOH 1N previo a la esterilización por 20 min a 120°C y 105 KPa. Los embriones se incubaron en un cuarto de crecimiento a 27°C con un fotoperiodo de 16 horas y una intensidad lumínica de 100 μmol m-2 s-1; el diseño experimental fue completamente al azar siendo cada frasco con tres embriones una unidad experimental; se realizaron 10 repeticiones por tratamiento. Se registró la emergencia del tallo y radícula cuando alcanzaron aproximadamente 2 mm de longitud.
Resultados
Las semillas presentaron características físicas variables: de 2.91 a 4.82 g, 7.62 a 9.22mm y 13.6 a 15.56 mm de peso, longitud y diámetro, respectivamente, y una viabilidad promedio de 85%. La germinación en condiciones de semillero dio inició a la cuarta semana (germinación inicial) en todos los tratamientos, observando diferentes porcentajes de germinación (cuadro 1); el tratamiento con H2O2 fue el que alcanzó el mayor porcentaje con 72%, seguido de los tratamientos con ácido giberélico y remojo en agua con 50 y 52%, respectivamente. Los valores menores fueron observados en los tratamientos de KNO3 con 41.33%, mientras que el testigo presentó una germinación de 19.81%. Se registró la emergencia cada semana, notando que después de la séptima ya no se presentaron más eventos de germinación, por lo que a este momento se le consideró como germinación final. Al concluir ésta, se encontraron diferencias significativas tanto al inicio como al final de la germinación en cada tratamiento. En el caso del tratamiento con H2O2, que al inicio alcanza el máximo porcentaje de germinación, concluye con la misma tendencia. Para el tratamiento con KNO3 se observa una respuesta inicial baja, pero que al transcurrir las semanas, concluye con valores similares a los tratamientos de GA3 y remojo en agua. Respecto al testigo, tanto al inicio como al final se observaron los valores más bajos de respuesta a germinación. Resulta importante destacar que el tratamiento con H2O2 que alcanzó valores de germinación del 84.59%, coincide con los valores observados al momento de realizar la determinación de viabilidad antes de iniciar los tratamientos.
Cuadro 1 Germinación de semillas diferentes tratamientos de Calyptrogyne ghiesbreghtiana bajo en condiciones de vivero.
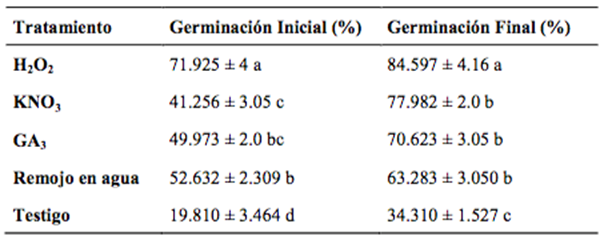
Media ± sd con la misma letra en la misma columna no presentaron diferencias significativas (p ≤ 0.01) de acuerdo a prueba de Tukey, promedio de 30 semillas con tres repeticiones.
En condiciones de germinación in vitro, los embriones aislados durante la primera y segunda semana de colecta de semillas respondieron favorablemente desde la primera semana de cultivo, iniciando al sexto día con presencia de hidratación e incremento de tamaño, a la tercera semana se presentó cambio en la coloración y emergencia de plúmula. No se presentaron problemas o pérdidas importantes por fenolización, contaminación o formación de otro tipo de tejido (fig. 1). Resulta importante destacar que, a partir de la tercera semana de haber colectado el material vegetal, disminuyó considerablemente la viabilidad que afectó directamente el porcentaje de germinación obtenido bajo condiciones de inducción de germinación in vitro (fig. 2). Después de un mes de la colecta de semillas, la viabilidad observada decreció hasta 0%, por lo que después de este periodo no se observa respuesta positiva a la germinación. Respecto a la inducción de la germinación in vitro de semillas completas, los resultados no fueron positivos pues se observó una respuesta nula.

Fig. 1 Proceso de germinación. a) Fruto completo (barra = 5 mm); b) semilla desprovista de epicarpio; c) embrión cigótico (EM) (barra = 1mm); d) germinación in vitro (barra =1 cm); e) plántulas después de dos meses de cultivo in vitro (barra = 1cm); f) germinación en vivero (barra =1cm).
Discusión
El empleo de pretratamientos con sustancias químicas, combinado con la eliminación del pericarpio para incrementar la germinación en semillas de C. ghiesbreghtiana bajo condiciones de vivero, permitió incrementar el índice de germinación respecto a semillas frescas y sin eliminar epicarpio. Al respecto, Moussa et al. (1998), al trabajar con semillas de la palma Hyphaene thebaica Mart, obtuvo diferencias significativas en los porcentajes de germinación al utilizar semillas recién colectadas intactas (2%) y semillas sin pericarpio (85%). En el mismo sentido, Pérez et al. (2008) encontraron que la remoción del endocarpio favorece la rápida germinación en semillas de Pritchardia remota (Kuntze) Beck., además de alcanzar porcentajes de éxito cercanos al 100%.
El uso de semillas frescas y recientemente colectadas para la producción de plántulas en palmas ha sido recomendado en trabajos realizados por Koebernik (1971), Nagao et al. (1980), Moussa et al. (1998) y Gomes et al. (2006). De igual forma, para lograr la inducción de la germinación in vitro, varios autores recomiendan la utilización de semillas frescas recién colectadas (Sarasan et al., 2002; Tzec-Sima et al., 2006), una semana después de realizada la colecta (Pérez et al., 2008) o no mayor a dos semanas (Monteiro et al., 2012).
Conclusiones
Para la promoción de germinación de semillas de C. ghiesbreghtiana en condiciones de vivero, la remoción del epicarpio puede ser practicada seguida de un tratamiento con H2O2 a una concentración de 0.3% por 24 h. Otra alternativa para la germinación, representa la aplicación del cultivo de embriones cigóticos aislados y cultivados in vitro. En ambos casos, debe aplicarse la estrategia a la brevedad posible de realizada la colecta, debido al decremento acelerado en la pérdida de viabilidad celular. En el caso de la utilización de H2O2, bajo condiciones de germinación en vivero, representa una opción económica para viveristas o personas interesadas en la conservación del recurso para contribuir en la disminución de la extracción de las poblaciones silvestres. Desde luego, queda abierta la posibilidad para optimizar el proceso de germinación empleando recursos como la utilización de otras sustancias químicas, tiempo de exposición e interacción con escarificación. Resulta de vital importancia realizar estudios que conduzcan hacia la disminución de pérdida de viabilidad observada y que permita extender el tiempo de viabilidad de los embriones.











 nova página do texto(beta)
nova página do texto(beta)



