Introducción
A nivel mundial, el género Pinus está constituido por más de un centenar de especies, es el género de coníferas más extenso del hemisferio norte incluyendo México (Eckert y Hall, 2006), el 85% de los recursos maderables proviene de este grupo de especies forestales (SEMARNAT, 2010; Caballero, 2010). En nuestro país estas especies se destacan por su amplia distribución e importancia económica, por ejemplo; Pinus devoniana Lindley también conocida como Pinus michoacana Martínez o Pinus michoacaensis Roezl (Perry et al., 2000) es endémica de México y Guatemala, en México está distribuida en los estados de Nayarit, Jalisco, Colima Michoacán, Guerrero, Guanajuato, Morelos, Puebla, Hidalgo, Tlaxcala, Oaxaca, Veracruz, Zacatecas y Chiapas (CONAFOR, 2012). La madera de P. devoniana se destina principalmente a la industria de la celulosa y el aserrío, obteniéndose de ellos diferentes productos de un alto valor económico (Perry et al., 2000; Flores-Velázquez et al., 2007). Sin embargo, P. devoniana requiere de un largo periodo de tiempo para poder ser aprovechada, ya que tarda al menos 10 años en alcanzar la talla necesaria para su explotación comercial (Zepeda y Acosta, 2000).
Una de las alternativas para mejorar y conservar estos recursos forestales la componen la realización de investigaciones sobre la biología y los métodos para el manejo de semillas (Meraz et al.,1999). En ocasiones las semillas viables inhiben su germinación, posiblemente debido a no existir condiciones propicias, como por ejemplo el pH, temperatura o disponibilidad de nutrientes (Miransari y Smith, 2014). La mayoría de las investigaciones que se han llevado a cabo como los tratamientos pregerminativos se realizan particularmente para optimizar los tiempos de germinación y obtener un mayor porcentaje de semillas germinadas (Martínez-Pérez et al., 2006).
Las pruebas de germinación se han realizado en condiciones de temperatura, sustrato, pH y luz, las cuales han mostrado que existe un efecto diferencial dependiente de cada uno de estos factores (Samaniego, 1995; Sánchez et al., 2006; Reino et al., 2008). Un estudio enfocado en cuatro especies arbóreas forrajeras (Guazuma ulmifolia, Enterolobium cyclocarpum, Pithecellobium dulce y Prosopis laevigata) mediante el uso de escarificación e inmersión en ácido sulfúrico mostró un aumento del porcentaje de germinación (Hernández-Vargas et al., 2001). Por otro lado, los microorganismos del suelo son indispensables en ecosistemas forestales (Baldrian et al., 2012), podemos encontrar principalmente hongos y bacterias, cuyo efecto puede ser la estimulación tanto en la germinación como en el crecimiento vegetal. La inoculación con estos organismos fúngicos o bacterianos promotores del crecimiento vegetal (Plant Growth Promoting Rhizobacteria o PGPRs) (Lugtenberg y Kamilova, 2009) constituyen una importante herramienta biotecnológica, fortaleciendo, entre otras cosas, su adaptación al campo y aumentando las posibilidades de sobrevivencia (Lucy et al., 2004; Bais et al., 2006).
Las PGPRs pueden promocionar del crecimiento vegetal de diversas formas, por ejemplo: Rhizobium y Bradyrhizobium pueden formar nódulos en leguminosas (Ferreira et al., 2012), existen microorganismos solubilizadores hierro y fosfatos (Bhattacharyya y Jha, 2012), otros producen aminociclopropano-1-carboxilato deaminasa (ACC) (Glick et al., 2007), también pueden interferir con los mecanismos de comunicación quórumsensing (QS), producen fitohormonas, inhiben la actividad antifúngica y producen compuestos orgánicos volátiles (VOC) (Nelson, 2004; Hass y Défago, 2005;Hallmann y Berg, 2006). En especies forestales como Pinus sylvestris y Pinus radiata presentan simbiontes naturales como micorrizas y bacterias (Timonen y Hurek, 2006). P. sylvestris presenta principalmente en su comunidad simbiontes bacterianos del género Burkholderia y especies del género Paenibacillus. Algunas de estas bacterias puede ayudar a los árboles con la adquisición de nitrógeno, ya que sus propiedades diazotróficas albergan nitrógeno reductasa (Timonen y Hurek, 2006). En cambio, P. radiata presenta organismos como Betaproteobacteria, Bacilli, Alphaproteobacteria, Actinobacteria, Sphingobacteria, Gammaproteobacteria y Acidobacteria, generando ventajas en cuanto la fijación de nitrógeno y la oxidación de amonio, así como en el crecimiento de la planta y el control biológico de organismos patógenos (Lottmann et al., 2010). La aplicación de este tipo de rizobacterias en diversos cultivos de numerosas etapas del desarrollo ha dado como resultado la promoción evidente del crecimiento de plantas, observándose un incremento en la emergencia, vigor, biomasa y desarrollo del sistema radical (Kamilova et al., 2006; Angulo et al., 2014).
Arthrobacter agilis UMCV2 es una rizobacteria PGPR aislada de la rizosfera de maíz, que presenta características de solubilizar hierro (Valencia-Cantero et al., 2007). Esta cepa ha demostrado aumentar el estatus nutrimental en Phaseolus vulgaris L., generando un marcado aumento en la biomasa (peso fresco de la planta). A. agilis UMCV2 también ha mostrado promover el crecimiento de Medicago sativa, como la longitud de la parte aérea, densidad de raíces laterales y peso fresco. Por medio de un análisis cromatográfico se identificó que esta cepa produce un aminolípido denominado dimetilhexadecilamina, implicado en el aumento del crecimiento vegetal en estas especies de interés agrícola (Velázquez Becerra et al., 2011). Sin embargo, estudios enfocados a conocer el efecto que produce A. agilis en especies forestales desde sus primeras etapas de desarrollo no existen. Por esta razón, decidimos evaluar la germinación y crecimiento en P. devoniana, mediante la inoculación con A. agilis UMCV2, colaborando con información valiosa para a mediano plazo obtener una herramienta biotecnológica y poder conseguir arboles maderablemente maduros en un periodo considerablemente más corto.
Material y métodos
Material vegetal
Se utilizaron semillas de Pinus devoniana, las cuales de obtuvieron de la Comisión Forestal del Estado de Michoacán (COFOM), México.
Cepa bacteriana
Se usó la cepa Arthrobacter agilis UMCV2 (Valencia-Cantero et al., 2007), proporcionada por el Laboratorio de Ecología Microbiana del Instituto de Investigaciones Químico-Biológicas de la UMSNH, Morelia Michoacán, México.
Preparación del inóculo bacteriano
La rizobacteria A. agilis UMCV2 se crece previamente en cajas de Petri con aproximadamente 30 ml de agar nutritivo (AN), el organismo se deja por un periodo de cinco días en la oscuridad a 26°C, una vez que ha alcanzado el umbral de crecimiento en las cajas de Petri posteriormente se recuperaran las células con 10 ml de agua desionizada estéril, hasta conseguir un volumen final de 250 ml a una absorbencia de 1,0 con una longitud de onda de 600 nm (Catford et al., 2003). Este último volumen obtenido se resuspende con agua corriente estéril para aforar a 300 ml y utiliza aplicándolo como agua de riego para cada maceta (solución UMCV2).
Efecto de A. agilis UMCV2 sobre la germinación de P. devoniana L.
Se usaron semillas de P. devoniana las cuales se esterilizaron superficialmente mediante un lavado en hipoclorito de sodio (Cloralex M.R.) al 10% durante diez minutos, a continuación se enjuagan en agua corriente estéril cinco veces. Posteriormente, se tomaron la mitad de las semillas y se sumergieron por 12 horas en la solución UMCV2 ya descrita con anterioridad (9 x 108 cel mL-1). Las semillas se germinaron en cajas de Petri estériles con papel filtro humedecido con 10 ml de agua corriente también estéril, para después ser colocadas en una cámara de crecimiento con luz y temperatura controladas, durante un fotoperiodo de 16 h luz/8 h oscuridad, una intensidad de luz de 200 mmolm-2s-1 a 22-23oC. Cuando la primera semilla germinó, es decir: apareció visiblemente la radícula (Lovey et al., 2010), se dejaron por nueve días más para poder evaluar los parámetros de respuesta como la longitud total de la plántula, peso fresco total de la plántula y el porcentaje de germinación.
Efecto de A. agilis UMCV2 sobre el crecimiento en plántulas de P. devoniana L.
Las plántulas utilizadas en el experimento anterior se trasladaron cuidadosamente con ayuda de una pinza de disección a tubetes de plástico. El sustrato que se empleó en este experimento fue de acuerdo a una modificación de los utilizados por Morales 2014 y Montejo 2015, donde se mezclaron los siguientes elementos: 1 kg de peatmoss (60%), agrolita (20%) y vermiculita (20%), respectivamente, con un pH 5.45 previamente esterilizado en autoclave para después dividirse en dos tratamientos: el primero es un tratamiento llamado "control" (sin inóculo), donde se colocaron las plántulas durante un periodo de 65 días; el segundo se trata de un tratamiento experimental llamado "A. agilis UMCV2", donde se colocaron las plántulas y se reinocularon con la cepa UMCV2 también hasta cumplir 65 días de edad después de la germinación. Este segundo experimento se llevó a cabo en el invernadero del Instituto de Investigaciones Químico-Biológicas de la UMSNH bajo condiciones no controladas de luz ni temperatura (Zurita-Valencia et al., 2014). Durante este periodo los tubetes que contenían las plántulas fueron regados cada tres días con 300 ml de agua corriente estéril. Al terminar el experimento se evaluaron los siguientes índices de respuesta en plántulas: longitud total de la plántula, longitud de la parte aérea, peso fresco total de la plántula y densidad de raíces laterales (Velázquez Becerra et al., 2011).
Resultados
Efecto de A. agilis UMCV2 en semillas de P. devoniana
Nuestros resultados muestran que las semillas de P. devoniana al ser germinadas en presencia de la bacteria A. agilis UMCV2 después de nueve días obtuvimos plántulas de mayor longitud. En la figura 1A se aprecian el efecto al ser germinadas en condiciones de esterilidad, mostrando valores de 1.4 cm de longitud en el tratamiento control, contra 2.7 cm para el tratamiento previamente inoculado con la bacteria, siendo estadísticamente significativo el aumento de talla. Sin embargo, en la figura 1B mostramos que en el peso fresco de las plántulas no hubo un aumento estadísticamente significativo entre tratamientos después de nueve días de exposición al inóculo.
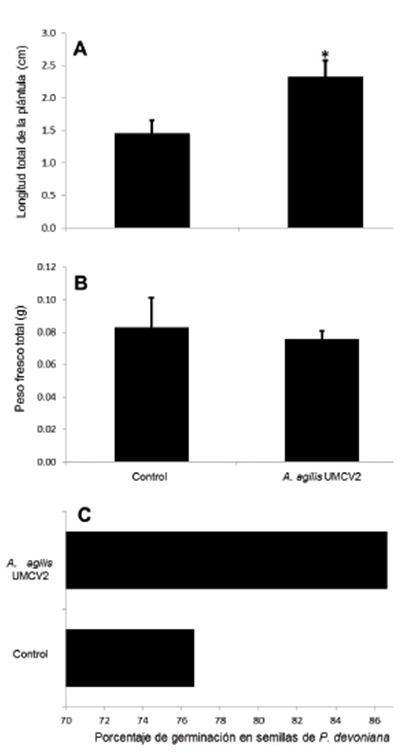
Fig. 1 Efecto de A. agilis UMCV2 en semillas de P. devoniana a nueve días después de su germinación. El panel A muestra la longitud total de la plántula, el panel B muestra el peso fresco total de la plántula y el panel C indica el porcentaje de germinación. El asterisco señala si hay diferencia significativa entre tratamientos, sólo para el panel A y B, ANOVA (p < 0.05).
También en nuestros resultados encontramos que el porcentaje de germinación entre los tratamientos control y A. agilis UMCV2, mostró un aumento del 10% en semillas previamente inoculadas. En la figura 1C vemos los valores de 76% para el control contra 86% para UMCV2.
Efecto de A. agilis UMCV2 en plántulas de P. devoniana
Para nuestro siguiente experimento, en donde las plántulas se colocaron en tubetes con sustrato estéril por un periodo de 65 días, los datos muestran que la longitud total de la plántula no presenta diferencias significativas. En la figura 2A vemos los valores del tratamiento control con 14.5 cm y 15.5 cm para el inoculado con UMCV2. Sin embargo, con los datos de la longitud de la parte área de la plántula descubrimos una clara diferencia estadísticamente significativa (fig. 2B), con valores de 5.2 cm (control) contra 8.5 cm (A. agilis UMCV2). En el peso fresco total de las plántulas no encontramos diferencias significativas entre tratamientos después de 65 días, pero sí observamos una clara tendencia a un mayor peso en los tratamientos inoculados con la bacteria (fig. 2C).
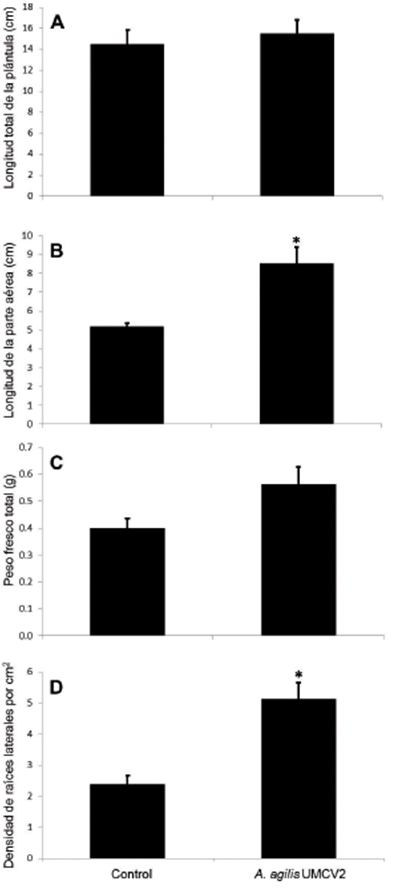
Fig. 2 Efecto de A. agilis UMCV2 en plántulas de P. devoniana a 65 días de edad. El panel A muestra la longitud total de la plántula, el panel B muestra la longitud de la parte aérea, el panel C muestra el peso fresco total de la plántula y el panel D indica la densidad de raíces laterales. El asterisco señala si hay diferencia significativa entre tratamientos, ANOVA (p < 0.05).
Un aspecto importante durante el desarrollo vegetal se lleva a cabo en la raíz de las plántulas, nuestros datos indican un efecto diferencial sobre la densidad de las raíces laterales. En la figura 2D tenemos que la presencia de la bacteria UMCV2, tras 65 días del experimento, fue capaz de promover de manera estadísticamente significativa una mayor densidad de raíces laterales, mostrando valores de 2.4 contra 5.1 raíces laterales por cm2. En la figura 3 podemos ver plántulas representativas del experimento para los dos tratamientos, en donde percibimos las condiciones generales de talla y morfología radicular.

Fig. 3 Efecto de A. agilis UMCV2 en plántulas de P. devoniana, imágenes representativas del experimento después de 65 días de edad. En el panel A se muestra a P. devoniana crecida en condiciones de esterilidad (control) y el panel B se muestra a P. devoniana inoculada con A. agilis UMCV2. En ellas se puede ver una mayor talla y densidad de raíces laterales en plántulas crecidas en presencia de la bacteria.
Discusión
Con los resultados obtenidos podemos ver como la presencia de la rizobacteria A. agilis UMCV2 influyó en la germinación y crecimiento de P. devoniana. En nuestro experimento de germinación, después de nueve días se desarrollaron plántulas de mayor longitud. Sin embargo, bajo estas condiciones después de 65 días el crecimiento no fue significativamente superior, ya que la longitud total de la plántula no muestra una diferencia estadística entre estos dos tratamientos (fig. 2A). Por otro lado, cuando analizamos el crecimiento alcanzado por la parte aérea de la plántula encontramos que los tratamientos inoculados con la bacteria UMCV2 mostraron un mayor crecimiento que el tratamiento control a 65 días de edad.
En el proceso de germinación están implicados mecanismos morfológicos y fisiológicos que resultan en la activación del embrión, los factores que intervienen en este fenómeno son principalmente el agua, algunas proteínas y hormonas vegetales. El balance entre el ABA y las giberelinas son determinantes en la germinación, como lo son los compuestos nitrogenados, estos últimos pueden provocar la germinación mediante un ajuste en las concentraciones de K+/Na+, además de un incremento en la producción de ATP (Miransari y Smith, 2014). Sabemos que la cepa UMCV2 secreta metabolitos ricos en N, como por ejemplo la dimetil pirazina, metil triazol y dimetilhexadecilamina (Velázquez-Becerra et al., 2011) que pudieran estar involucrados de forma directa.
Los datos obtenidos en el peso fresco de las plántulas mostraron que a nueve y 65 días después de la inoculación no se produjo un aumento estadísticamente significativo. Sin embargo, a los 65 días podemos apreciar una marcada tendencia al aumento de peso (fig. 2C). La presencia de bacterias del género Arthrobacter en interacción con pináceas ya se ha reportado con anterioridad (Pokojska, 1982), en donde el autor describe en su trabajo un incremento del 69% en la longitud del tallo; Arthrobacter oxydans reporta un incremento de la altura y biomasa de un 68% en árboles de Pseudotsuga menziesii (Chanway y Holl, 1994); Arthrobacter citreus genera un aumento en la biomasa en arboles de Picea mariana (Lucy et al., 2004).
El uso de rizobacterias promotoras del crecimiento vegetal es una práctica usual en la industria forestal, la agricultura y la restauración ecológica (Lucy et al., 2004; Frey et al., 2007). Bacterias de estas características presentan la cualidad de promover el crecimiento vegetal por varias vías, en la que se encuentra la inhibición de patógenos, solubilización de minerales o producción de reguladores del crecimiento vegetal (Okon et al.,1998; Bloemberg y Lugtenberg, 2001; Lucy et al., 2004). En el suelo se pueden tener microorganismos tanto bacterias como hongos que aumentan el rendimiento de la planta; encontramos organismos como Agrobacterium radiobacter, Pseudomonas fluorescens, Arthrobacter oxydans, Azospirillum brasilense, Bacillus megaterium, Stenotrophomonas maltophilia, entre muchos otros (Leyval y Berthelin, 1989; Chanway y Holl, 1994; Mohammad y Prasad, 1998; Valencia-Cantero et al., 2007).
Para el caso de la rizobacteria A. agilis UMCV2 sabemos que presenta la característica de promover el crecimiento vegetal mediante la emisión de compuestos orgánicos volátiles. Por lo cual creemos que compuestos como la dimetilhexadecilamina pudieran estar involucrados no sólo en la germinación, sino también en la promoción del crecimiento en plántulas. Ejemplo de ello es que sabemos existen compuestos de similar naturaleza química a las aminas y en particular la dimetilhexadecilamina, tenemos evidencia clara del papel que ejercen en el desarrollo de plantas, tal es el caso de las alcamidas. Las alcamidas son metabolitos secundarios en las plantas y originados mediante la condensación de un ácido graso insaturado y una amina (Ramírez-Chávez et al., 2004). La afinina y la amidenina son alcamidas implicadas en la diferenciación y crecimiento de las plantas, además se ha visto que la afinina incrementa en un 70% la formación de primordios de raíces laterales en Arabidopsis, sugiriendo que la afinina puede promover la ramificación de la raíz por la inducción de raíces laterales. Además de las alcamidas, las N-acil-etanolamidas (NAEs) son canabinoides endógenos de mamíferos y relacionados estructuralmente con las alcamidas. Los efectos mencionados por este grupo de moléculas se sabe que son capaces de propiciar un efecto de promoción para la planta similar a los encontrados en nuestro trabajo. Evidencia de lo antes mencionado, tenemos que después de 65 días de estar en contacto con la cepa UMCV2, las plántulas de P. devoniana desarrollaron una mayor densidad de raíces laterales estadísticamente superior al tratamiento sin inóculo (fig. 2D).
Autores como Ryuy et al. (2003) mencionan que el descubrimiento de estos compuestos constituye un importante mecanismo de licitación para el crecimiento de plantas por rizobacterias. Se ha establecido bien que los volátiles producidos por las rizobacterias pueden actuar como moléculas señalizadoras que median las interacciones plantamicrobio, en situaciones donde las PGPRs colonizan la raíz de la planta, para generar una respuesta positiva de crecimiento (Ping y Boland, 2004; Bhattacharyya y Jha, 2012). Sin embargo, el papel que juegan estas moléculas tanto en plantas como en microorganismos del suelo se encuentra aún en investigación (Farmer, 2001; Zhang et al., 2007).
La importancia de este trabajo resalta en varios aspectos, ya que es el primero en donde se muestra el efecto de la inoculación de la rizobacteria A. agilis UMCV2 en semillas y plántulas de interés forestal, además se está descubriendo una novedosa interacción entre P. devoniana-A. agilis UMCV2.
Conclusiones
En este trabajo encontramos que una exposición de la rizobacteria A. agilis UMCV2 promovió tanto la germinación como el crecimiento en plántulas de P. devoniana a 65 días de estudio. Los resultados señalan un potencial para usar inóculos microbianos tanto en condiciones de invernadero como en suelo abierto para generar una promoción del crecimiento en especies de interés tanto agrícola como forestal, de esa manera reducir los periodos de producción en función del cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)


