Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.40 México ago. 2015
Morfoanatomía foliar de Alvaradoa amorphoides Liebm. del estado de Morelos, México
Leaf morfoanatomy of Alvaradoa amorphoides Liebm. in Morelos state, Mexico
Ana Teresa Jaramillo-Pérez1, Alejandra Quintanar-Isaías1, María Eugenia Fraile-Ortega2, Angélica Martínez-Bernal2, y José David Sepúlveda-Sánchez3
1 Laboratorio de Anatomía y Tecnología de la Madera, Departamento de Biología, Universidad Autónoma Metropolitana- Unidad Iztapalapa.
2 Laboratorio de Biosistemática de Leguminosas, Departamento de Biología.
3 Laboratorio de Microscopía Electrónica, Edificio de la Ciencia y Tecnología Ambiental. Universidad Autónoma Metropolitana Unidad Iztapalapa. Av. San Rafael Atlixco núm. 186, col. Vicentina, Iztapalapa, CP 09340, México, DF, AP 55-535. Correo electrónico: aqi@xanum.uam.mx
Recibido: 2 mayo 2014.
Aceptado: 23 febrero 2015.
Resumen
Se describen las características anatómicas y morfológicas de la hojas compuestas de Alvaradoa amorphoides Liebm. procedente de una selva baja caducifolia ubicada en el municipio de Tlaquiltenango, Morelos, México. Las hojas se fijaron y se prepararon para obtener secciones transversales, longitudinales y paradermales en un criostato Leica a -20°C. Se tiñeron con safranina-azul alciano y azul de toluidina; se deshidrataron y montaron con resina. Se siguieron los protocolos de diafanización para describir la arquitectura foliar.
Para las descripciones anatómicas y morfológicas se midieron: los pecíolos y peciólulos, la lámina, los pelos, las células epidérmicas y los parénquimas en empalizada y esponjoso. A los caracteres mensurables se les aplicaron los siguientes análisis: de varianzas de una vía o en su caso pruebas no paramétricas. Se registraron datos de ψx y valores de conductancia estomática. Los resultados muestran: hojas compuestas y pubescentes imparipinnadas con filotaxis helicoidal, con venación broquidódroma festonada. Hojas bifaciadas hipostomáticas, con estomas anomocíticos y hundidos en cámaras pre-estomáticas con células epidérmicas modificadas en papilas. El peciólulo es móvil, presenta parénquima cortical con drusas y depósitos de origen polifenólico. Los valores de ψh fueron del orden de -3.29 y -2.01 MPa registrados en junio y septiembre respectivamente.
Se observó que aunque la morfología de la epidermis y el movimiento foliar reducen el área de exposición de la hoja a la radiación solar directa, los espacios intercelulares del mesófilo permiten el desarrollo de una interfase líquido-vapor que logra valores hasta de 313 mmol/m2s de gs en promedio, lo que sugiere el continuo abastecimiento de una capa límite que evita un posible sobrecalentamiento de las hojas.
Palabras clave: anatomía y morfología foliar, Alvaradoa amorphoides, selva baja caducifolia, Morelos.
Abstract
Anatomical and morphological features of the compound leaves of Alvaradoa amorphoides Liebm. from a deciduous forest located in the Municipality of Tlaquiltenango, Morelos, Mexico, are described. The leaves were fixed and prepared to obtain cross, longitudinal and paradermal sections using a Leica Cryostat at -20°C. These were stained with safranin-alcian blue and toluidine blue; later dehydrated and mounted with resin. Diaphanization protocols were followed to describe the foliar architecture.
For anatomical and morphological sizes of petioles and petiolules, sheet, epidermal cells, hairs, and palisade and sponge parenchyma were obtained. One-way ANOVA or non-parametric tests were applied. ψx and stomatal conductance values were recorded. Our results show: pubescent-compound leaves and imparipinnated with helical phyllotaxy; festooned brochidrodromous veins present; bifacial and hypostomatic leaves, with sunken stomata in anomocytic arrange; epidermal cells as papilla-like; mobile petiolules, with cortical parenchyma cells which contain druses and polyphenolic brownish deposits. ψh at -3.29 and -2.01 MPa in June and September were respectively recorded.
Although morphology of epidermis and leaf movement reduces the exposure of foliar surface to solar radiation, volume formed by intercellular spaces in mesophyll allow the development of a liquid-vapor interface that manages gs values up to 313 mmol/m2s in average, suggesting a continuous water supply to the boundary layer that avoids a possible overheating of leaves.
Key words: leaf anatomy, leaf morphology, Alvaradoa amorphoides, tropical dry deciduous forest, Morelos.
Introducción
La hoja es el órgano evapotranspirador por excelencia, por lo que es sensible a los cambios en la disponibilidad del agua en el suelo y las condiciones de humedad relativa de la atmósfera. Desde el punto de vista ecológico estos factores se consideran importantes para ubicar a las plantas en tres grandes grupos: hidrófitas, mesófitas y xerófitas (Eames y McDaniels, 1947 y Kirkham, 2005). Los requerimientos hídricos pueden medirse a través del potencial hídrico de la hoja (ψh) lo que permite conocer el estatus hídrico de las plantas con respecto al medio físico (Kirkham, 2005). Se ha considerado que las plantas son hidrófitas si por lo general el ψh≤ -1 MPa; son mesófitas si, -1 MPa< ψh≤ -2 MPa y son xerófitas si -2 MPa< ψh≤ -4 MPa (Nilsen y Orcutt, 1996). Aunque Maherali et al. (2004) revelan que hay especies de selva baja caducifolia capaces de tolerar ψh< -4 MPa.
Las xerófitas constituyen un grupo numeroso de especies que presentan una amplia complejidad estructural y por tanto una gran diversificación. Las plantas xerófitas son aquellas que crecen en hábitats áridos y cuya transpiración, bajo condiciones de deficiencia hídrica, disminuye a un mínimo. Estas plantas han desarrollado caracteres fisiológicos, morfológicos y anatómicos estructurales relevantes para establecerse en hábitats áridos o xerófitos (Fahn, 1978; Santos y Ochoa 1990; Dickison, 2000).
Dentro de los ajustes estructurales que experimentan las plantas xerófitas, se encuentran las adaptaciones fenológicas relacionadas con la permanencia o pérdida de hojas en periodos de sequía y que en ambos casos, involucran también adaptaciones internas de los tejidos. Por otro lado, se encuentran las fisiológico-bioquímicas que regulan las respuestas estomáticas y el mantenimiento de la turgencia por ajuste osmótico (Santos y Ochoa, 1990).
Un ajuste anatómico que destaca en plantas xerófitas es la presencia de tricomas principalmente sobre las superficies evaporativas. El significado adaptativo de la pubescencia foliar en plantas ha sido estudiada para entender como funciona con respecto a la reflexión de la luz, los cambios en el grosor de la capa límite, la prevención de la obstrucción de los estomas por agentes ya sea el agua en estado líquido o por partículas suspendidas en la atmósfera y la protección contra los herbívoros (Meinzer y Goldstein, 1985; Levizou et al., 2005; Molina-Montenegro, 2008). Para especies con hojas persistentes que se establecen en ambientes cálidos secos, el indumento es una estructura funcionalmente importante, que permite a las hojas estar protegidas de la radiación y las temperaturas excesivas, así como del déficit hídrico presente en el ambiente (Fahn, 1986; Ely y Torres, 2003). Alvaradoa amorphoides es una especie típica de vegetación primaria y perturbada de selvas bajas caducifolias, selvas medianas subperennifolias y zonas de transición de encinares con selva baja caducifolia. Se localiza entre los 800-1370 (-1750) m.s.n.m. en México, por lo que tiene una amplia distribución geográfica desde la península de Yucatán, Chiapas, Oaxaca, Guerrero, México y Morelos hasta Michoacán, Jalisco, Colima, Nayarit, Sinaloa, Sonora, Durango y Chihuahua (Riley, 1923; Graham, 1976; Rzedowski, 1981; Rebollar et al., 1996-1997; Salazar y Soihet, 2001; Salas-Morales et al., 2003; Pennington y Sarukhán, 2005). De acuerdo con lo reportado en Salazar y Soihet (2001), A. amorphoides presenta hojas compuestas y persistentes puesto que los individuos conservan su follaje durante la estación seca. En esta especie ocurre el movimiento foliar paraheliotrópico en el que las hojas pliegan sus folíolos, dejando ambas superficies paralelas a la radiación solar (Jones, 1992). En relación a este fenómeno Ely y Torres (2003) reportan que otras especies responden de la misma manera, bajo condiciones similares.
Con base en estudios moleculares filogenéticos de Fernando y Quinn (1995), Fernando et al. (1995), Soltis et al. (2005) y Haston et al. (2009) y APG III (2009) A. amorphoides ha sido ubicada en la familia Picramniaceae. Para esta familia se han reportado estudios sobre la anatomía foliar de algunos de sus géneros (Watson y Dallwitz, 1992), refiriendo que la epidermis abaxial puede o no presentar papilas, en ocasiones es mucilaginosa, con estomas de tipo anomocítico y confinados principalmente a la superficie abaxial y la presencia de pelos simples o glandulares en ambas superficies. También destacan que el género Alvaradoa presenta cristales de tipo estiloides y su mesófilo es semejante al resto de los géneros de esta familia: con idioblastos esclerenquimatosos, drusas y cristales prismáticos solitarios de oxalato de calcio. Cortadi et al. (2010) estudiaron la anatomía de la hoja de Alvaradoa subovata encontrando que presenta epidermis uniestratificada hipostomática papilosa, estomas anomocíticos hundidos, nervio medio formado por haces vasculares primarios colaterales abiertos en arco acompañado por una vaina conspicua de fibras y colénquima de tipo laminar. Zindler-Frank (1987) menciona que en general los cristales de oxalato de calcio pueden encontrarse en el mesófilo, en el xilema y/o en la epidermis de hojas de leguminosas y dependiendo de su ubicación, toma un valor taxonómico. Asimismo sostiene que la precipitación de estos cristales puede ser el resultado de su baja solubilidad y alta evapotranspiración. En este sentido Ely y Torres (2003) han destacado que la presencia de cristales y esclereidas subepidérmicas, en los pecíolos de Chaetolepis lindeniana, incrementan la resistencia mecánica de sus hojas como respuesta a la fuerza deformadora del viento. Para A. amorphoides sólo se ha reportado la anatomía de la madera de especímenes del estado de Quintana Roo, México (Rebollar et al., 1996-1997).
Por lo anterior, el propósito de este trabajo es describir la anatomía de las hojas de esta especie y relacionar las posibles estrategias morfoanatómicas que presenta este órgano bajo condiciones de atmósferas desecantes.
Material y métodos
El sitio de estudio se ubica en la localidad Valle de Vázquez, municipio de Tlaquiltenango, Morelos, México, en las coordenadas: N 18° 30' 39.2''; W 099° 05' 16.9'', a una altitud de 930 m.s.n.m. Presenta un clima cálido húmedo A w(w), con lluvias de verano y con un porcentaje de lluvias invernal menor del 5% con respecto al total anual (García, 1988). El promedio de temperatura y la precipitación total anual para este sitio es: 23.50°C y 769.5 mm, respectivamente (fig. 1). El promedio de la velocidad del viento es de 0.30 km/h. El tipo suelo para el sitio de estudio en Valle de Vázquez pertenece al subgrupo Feozem calcárico (INEGI, 2007). El tipo de vegetación es una selva baja caducifolia, de la que proceden los árboles estudiados (Jaramillo-Pérez, 2011).
A los individuos en pie se les midió el potencial hídrico nativo (ψh) de sus hojas con una cámara de presión, modelo PMS 1000 y datos de conductancia estomática (gs) con un porómetro modelo CS-1, marca Decagon.
El estudio morfológico y anatómico se hizo con hojas recolectadas frescas, fijadas y herborizadas de individuos de Alvaradoa amorphoides. Los ejemplares de respaldo se encuentran depositados en el Herbario Metropolitano (UAMIZ) (tabla 1).
La arquitectura foliar se estudió en una muestra de 30 folíolos provenientes de la parte media de hojas maduras. Los folíolos se diafanizaron según la técnica de Dilcher (1974). Para elaborar preparaciones permanentes de los folíolos diafanizados se deshidrataron en alcoholes graduales hasta xilol y se montaron en resina Entellán. Las fotografías se obtuvieron con un microscopio estereoscópico (AO-Modelo 2000) y en un microscopio de campo claro Axiophot (Modelo 7882, Carl Zeiss). Para describir los patrones de nervación se utilizó la terminología de Hickey (1974) y Ash et al. (1999).
Para la descripción morfológica se usaron hojas maduras de ramas jóvenes, en las que se midieron los mínimos y máximos de: la lámina del folíolo, el pecíolo, el raquis y el número de pares de folíolos. Se describió el color de la lámina con las tablas de color para tejidos vegetales de Munsell (Munsell Co., 2002). Después un grupo de hojas se fijaron en FAA y otro en glutaraldehído al 2.5%.
De hojas fijadas en FAA, se separaron el pecíolo, la lámina y el peciólulo; cada una de estas estructuras se dividió en tres segmentos: basal, medio y apical (fig. 2). Las muestras se lavaron en dH2O e infiltraron en una solución de soporte (Quintanar-Isaías et al., 2009). Se elaboraron cortes transversales y longitudinales de 20 μm, así como paradermales de lámina de 5 μm de grosor con un criostato Leica a -20°C. Para el contraste del material ergástico y las características de la pared celular se usaron las técnicas de safranina-azul alciano y azul de toluidina. Las muestras se deshidrataron y montaron con resina Entellán (Ruzin, 1999). Por último, para obtener mayor detalle de las características de la epidermis y del mesófilo, las muestras fijadas en glutaraldehído al 2.5%, se postfijaron en OsO4 siguiendo la técnica Dawes (1971) para microscopía electrónica de barrido.
En secciones transversales se midieron el diámetro mayor y el menor del pecíolo y del peciólulo. En los segmentos de las láminas de los folíolos, se midieron, el grosor total de la lámina, la anchura y la altura de las células epidérmicas adaxiales y abaxiales, la longitud de los pelos; la anchura y altura de las células del parénquima en empalizada y el espesor total del parénquima esponjoso. De los datos mensurables se obtuvieron las medias y la desviación estándar. Cada variable fue analizada por medio de procedimientos estadísticos exploratorios y confirmatorios: diagramas de caja para observar la distribución de los datos, pruebas de Anderson-Darling y de Levene para asegurar o descartar normalidad y homocedasticidad respectivamente. Se hicieron análisis de varianza (ANOVA) de una vía con pruebas a posteriori de Tukey-Kramer con un nivel de significancia al 5% (α = 0.05). Si las varianzas eran desiguales entonces se usaron pruebas de Kruskal-Wallis seguido de comparaciones múltiples con el criterio de Bonferroni (Zar, 1984). Se utilizaron los programas Stata 7 (StataCorp., 2001) y el NCSS 2007 (Hintze, 2009). Para comparar qué segmento del folíolo muestra mayor cantidad de parénquima fotosintético se calculó, en cada uno, el porcentaje de parénquima del mesófilo, tomando como referencia el grosor total de la lámina.
Resultados
Potencial hídrico y conductancia estomática foliar
Los valores de ψh fluctuaron entre -3.29 y -2.01 MPa registrados en junio y septiembre respectivamente. Los valores promedio de gs registrados al mediodía fueron de 313.03 mmol/m2s durante el mes de junio y de 300.51 mmol/m2s durante el mes de septiembre.
Descripción morfológica de la hoja
Las hojas pecioladas compuestas, imparipinnadas y arregladas helicoidalmente sobre el tallo; de (16.5-) 19.0-29 cm de largo total; pecíolo de 2.5-4.0 (-6.0) cm de largo; raquis de (12.0-) 14.0-24.0 cm de largo y peciólulo de 0.1 a 0.2 cm de largo. Folíolos alternos con 12-23 pares por hoja, textura papirácea, de forma oblonga y elíptica (tabla 2).
El color de los folíolos corresponde a verde oscuro brillante para la superficie adaxial y va de 7.5 GY 4/4 a 7.5 GY 3/4. La superficie abaxial cambia a verde claro cenizo y va de 7.5 GY 6/4 a 7.5 GY 5/4.
Pecíolo
La forma transversal del pecíolo en el segmento (BPe) adyacente al tallo es acanalada y casi terete hacia los segmentos medio (MPe) y apical (APe) (fig. 2b y 3). La epidermis es uniestratificada, con pelos simples, unicelulares. El colénquima anular formado por tres o cuatro hileras de células con polifenoles en sus cavidades y el parénquima cortical por dos o tres hileras de células (fig. 4a). Una banda concéntrica de fibras de aproximadamente 87 ± 34.01 μm de anchura y formada hasta por seis hileras de células de paredes gruesas (5.14 ± 1.07 μm) (fig. 4a) rodea al sistema vascular de xilema y floema secundarios. La disposición concéntrica de esta banda sugiere un reforzamiento mecánico adicional al que proporciona el colénquima.

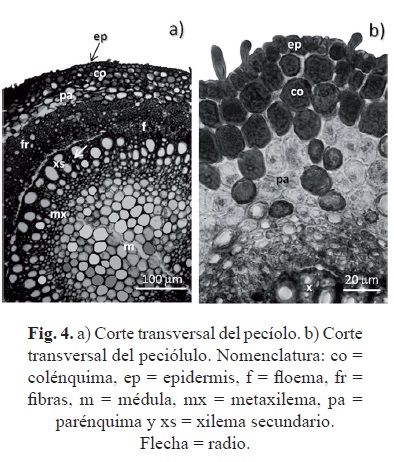
El segmento BPe presenta tres haces leñosos (Raven et al., 2005). En el segmento MPe se aprecia la conglutinación de estos haces leñosos para formar uno concéntrico hacia el segmento APe dejando una médula (figs. 3 y 4a) (Dickison 2000).
Peciólulo
Su forma es casi terete (fig. 5a), los pelos y la estratificación de la epidermis similares a los del pecíolo. Hacia el interior dos o tres estratos de colénquima anular característicos con depósitos de origen polifenólico (fig. 4b, tabla 2). Le siguen tres a cuatro hileras de células de parénquima con cristales romboidales o drusas de dos tamaños (fig. 5b) que hacia la vena principal del folíolo rodean al sistema vascular, lo que sugiere el incremento en la resistencia mecánica (fig. 5a).
En el sistema vascular reniforme, los elementos de tubo criboso del floema se alternan con células de parénquima que contienen depósitos de origen polifenólico (fig. 5a). El xilema secundario formado por series radiales de hasta once vasos en promedio, alternadas con radios uniseriados.
Con relación a las características cuantitativas se observó que el diámetro mayor del peciólulo del segmento apical (AP) fue significativamente diferente a los segmentos medio (MP) y basal (BP) (fig. 2a, tabla 3) y el diámetro menor mostró diferencias significativas entre el segmento BP y los MP y AP (fig. 2a, tabla 3).
Arquitectura y anatomía del foliolo
Venación broquidódroma festonada, con uno o más juegos de arcos por fuera del principal broquidódromo (fig. 5c). La vena media central es de tamaño masivo con recorrido recto. Las venas terciarias con arreglo reticulado azaroso, siguiendo una trayectoria sinuosa al cambiar la dirección de su curvatura. La última venación marginal forma arcos incompletos; las vénulas terminales libres simples o bifurcadas con traqueidas terminales con engrosamientos helicoidales (figs. 5d y 5e).
Las células epidérmicas son de dos tipos: tipo 1) papila redondeada, sus cavidades ocluidas por depósitos de origen polifenólico y comúnmente asociadas a pelos; tipo 2) papila alargada e inclinada conteniendo extractivos en su cavidad y asociada a los estomas; forman una cámara preestomática con cinco a siete células.
Epidermis hipostomática, de cutícula delgada y ornamentada; ambas caras uniestratificadas. La adaxial formada por células epidérmicas tipo 1 (figs. 5f y 5g) y la abaxial por el tipo 2 con estomas pequeños, hundidos, anomocíticos (figs. 5h, 5i, 6a y 6b; tabla 2), en ocasiones algunas papilas pueden asistir dos cámaras preestomáticas adyacentes (fig. 6a).
Los pelos son simples y unicelulares; son más abundantes en la cara abaxial y a lo largo de la vena media, que en la adaxial (figs. 5g y 5i; tabla 2).
El mesófilo es bifaciado, con un estrato de parénquima en empalizada. El parénquima esponjoso formado por pares de células arqueadas horizontalmente y apiladas en dos o tres estratos. (fig.s 6c-6f; tabla 2). Los haces vasculares forman circuitos paralelos con el estrato superior del parénquima esponjoso (fig. 6e).
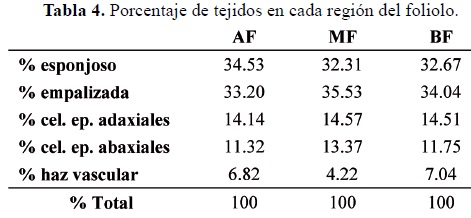
Con respecto a las características cuantitativas se observó que el grosor del folíolo y la anchura del parénquima en empalizada no mostraron diferencias significativas en ninguna de las tres regiones de la lámina (tabla 3). Sin embargo, el grosor del esponjoso sólo mostró diferencias significativas entre el segmento medio y el ápice del folíolo (tabla 3). La altura del parénquima en empalizada mostró diferencias significativas entre el ápice (AF) y los segmentos medio (MF) y basal (BF) del folíolo. La distribución del porcentaje de ambos parénquimas en el folíolo muestra que hay mayor proporción de empalizada en el segmento BF y MF que en el AF, donde el esponjoso es más abundante. También se observa que en el segmento MF, el parénquima en empalizada es más abundante que el esponjoso (tabla 4).
Discusión
Los caracteres que A. amorphoides comparte con géneros estudiados para la familia Picramniaceae (Simarubaceae sensu lato) son las hojas compuestas, la arquitectura broquidódroma, la epidermis papilosa, pubescente e hipostomática, así como el parénquima con drusas, lo que se consideran caracteres generales que definen al grupo (Watson y Dallwitz, 1992; Salazar y Soihet, 2001; Kubitzki, 2007; Cordati et al., 2010). Sin embargo Cordati et al. (2010) describen que A. subovata, Pricramnia parvifolia, P. sellowii y Castela coccinea se caracterizan por tener colénquima laminar y haces colaterales abiertos, que se entiende son primarios, lo que contrasta notablemente con el colénquima anular y un haz vascular reniforme de las nervaduras centrales de los folíolos de A. amorphoides. Por lo que es necesario realizar una revisión de la histología de esta zona para esas especies reportadas.
Los individuos estudiados de A. amorphoides, presentaron valores de ψhcaracterísticos de una xerófita (Nilsen y Orcutt, 1996), pero los valores de gs muestran una baja resistencia estomática, es decir que los espacios intercelulares que se presentan en el mesófilo, estarían más relacionados con la formación de una interfase líquido-vapor mayor a la que presentaría una xerófita ortodoxa (Jones, 1992; Medlyn et al., 2001).
Por lo anterior en los resultados de la anatomía del mesófilo se reconocen rasgos morfológicos y anatómicos de tipo xerófito y otros que proponen un control evaporativo alterno al de las xerófitas como se señala a continuación.
El tipo de hoja y la pubescencia han sido descritas como estrategias para mitigar el efecto de la radiación solar sobre la superficie evaporativa, lo que limita la pérdida de agua y permite el control de la temperatura excesiva, con lo que se protegen los tejidos de las atmósferas desecantes características de condiciones xerófitas (Taiz y Zeiger, 2006). Adicionalmente los pelos incrementan la capa límite, la que ayuda a disminuir el movimiento del aire en la superficie del folíolo (Jones, 1992; Ely y Torres, 2003; Yabuki, 2004). Los derivados epidérmicos crean relieve en las superficies de las hojas en donde queda estacionado el vapor de agua producto de la evapotranspiración; el grosor de esta microregión puede aumentar o disminur dependiendo del tipo, densidad y tamaño del derivado epidérmico, lo que determinará la cantidad de vapor de agua que quedará atrapado y, por tanto, la capacidad para amortiguar los cambios de temperatura en la superficie foliar. Los datos registrados de gs y temperatura (34° C) así como la presencia de gran cantidad de pelos en las superficies abaxiales de los foliolos de A. amorphoides sugieren la formación de una capa límite que se mantiene abastecida constantemente por agua de la evapotranspiración, por tanto, deberá conservar una temperatura óptima y favorable en la superficie del folíolo, lo anterior evitará el sobrecalentamiento que genera la atmósfera desecante (Medlyn et al., 2001) de esta selva baja.
Asimismo la epidermis papilosa y la presencia de compuestos fenólicos hidrofóbicos en sus cavidades recomiendan que en esta especie ocurren eventos de control de temperatura por refracción de la luz con disminución en la pérdida de agua (Fahn, 1986; Ely y Torres, 2003). La síntesis de este tipo de compuestos está relacionada con su actividad antioxidante que inhibe las especies reactivas de oxígeno formadas durante eventos de estrés en la planta (Rice-Evans et al., 1995; Yan et al., 2000; Evert, 2006; Guzmán-Gutiérrez et al., 2012). Asimismo el movimiento paraheliotrópico es un fenómeno que disminuye el impacto de los rayos solares sobre las superficies de la hoja (Jones, 1992 y Flores-Hernández et al., 2013), sin embargo ocasiona estrés mecánico (Moysset y Simon, 1991) por lo que también la presencia de estos compuestos en el colénquima del pecíolo, del peciólulo y del folíolo sugiere, adicionalmente a la desintoxicación celular, el reforzamiento mecánico y la impermeabilización de estas zonas de la hoja.
Adicionalmente, los estomas hundidos en cámaras presentes en esta especie contribuyen al incremento de la capa límite y por tanto en los beneficios antes descritos, (Roth, 1966; Jones, 1992; Taiz y Zeiger, 2006). Resalta que las células papilosas que forman la cámara preestomática no contienen compuestos polifenólicos, lo que parece relacionarse con la reflexión de la luz cuando el folíolo expone la superficie abaxial durante el movimiento paraheliotrópico (Taiz y Zeiger, 2006).
Caracteres anatómicos asociados al plegamiento foliar
El plegamiento foliar, es una respuesta para reducir el área expuesta a la radiación directa del sol y es propio de plantas que reciben una alta insolación durante el día. Los folíolos de esta especie giran paraheliotrópicamente y logran movimientos desde 20º a 316º en periodos de 24 horas (Jaramillo-Pérez, 2011). Este movimiento nástico foliar se ha atribuido a cambios de turgor en las células corticales de pulvínulos que presentan abundancia de compuestos fenólicos y escasez de granos de almidón (Ferrarotto y Jauregui, 2008), equivalente a la presencia de componentes fenólicos en las paredes de las células del colénquima y de las vacuolas del parénquima cortical del peciólulo de A. amorphoides. Los cambios osmóticos que deben ocurrir en estas células suponen la generación de esfuerzos en sus paredes con lo que se explicaría la presencia de polifenoles en el colénquima (Moysset y Simon, 1991; Ferrarotto y Jáuregui, 2008), y de cristales asociados a algunas células del parénquima cortical, recomendando un sistema mecánico muy sólido que permite soportar el peso y movimiento de los folíolos durante las 24 horas (fig. 4b). También se ha propuesto que las acuaporinas, son responsables de los rápidos movimientos de agua que ocurren a través de las membranas celulares como respuesta a cambios osmóticos (Taiz y Zeiger, 2006; Vera-Estrella et al., 2005). Lo anterior sugiere que los movimientos rápidos de los folíolos en A. amorphoides estén asociados a este tipo transporte, aspecto que se recomienda ser estudiado.
La abundancia de cristales en la hoja de A. amorphoides sugiere una asociación a las condiciones edafológicas y de gran evapotranspiración ocasionada por las altas temperaturas y la baja humedad relativa del ambiente en estas selvas del estado de Morelos. Franceschi y Horner (1980) consideran que la formación de cristales es un mecanismo para remover el exceso de calcio que ingresa a la planta. Asimismo, Ely y Torres (2003) y Zindler-Frank (1987) señalan que los cristales pueden ser reabsorbidos bajo condiciones de deficiencia de calcio, lo que podría recomendar que en esta especie este mecanismo cambie la osmolaridad de las células del parénquima responsables del movimiento foliar a lo largo del día o bien para crear un gradiente de concentración de solutos e iones que le permitan absorber y recargar agua cuando se inicie la temporada de lluvias. En esta especie destaca que los cristales se oxalato de calcio se concentran mayormente en el parénquima cortical de la vena media y del peciólulo (Jaramillo-Pérez, 2011), lo que también señalan Cordati et al. (2010) para A. subovata. Esto sugiere un mecanismo asociado a cambios osmóticos por uso y reuso del calcio (Ely y Torres, 2003; Zindler-Frank, 1987).
El mesófilo de los folíolos de A. amorphoides, presentó una mayor densidad de parénquima en empalizada en la zona basal y media de la lámina y una mayor densidad del esponjoso en el ápice. Esta condición podría estar asociada a dos fenómenos: a) la distribución del mayor peso en la base, haciendo el extremo del folíolo más ligero para asegurar el movimiento durante todo el día y; b) asegurar una rápida y mejor distribución del agua en el folíolo (tabla 4) (Taiz y Zeiger, 2006; Jaramillo-Pérez, 2011).
Adicionalmente es característico que en el parénquima esponjoso sus espacios intercelulares pueden albergar un volumen considerable para la interfase líquido-vapor. Lo anterior se ve reflejado indirectamente en los valores de gs registrados al mediodía (313.03 mmol/m2s y 300.51 mmol/m2s; junio y septiembre respectivamente). Al comparar estos valores con los registrados para hojas típicamente xerófitas como es en Pinus sp. (gs = 24.1 mmol/m2s) destaca el poco volumen que dejan los espacios intercelulares del parénquima esponjoso de ensamblaje lobulado (Medlyn et al., 2001 y datos inéditos de las autoras, 2013).
El arreglo broquidódromo festonado de las nervaduras, se ajusta con el del parénquima esponjoso, formando circuitos (fig. 6e y 6f) que recorren toda la superficie y el volumen foliar (Jaramillo-Pérez, 2011). Este ensamblaje recomienda que las hojas de esta especie tienen una buena irrigación hídrica a lo largo y ancho del folíolo y, como resultado de esto, el efectivo enfriamiento de las hojas. Adicionalmente, esta disposición de cilindros parenquimatosos del esponjoso (fig. 6f) permite que el mesófilo resista la deformación mecánica que experimenta durante la transpiración (Balsamo et al., 2003), pues esta geometría es de las más resistentes y estables en la naturaleza.
Por otro lado, A. amorphoides presenta abundantes vénulas libres simples y/o bifurcadas rematando en traqueidas, las que aseguran la irrigación hacia las últimas células del margen de la lámina, lo que sugiere una respuesta rápida para la repartición del líquido como consecuencia de la atmósfera desecante que experimenta esta especie.
Conclusiones
Las características foliares descritas para Alvaradoa amorphoides como son las hojas compuestas y pubescentes, así como las modificaciones anatómicas a nivel de la epidermis y la presencia de compuestos ergásticos y los valores de ψh, claramente indicarían que esta especie se encuentra bajo condiciones de estrés hídrico y de gran insolación. Sin embargo, los valores de conductancia estomática sugieren que la interfase líquido-vapor formada en el mesófilo le permite un gran control en la temperatura y enfriamiento de la superficie foliar. Evidentemente este continuo abastecimiento de agua en forma de vapor hacia la capa límite requiere de garantía de agua líquida desde el suelo, factor que ha permitido su establecimiento en Valle de Vázquez, en donde existe un régimen de lluvias de verano y un constante abastecimiento hídrico al subsuelo debido a su cercanía con la Sierra Nevada, de Huautla y Guerrerense.
Los autores consideran que el fenómeno de plegamiento foliar en esta especie es una característica seleccionada para disminuir la radiación solar directa en las superficies fotosintéticas, que en conjunto con la capa límite generada por la rugosidad de la epidermis y el vapor de agua atrapado en esa zona contribuyen a evitar un posible sobrecalentamiento de las hojas.
Alvaradoa amorphoides es una planta que puede establecerse en ambientes cálido-secos gracias a las características anatómicas y morfológicas que ha desarrollado. Sin embargo, es importante investigar más a fondo el mecanismo del plegamiento foliar y el papel que juegan las proteínas transmembranales en los movimientos osmóticos celulares de los peciólulos.
Literatura citada
APG III, 2009. "An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III". Bot. J. Linn. Soc., 161: 105-121. [ Links ]
Ash, A.; B. Ellis, L.J. Hickey, K. Johnson, P. Wilf, y S. Wing, 1999. Manual of Leaf Architecture. Morfological description and categorization of dicotyledonous and net-veined monocotyledonous angiosperms. Leaf Architecture Working Group. 65 pp. [ Links ]
Balsamo, R.A.; A.M. Bauer, S.D. Davis, y B.M. Rice, 2003. "Leaf biomechanics, morphology, and anatomy of the deciduous mesophyte Prunus serrulata (Rosaceae) and the evergreen sclerophyllous shrub Heteromeles arbutifolia (Rosaceae)". Am. J. Bot., 90(1): 72-77. [ Links ]
Bidwell, R.G.S., 1979. Plant Physiology. 2a ed. Macmillan Publishing Co., Inc. New York. 726 pp. [ Links ]
Cortadi, A.; L. Andriolo, M.N. Campagna, M.L. Martínez, O.D. Sapio, A. Broussalis, M. Gattuso, y S. Gattuso, 2010. "Estudio de hojas, cortezas y leños de Simaroubaceae sensu lato de Argentina. Parte I. Alvaradoa subovata Cronquist, Pricamnia parvifolia Engl., Picramnia sellowii Planch. y Castela coccinea Griseb". Bol. Latinoam. Caribe Plant Med. Aromat., 9(1): 38-55. [ Links ]
Dawes, C.J., 1971. Biological Techniques in Electron Microscopy. Barnes y Noble, INC. New York, USA. 193 pp. [ Links ]
Dickison, W.C., 2000. Integrative plant anatomy. Harcourt Academy Press. USA. 533 pp. [ Links ]
Dilcher, D.L., 1974. "Approaches to the identification of angiosperms leaf remains". Bot. Rev., 40: 1-157. [ Links ]
Eames, A.J., y L.H. McDaniels, 1947. An Introduction to Plant Anatomy. 2a ed. Ed. McGraw-Hill Book Company, INC. New York, EU. pp. 380-396. [ Links ]
Evert, R.F., 2006. Esau Anatomía Vegetal. Meristemas, células y tejidos de las plantas: su estructura, función y desarrollo. 3ed. Omega. 614 pp. [ Links ]
Ely, F., y F. Torres, 2003. "Adaptaciones anatómico-estructurales foliares de Chaetolepis lindeniana (Naud.) Triana a lo largo de un gradiente altitudinal en el Páramo del Parque Nacional Sierra Nevada de Mérida (Venezuela)". Plant, 3(2): 101-115. [ Links ]
Fahn, A., 1978. Anatomía Vegetal. Ed. H. Blume Ediciones. Madrid, España. pp. 258-309. [ Links ]
Fahn, A., 1986. "Structural and Functional Properties of Trichomes of Xeromorphic Leaves". Ann. Bot., 57: 631-637. [ Links ]
Fernando, E.S.; P.A. Gadek, y C.J. Quinn, 1995. "Simaroubaceae, an artificial construct: evidence from rbcL sequence variation". Am. J. Bot., 82(1): 92-103. [ Links ]
Fernando, E.S., y C.J. Quinn, 1995. "Picramniaceae, a new family, and a recircumscription of Simaroubaceae". Taxon. 44(2):177-181. [ Links ]
Ferrarotto, M., y D. Jáuregui, 2008. "Relación entre aspectos anatómicos del pecíolo de Crotalaria juncea L. (Fabacea) y el movimiento nástico foliar". Polibotánica, 26: 127-136. [ Links ]
Flores-Hernández, N.; A. Quintanar-Isaías, A.T. Jaramillo-Pérez, y C. De la Paz Pérez O., 2013. "Plasticidad Fenotípica: el papel de las hojas en plantas leñosas xerófitas". ContactoS, 87: 37-45. [ Links ]
Franceschi, V.R., y H.T. Horner, Jr., 1980. "Calcium Oxalate Crystals in Plants". Botanical Review, 46(4): 361-427. [ Links ]
García, E., 1988. Modificaciones al Sistema de Clasificación Climática de Köppen para adaptarlo a las condiciones de la República Mexicana. Ed. Offset Larios. México. 217 pp. [ Links ]
Guzmán-Gutiérrez, S.L.; R. Gómez-Cancino, J.C. García-Zebadúa, N.C. Jiménez-Pérez, y R. Reyes-Chilpa, 2012. "Antidepressant activity of Litsea glaucescens essential oil: Identification of b-pinene and linalool as active principles". J. Ethnopharmacol., 143: 673-679. [ Links ]
Graham, A., 1976. "Studies in Neotropical Paleobotany. II. The Miocene Communities of Veracruz, Mexico". Ann. Missouri Bot. Gard., 63(4): 787-842. [ Links ]
Haston, E.; J.E. Richardson, P.F. Stevens, M.W. Chase, y D.J. Harris, 2009. "The linear angiosperm Phylogeny Group (LAPG) III: a linear sequence of the families in APG III". Bot. J. Linn. Soc., 161: 128-131. [ Links ]
Hickey, L.J., 1974. "Arquitectura de las hojas dicotiledóneas". Bol. Soc. Argent Bot., 16: 1-26. [ Links ]
Hintze, J., 2009. NCSS 2007. NCSS, LLC. Kaysville, Utah. Copyright © All Rights Reserved. www.ncss.com [ Links ]
INEGI, 2007. Carta Edafológica Jojutla de Juárez. E-14-A-69, escala 1:50 000 Km. INEGI, México. [ Links ]
Jaramillo-Pérez, A.T., 2011. "Anatomía foliar funcional de Alvaradoa amorphoides Liebm. (Picramniaceae) del estado de Morelos". Tesis de maestría. Universidad Autónoma Metropolitana. 129 pp. [ Links ]
Jones, H.G., 1992. Plants and microclimate, a quantitative approach to environmental plant physiology. Cambridge University Press, N.Y. 428 pp. [ Links ]
Kirkham, M.B., 2005. Principles of Soil and Plant Water Relations. Elsevier Academic Press. Kansas University. U.K. 500 pp. [ Links ]
Kubitzki, K., 2007. Picramniaceae. Picramniaceae (Engl.) Fernando y Quinn, Taxon, 44: 177 (1995) In: The Families and Genera of Vascular. [ Links ] Springer Berlin Heidelberg. vol. 9. pp 301-303. [ Links ]
Levizou, E.; P. Drilias, G.K. Psaras, e Y. Manetas, 2005. Nondestructive assessment of leaf chemistry and physiology through spectral reflectance measurements may be misleading when changes in trichome density co-occur. New Phytol., 165: 463-472. [ Links ]
Luckow, M., 2002. Anatomical Features of the Leaves in the Dichrostachys Group (Leguminosae: Mimosoideae) and their Utility for Phylogenetic Studies. Syst. Bot., 27(1): 29-40. [ Links ]
Maherali, H.; W.T. Pockman, y R.B. Jackson, 2004. Adaptative variation in the vulnerability of wood plants to xylem cavitation. Ecology, 85(8): 2184-2199. [ Links ]
Medlyn, B.E.; C.V.M. Barton, M.S.J. Broadmeadow, R. Ceulemans, P. De Angelis, M. Forstreuter, M. Freeman, S.B. Jackson, A. Kellomäki, E. Laitat, A. Rey, P. Roberntz, B.D. Sigurdsson, J. Strassemeyer, K. Wang, P.S. Curtis, y P.G. Jarvis, 2001. "Stomatal Conductance of Forest Species after Long-Term Exposure to Elevated CO2 Concentration: A Synthesis". New Phytol., 149: 247-264. [ Links ]
Meinzer, F., y G. Goldstein, 1985. "Some consequences in the Andean Giant Rosette Plant Espeletia timotensis". Ecology, 66(2): 512-520. [ Links ]
Molina-Montenegro, M.A., 2008. "Variación en la pubescencia foliar en plantas y sus implicaciones funcionales a lo largo de gradientes altitudinales". Ecosistemas 17(1): 146-154. http://www.revistaecosistemas.net/articulo.asp?Id=519 [ Links ]
Moysset, L., y E. Simon, 1991. "Secondary pulvinus of Robinia pseudoacacia (Leguminosae): Structural and Ultrastructural Features". Am. J. Bot., 78(11): 1467-1486. [ Links ]
Munsell Color Company, 2002. Munsell color charts for plant tissues. Pye Rare Books. Maryland, USA. 17 pp. [ Links ]
Nilsen, E., y D. Orcutt, 1996. The physiology of plants under deficit. Abiotic Factors. Willey, USA. 689 pp. [ Links ]
Pennington, T.D., y J. Sarukhán, 2005. Árboles tropicales de México. Manual para la indentificación de las principales especies. 3a ed. Universidad Nacional Autónoma de México, Fondo de Cultura Económica. México. DF 523 pp. [ Links ]
Quintanar-Isaías, A.; G. Ángeles, y J.A. Zavala-Hurtado, 2009. "Anatomía, índices físicos e hidráulicos de la madera de Gliricidia sepium (Jacq.) Steud". Madera y Bosques, 15(2): 71-91. [ Links ]
Raven, P.H.; R.F. Evert, y S.E. Eichhorn, 2005. Biology of plants. 7ª ed. W. H. Freeman and Co. USA. 686 pp. [ Links ]
Rebollar-Domínguez Silvia, C. De la Paz Pérez-Olvera y P. A. Quintanar-Isaías. 1996-1997. "Anatomía de la madera de ocho especies de la selva mediana subperennifolia de Quintana Roo, México". Rev. Biol. Trop., 44(3)/45(1): 66-77. [ Links ]
Rice-Evans, C.A.; N.J. Miller, P.G. Bolwell, P.M. Bramley, y J.B. Pridham, 1995. "The relative antioxidant activities of plant-derived polyphenolic flavonoids". Free Radical Research, 23: 375-383. [ Links ]
Roth, I., 1966. Anatomía de las plantas superiores. Universidad Central de Venezuela. Ediciones de la Biblioteca. Caracas. pp. 245-249 y 264-270. [ Links ]
Ruzin, S.E., 1999. Plant Microtechnique and Microscopy. Oxford University Press. New York. 322 pp. [ Links ]
Rzedowski, J., 1981. Vegetación de México. Ed. Limusa, México. pp. 189-203. [ Links ]
Riley, L.A.M., 1923. "Contributions to the Flora of Sinaloa: II". Bulletin of Miscellaneous Information (Royal Gardens, Kew), 4: 163-175. [ Links ]
Salas-Morales, S.H.; A. Saynes-Vásquez, y L. Schibli, 2003. "Flora de la Costa de Oaxaca, México: Lista Florística de la región de Zimatán". Bol. Soc. Bot. México, 72: 21-58. [ Links ]
Salazar, R., y C. Soihet, 2001. Manejo de semillas de 75 especies forestales de América Latina. vol. II. Serie Técnica, Nota técnica núm. 133. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Proyecto de semillas forestales (PROSEFOR). Costa Rica. pp. 65-66. [ Links ]
Santos Díaz, M.S., y N. Ochoa Alejo, 1990. "Adaptación de las plantas al déficit hídrico". Ciencia, 41: 333-344. [ Links ]
StataCorp., 2001. Stata Statistical Software: Release 7.0 College Station, TX: Stata Corporation. [ Links ]
Soltis, D.E.; P.S. Soltis, P.K. Endress, y M.W. Chase, 2005. Phylogeny and Evolution of Angiosperms. Sinauer Associates Inc. Publishers. USA. 370 pp. [ Links ]
Taiz, L., y E. Zeiger, 2006. Plant Physiology. 4a. ed. Sinauer Associates, Inc., Sunderland. 764 pp. [ Links ]
Vera-Estrella, R., B. J. Barkla y O. Pantoja, 2005. "La Biología y la Fisiología de las Acuaporinas de Plantas". BioJournal, 1: 1-15. [ Links ]
Watson, L., y M.J. Dallwitz, 1992. The families of flowering plants: descriptions, illustrations, identification and information retrieval. Version: 30th April 2009. http://delta-intkey.com [ Links ]
Yabuki, K., 2004. Photosynthetic Rate and Dynamic Environment. Kluwer Academic Publishers. Netherlands. 136 pp. [ Links ]
Yan, X.H.; F.X. Zhang, H.H. Xie, y X.Y. Wei, 2000. "A review of the studies on chemicals constituents from Litsea Lam". J. Trop. Subtrop. Bot., 8: 171-176. [ Links ]
Zar, J.H., 1984. Biostatistical Analysis. 2ª ed. Prentice Hall. New Jersey. 718 pp. [ Links ]
Zindler-Frank, E., 1987. "Calcium oxalate crystals in legumes". In Advances in legume systematics. Part 3. Ed C.H. Stirton. Kew: Royal Botanic Gardens. pp. 279-316. [ Links ]














