Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.40 México ago. 2015
Hongos asociados con el declinamiento de la manzanita Arctostaphylos pungens HBK en la Sierra Fría de Aguascalientes, México
Fungi associated with the decline of the manzanita (Arctostaphylos pungens HBK.) in the Sierra Fría from Aguascalientes state, Mexico
Moreno-Rico, O.1, G.J., Marmolejo-Monsivais2, G. Sánchez-Martínez3, R. Díaz-Moreno4, J.J. Luna-Ruíz5, J. Sosa-Ramírez5, K.J. Pérez-Hernández1, y C.E. Moreno-Manzano1
1 Departamento de Microbiología, Centro de Ciencias Básicas, Universidad Autónoma de Aguascalientes (UAA), Av. Universidad núm. 940, col. Cd. Universitaria, CP 20131 Aguascalientes, Ags., México;
2 Laboratorio de Patología y Micología Forestal, Facultad de Ciencias Forestales, UANL, Carr. Nac. Km 145, C.P. 67700, Linares, N.L., México.
3 Campo Experimental Pabellón-Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias, Km. 32.5 Carr. Ags.-Zac., CP 20660, Pabellón de Arteaga, Ags.,
4 Escuela de Ciencias Forestales, Universidad Juárez del Estado de Durango, Rio Papaloapan y Prolongación Chihuahua S/N, col. del Valle Sur, CP 34129, Durango, Dgo., México.
5 Depto. de Disciplinas Agrícolas, Centro de Ciencias Agropecuarias, UAA, Jesús María, Ags. Correo electrónico: omoreno@correo.uaa.mx
Recibido: 6 febrero 2014.
Aceptado: 12 enero 2015.
Resumen
La manzanita (Arctostaphylos pungens) es un arbusto que se encuentra con regularidad en la Sierra Fría del estado de Aguascalientes, México. Este arbusto, al igual que otras plantas silvestres, es afectado por factores bióticos, como las enfermedades, que pueden causar desde daños insignificantes hasta la muerte de las plantas. Los objetivos de este trabajo fueron: 1) identificar los hongos relacionados con el declinamiento de la manzanita en la Sierra Fría de Aguascalientes y 2) conocer la incidencia y severidad de las enfermedades causadas por hongos que afectan tallos y ramas de la manzanita. En cada uno de los sitios visitados se realizó un transecto, de dimensiones variables, en una dirección determinada al azar, que incluyó 100 arbustos, para revisar y estimar: a) el porcentaje de plantas sanas, enfermas y muertas, y b) la incidencia, severidad y distribución de las enfermedades. Los fitopatógenos se identificaron con base en los síntomas y signos que causan comparándolos con lo reportado en la bibliografía. Las enfermedades más importantes resultaron las causadas por los hongos basidiomicetos Inonotus aff. jamaicensis y Phellinus arctostaphyli, que causan pudrición blanca de la madera y cancrosis en la base del tallo y en ramas. Inonotus aff. jamaicensis se encontró en 20 de los 21 sitios muestreados variando su incidencia de 3 a 25%, mientras que P. arctostaphyli se encontró en 17 de los 21 sitios muestreados variando su incidencia de 1 a 25%. La severidad de las cancrosis varió de 2 a 44 %. También, se identificaron manchas foliares causadas por Harknessia arctostaphyli, Coccomyces spp., y Passalora spp. Se reporta por primera ocasión la presencia de Phellinus arctostaphyli en Aguascalientes. Se reporta por primera vez en México la presencia de Inonotus aff. jamaicensis, Harknessia arctostaphyli, Coccomyces spp. y Passalora spp.
Abstract
Manzanita (Arctostaphylos pungens) is a shrub regularly found in Sierra Fría mountain Aguascalientes, Mexico. Like other wild plants, it is affected by biotic factors such as disease, which can cause anything from minor damage to death. The objectives of this work were: 1) To identify the fungi associated with decline of Manzanita in the Sierra Fría mountain of Aguascalientes and 2) To determine the incidence and severity of fungal diseases affecting the stems and branches of Manzanita. In each visited site a transect of variable dimension and random direction was set, which included 100 shrubs in order to analize and estimate: a) the percentage of healthy, sick and dead plants, and b) the incidence, severity and distribution of diseases. Pathogens were identified based on symptoms and signs as compared with those reported in literature. The most important diseases were caused by the basidiomycetes Inonotus aff. jamaicensis and Phellinus arctostaphyli, which cause white wood-rot and canker at the base of stems and branches. Inonotus aff. jamaicensis was found in 20 of the 21 sampled sites whit a varying incidence of 3-25 %, while P. arctostaphyli was found in 17 of the 21 sampled sites with a varying incidence of 1-25 %. The severity of cankers ranged from 2 to 44%. Leaf spot caused by Harknessia arctostaphyli, Coccomyces spp. and Passalora spp. were also identified. The presence of Phellinus arctostaphyli is reported for the first time in Aguascalientes. The presence of Inonotus aff. jamaicensis, Harknessia arctostaphyli, Coccomyces spp. and Passalora spp. is reported for the first time in Mexico.
Introducción
La manzanita (Arctostahylos pungens HBK) es una especie de arbusto originaria de México que se distribuye desde el sur de Estados Unidos hasta los estados de Veracruz y Oaxaca, México. Esta planta se encuentra en todas las zonas montañosas desarrollándose entre los 1375 a 3230 m.s.n.m. (Márquez-Linares et al., 2004), encontrándose con regularidad en la Sierra Fría de Aguascalientes cumpliendo una función ecológica importante en su entorno. Según Márquez-Linares et al. (2004), A. pungens se establece en las primeras etapas del proceso de sucesión ecológica después de un disturbio, lo que la convierte en una planta importante para el control de la erosión. Los frutos de esta planta sirven de alimento a diferentes especies de fauna silvestre. En el aspecto utilitario, A. pungens se emplea como planta medicinal, como edulcolorante, como saborizante de agua fresca, como leña de uso doméstico en áreas rurales o en rosticerías de pollos en áreas urbanas (Márquez-Linares et al., 2004). Al igual que otras plantas silvestres y cultivadas A. pungens es afectada por enfermedades que pueden causar desde daños insignificantes hasta su muerte. Poco se conoce de estas enfermedades tanto en México como en el mundo en general. La Universidad de California de EU, en su Programa Integrado de Manejo de Plagas (UC IPM) (http://www.ipm.ucdavis.edu/PMG/GARDEN/PLANTS/manzanita.html) señala que la manzanita puede ser afectada por varias enfermedades, entre ellas, una bacteriosis causada por Pseudomonas syringae Van Hall, la pudrición de las raíces y base del tallo causada por Phytophthora ramorum Werres, De Cock y Man in`t Veld y P. cinnamomi Rands. Además, señala que las especies de los hongos Nectria (Tode) Fr. y Cytospora Ehrenb pueden causar cancrosis de los tallos. También, menciona que las manchas foliares en la manzanita son causadas por diferentes especies de hongos de los géneros Alternaria Nees., Gloeosporium Desm. y Mont., Cercospora Fres., Marssonina Magn.y Entomosporium Lev., entre otros. Por otra parte, Brooks y Ferrin (1994) señalan que el hongo Botryosphaeria dothidea (Moug. ex Fr.) Ces. y De Not., causa cancrosis en los tallos de Arctostahylos catalinae Wells, A. elegans (Geps.) Wells, A. glandulosa Eastw., A. glauca Lindl.y A. pungens, entre otras especies de manzanitas. Popp y Lundquist (2006) mencionan que Fomes arctostaphylii (ahora Phellinus arctostaphyli (Long) Niemelä) afecta a Arctostaphylus pringeli Parry en Nuevo México y a A. pringeli, A. pungens, A uva-ursi (L.) Spreng, A. patula Greene y Arcotstaphylos spp. en Arizona, EU. Holzman et al. (2003) realizaron un estudio sobre las enfermedades que causan problemas en Arctostaphylos myrtifolia Parry (manzanita ione) y A. viscida Parry en California, EU, encontrando cancrosis en las ramas causadas por Fusiccocum Corda. y pudrición de las raíces y base del tallo por Phytophthora cinnamomi. En México, Esqueda (2009) señala que Phellinus arctostaphyli es un taxón nuevo para la micobiota mexicana, recolectado en Arctostaphylos pungens en bosque de pino-encino de la Reserva de la Biosfera El Pinacate y Gran Desierto de Altar, en el extremo noroeste de Sonora, México. Díaz et al. (2009) señalan la presencia de P. arctostaphyli en Arctostaphylos pungens en el estado de Chihuahua, México. Cibrián et al. (2007) señalan que Botryosphaeria dothidea (Moug. ex Fr.) Ces. y De Not., cuyo anomorfo es Fusicocum aesculi Corda causa cancrosis y muerte descendente de las ramas de la manzanita, aunque no la muerte de las plantas, y que afecta a arbustos que se encuentran en sitios con suelos pobres. También, indican que B. dothidea es un hongo patógeno débil aunque causa daños importantes no sólo a manzanita, sino también a otros árboles forestales. El presente trabajo tuvo como objetivos: 1) Identificar los hongos relacionados con el declinamiento de la manzanita y 2) Determinar la incidencia y la severidad de las enfermedades fúngicas de la manzanita.
Material y métodos
Identificación de los hongos asociados con el declinamiento de la manzanita
La identificación de los hongos relacionados con el declinamiento se realizó con base en los síntomas y signos que forman. Estos hongos fueron agrupado en: a) los que causan cancrosis y pudrición de tallos y ramas y b) los que causan manchas foliares. Respecto a los primeros, se registraron los síntomas y se recolectaron muestras de basidiomas. Respecto a las enfermedades foliares, se recolectaron hojas con síntomas de manchas causadas por tres hongos diferentes. Las muestras fueron colocadas en bolsas de plástico limpias y trasladadas al laboratorio del Departamento de Microbiología, Centro de Ciencias Básicas de la Universidad Autónoma de Aguascalientes (UAA). Para el aislamiento de estos hongos se cortaron secciones (5 mm2) de la hoja, del límite del avance de las lesiones, que fueron desinfestadas en hipoclorito de sodio (1%), durante 1-2 min. Posteriormente, en condiciones asépticas, se enjuagaron en agua destilada estéril 2-3 veces, se secaron en papel estéril y 4-5 secciones fueron sembradas en cajas de petri con medio de cultivo papa dextrosa agar (PDA: papa 200 g, dextrosa 20 g, agar 15 g, 800 ml de agua destilada), extracto de malta agar (EMA: 20 g de extracto de malta, 20 g de agar y 1000 ml de agua) u otro apropiado al hongo (Agrios, 2005; Crous et al., 1999). Para obtener fotografías con el microscopio electrónico de barrido, se cortaron secciones de hojas de 0.5 cm2 con una navaja de afeitar y se fijaron en glutaraldehído al 1.5% con pH 7.2 durante 24 h. Las secciones se lavaron tres veces con el amortiguador de fosfatos durante un minuto. Después, cada muestra se deshidrató en una serie de soluciones graduales de etanol (60, 70, 80, 96 y 100%) durante 10 a 15 min en cada una. Las muestras se secaran a punto crítico con CO2 en una secadora Sandri- 2 780A® (TOUSIMIS Research Corporation, Rockville, EU), se colocaron sobre un portamuestras usando una cinta doble adhesiva de cobre (o carbón) y se recubrieron con oro durante 4 min. en una ionizadora JFC-1100® (JEOL LTD, Tokio, Japón). Las muestras se observaron en un microscopio electrónico de barrido JSM-35C® (JEOL LTD, Tokio, Japón) en el laboratorio de Microscopia Electrónica del Departamento de Biología de la Universidad Autónoma de Aguascalientes. Los síntomas y signos fueron comparados con la descripción de enfermedades reportadas previamente por la bibliografía especializada correspondiente al grupo taxonómico del hongo (Barnet y Hunter, 1999; Gilbertson y Ryvarden, 1987; Nag Raj y DiCosmo, 1981; Nag Raj, 1993; Sherwood, 1980; Sutton, 1980).
Incidencia y severidad de las cancrósis e incidencia de las enfermedades foliares
Se realizaron viajes de estudio a diferentes localidades de la Sierra Fría, Aguascalientes (tabla 1). Cada uno de los sitios visitados fueron georeferenciados y en cada uno se estableció un transecto de dimensiones variables en una dirección determinada al azar, que incluyó 100 arbustos que fueron revisados con el fin de estimar la distribución e incidencia (presencia o ausencia en %) de las enfermedades foliares y las cancrosis. La severidad se estimó visualmente, como el porcentaje de tejido dañado en los tallos (a nivel del suelo) de la manzanita. La severidad se estimó sólo para las cancrosis que fueron consideradas como la enfermedad más importante de las manzanitas.
Análisis de la información
Los datos se ordenaron para su análisis de una manera descriptiva. Los porcentajes de árboles dañados por los diferentes hongos se obtuvieron contando el número de árboles afectados a lo largo del transecto de dimensiones variables que tuvo como límite 100 árboles.
Resultados y discusión
Las enfermedades más importantes que fueron observadas en las manzanitas correspondieron a dos especies de hongos basidiomicetos del grupo de los poliporoides que causaron cancrosis y pudrición blanca.
También se encontraron manchas foliares causadas por los hongos Harknessia arctostaphyli, Coccomyces spp. y por Passalora spp.
Identificación de los hongos que causan cancrosis
Phellinus arctostaphyli (Long) Niemelä
Síntomas. La acción degradadora de la madera por las enzimas (celulasa, hemicelulasa, pectina metil estereasa, poligalacturonasa, entre otras) que secreta este hongo causa la formación de cancros en los tallos y ramas de la manzanita (Agrios, 2005). Las cancrosis, cuando son pequeñas, tienen forma de huso de 5 a 20 cm de longitud y color oscuro. Con el paso del tiempo estas cancrosis pueden crecer a lo largo de todo el tallo y de las ramas principales del arbusto y tener varios metros de longitud. En muchos de los arbustos revisados sólo se observó la presencia de cancros pero no de cuerpos fructíferos (basidiomas) que nos indicara cuál era el fitopatógeno que causa la enfermedad. Sin embargo, en muchos arbustos pudimos observar la presencia de uno o varios basidiomas en las cancrosis lo que nos indicó que este hongo causa esos síntomas y enfermedad. Inclusive, en varias ocasiones encontramos que este fitopatógeno puede formar muchos basidiomas a lo largo de las cancrosis, en la línea de avance de la enfermedad y que presentaba un crecimiento activo de las hifas señalándonos, con mucha probabilidad, que P. arctostaphyli es el causante de esas cancrosis (fig. 1 A-B). El desarrollo y crecimiento de P. arctostaphyli se realiza tanto en el duramen como la albura del arbusto causando una pudrición blanca de los troncos y una masa húmeda, suelta y esponjosa de color blancuzco, que contrasta con el color rojo del duramen (fig. 1D). La madera afectada no tiene la consistencia ni fuerza para soportar los vientos fuertes por lo que las ramas dañadas, e inclusive los tallos de los arbustos a nivel del suelo, se rompen causando la muerte de la planta o parte de ella (Agrios, 2005; Gilbertson y Ryvarden, 1987).

Signos. El basidioma que forma P. arctostaphyli es perenne, convexo a ungulado, dimidiado, de 20-80 mm de diámetro y 10-30 mm de grosor. El píleo es glabro, rimoso, grisáceo a negro con la edad; margen con color café claro, redondeado. El himenóforo es café grisáceo pálido a café óxido pálido, liso, poros circulares, 5-6 por mm, disepimento grueso y enteros; contexto café rojizo, azonado, firme y leñoso hasta 2 cm de espesor (fig. 1 A-C). Las capas de poros son indistintamente estratificadas, las capas viejas rellenas con micelio. El sistema hifal es dimítico, las hifas generativas de septos simples, hialinas a pálido amarillento de paredes delgadas, de 1.6-3.6 µm de diámetro, hifas esqueléticas bifurcadas, marrón obscuro a pardo rojizas, de paredes gruesas, 3.2-4.8 µm de diámetro. Setas poco frecuentes, sublobuladas, paredes gruesas pardo rojizas de 12.5-27.5 (18.6) x 6-8.5 µm, mucho más pequeñas que las reportadas por Gilbertson y Ryvarden (1987), 32-48 x 5.6-8.8 µm. Las basidiosporas son hialinas, ovoides, de paredes gruesas, lisas e inamiloides de 5-7 (5.7) x 3-5 (4.3) µm, ligeramente más grandes que las reportadas por Gilbertson y Ryvarden (1987), 4.8-6 x 3.4-4.4 µm (fig. 1D). Las características anteriormente señaladas concuerdan con las descritas para el hongo Phellinus arctostaphyli (Long) Niemelä (Cibrián et al., 2007; Gilbertson y Ryvarden, 1986, 1987; Murril, 1904).
Distribución y patogenicidad. Con base en la observación de los basidiomas podemos señalar que P. arctostaphyli fue encontrado en 17 de los 21 sitios (tabla 1) muestreados, variando su incidencia de 1%, en La Sauda, Jesús María, Ags., hasta 25% en El Aserradero, San José de Gracia, Ags. (tabla 1). A este hongo se le encontró con mayor frecuencia afectando a arbustos maduros y sobremaduros, pero no en arbustos muy jóvenes (tabla 1). Respecto a la distribución de P. arctostaphyli en México, Cibrián et al. (2007) señalan que es difícil encontrarlo. Sin embargo, en este estudio lo encontramos con relativa facilidad. Respecto a la patogenicidad de P. arctostaphyli, Gilbertson y Ryvarden (1987) señalan que esta especie causa pudrición blanca en arbustos vivos, principalmente en diferentes especies de Arctostaphylos, aunque también ha sido observado en Adenostoma Hook. y Arn. y raramente en Cercocarpus Kunt. Para nuestro conocimiento, ésta es la primera vez que se reporta P. arctostaphyli en A. pungens en la Sierra Fría del estado de Aguascalientes, México (Cibrián et al., 2007).
Inonotus aff. jamaicensis Murrill
Síntomas. Los síntomas que causa este hongo son similares a los que causa Phellinus arctostaphyli. Sin embargo, en las cancrosis producidas por este hongo se observaron los basidiomas característicos de este género (fig. 2 A-F). También, similar a P. arctoastaphyli, se observó frecuentemente la presencia de muchos basidiomas, activos y/o inactivos, a lo largo de una cancrosis de varios metros de longitud (fig. 2 D-F).

Signos. Los basidiomas son anuales (fig. 2 A-G), de 30-85 x 24-36 x 10-20 mm, imbricados, efuso-reflejos a pileado-sésiles, ampliamente adheridos, de forma triangular, conchado, convexo, de consistencia corchosa a leñosa. El píleo es zonado concéntricamente, de color marrón en la base del píleo, naranja grisáceo en el centro, hacia el margen se encuentra cubierto por un micelio algodonoso de color amarillento pálido y algunos ejemplares maduros están cubiertos por una costra negra, tomentoso a híspido, con algunas porciones glabras. Margen entero, liso, de agudo a obtuso, fértil o estéril, involuto, concoloro con el píleo. El himenóforo con poros circulares a angulares, 3-5 por mm, con el borde fimbriado a flocoso, de color marrón oscuro, hacia la base y de color amarillo claro hacia el margen. Los tubos son de hasta 8 mm de longitud, quebradizos, de color marrón óxido. El contexto es de hasta 20 mm de grosor, con corazón granular poco desarrollado a bien desarrollado, de color marrón claro. El sistema hifal es monomítico con hifas generativas de septos simples de color marrón amarillento a marrón rojizo en hidróxido de potasio (KOH), de pared delgada a gruesa, de 2.4-6.4 µm de diámetro. Los basidios miden de 16.8-23.2 x 4.8-5.6 µm, claviformes, tetraspóricos, hialinos en KOH. Las basidiosporas miden de 5-6.5 (6.8) x 4-5 (4.3) µm, elipsoidales a subglobosas, de pared gruesa, de color amarillento a marrón rojizo en KOH, inamiloides, muy abundantes (fig. 2H). Las características anteriores concuerdan con las señaladas por varios autores para Inonotus jamaicensis Murrill (Cibrián et al., 2007; Díaz, et al, 2009; Gilbertson y Ryvarden, 1986, 1987; Murril, 1904; Popp y Lundquist, 2006). No obstante, Valenzuela-Garza R. (ENCB, IPN, México, comunicación personal) señala que, después de revisar la morfología macro y microscópica de estos basidiomas y compararlas con la monografía mundial de Inonotus, los especímenes no concuerdan con ninguna especie de Inonotus conocida. Señala que sólo se parece, en algunas características, a I. jamaicensis y a I. rheades (Pers.) P. Karst. Sin embargo, del primero se diferencia por el tomento que presenta y por las esporas que son ligeramente más pequeñas; del segundo por el hospedero y porque el corazón granular es más desarrollado en I. rheades, misma que sólo crece en Populus (L.), aunque también se ha registrado en Quercus (L.). Por estas razones, es necesario tener aislamientos de varios especímenes, de distintos árboles y arbustos, para realizarles estudios filogenéticos y corroborar si es nueva especie ó a qué especie corresponde.
Distribución. Inonotus aff. jamaicensis Murrill se encontró en 20 de las 21 localidades muestreadas variando su incidencia de 3%, en Barbechitos, Rincón de Romos, Ags., a 25% en La Ciénega, Calvillo, Ags. Para nuestro conocimiento, esta es la primera vez que se reporta este hongo en manzanitas en la Sierra Fría de Aguascalientes, México (Cibrián et al., 2007).
Incidencia y severidad de las cancrósis. Phellinus arctostaphyli e Inonotus aff. jamaicensis fueron los dos hongos relacionados con las cancrosis observadas en la manzanita en este estudio. En todos los sitios muestreados las manzanitas presentaron cancrosis en las bases de sus tallos y en las ramas. La incidencia de estas cancrosis, por ambos hongos, en la base de los tallos varió de un 20 % (Mesa de Los Charcos, Calvillo, Ags.) a 100% en nueve sitios diferentes (tabla 1). La severidad media de estas cancrosis varió de 2 %, en La Ciénega, Calvillo, Ags., hasta un 44 % en La Sauda, Jesús María, Ags. (tabla 1).
Identificación de los hongos que causan manchas foliares
Harknessia arctostaphyli Cooke & Harkn.
Síntomas. Este hongo causa manchas oscuras que generalmente inician en el ápice de la hoja, de 3-4 milímetros de longitud. En estas lesiones incipientes se pueden observar conidiomas inmaduros y de color amarillento (fig. 3 A, B). Conforme transcurren los días las lesiones van creciendo en tamaño hasta cubrir toda la hoja (fig. 3 A, D). En las hojas parcial o completamente destruidas los conidiomas toman un color oscuro, por la maduración de sus conidios, observándose a manera de pequeñas puntuaciones, de 0.3 mm de diámetro, que sobresalen la superficie de la lámina foliar y rodeados por el tejido vegetal amarillento. Finalmente, las hojas muertas presentan conidiomas de color negro que pueden estar rodeados o no por un halo de tejido amarillento ó blanquecino (fig. 3 D).

Signos. En las hojas el hongo forma conidiomas estromáticos (fig. 3 C-H), anfígenos, abundantes, esparcidos o gregarios, subepidermales, inmersos al principio pero luego errumpentes, 180-360 mµ ( 275 mµ), unilocular, glabro, sin ostiolo. El área de dehiscencia rodeado por un halo amarillo pálido (furfuráceo) a hialino. Los conidióforos son filiformes: Los macroconidios (fig. 3 H, I) no poseen bandas, están compuestos por un cuerpo conidial y un apéndice basal color café oscuro, de 20-28 x 10-15 mµ (
275 mµ), unilocular, glabro, sin ostiolo. El área de dehiscencia rodeado por un halo amarillo pálido (furfuráceo) a hialino. Los conidióforos son filiformes: Los macroconidios (fig. 3 H, I) no poseen bandas, están compuestos por un cuerpo conidial y un apéndice basal color café oscuro, de 20-28 x 10-15 mµ ( = 21 x 12). El apéndice basal es tubular, más o menos cilíndrico, con pared delgada, lisa y hialina y su cociente largo/ancho = 2:1. Los microconidios (fig. 3 F, G) son claviformes a ovoides con un ápice ampliamente redondeado y el otro estrecho y truncado, unicelulares, hialinos y lisos 2-6 x 1-3 µm (
= 21 x 12). El apéndice basal es tubular, más o menos cilíndrico, con pared delgada, lisa y hialina y su cociente largo/ancho = 2:1. Los microconidios (fig. 3 F, G) son claviformes a ovoides con un ápice ampliamente redondeado y el otro estrecho y truncado, unicelulares, hialinos y lisos 2-6 x 1-3 µm ( = 4.8 x 2.1). Todas las características señaladas anteriormente concuerdan con la descripción de Harknessia arctostaphyli señaladas por Nag Raj y DiCosmo (1981), Nag Raj, (1993) y Sutton (1980).
= 4.8 x 2.1). Todas las características señaladas anteriormente concuerdan con la descripción de Harknessia arctostaphyli señaladas por Nag Raj y DiCosmo (1981), Nag Raj, (1993) y Sutton (1980).
Distribución, incidencia y patogenicidad. Se encontró a este hongo en todos los sitios de muestreo (tabla 1). Su incidencia fue del 100%. Se reporta que H. arctostaphyli se ha encontrado, en California EU, en hojas caídas de Arbutus menziesii Pursh (Anónimo, 1960; French, 1989), en hojas de Arctostaphylos bicolor (Nut.) A. Gray (Nag Raj y DiCosmo, 1981), de Arctostaphylos spumila Nutt. (Nag Raj, 1993; Nag Raj y DiCosmo, 1981), en hojas muertas de Arctostaphylos spp. y en hojas de Arctostaphylos uva-ursi (Nag Raj y DiCosmo, 1981; Nag Raj, 1993), en hojas muertas de Arctostaphylos viscida (Anónimo 1931-1970), en hojas de Xylococcus bicolor Nutt. (Egliti et al., 1966) y en hojas muertas de Arctostaphylos pungens (Anónimo, 1960; French, 1989). También se ha reportado en Arctostaphylos bicolor en Oregón, EU (Nag Raj y DiCosmo, 1981). Se reporta que este hongo sólo se encuentra distribuido en EU (Nag Raj, 1993). Respecto a la patogenicidad de H. arctostaphyli, Crous y Rogers (2001) señalan que las inoculaciones en hojas de doce especies diferentes de eucaliptos con H. hawaiiensis F. Stevens y E. Young produjeron lesiones grandes. Aunque varias especies de Harknessia pueden ser patogénicas poco se conoce sobre su patogenicidad y, en general, son señaladas como de poca importancia económica (Seonju et al., 2004; Crous et al., 2012). Más recientemente, Crous et al. (2012), señalan que las especies de este género se encuentran comúnmente asociadas a manchas foliares y muerte descendente de ramitas de muchas plantas. Sin embargo, también señalan que otras especies se han observado en hojas muertas. Por otra parte, Seonju et al. (2004), señalan que el teleomorfo de Harknessia es el género Wuestneia Auersw. ex Fuckel (Melanconidaceae, Diaporthales). Los peritecios son estromáticos formando ascas con tallos deliquicentes y ascosporas unicelulares, elipsoidales a inequilaterales y hialinas. En este trabajo, nosotros damos evidencia de que Harknessia arctostaphyli es muy posiblemente un hongo patogénico causante de las manchas foliares de Arctostaphylos pungens. A pesar de intentarlo muchas veces y en diferentes medios de cultivo, no pudimos aislar a este hongo. Por lo tanto, es necesario aislarlo y realizar los postulados de Koch para confirmar su patogenicidad. Para nuestro conocimiento, este es el primer reporte sobre la presencia de este hongo en manzanita en México.
Coccomyces spp.
Síntomas. En las hojas de la manzanita este hongo ascomiceto forma manchas circulares, al inicio de 2-3 mm de diámetro, de color obscuro, con la parte central de color pardo clara, rodeadas o no de un halo amarillento (figs. 4 A y B). En la zona pardo claro de las lesiones el hongo desarrolla varios apotecios oscuros, situados de manera irregular aunque también puede formar uno o varios círculos concéntricos con ellos. Con el paso del tiempo las lesiones llegan a medir hasta 7-10 mm de diámetro observándose que las nervaduras que rodean la lesión sufren necrosis y toman un color negro. Finalmente, las hojas toman un color amarillo se secan y mueren.

Signos. Es un hongo epígeo. Los apotecios son circulares, ligeramente errumpentes, cubiertos por un estroma negro, delgado, que se abre por fisuras en forma de estrella; las ascas son claviformes de 90-110 x 10-12 µm, sin opéculo, algo puntiagudas y con el ápice ligeramente engrosado, con una capa gelatinosa que las rodea; las ascosporas son cilíndricas de 45-55 x 2-2.5 µm, hialinas, unicelulares o con un septo, de 6-8 por asca; los parafisos son septados, ramificados y con un hinchamiento apical. Su fase conidial es Cylindrosporium Unger (Cibrián et al., 2007; Romero, 1999; Sherwood, 1980). También, Sherwod (1980) señala que algunas especies de Coccomyces producen pequeños picnidios aplanados, lenticulares subcuticulares o intraepidermales de color café, con fiálides simples, hialinas, subuladas formando una capa basal simple. Éstos a su vez producen conidios hialinos, pequeños, unicelulares y baciliformes. Estos picnidios son asignados al género Leptothyrium Kunze. Se ha reportado a Coccomyces arctostaphyli sobre hojas muertas de Arctostaphylus uva-ursi en el noreste y centro de Europa y en el oeste de los EU (Ellis y Ellis, 1989; Sherwod, 1980). Respecto a C. arctostaphyli y la especie de Coccomyces encontrada en manzanita en este estudio, podemos señalar que existen diferencias marcadas en las dimensiones de las diferentes estructuras de los apotecios, ascas y ascosporas (tabla 2). Estas diferencias nos señalan que Coccomyces encontrado en este estudio puede ser una nueva especie.
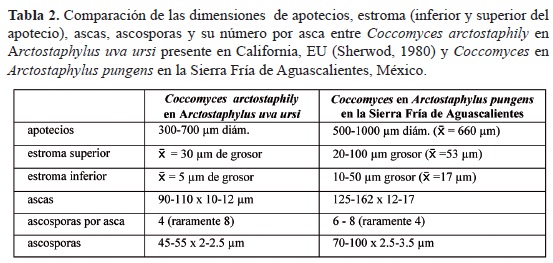
Distribución incidencia y patogenicidad. Este hongo fue encontrado sólo en Mesa de los Charcos, Calvillo, Ags., con una incidencia de 45%. Casualmente, también fue observado en Los Alamitos y Laguna Seca, San José de Gracia, Ags., sitios no incluidos en este estudio. Respecto a su patogenicidad, Sherwod (1980) señala que hay 50 especies descritas y que la mayoría se han encontrado en diferentes partes vegetativas de plantas recién muertas. Sin embargo, señala que posiblemente este hongo afecta a los tejidos vivos y fructifica cuando estos tejidos mueren. Por su parte, Romero (1999) menciona que entre las especies que tiene este género hay cinco que afectan al género Prunus (L.), causando enfermedades conocidas con el nombre genérico de "Tiro de Munición". La especie más importante es C. hiemalis B.B. Higgins que causa la mancha amarilla o mancha foliar del cerezo. Más recientemente Cheng-Lin y Piepenbring (2009) señalan que en realidad hay cerca de 100 especies de Coccomyces y de Lophodermium Chevall. y que ambos son los géneros de Rhytismatales más grandes, en número de especies, seguidos por Hypoderma De Not. La especie de Coccomyces que aquí se reporta afecta a hojas vivas de manzanita, por lo tanto posiblemente sea un hongo fitopatógeno. Desafortunadamente, no hemos podido aislar a este hongo para poder realizar los postulados de Koch y confirmar su patogenicidad. Éste es el primer reporte de la presencia de Coccomyces spp. afectando hojas de manzanita en México.
Mancha foliar por Passalora spp.
Síntomas. Este hongo causa manchas en las hojas que al inicio son circulares, de color oscuro. Cuando maduran pueden o no presentar el centro de la lesión de color pardo claro. Las manchas al principio son circulares, de 1 a 2 mm de diámetro; sin embargo, conforme pasa el tiempo toman una forma irregular, los bordes son delimitados por las nervaduras de las hojas y pueden o no tener un halo amarilllo (fig. 5 A, B). En el tejido amarillo las nervaduras se observan de color obscuro.

Signos. El hongo forma conidiomas sinematosos sobre el substrato natural, los conidióforos y conidos son pigmentados (fig. 5 C). Los conidióforos presentan cicatrices en los sitios donde se formó y desprendió un conidio con el locus engrosado y oscuro, ramificados. Los conidios son simples (fig. 5 E y F), raramente en cadenas; este hongo causa manchas foliares y su micelio es interno (fig. 5 D). Estas características coinciden para el género Passalora Fr. (Barnet y Hunter, 1999; Crous y Braun, 1996, 2003; Crous et al., 2000; Seifert et al., 2011).
Distribución incidencia y patogenicidad. Al igual que H. arctostaphyli este hongo fue encontrado en todos los sitios de muestreo y en todos los arbustos revisados siendo su incidencia de 100% (tabla 1). Al parecer, ésta es una nueva especie del género Passalora y no se tiene ningún reporte en la manzanita en México. Desafortunadamente, no hemos podido aislarlo por lo que tampoco se han realizado pruebas de patogenicidad. El género Passalora es un hongo anomórfico (fase asexual) que se encuentra ampliamente distribuido a través del mundo. Las especies de este género se encuentran afectando a diferentes tipos de plantas hospederas, desde herbáceas a árboles frutales, de sombra y forestales, donde causan manchas foliares (Crous y Braun 2003).
Conclusiones
En este estudio se encontraron cinco hongos relacionadas con el declinamiento de la manzanita en la Sierra Fría de Aguascalientes, Mexico. Se encontró que Inonotus aff. jamaicensis y Phellinus arctostaphyli causan pudrición blanca, cancrosis y muerte de arbustos de manzanita maduros y viejos. Se consideró, por los daños que causan, que éstos son los dos hongos más importantes involucrados con el declinamiento de la manzanita. Las cancrosis causadas por estos dos hongos estuvieron presentes en todos los sitios de estudio, principalmente en árboles maduros y sobremaduros. También, se encontraron a los hongos Harknessia arctostaphyli, Coccomyces spp. y a Passalora spp., causando manchas foliares, clorosis y muerte de las hojas de manzanita. H. arctostaphyli y Passalora, al igual que las cancrosis, estuvieron presentes en todos los sitios estudiados. Las manchas foliares causadas por el hongo Coccomyces spp. se encontraron sólo en uno de los sitios estudiados.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología, del estado de Aguascalientes, por el apoyo brindado para la realización del proyecto intitulado "Interacciones Ecológicas y Aprovechamiento de la Manzanita (Arctostaphylos pungens) en la Sierra Fría del Estado de Aguascalientes", con la Clave: Ags-2009-C04-133380. A la Secretaría del Medio Ambiente del estado de Aguascalientes, a la Asociación Sierra Fría A.C. y a la Universidad Autónoma de Aguascalientes por los apoyos brindados para la realización del presente estudio. A Francisco Juárez Reyes, guardabosques de la Secretaria del Medio Ambiente de Ags., por el apoyo, interés, entusiasmo y dedicación al trabajo que desempeñó en todas las salidas de campo.
Literatura citada
Anónimo, 1960. Index of plant diseases in the United States. USDA Agriculture handbook, 165: 1-531. [ Links ]
Agrios, N.G., 2005. Plant Pathology. Fifth edition. Elsevier Academic Press. EU, 922 pp. [ Links ]
Barnet, H.L., y Hunter, B.B., 1999. Ilustrated genera of imperfect fungi. The American Phytopathological Soc. EU, 218 pp. [ Links ]
Brooks, F.E., y Ferrin, D.M., 1994. "Branch dieback of southern California chaparral vegetation caused by Botryosphaeria dothidea". Phytopathology, 84: 78-83. [ Links ]
Cheng-Lin, H., y M. Piepenbring, 2009. "New species and new records of Rhytismatales from Panama". Mycologia, 101(4): 565-572. [ Links ]
Cibrián, T.D.; R.D. Alvarado, y D.S.E. García, 2007. Enfermedades Forestales en México/Forest Diseases in Mexico. UACH; CONAFORT-SEMARNAT, México; Forest Service USDA, EEUU; NRCAN Forest Service, Canadá y Comisión Forestal de América del Norte, COFAN, FAO. Chapingo, México. 587 pp. [ Links ]
Crous, W.P., y U. Braun, 2003. "Mycosphaerella and its anamorphs 1". Names published in Cercospora and Passalora. CBS Biodiversity Series, 1: 1-571. [ Links ]
----------, 1996. "Cercosporoid fungi from South Africa". Mycotaxon, 57: 233-321. [ Links ]
Crous, W.P.; A. Aptroof, K. Ji-Chuan, U. Braun, y J.M. Wingfield, 2000. "The genus Mycosphaerella and its anamorphs". Studies in Mycology, 45: 107-121. [ Links ]
Crous, W.P., y J.D. Rogers, 2001. "Wuestneia molokaiensis and its anamorph Harknessia molokaiensis spp. nov. from Eucalyptus". Sydowia, 53: 74-80. [ Links ]
Crous, P.W.; B.A. Summerell, R.G. Shivas, A.J. Carnegie, y J.Z. Groenewald, 2012. A re-appraisal of Harknessia (Diaporthales), and the introduction of Harknessiaceae fam. nov. Persoonia, 28: 49-65. [ Links ]
Crous, P.W.; J.Z. Verkley, J.Z. Groenewald, y R.A. Samson, 1999. CBS Laboratory manual series 1. Fungal biodiversity. CBS. KNAW Fungal Biodiversity Centre, Utrecht, The Netherlands. 287 pp. [ Links ]
Díaz, M.R.; R. Valenzuela, M.G.J. Marmolejo, y A.E. Aguirre, 2009. "Hongos degradadores de la madera en el estado de Chihuahua, México". Revista Mexicana de Biodiversidad, 80: 13-22. [ Links ]
Eglitis, M.; C.J Gould, y F. Johnson, 1966. "Fungi found on Ericaceae in the Pacific coastal area". Washington State Agric. Exp. Sta. Bull., 675: 1-21. [ Links ]
Ellis, M.B., y J.P. Ellis, 1997. Microfungi on land plants. An identification handbook. The Richmond publishing Co., London, UK. 818 pp. [ Links ]
Esqueda-Valle, M.C., 2009. Biodiversidad de macromicetos en reserva de la biosfera El Pinacate y Reservas de protección: Ajos-Bavispe y Álamos-Río Cuchujaqui. Centro de Investigación en Alimentación y Desarrollo A.C. Informe final SNIB-CONABIO proyecto Núm. DC026. México, DF 76 pp. [ Links ]
French, A.M., 1989. California Plant Disease Host Index. Calif. Dept. Food Agric., Sacramento, 394 pp. [ Links ]
Gilbertson, R.L., y L. Ryvarden, 1986-1987. North American Polypores, vol. 1-2. Fungiflora Oslo. 885 pp. [ Links ]
Holzman B.; T.J. Swiecki, y E.A. Bernhardt, 2003. Diseases threaten the survival of Ione manzanita (Arctostaphylos myrtifolia). Prepared for San Francisco State University/California Department of Fish and Game. 49 pp. http://www.ipm.ucdavis.edu/PMG/GARDEN/PLANTS/manzanita.html). [ Links ]
Márquez-Linares; M.A., 2004. "Distribución, germinación y estructura de poblaciones de Arctostaphylos pungens HKB, y su relación con el fuego en Durango, México". Tesis de doctor en ciencias. Facultad de ciencias Forestales, UANL, N.L., México. 102 pp. [ Links ]
Murrill, A.W., 1904. "The Polyporaceae of North America-IX. Inonotus, sesia and monotypic genera". Bulletin of the Torrey Botanical Club, 31(11): 593-610. [ Links ]
Nag-Raj, T.R., y F. DiCosmo, 1981. "A monograph of Harknessia and Mastigosporella, with notes on associated teleomorphs". Biblioth. Mycol., 80: 1-62. [ Links ]
Nag-Raj, T.R., 1993. Coelomycetous anamorphs with appendage-bearing conidia. Mycologue Publications, Waterloo, Ontario, 1101 pages. [ Links ]
Popp, B. J., y E.J. Lundquist, 2006. Pathology Collection of the Rocky Mountain Research Station. USDA Forest Service. Gen. Tech. Rep. RMRS-GTR-167WWW. EU, 186 pp. [ Links ]
Romero, C.S., 1999. Hongos fitopatógenos. Segunda reimpresión. Universidad Autónoma Chapingo, Chapingo, México. 347 pp. [ Links ]
Seifert, K.; G. Morgan-Jones, W. Gams, y B. Kendrick, 2011. The Genera of Hyphomycetes. CBS Biodiversity Series vol. 9. The Neterlands. 997 pp. [ Links ]
Seonju, L.; Z.G. Johannes, y P.W. Crous, 2004. "Phylogenetic reassessment of the coelomycete genus Harknessia and its teleomorph Wuestneia (Diaporthales), and the introduction of Apoharknessia gen. nov.". Studies in Mycology, 50: 235-252. [ Links ]
Sherwood, M.A., 1980. "Taxonomic studies in the Phacidiales: the genus Coccomyces (Rhytismataceae)". Occasional Papers from the Farlow Herbarium, 15: 1-120. [ Links ]
Sutton, C.B., 1980. The Coelomycetes: Fungi imperfecti with pycnidia acervuli and stromata. Commonwealth Mycological Institute. CABI Publishing. England. 696 pp. [ Links ]














