Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Polibotánica
Print version ISSN 1405-2768
Polibotánica n.38 México Aug. 2014
Efecto de la composición de una mezcla de hidrocarburos en la respuesta fenotípica y la acumulación de azúcares por Bouteloua curtipendula Michx. Torr en cultivos in vitro
Effect of the composition of a mixture of hydrocarbons in phenotypic response and sugar accumulation by Bouteloua curtipendula Michx. Torr. Cultivated in vitro
Marianela Orozco-Soto1, Mariano Gutiérrez-Rojas1, María del Rosario Peralta-Pérez2
1Departamento de Biotecnología, Universidad Autónoma Metropolitana-Iztapalapa. San Rafael Atlixco 186, Col. Vicentina, México 09340 DF.
2Facultad de Ciencias Químicas, Universidad Autónoma de Chihuahua. Circuito núm. 1, Nuevo Campus Universitario; Chihuahua 31125, México. AP 669 y 1542-C. Correo electrónico: mperalta@uach.mx.
Recibido: 5 febrero 2013.
Aceptado: 15 noviembre 2013.
Resumen
Bouteloua curtipendula Michx Torr. es un pasto originario de México con gran capacidad de adaptación a condiciones climáticas adversas, ha sido reportado con potencial para fitorremediar suelos contaminados con hidrocarburos (HC). En el presente estudio, se hicieron cultivos in vitro de B. curtipendula con una concentración de 1 500 mg HC-L-1 de medio de cultivo, y distintas mezclas de fenantreno (PHE), pireno (PYR) y hexadecano (HXD). En todos los casos, tanto la longitud de brotes y raíces, así como la producción de biomasa disminuyeron significativamente con respecto al control. El 100% de las semillas germinaron en el medio sin HC, mientras que en las mezclas con mayor proporción de HDX (1 100 mg HC-L-1) germinó alrededor del 75% de las semillas. La mayor acumulación de azúcares totales en el medio de cultivo, después de 35 días (40 mg de azúcares totales acumulados en el medio-mg-1 de raíz seca, equivalentes a 200 mg de azúcares totales-tubo) se registró en la mezcla con menor concentración de HXD; por otro lado, en los cultivos donde no se adicionó HC se observó un consumo en los azúcares totales (225.7 ± 3 mg azúcares totales-tubo). Los resultados obtenidos sugieren que una mayor proporción de HXD en las mezclas incrementa el efecto tóxico a las plantas. Aunque hay estudios en donde se han cuantificado los azúcares exudados por las raíces, en nuestro conocimiento éste es el primer reporte de cultivos in vitro en donde se observa la producción de azúcares como respuesta de un pasto al estrés por HC.
Palabras clave: pastos, fitorremediación, exudados radiculares, hidrocarburos.
Abstract
Bouteloua curtipendula Michx Torr. is a Mexican grass able to adapt to adverse climatic conditions. It has been reported with phytoremediation potential to clean hydrocarbons (HC) contaminated soils. In this work, B. curtipendula was tested in vitro culture conditions with 1 500 mg HC-L-1 culture medium, and different phenanthrene (PHE), pyrene (PYR) and hexadecane (HXD) mixtures. In all cases the length and biomass production of roots and stem decreased significantly compared with control. 100% of the seeds germinated in the medium without HC, while in mixtures with higher proportion of HDX (1100 mg HC-L-1) germinated 75% of seeds. The highest total sugars accumulation into the culture medium, after 35 days, (40 mg of total sugars accumulated into culture medium-mg-1 of dry root, equivalent to 200 mg of total sugar-tube) was recorded in mixture with lower HXD concentration. On the other hand, there was sugar consumption in culture without HC (225.7 ± 3 mg of total sugar-tube). Our results suggest that a greater proportion of HXD increase the toxic effect to the plants. Although there are studies devoted to quantify sugars in roots exudates to our knowledge, this is the first work dealing with sugar root exudates as response mechanism of a grass to HC stress under in vitro cultures.
Key words: grass, phytoremediation, root exudates, hydrocarbons.
Introducción
Los hidrocarburos (HC) son contaminantes persistentes en el medio ambiente cuyos efectos tóxicos han sido documentados desde hace mucho tiempo (Edwards, 1983; Pothuluri et al., 1995; Haritash y Kaushik, 2009). Una propuesta para el tratamiento de suelos contaminados con HC es la fitorremediación, cuyo objetivo es degradar, asimilar o metabolizar los HC por medio de la acción combinada de plantas y microorganismos con capacidad fisiológica y bioquímica para absorber, retener, transformar o degradar sustancias contaminantes a formas menos tóxicas (Harvey et al., 2002; López-Martínez et al., 2005).
Entre las plantas que se han probado con éxito para fines de fitorremediación de HC puros o en mezclas que los contienen se encuentran leguminosas, gramíneas (Sangabriel et al., 2006), árboles (Tesar et al., 2002) y pastos (Chen et al., 2003; Sang-Hwan et al., 2007). Los pastos han sido objeto de estudio debido a su extenso sistema radicular y su tolerancia a condiciones de estrés. Bouteloua curtipendula Michx. Torr. es un pasto nativo de México, ampliamente utilizado como forraje. Hasta ahora se conocen al menos 577 ecotipos con una amplia variabilidad para polimorfismo (Morales-Nieto et al., 2006), lo que contribuye a mantener su adaptabilidad a condiciones climáticas adversas (Taylor y Erwing, 1996) y recientemente se ha comprobado que tiene gran potencial fitorremediador (Reynoso-Cuevas et al., 2011).
Dependiendo de su estructura química y concentración, los HC afectan la morfología de las plantas (Smith et al., 2006) observándose una disminución en el crecimiento, así como en la germinación y sobrevivencia después de 12 semanas de cultivo (Adam y Duncan, 2002). Algunos HC, como el fenantreno (PHE), afectan también la producción radicular de enzimas como guaiacol peroxidasas, lacasas, ascorbato peroxidasas y fosfatasas ácidas (Guerrero-Zúñiga y Rodríguez-Dorantes, 2009). Como un signo más del estrés provocado por HC, se ha observado que existe una concentración crítica de HC a la cual la planta comienza a presentar signos de clorosis (Alkio et al., 2005). En este sentido, hay estudios donde la presencia de petróleo crudo (5% P/P) afecta a las plantas provocando una reducción en la longitud, diámetro promedio y volumen específico de las raíces de gramíneas (Merkl et al., 2005), mientras que otros autores reportan que hay modificaciones en las características fenológicas de plantas cultivadas en presencia de HC como son la reducción en el tiempo de florescencia (Escalante-Espinoza et al., 2005). La tolerancia a los HC depende básicamente de las características propias de la planta que se está trabajando, variando mucho de una especie a otra, también influyen las condiciones de cultivo pues la disponibilidad de los HC es fundamental.
Recientemente, utilizando cultivos in vitro, se ha demostrado que B. curtipendula es capaz de biotransformar fenantreno, pireno y benzo(a)pireno, sin embargo, los mecanismos de remoción de contaminantes involucrados en la fitorremediación son complejos y no están limitados únicamente al metabolismo de las plantas (Reynoso-Cuevas et al., 2011). Se ha demostrado que los HC se transforman en la rizósfera de las plantas, donde la actividad microbiana es mayor y se produce un efecto de sinergia de la planta con los microorganismos rizosféricos (Glick, 2003). A esta particular forma de fitorremediación se le llama rizorremediación (Pilon-Smit, 2005). Las complejas relaciones entre los microorganismos rizosféricos y las plantas están mediadas por los exudados de las raíces (Bais et al., 2006); esto es evidente en estudios realizados por Rentz et al. (2005), en donde cultivos de Sphingomonas yanoikuyae JAR02 adicionados con exudados de Morus alba, favorecieron la remoción de un 15-20% de pireno con una mineralización del compuesto del 0.2-0.3%, lo que demostró que la rizorremediación puede ocurrir por cometabolismo.
A pesar de que se ha visto que los exudados radiculares tienen una importante función para determinar la microflora de la rizósfera además de estimular la degradación de los contaminantes, se conocen pocos estudios enfocados a estudiar la respuesta de las plantas en la producción de exudados ante cambios en la concentración y/o composición de HC (Muratova et al., 2009). Esto se debe, en parte, a que los estudios de fitorremediación requieren mucho tiempo y es difícil controlar las condiciones de cultivo a nivel de laboratorio, por lo que una opción novedosa ha sido el empleo de cultivos in vitro para estudiar el efecto que los contaminantes tienen únicamente en las plantas, disminuyendo los tiempos de estudio y controlando las condiciones con mayor facilidad (Reynoso-Cuevas et al., 2008).
El objetivo de este trabajo fue estudiar el efecto de la composición de una mezcla de hidrocarburos fenantreno (PHE), pireno (PYR) y hexadecano (HXD) en la expresión fenotípica y la acumulación de azúcares en el medio de cultivo por B. curtipendula Michx Torr. cultivada in vitro.
Material y métodos
Se trabajó con semillas de B. curtipendula ECO 00-118-UC 128, originaria de Zacatecas, México. Las semillas fueron almacenadas hasta su uso en bolsas de papel, en oscuridad y en un ambiente libre de humedad.
Preparación de los cultivos
Las semillas se escarificaron retirando la cubierta externa y para su desinfestación se colocaron en un sobre de papel filtro, enseguida se lavaron por 20 min mediante agitación constante con una solución de detergente en polvo (60 g-L-1 agua). Posteriormente y en la campana de flujo laminar, se sumergió el sobre en una solución de etanol al 70% (V/V) durante 30 s, seguido de una solución de hipoclorito de sodio al 0.6% (V/V) y 0.1 mL de Tween 20 por 20 min (Reynoso-Cuevas et al., 2008). En cada recambio de solución, el sobre con las semillas se enjuagó abundantemente con agua destilada estéril. Finalmente, el sobre se abrió bajo condiciones de asepsia y se guardaron las semillas en una caja de Petri, a temperatura ambiente, hasta su uso.
El medio de cultivo utilizado fue Murashige y Skoog (MS) (Murashige y Skoog, 1962) con 15 g-L-1 de sacarosa (99% pureza) y 2 g-L-1 de phytagel. El pH se ajustó a 5.8 con una solución de HCl 0.1 M. Antes de la esterilización, se colocaron 10 mL de medio de cultivo en tubos de ensayo y a cada tubo se le adicionaron 0.5 mL de la mezcla de PHE (96% de pureza), PYR (98% de pureza) y HXD (99% de pureza) disueltos en diclorometano a fin de alcanzar en todos los casos una concentración final de 1 500 mg de HC-L-1 de medio de cultivo, pero con distinta proporción de HC, como se ilustra en el cuadro 1. Para la cuantificación de HC se realizó una extracción líquido-líquido con diclorometano (1:1), la cuantificación fue por cromatografía de gases de acuerdo a la metodología descrita por Reynoso-Cuevas et al. (2011). Bajo estas condiciones los porcentajes de recuperación de HC fueron 96.7±3.82% y 98.2±2.57% para PHE y PYR respectivamente. Al control también se le adicionaron 0.5 mL de diclorometano pero sin HC. Todos los reactivos empleados en este estudio fueron marca Sigma-Aldrich.

Se trabajó con 30 réplicas para cada relación de hidrocarburos. Los tubos se mantuvieron abiertos en la campana de extracción durante 1 h a fin de evaporar el diclorometano, después se esterilizaron durante 15 minutos a 1.2 kg&•cm-2.
Posterior a la esterilización, en condiciones de asepsia, se colocó cuidadosamente en cada tubo una semilla de B. curtipendula. Los tubos ya sembrados se incubaron por 35 días en una cámara con temperatura controlada a 25°C con fotoperiodos de 16 horas.
Evaluación de la germinación y crecimiento de las plántulas. Para evaluar la germinación de las semillas se realizaron observaciones a los tres, siete y 10 días posteriores al sembrado. Se tomó como criterio de germinación observar un rompimiento de la semilla y la aparición de un brote o raíz (Maila y Cloete, 2002).
La evaluación de la supervivencia se realizó efectuando observaciones diarias del tamaño y color, tanto de hojas como de raíces, de las plántulas germinadas hasta los 35 días que se mantuvo el experimento. Pasado este tiempo las plantas que sobrevivieron fueron extraídas del tubo y analizadas para conocer la longitud y peso seco de tallos y raíces.
Longitud de brotes y raíces. Las plantas se extrajeron cuidadosamente del tubo de ensayo con ayuda de unas pinzas y las raíces se lavaron con agua a fin de eliminar el gel adherido. Los brotes y raíces se separaron utilizando un bisturí y se midieron utilizando un vernier.
Biomasa en peso seco de brotes y raíces. Las muestras de brotes y raíces de las plantas sobrevivientes se colocaron por separado en papel filtro, previamente llevado a peso constante. Se secaron en una estufa a 60°C durante 24 h y fueron pesadas en una balanza analítica OHAUSAR2140. El peso seco de las muestras se obtuvo por diferencia.
Cuantificación de azúcares totales. Una vez separada la planta, al medio de cultivo residual de cada tubo de ensayo se le adicionaron 10 mL de agua destilada, se agitó vigorosamente durante 1 min con ayuda de un vortex. El sobrenadante se guardó en congelación a -20°C hasta su análisis.
La cuantificación de azúcares totales, en el medio de cultivo residual de cada tubo, se realizó empleando el método de fenolsulfúrico (Dubois et al., 1956). La estimación de la acumulación de azúcares totales por mg de raíz se realizó mediante la diferencia de los azúcares presentes en el medio de cultivo al tiempo cero (t0) y los obtenidos en el medio al final del cultivo (tf) de cada una de las plantas, expresadas como mg azúcares totales-tubo-1. Dicha diferencia se dividió entre la cantidad de biomasa de raíces producida en cada caso (mg de biomasa de raíz-tubo-1):

De esta manera, la acumulación de azúcares totales se puede expresar como mg de azúcares totales acumulados-mg-1 de raíz seca.
Análisis estadístico
Para probar las diferencias significativas entre las plantas cultivadas en diferentes mezclas de HC se realizaron pruebas de Tukey con una p = 0.05, utilizando el paquete estadístico Minitab versión 14.13.
Resultados
Efecto de la composición de la mezcla de hidrocarburos sobre la germinación y crecimiento de B. curtipendula.
En los controles sin HC y la mezcla I de HC se observó siempre un 100% de germinación, mientras que en las mezclas II y III la germinación de las semillas fue de 74 y 75% respectivamente (fig. 1A). Las mezclas que mostraron la disminución del 25% de germinación fueron las que contenían la mayor proporción de HXD, por lo que este compuesto podría estar provocando el aumento del efecto tóxico de los HC. Este efecto tóxico también es evidente al analizar la sobrevivencia de las plantas (fig. 1B), mientras que a los 35 días de cultivo en los controles se observó una sobrevivencia de 100%, las plantas cultivadas en presencia de HC mostraron una disminución de hasta 75% en los ensayos con una mezcla de HC de mayor concentración de HXD.

Con respecto a la producción de biomasa de brotes (fig. 2A) y de raíces (fig. 2B) en los cultivos de B. curtipendula se observó una disminución de más del 80% en el peso seco con respecto al control. La elevada concentración de HC empleada en este trabajo también propició una disminución de hasta un 80% en la longitud de brotes y raíces de las plantas (fig. 3A y B respectivamente).


Efecto de la composición de la mezcla de hidrocarburos en la acumulación de azúcares por B. curtipendula
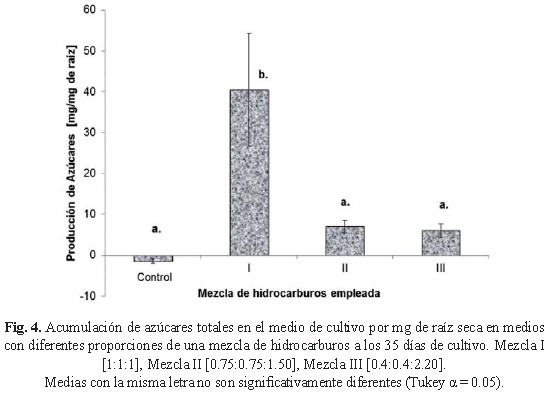
Se sabe que los cultivos in vitro no son totalmente autotróficos debido a que bajo estas condiciones disminuye la tasa fotosintética, por lo tanto es necesario adicionar una fuente de carbono para asegurar el desarrollo de la planta (Yassen et al., 2012), en este trabajo se emplearon 15 g-L-1 de sacarosa. Dado que se ha sugerido que los cambios en la composición y concentración de los exudados radiculares, incluidos los azúcares, en presencia de compuestos tóxicos como el PHE puede atribuirse a alteraciones adaptativas de las plantas como respuesta al estrés (Muratova et al., 2009) se decidió cuantificar la cantidad de azúcares totales acumulados en el medio al final del cultivo. Se observó que las plantas cultivadas en ausencia de HC consumieron los azúcares inicialmente adicionados al medio de cultivo (225.7 ± 3 mg azúcares totales-tubo-1) encontrándose solamente 186.1 ± 8.4 mg azúcares totales-tubo-1 después de 35 días de cultivo, lo que equivale a 1.1 mg azúcares totales consumidos-mg-1 de raíz (fig. 4). Sin embargo, aunque la concentración de HC empleada provoca que las plantas limiten su crecimiento y producción de biomasa de manera significativa, las raíces fueron capaces de producir azúcares encontrándose, en presencia de los HC, hasta 261.6 ± 0.45 mg azúcares totales-tubo-1 al final del cultivo, lo cual equivale a una concentración de 40 mg azúcares totales acumulados en el medio de cultivo-mg-1 de raíz cuando se les cultiva en la mezcla I.
Discusión
Estudios previos han demostrado que la germinación se ve afectada dependiendo de la biodisponibilidad de los contaminantes, y se inhibe conforme se incrementa la concentración de HC. Adam y Duncan (2002) encontraron, a concentraciones de 25 y 50 mg de diesel-kg-1 de suelo, que la fracción volátil del diesel juega un papel determinante para disminuir la germinación en semillas de pastos de tal manera que en suelos recién contaminados (donde la biodisponibilidad de los HC contaminantes es elevada), la germinación disminuye hasta un 40% en comparación a semillas que germinan en suelos intemperizados. Otros estudios realizados con mezclas bien definidas de HC han mostrado que la germinación de semillas de B. curtipendula en cultivos estériles no se modifica por la presencia de los HC aún a concentraciones de 5 000 mg de HC-kg-1 de medio de cultivo (Reynoso-Cuevas et al., 2008). Estas discrepancias pueden atribuirse al hecho de que la respuesta ante los contaminantes varía de acuerdo a la especie empleada e incluso con respecto al ecotipo de la misma (Xiong et al., 2004). En el presente estudio las mezclas de HC con mayor concentración de HXD provocan una considerable disminución de la germinación, posiblemente debido a que el HXD puede actuar como un acarreador que promueve o facilita la difusión del PHE y PYR en el seno del medio de cultivo incrementando así su biodisponibilidad y generando un efecto tóxico mayor en la mezcla III, donde el HXD es el compuesto mayoritario de la mezcla.
Se sabe que el éxito en la germinación no garantiza un subsecuente sano desarrollo de las plantas (Merkl et al., 2005). Trabajos anteriores de Chaineau et al. (1997) han demostrado una correlación entre la baja germinación de plantas y su pobre crecimiento en suelos recientemente contaminados, esta misma correlación se obtuvo en los cultivos de B. curtipendula donde se observó una disminución de más del 80% en el peso seco tanto de brotes como de raíces (fig. 2A y 2B respectivamente). Los hidrocarburos poliaromáticos provocan una disminución significativa de la producción de biomasa en especies de leguminosas y pastos (Sang-Hwan et al., 2007). Estudios previos (Smith et al., 2006) han mostrado una disminución en más de 70% de la producción de forraje con respecto al control en especies de pastos cuando se cultivan en suelos contaminados con 1 000 mg de HC-kg-1 de suelo, lo cual es congruente con lo observado en este estudio donde los resultados sugieren que la biodisponibilidad es mayor, probablemente debido a las características mismas de nuestros cultivos in vitro y que la concentración de hidrocarburos es 50% mayor, en nuestro caso, a dicho estudio.
Dado que son las raíces las que establecen un contacto directo con los compuestos hidrofóbicos, éstas son inmediatamente afectadas (Liste y Alexander, 2000) modificando su capacidad para tomar agua y nutrientes, de tal modo que la disminución en la longitud de brotes es aún mayor (90%). En nuestro trabajo, el efecto negativo fue visible al observarse una coloración obscura que podría atribuirse a la producción de compuestos fenólicos como se ha demostrado en trabajos anteriores (Sang-Hwang et al., 2007).
Reynoso-Cuevas et al. (2011) demostraron que B. curtipendula es fitorremediadora de HC; sin embargo, no hay estudios sobre la composición de los exudados de dicha planta bajo condiciones de estrés por HC. Los mecanismos de fitorremediación son muy complejos y difíciles de estudiar, los cultivos in vitro permitieron aislar el efecto que tiene únicamente B. curtipendula. En este sentido, la producción de azúcares en las mezclas II y III, que posiblemente fueron más tóxicas, no mostraron diferencias significativas con respecto al control sin HC. Esto muestra que B. curtipendula produce los azúcares como respuesta al estrés provocado por los HC pero que a concentraciones mayores (mezclas II y II), cuando es mayor la afectación a las raíces, dicha producción disminuye drásticamente.
En estudios recientes se ha encontrado que los exudados radiculares, que representan entre 2 y 10% del total del carbono fijado por la planta (Jones et al., 2004), regulan la composición y diversidad de las comunidades fúngicas en la rizósfera (Broeckling et al., 2011) además de que son las propiedades del suelo y de las plantas los factores que tienen gran influencia en determinar la naturaleza de las comunidades bacterianas en la rizósfera de las plantas que crecen en suelos contaminados con HC (Robertson et al., 2011). Los resultados obtenidos son interesantes desde el punto de vista de fitorremediación, ya que se ha reportado que el principal mecanismo de las plantas para eliminar HC es la rizoremediación y son los carbohidratos exudados por la planta los que pueden favorecer las asociaciones benéficas con los microorganismos degradadores que habitan en los suelos (Rentz et al., 2005; Fan et al., 2008).
Conclusiones
Los cultivos de vegetales in vitro permiten estudiar con mayor facilidad, en la ausencia de los microorganismos del suelo, el impacto que producen los contaminantes, en este caso los HC, en las respuestas de las plantas simplificando los modelos de estudio. En este estudio, se encontró que la elevada concentración de HC empleada logró una disminución en la longitud y producción de biomasa en brotes y raíces de B. cutipendula demostrando con ello que una mayor concentración de HXD en el medio de cultivo incrementa el efecto tóxico de la mezcla.
El estrés provocado por la actividad tóxica de los HC induce la producción de azúcares en los exudados radiculares a partir del carbono fijado por la planta, lo cual puede ser una estrategia de la planta para atraer microorganismos que le permitan tolerar a los contaminantes. Aunque se ha documentado la producción de exudados en plantas bajo estrés por contaminantes, estos trabajos se han realizado en condiciones de hidroponía o en invernadero y se desconoce el mecanismo por el cual se excretan dichos exudados. El presente estudio realizado en cultivos estériles permite atribuir este aumento en la concentración de azúcares a una respuesta ante las mezclas de HC.
Agradecimientos
Los autores agradecen al doctor Adrián Quero Carrillo quien proporcionó las semillas de B. curtipendula ECO 00-118 UC 128 para este estudio, y a la doctora Guadalupe Virginia Nevárez Moorillón por su ayuda en el análisis estadístico.
Literatura citada
Adam G., y H. Ducan, 2002. "Influence of diesel fuel on seed germination". Environ. Pollut., 120: 363-370. [ Links ]
Alkio, M.; T.M. Tabuchi, X. Wang y A. Colón-Carmona, 2005. "Stress response to polycyclic aromatic hydrocarbons in Arabidopsis include growth inhibition and hypersensitive response-like symptoms". J. Exp. Bot., 56: 2983-2994. [ Links ]
Bais, H.P.; L.W. Tiffany, L.G. Perry, S. Gilroy, y J.M. Vivanco, 2006. "The role of root exudates in rhizosphere interactions with plants and other organisms". Annu. Rev. Plant Biol., 57: 233-66. [ Links ]
Broeckling, C.D.; A.K. Broz, J. Bergelson, D.K. Manter, y J.M. Vivanco, 2008. "Root exudates regulate soil fungal community composition composition and diversty". Appl. and Environ. Microb., 74: 738-744. [ Links ]
Chaîneau, C.H.; J.L. Morel, y J. Oudot, 1997. "Phytotoxycity and plant uptake of fuel oil hydrocarbons". J. Environ. Qual., 26: 1478-1483. [ Links ]
Chen, Y.; K. Banks, y P. Schwab, 2003. "Pyrene degradation in the rhizosphere of tall fescue (Festuca arundinacea) and switchgrass (Panicum virgatum L.)". Environ. Sci. Technol., 37: 5778-5782. [ Links ]
Dubois, M.; K.A. Gilles, J.K. Hamilton, P.A. Rebers, y F. Smith, 1956. "Colorimetric method for determination of sugars and related substances". Anal. Chem., 23: 350-356. [ Links ]
Edwards, N.T., 1983. "Polycyclic aromatic hydrocarbons (PAHs) in the terrestrial environment - a review." J. Environ. Qual., 12: 427-441. [ Links ]
Escalante-Espinoza, E.; M.E. Gallegos-Martínez, E. Favela-Torres, y Gutiérrez-Rojas M., 2005. "Improvement of the hydrocarbon phytoremediation rate by Cyperus laxus Lam. inoculated with a microbial consortium in a model system". Chemosphere, 59: 405-413. [ Links ]
Fan, S.; P. Li, Z. Gong, W. Ren, y N. He, 2008. "Promotion of pyrene in rhizosphere of alfalfa (Medicago sativa L.)". Chemosphere, 71: 1593-1598. [ Links ]
Glick, B.R., 2003. "Phytoremediation: synergic use of plants and bacteria to clean up the environment". Biotech. Adv., 47: 383:393. [ Links ]
Guerrero-Zúñiga, L.A., y A.M. Rodríguez-Dorantes, 2009. "Efecto de la presencia de fenantreno sobre la expresión de proteínas y la actividad enzimática radical de Cyperus hermaphroditus". Polibotánica, 27: 103-130. [ Links ]
Haritash, A.K., y C.P. Kaushik, 2009. "Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review". J. Hazard. Mater., 169: 1-5. [ Links ]
Harvey, P.; B. Campanela, P. Castro, H. Harms, E. Lichtfouse, A. Schaffner, S. Smrcek, y D. Werck, 2002. "Phytoremediation of polyaromatic hydrocarbons, anilines and phenols". Environ. Sci. Pollut. Res. Int., 9: 29-47. [ Links ]
Jones, D.L.; A. Hodge, y R.D. Bardgett, 2004. "Plant and mycorrhizal regulation of rhizodeposition". New. Phytol, 163: 459-480. [ Links ]
Liste, M., y H. Alexander, 2000. "Plantpromoted pyrene degradation in soil". Chemosphere, 40: 4-10. [ Links ]
López-Martínez, S.; M.E. Gallegos-Martínez, L. Pérez-Flores, y M. Gutiérrez-Rojas, 2005. "Mecanismos de biorremediación de suelos contaminados con moléculas orgánicas xenobióticas". Rev. Int. Cont. Ambiental., 21: 91-100. [ Links ]
Maila, M.P., y Cloete T.E., 2002. "Germination of Lepidium sativum as a method to evaluate polycyclic aromatic hydrocarbons (PAHs) removal from contaminated soil". Int. Biodeter. Biodegr., 50: 107-113. [ Links ]
Merkl, N.; R. Schultze-Kraft, e C. Infante, 2005. "Phytoremediation in the tropics - influence of heacvy crude oil on root morphological characteristics of graminoids". Environ. Pollut., 138: 86-91. [ Links ]
Morales-Nieto, C.; A. Quero-Carrillo, O. Le-Blanc, A. Hernández-Garay, J. Pérez-Pérez, y S. González-Muñoz, 2006. "Caracterización de la diversidad del pasto nativo Bouteloua cutipendula Michx. Torr. mediante marcadores de AFLP". Agrociencia, 40: 711-720. [ Links ]
Murashige, T., y F. Skoog, 1962. "A revised medium for rapid growth and bioassays with tobacco tissue cultures". Physiol. Plant, 15: 473-497. [ Links ]
Muratova, A.; S. Golubev, L. Wittenmayer, T. Dmitrieva, A. Bonderenkova, F. Hirche, W. Merbach, y O. Turkovskaya, 2009. "Effect of the plyciclic aromatic hydrocarbon phenanthrene on root exudation of Sorghum bicolor (L.) Moench". Environ. Exp. Bot., 66: 514-521. [ Links ]
Pilon-Smits, E., 2005. "Phytoremediation". Annu. Rev. Plant Biol., 56: 15-39. [ Links ]
Potholuri, J.V.; A. Selby, F.E. Evans, J.P Freeman, y C.E. Cerniglia, 1995. "Transformation of chrysene and other polycyclic aromatic hydrocarbon mixtures by the fungus Cunninghamella elegans". Can J. Bot., 73: S1025-S1033. [ Links ]
Rentz, J.A.; P.J.J. Alvarez, y J.L. Schnoor, 2005. "Benzo[a]pyrene cometabolism in the presence of plant root extracts and exudates: Implications for phytoremediation". Environ. Pollut., 136: 477-484. [ Links ]
Reynoso-Cuevas, L.; M.E. Gallegos-Martínez, F. Cruz-Sosa, y M. Gutiérrez-Rojas, 2008. "In vitro evaluation of germination and growth of five plant species on medium supplemented with hydrocarbons associated with contaminated soils". Bioresource Technol., 99: 6379-6385. [ Links ]
----------, 2011. "Phytoremediation and removal mechanisms in Bouteloua curtipendula growing in sterile hydrocarbon spiked cultures". Int. J. Phytoremediat., 13: 613-625. [ Links ]
Robertson, S.J.; P.M. Rutherford, y H.B. Massicotte, 2011. "Plant and soil properties determine microbial community structure of shared Pinus-Vaccinium rhizospheres in petroleum hydrocarbon contaminated forest soils". Plant Soil., 346: 121-132. [ Links ]
Sangabriel, W.; R. Ferrera-Cerrato, D. Trejo-Aguilar, M.R. Mendoza-López, J.S. Cruz-Sánchez, C. López-Ortiz, J. Delgadillo-Martínez, y A. Alarcón, 2006. "Tolerancia y capacidad de fitorremediación de combustóleo en el suelo por seis especies vegetales". Rev. Int. Contam. Ambient., 22: 63-73. [ Links ]
Sang-Hwan, L.; L. Won-Seok, L. Chang-Ho, y K. Jeong-Gyu, 2007. "Degradation of phenanthrene and pyrene in rhizosphere of grasses and legumes". J. Hazard. Mater., 153: 892-868. [ Links ]
Smith M.J.; T.H. Flowers, H.J. Duncan y J. Alder, 2006. "Effects of polycyclic aromatic hydrocarbons on germination and subsequent growth of grasses and legumes in freshly contaminated soil and soil with aged PAHs residues". Environ. Pollut., 141: 519-525. [ Links ]
Taylor, G.B., y M.A. Erwing, 1996. "Effects of extended (4-12 years) burial on seed softening in subterranean clover and annual medics". Aust. J. Exptl. Agric., 3: 145-150. [ Links ]
Tesar, M.; T.G. Reichenauer, y A. Sessische, 2002. "Bacterial rhizosphere populations of black poplar and herbal plants to be used for phytoremediation of diesel fuel". Soil Biol. Biochem., 34: 1883-1892. [ Links ]
Xiong, Y.H.; X.E. Yang, Z.Q. Ye, y Z.L. He, 2004. "Characteristics of cadmium uptake and accumulation by two contrasting ecotypes of Sedum alfredii Hance". J. Environ. Sci. Heal. A., 39: 2925-2940. [ Links ]
Yaseen, M.; T. Ahmad, G. Sablok, A. Standardi, H.I. Ahmad, 2012. "Review: role of carbon sources for in vitro plant growth and development". Mol. Biol. Rep. DOI 10.1007/s11033-012-2299-z [ Links ]














