Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.37 México feb. 2014
Variación anual de la biomasa de Nymphoides fallax ornduff (menyanthaceae) en la laguna de Tecocomulco, Hidalgo, México
Seasonal changes of biomass of Nymphoides fallax ornduff (menyanthaceae) in the lagoon of Tecocomulco, Hidalgo, Mexico
Agustín Quiroz-Flores, Pedro Ramírez-García, y Antonio Lot-Helgueras
Laboratorio de Vegetación Acuática, Departamento de Botánica, Instituto de Biología, Universidad Nacional Autónoma de México. Correo electrónico: ajquiroz@ib.unam.mx.
Recibido: 6 junio 2012.
Aceptado: 3 junio 2013.
Resumen
Durante un ciclo anual se cuantificó la variación en la estratificación vertical de la biomasa de Nymphoides fallax y se analizaron las variables físicas y químicas del agua y sedimentos de la laguna de Tecocomulco, Hidalgo. La producción anual neta de N. fallax fue de 3 070.1 g PS m2. En el mes de junio la biomasa alcanzó su máximo (958.4 g PS m2 ). La contribución de biomasa foliar de N. fallax a la proporción total de biomasa representa el 10%, la de peciolos alcanza el 40% y la contribución de biomasa subterránea equivale en ocasiones a más del 50%. El nivel de fósforo en los sedimentos se encuentra por arriba de la cantidad necesaria para sostener la producción vegetal (≥ 0.04%). Por los resultados obtenidos en este estudio, se puede señalar que en aquellas zonas ribereñas de la laguna en donde los agricultores han construido bordos, se propicia que durante la época de lluvias la columna de agua cambie bruscamente sus dimensiones pasando de 10 cm hasta alcanzar los 75 cm de profundidad y se eleven los niveles de fósforo en agua y sedimentos, lo que a su vez induce que Nymphoides fallax se vea estresada, y en un caso extremo, temporalmente sea sustituida por aquellas especies mejor adaptadas a las nuevas condiciones físicas y químicas del medio.
Palabras clave: Nymphoides fallax, biomasa, aguas, sedimentos, fósforo.
Abstract
During an annual cycle was quantified the vertical stratification of the biomass of Nymphoides fallax and analyzed the physical and chemical variables of water and sediments in laguna Tecocomulco, Hidalgo. The annual net production of N. fallax was 3 070.1 g DW m2. In June, biomass reached its maximum (958.4 g DW m2). The contribution of foliar biomass of N. fallax to total biomass ratio was 10% that of petioles reaches 40% and the contribution of belowground biomass, sometimes exceeded 50%. The level of phosphorus in sediments was above the amount needed to sustain crop production (≥ 0.04%). From the results obtained in this study, we concluded that in those coastal areas of the lagoon where farmers have built levees, these propitiated that during the rainy season the water column abruptly changes from 10 cm to 75 cm and raise the levels of phosphorus in waters and sediments, which in turn appear to induce stress on N. fallax stands. After extreme events of these types, this species can be temporarily substituted by other species best adapted to the new physical and chemical environmental conditions.
Key words: Nymphoides fallax, biomass, waters, sediments, phosphorus.
Introducción
"El crecimiento y producción de biomasa de las hidrófitas están regidos por una compleja interacción de factores físicos, químicos y bióticos del medio en el que se desarrollan las plantas acuáticas" (Haslam, 1978). En los ecosistemas, la asignación de biomasa a partes activas fotosintéticas y partes estructurales de las plantas varía considerablemente. Diferencias en tal asignación pueden ser un indicador adecuado de algunos aspectos del funcionamiento de los ecosistemas. El valor del indicador estará influenciado por las proporciones relativas y las cantidades absolutas de la planta, que a su vez están influenciadas por la disponibilidad espacial y temporal de luz y nutrientes, así como por la presión que ejercen otros factores ambientales como la temperatura, salinidad, velocidad de la corriente, profundidad del medio acuático y tipo de sedimento (Hutchinson, 1975).
La laguna de Tecocomulco es el cuerpo de agua más importante en la cuenca de México, no sólo por su extensión sino por que la flora acuática presente constituye uno de los últimos reductos de las principales asociaciones y tipos de vegetación constituidos por hidrófitas de la cuenca de México (Lot, 2005).
"En la subcuenca de Tecocomulco existen grandes superficies erosionadas, las cuales se han originado por diversos factores que han acelerado los procesos de degradación. Entre éstos destacan la deforestación para fines de ampliación de la superficie agrícola, el consumo de leña o madera, el sobrepastoreo, las prácticas agrícolas no adecuadas, incendios forestales, cambios de uso del suelo sin considerar su aptitud. Todos estos factores contribuyen a incrementar la escorrentía y erosión en la subcuenca, generando empobrecimiento de suelos en las partes altas, inundaciones de superficies de cultivo en las partes bajas y acumulación de sedimentos en cauces de la propia laguna de Tecocomulco" (Comisión de Cuenca de la Laguna de Tecocomulco, A.C., 2007). En forma global se calcula un aporte anual de sedimentos a la laguna de 248 000 toneladas, lo que puede representar una pérdida de la capacidad de almacenamiento del embalse de 190 839 m3 anualmente (Martínez, 2009). Esta situación ha modificado la profundidad, superficie y los recursos bióticos de la laguna de Tecocomulco, en la que se concentran los escurrimientos. Finalmente, el continuo crecimiento de Schoenoplectus californicus, propició que para el año 2005, la comunidad ocupara un poco más del 70% de la laguna (Comisión de Cuenca de La Laguna de Tecocomulco, 2007), desplazando a otras especies nativas como Typha latifolia y Stuckenia pectinata.
La abundancia de Schoenoplectus californicus y la reducción de otras comunidades de hidrófitas como Nymphoides fallax, Lilaeopsis schaffneriana, Marsilea mexicana y Sagittaria demersa, ésta última especie endémica, señalan la urgencia de establecer programas de monitoreo de aquellas variables del medio ambiente que pueden estar influyendo en ésta dinámica poblacional.
Nymphoides fallax Ornduff (Menyanthaceae) es una hidrófita enraizada de hojas flotantes, propia de lagos de montaña y de cuerpos de agua permanentes, aunque puede encontrarse en charcas, ciénagas y corrales inundados. Se ha registrado entre 1 500 y 2 600 m de altitud y se distribuye desde el norte de México (Chihuahua) hasta Guatemala (Lot et al., 1999). Dicha distribución, permite distinguirla como endémica de México, siguiendo el criterio definido como Megaméxico II de Rzedowski (1998). En el estado de Hidalgo se conoce con el nombre de "lirio". Se caracteriza por presentar largos pecíolos de hasta 2 m, que elevan las hojas hasta la superficie de agua; las flores son vistosas por presentar lóbulos de los pétalos de un intenso color amarillo. En el Valle de México es considerada como una especie vulnerable y en peligro de extinción, fundamentalmente por la contaminación y fragmentación de los humedales que constituyen su hábitat natural.
El presente estudio se condujo con el propósito de conocer los cambios estacionales en la estratificación vertical de la biomasa de Nymphoides fallax y cuantificar las variables físico químicas de agua y sedimentos que pueden estar influyendo en su dinámica, así como distinguir la posibilidad de cambios en asignación de biomasa a distintas partes de la planta que indiquen un deterioro del estado de conservación de esta especie en la laguna de Tecocomulco.
Material y métodos
Área de estudio. La laguna de Tecocomulco se localiza a 17 km al noreste de Ciudad Sahagún en el estado de Hidalgo, entre los 19° 53' 45" y 19° 49' 56" de latitud norte y 98° 20' 14" y 98° 26' 24" de longitud oeste (fig. 1). Su forma es irregular alargada, con 10.5 km de longitud y entre 1.0 y 3.5 de anchura, su superficie aproximada es de 27 km2 (Huizar y Ruiz, 2005); es una laguna somera en la que la zona más profunda de la columna de agua puede alcanzar los 2.5 m, (Novelo et al., 2005).
Vegetación. Se eligieron dos sitos de muestreo de la población de N. fallax ubicados entre los 19° 50' 43.7" de latitud norte y 98° 25' 67.6" de longitud oeste (sitio A); y los 19° 50' 39.5" de latitud norte 98° 25' 57.7" de longitud oeste (sitio B). Se realizaron cinco colectas durante el año 2007 y en cada sitio se recolectaron dos núcleos de 30 cm de diámetro por 40 cm de profundidad, con vegetación y sedimento. Cada grupo de cuatro núcleos colectados por fecha, fueron cuidadosamente lavados separando las hojas, pecíolos, rizomas y raíces para posteriormente ser secados por separado en el laboratorio a peso constante durante cuatro días en una estufa a 60°C. De esta forma se obtuvo la biomasa de hojas, pecíolos, rizomas y raíces, los valores se interpolaron por unidad de área (m2) y en forma proporcional para cada una de las estructuras de toda la planta.
Agua. En la misma zona en donde se colectó el material vegetal, se establecieron dos estaciones de muestreo permanente con cinco colectas durante un ciclo anual. En cada estación se tomaron muestras por duplicado, determinando la ubicación de los sitios de muestreo, con la ayuda de un GPS 12 marca Garmin. Las muestras de agua se tomaron a media profundidad; una primera submuestra fue pasada a través de un filtro Millipore de 0.45 Lim y se depositó en un recipiente de polipropileno; una segunda submuestra se almacenó directamente en un recipiente de polipropileno de un litro de capacidad y se agregó 1 ml de ácido sulfúrico concentrado como conservador. Posteriormente, ambos recipientes se depositaron en una hielera a 4°C para ser transportados al laboratorio. Se midieron in situ, atenuación de la luz mediante disco de Secchi (transparencia), pH, conductividad, temperatura subsuperficial y oxígeno disuelto con un equipo de campo marca Corning modelo Check-mate 90. Una vez en el laboratorio, en las muestras de agua se cuantificó dureza al calcio y alcalinidad total por método volumétrico; sodio y potasio soluble por método flamométrico, con un equipo marca Jenway modelo PFP7; nitrógeno y fósforo total por colorimetría previa digestión ácida; nitratos, nitritos, amonio y ortofosfatos por método colorimétrico con un espectrofotómetro marca Bausch and Lomb modelo Spectronic 21, de acuerdo con los métodos oficiales recomendados por Standard Methods for the Examination of Water and Wastewater (1998).
Sedimentos. Las muestras se tomaron en las mismas zonas y en los mismos intervalos de tiempo en donde se colectó el material vegetal y las muestras de agua. En cada estación, se obtuvieron por duplicado las muestras con la ayuda de un muestreador para toma de núcleos inalterados hasta una profundidad de 20 cm (Richardson et al., 1978). Los núcleos contenidos en tubos de PVC se depositaron en una hielera a 4°C para ser transportados al laboratorio.
Una vez en el laboratorio, las muestras se secaron a 60°C, molieron y se tamizaron a través de un tamiz de 2 mm de abertura (Richardson et al., 1978) y se les practicaron los siguientes análisis: pH previa rehidratación con agua desmineralizada en una relación 1:4, por método potenciométrico (van Reeuwijk, 1995), utilizando un potenciómetro Orion modelo EA 940; nitrógeno total por el método Kjeldahl modificado citado por Bremner (1965); fósforo total por el método de digestión por vía húmeda con un bloque digestor marca Tecator modelo 1007 y cuantificación colorimétrica por la técnica del ácido ascórbico (Soil Testing, 1980); fósforo asimilable por el método de Mehlich-3 y cuantificación colorimétrica por la técnica del ácido ascórbico (Mehlich, 1984); materia orgánica por oxidación en medio húmedo, según el método de Walkley modificado por Black, citado por Allison (1965); textura por el método del hidrómetro de Bouyoucos, citado por Baver (1961) y Day (1965), estableciéndose las clases de sedimentos de acuerdo al triángulo de textura según el United States Department of Agriculture (Porta et al., 1994).
Análisis estadísticos. Finalmente, a los resultados obtenidos de la biomasa vegetal se les aplicó un análisis estadístico de varianza (ANOVA) para observar las diferencias significativas entre los meses de muestreo y en su caso una prueba de comparaciones de Newman-Keuls, por grupos homogéneos (α = 0.05). Además, una correlación de Pearson (r) para demostrar la mejor interrelación entre las diferentes estructuras vegetativas estudiadas durante el periodo anual. Los análisis estadísticos se realizaron con la ayuda del programa Statistica 7.0.
Resultados
Vegetación. Se presentó una gran variabilidad de la biomasa foliar de N. fallax a lo largo del año como se observa en la figura 2. La biomasa foliar tuvo un promedio anual de 25.1 ± 4.7 g PS m2 (gramos de peso seco por metro cuadrado), con un máximo en diciembre de 44.3 ± 13.3 g PS m2, y un mínimo en febrero de 4.9 ± 1.2 g PS m2. Se determinó la existencia de diferencias significativas entre las fechas de muestreo (F4, 16 = 3.4; P < 0.022), principalmente de febrero y septiembre con el resto de las fechas (Newman-Keuls; α = 0.05, MS = 295.51, gl = 16).
Se presentó una gran variabilidad de biomasa de los pecíolos de N. fallax a lo largo del año (fig. 3). La producción promedio anual fue de 162.6 ± 27.7 g PS m2, con un máximo enjunio de 264.6 ± 56.4 g PS m2, y un mínimo en septiembre de 35.2 ± 9.8 g PS m2. Se observaron diferencias significativas entre las fechas de muestreo (F4, 16 = 4.2; P < 0.016), principalmente con el mes de septiembre (Newman-Keuls; α = 0.05, MS = 9804.3, gl = 16).
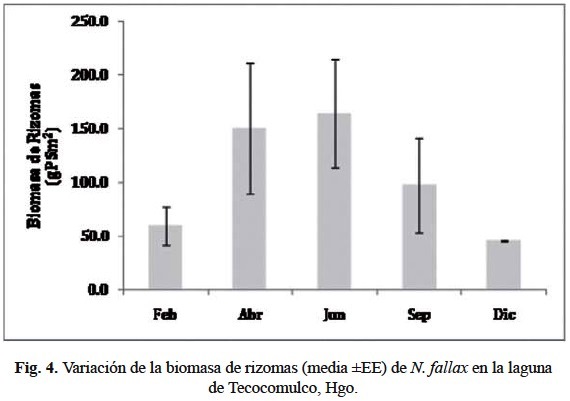
También se presentó una gran variación en la biomasa de rizomas de N. fallax (fig. 4), se observó inicialmente un gradual incremento y posteriormente una disminución de la misma a lo largo del año. El promedio anual fue de 110.1 ± 21 g PS m2, con máximo en junio de 164.5 ± 50.6 g PS m2, y un mínimo en diciembre de 45.3 ± 0.5 g PS m2. Debido a que la variabilidad de las muestras fue mayor que los valores entre fechas de muestreo, no se obtuvieron diferencias significativas entre estas (F4, 16 = 1.39; p < 0.29).
La biomasa de raíces (fig. 5) tuvo un comportamiento similar a la biomasa de rizomas, con un promedio anual de 340.0 ± 61.8 g PS m2, un máximo en junio de 491.2 ± 180.2 g PS m2, y un mínimo en el mes de diciembre de 157.3 ± 35.0 g PS m2, debido a la variación alta de las muestras no se pudo demostrar las diferencias significativas entre las fechas de muestreo (F 4, 16 = 1.03; p < 0.43).
Los cambios de la biomasa de hojas a lo largo del año fueron altos (C.V = 86.1%), con un mínimo en el mes de febrero con 4.9 ± 1.2 g PS m2, y un máximo en diciembre de 43.3 ± 13.3 g PS m2. En los peciolos se observó un mínimo en el mes de septiembre de 35.2 ± 9.8 g PS m2 y un máximo en junio de 264.6 ± 56.4 g PS m2. La biomasa de rizomas y raíces presentó un mínimo en el mes de diciembre de 45.3 ± 0.5 g PS m2 y 157.3 ± 35.0 g PS m2, respectivamente, y un máximo en junio de 164.5 ± 50.6 y 491.2 ±180.2 g PS m2, respectivamente. El coeficiente de variación (C.V.) en estructuras vegetativas como peciolos, rizomas y raíces también fue alto, de hasta un orden de magnitud entre el valor mínimo y el valor máximo observados. Sin embargo, la diferencia entre la biomasa foliar y la de raíces llego a ser de hasta dos órdenes de magnitud en el periodo de estudio.
La contribución de biomasa foliar de N. fallax a la proporción total de biomasa es mínima (fig. 6), ya que no representa más del 10% de la biomasa total en las diferentes fechas de muestreo. Sin embargo, la contribución de biomasa subterránea, o por debajo de los sedimentos, equivale a más del 50% en el mes de diciembre y hasta el 70% de la biomasa total de la planta en el mes de septiembre.
La mejor correlación significativa de la biomasa a través de las fechas de muestreo (tabla 1) se observó entre el peciolo y el rizoma (r = 0.65, p < 0.003), y el peciolo y la raíz (r = 0.68, p < 0.001), así como entre la biomasa del rizoma y la raíz (r = 0.91; p < 0.001).
Agua. Durante el año de estudio, la temperatura subsuperficial varió de 16 a 22°C y los valores de pH mostraron valores alrededor de la neutralidad (tabla 2.). Por los resultados obtenidos para la dureza, el tipo de agua se clasifica como blanda según la clasificación propuesta por Boyd (1990). Las variables que tuvieron amplias diferencias a lo largo del año fueron el amonio con un rango de 15 a 199 liM, la conductividad de 212 a 625 µS/cm, la profundidad de 10 a 75 cm, la transparencia de 5 a 40 cm y la alcalinidad de 29 a 239 mg/L. Es importante señalar que la transparencia en la columna de agua disminuyó a partir del mes de junio en un 50% debido a la gran cantidad de sólidos suspendidos de origen mineral provenientes de los campos agrícolas y las zonas deforestadas (De la Lanza y Gómez, 2005; Comisión de Cuenca de la Laguna de Tecocomulco, 2007). Los niveles de fósforo y nitrógeno total en la zona ribereña, nos indican que el agua muestra una significativa eutrofización (Ryding y Rast, 1989).
Sedimentos. Con relación a las texturas (tabla 3) es notable el contenido de arcillas, lo que determina que el tipo textural dominante en la zona de estudio sea el de arcilla. El pH es moderadamente ácido y los porcentajes de materia orgánica nos permiten caracterizar a todas las muestras analizadas como sedimentos minerales según la clasificación propuesta por Ungemach, citada por Ramírez y Noreña (2004). Las relaciones nitrógeno/fósforo que alcanzaron valores de 3 y 4, junto con los altos valores de fósforo asimilable, revelan una fertilidad de tipo inorgánico (Márquez et al., 2007) en la zona de estudio.
Discusión
"Desde el punto de vista nutricional, en los ecosistemas acuáticos la productividad está limitada principalmente por la biodisponibildad del fósforo y el contenido de nitrógeno total" (Carr et al., 1997). Cronk y Fennesy (2001) señalan que las plantas de los humedales costeros son más susceptibles a las variaciones en nitrógeno y las plantas de humedales de aguas continentales a las variaciónes en fósforo. En la zona de estudio, el nivel de fósforo en los sedimentos está por arriba de la cantidad necesaria para sostener la producción vegetal de acuerdo al criterio de Malmstrom citado por Richardson (1978), y para el caso del nitrógeno, se tienen valores medios. Si se consideran las condiciones tróficas del sustrato y el agua en el que se encuentra la comunidad de N. fallax, es de esperarse que la producción de biomasa en los órganos fotosintéticos y subterráneos mantenga un incremento constante, esta situación la podemos observar en los datos obtenidos para las colectas de abril y junio (figs. 2 y 3), y con la producción anual neta cuantificada (3070.1 g PS m2), la cual supera en dos órdenes de magnitud la reportada para Nymphoides peltata por otros autores (van der Velde et al., 1979; Brock et al., 1983). Sin embargo, durante el mes de septiembre los datos mostraron una caída en la tendencia en el incremento de la biomasa foliar y de peciolos. Este comportamiento, lo podemos atribuir a la serie de eventos que ocurrieron en la zona de estudio durante la época de lluvias y que enseguida describiremos. En el transcurso de un mes (agosto a septiembre), el nivel de la tabla de agua en la zona de estudio cambió de 10 a 75 cm, este cambio originado por las precipitaciónes relacionadas con el huracán Dean (13-28 de agosto de 2007) y la construcción de bordos por los agricultores ribereños, posiblemente comenzó a estresar a N. fallax (Kercher y Zedler, 2004; Lingfei y Dan, 2011), debido a que ante esta situación, la planta necesita asignar recursos al peciolo para que la biomasa foliar pueda alcanzar nuevamente la superficie y continuar con el proceso fotosintético (Rubio et al., 1995); este fenómeno queda demostrado indirectamente a través de los ratios obtenidos para la biomasa aérea/biomasa subterránea en las tres últimas colectas (0.4 para junio, 0.1 y 1.0 para septiembre y diciembre respectivamente), ya que al traslocar recursos hacia los órganos fotosintéticos, la biomasa de rizomas y de la raíz disminuye (figs. 4 y 5). Así mismo, entre junio y septiembre los niveles de fósforo reactivo en la columna de agua alcanzaron los valores más altos, y por otra parte, la transparencia disminuyó en un 50%. El escenario anterior se presentó debido a que los agricultores de la zona ribereña bombean el agua que inunda sus cutlivos de cebada maltera, los cuales han sido fertilizados con la fórmula 18(N)-46(P)-00(K) hacia el interior de la laguna; esta acción por parte de los agricultores, propició que el fósforo reactivo disuelto se incrementara hasta 28 µM, promoviendo que las hidrófitas libre flotadoras como Ricciocarpus natans, Lemnagibba, Wolffia brasiliensisy Wolffiella lingulata (Khan y Ansari, 2005) ocuparan casi totalmente la superficie de la columna de agua en gran parte de la zona de estudio. La presencia de hidrófitas libre flotadoras y la gran cantidad de sólidos minerales suspendidos afectan notablemente la calidad de la luz dentro de la columna de agua, lo que a su vez posiblemente disminuyó notablemente la tasa fotosintética de las hojas y peciolos de N. fallax que quedaron por debajo de la superficie del agua. Así mismo, durante el mes de septiembre las hidrófitas emegentes como Polygonum amphibium, Polygonum punctatum y Jaegeria glabra, aprovechando la profundidad (Kercher y Zedler, 2004) de la columna de agua (75 cm) y los altos niveles de fósforo asimilable (Barko et al., 1991) presentes en el sedimento (45 mg/kg), invadieron espacios en los que originalmente se encontraba la hidrófita de hojas flotantes N. fallax.
Conclusiones
Por los resultados obtenidos en este estudio, se puede señalar que en aquellas zonas ribereñas de la laguna de Tecocomulco en donde se han construido bordos por parte de los agricultores con el objetivo de ganarle terreno a la laguna, se propicia que durante la época de lluvias la columna de agua cambie bruscamente sus dimensiones y aumenten los niveles de fósforo asimilable en el agua y el fósforo total en los sedimentos, lo que a su vez induce que Nymphoides fallax se vea estresada e incluso, que en un caso extremo, temporalmente sea sustituida por aquellas especies mejor adaptadas a las nuevas condiciones físicas y químicas del medio.
Literatura citada
Allison, L.E., 1965. "Organic Carbon". En: Black, C.A.; D.D. Evans, J.L. White, L.E. Ensminger, y F.E. Clark. Eds. Methods of Soil Analysis. Serie Agronomy Núm. 9, Parte 2. American Society of Agronomy, Inc., Publisher. Wisconsin, USA. pp. 1372-1376. [ Links ]
Barko, J.W.; D. Gunnison, y S.R. Carpenter, 1991. "Sediment interaction with submersed macrophyte growth and community dynamics". Aquatic Botany, 41: 41-65. [ Links ]
Baver, L.D., 1961. Soil Physics. John Wiley and Sons, Inc. 3rd Edition. New York, USA. pp. 75. [ Links ]
Boyd, C.E., 1990. Water Quality in Ponds for Aquaculture. Alabama Agricultural Experiment Station. Alabama Auburn University. USA. pp. 46. [ Links ]
Bremner, J.M., 1965. "Total Nitrogen". En: Black, C.A.; D.D. Evans, J.L. White, L.E. Ensminger, y F.E. Clark. Eds. Methods of Soil Analysis. Serie Agronomy Núm. 9, Parte 2. American Society of Agronomy, Inc., Publisher. Wisconsin, USA. pp. 1149-1176. [ Links ]
Brock, Th.C.M.; G.H.P. Arts, I.L.M. Goossen, y A.H.M. Rutenfrans, 1983. "Structure and annual biomass production of Nymphoides peltata (Gmel.)". O. Kuntze (Menyanthaceae). Aquatic Botany, 17: 167-188. [ Links ]
Carr, G.M.; H.C. Duthie, y W.D. Taylor, 1997. "Models of aquatic plant productivity: a review of the factors that influence growth". Aquatic Botany, 59: 195-215. [ Links ]
Comisión de Cuenca de la Laguna de Tecocomulco, A.C., 2007. Informe Anual. Disponible en: http://www.conagua.gob.mx/DLHgo07/contenido/Documentos/Informe_Anual_CCLT_2007.pdf. [consultada 31 enero 2011] [ Links ].
Cronk, J.K., y M.S. Fennes, 2001. Wetland plants, biology and ecology. Lewis Publishers. Boca Raton, Florida. 462 p. [ Links ]
Day, P.R., 1965. "Hydrometer Method of Particle-Size Analysis". En: Black, C.A.; D.D. Evans, J.L. White, L.E. Ensminger, y F.E. Clark. Eds. Methods of Soil Analysis. Serie Agronomy No. 9, Parte 1. American Society of Agronomy, Inc., Publisher. Wisconsin, USA. pp. 545-566. [ Links ]
De la Lanza, E.G., y R.G. Gómez, 2005. "Analysis of the short term geoenvironmental evolution of an endorreic basin using satellite images: the case of Tecocomulco Lagoon, Mexico". Investigaciones Geográficas, 58: 66-79. [ Links ]
Haslam, S.M., 1978. River Plants, the macrophytic vegetation of watercourses. Cambridge University Press. London, Great Britain. pp. 77-149. [ Links ]
Huizar, R., y J. Ruiz. 2005. "Aspectos Físicos y Socioeconómicos de la Subcuenca de Tecocomulco". En: Huízar, R.; E. Jiménez, y C. Juárez, Eds. La Laguna de Tecocomulco, Geo-Ecología de un Desastre. Publicación Especial 3. Instituto de Geología, UNAM. México. pp. 9-17. [ Links ]
Hutchinson, G.E., 1975. A Treatise on Limnology. vol. III. John Wiley and Sons, Inc. New York, USA. pp. 409-508. [ Links ]
Khan, F.A., y A.A. Ansari, 2005. "Eutrophication: An Ecological Vision". The Botanical Review, 71(4): 449-482. [ Links ]
Kercher, J.M., y J.B. Zedler, 2004. "Flood tolerance in wetland angiosperms: a comparision of invasive and noninvasive species". Aquatic Botany, 80: 89-102. [ Links ]
Lingfei, Y., y Y. Dan, 2011. "Differential responses of the floating-leaved aquatic plant Nymphoides peltata to gradual versus rapid increases in water levels". Aquatic Botany, 94: 71-76. [ Links ]
Lorenzen, B.; H. Brix, I.A. Mendelssohn, K.L. McKee, y S.L. Miao, 2001. "Growth, biomass allocation and nutrient use efficiency in Cladium jamaicense and Typha domingensis as affected by phosphorus and oxygen availability". Aquatic Botany, 70(2), p. 117-133. [ Links ]
Lot, A.; A. Novelo, M. Olvera, y P. Ramírez-García, 1999. Catálogo de angiospermas acuáticas de México: hidrófitas estrictas emergentes, sumergidas y flotantes. Cuadernos 33. Instituto de Biología, UNAM. México. 161 pp. [ Links ]
Lot, A., 2005. "Vegetación Acuática de la Laguna de Tecocomulco". En: Huízar, R.; E. Jiménez, y C. Juárez. Eds. La Laguna de Tecocomulco, Geo-Ecología de un Desastre. Publicación Especial 3. Instituto de Geología, UNAM. México. pp. 141-147. [ Links ]
Márquez, A.; W. Senior, G. Martínez, y A. González, 2007. "Concentraciones de nitrógeno y fósforo en sedimentos recientes de la laguna Los Patos, Estado Sucre, Venezuela". Boletín Instituto Oceanográfico de Venezuela, 46(2): 137-145. [ Links ]
Martínez, J., 2009. Actores claves en la consolidación de la base social: cuenca de la Laguna de Tecocomulco. Disponible en: http://wwww.ine.gob.mx/descargas/cuencas/2011_cnch2_cco_jmartinez.pdf. [consultada 31 enero 2011] [ Links ].
Mehlich, A., 1984. "Mehlich-3 Soil Test Extractant: A Modification of Mehlich-2 Extractant". Communications in Soil Science and Plant Analysis, 15: 1409-1416. [ Links ]
Mueller-Dombois, D., y H. Ellenberg, 1974. Aims and Methods of Vegetation Ecology. John Wiley & Sons Publishers. N.Y., USA. 547 pp. [ Links ]
Novelo, E.; G. Montejano, E. Cantoral, y R. Tavera, 2005. "Las Algas de la Laguna de Tecocomulco". En: Huízar, R., Jiménez, E., y Juárez, C. Eds. La Laguna de Tecocomulco, Geo-Ecología de un Desastre. Publicación Especial 3. Instituto de Geología, UNAM. México. pp. 131-140. [ Links ]
Porta, J.; M. López-Acevedo, y C. Roquero, 1994. Edafología para la agricultura y el medio ambiente. Mundi-Prensa. Madrid, España. 807 pp. [ Links ]
Ramírez, R.J., y J.F. Noreña, 2004. "Caracterización del sedimento de una laguna tropical rasa". Caldasia, 26(1): 173-184. [ Links ]
Richardson, C.J.; D.L. Tilton, J.A. Kadlec, J.P. Chamie, y W.A. Wentz, 1978. "Nutrient dynamics of northern wetland ecosystems". En: Good, R.E. Ed. Freshwater Wetlands. Academic Press, Inc. New York, USA. pp. 217-241. [ Links ]
Rubio, G.; G. Casasola, y R.S. Lavado, 1995. "Adaptation and biomass production of two grasses in response to waterlogging and soil nutrient enrichment". Oecologia, 102: 102-105. [ Links ]
Ryding, S.O., y W. Rast, 1989. The control of eutrophication of lakes and reservoirs. Man and Biosphere Series. vol. I. Edited by S.O. Ryding and W. Rast. The Parthenon Publishing Group. New Jersey, USA. pp. 39. [ Links ]
Rzedowski, J., 1998. "Diversidad y orígenes de la flora fanerogámica de México". En: Ramamoorthy, T.P.; R. Bye, A. Lot, y J. Fa (eds.) Diversidad biológica de México: orígenes y distribución. Universidad Nacional Autónoma de México. México. pp. 129-145. [ Links ]
"Soil Testing, Handbook on Reference Methods". 1980. The Council on Soils Testing and Plant Analysis. Rev. Ed. University of Georgia. Athens, Georgia. pp. 37-40. [ Links ]
Standard Methods for the Examination of Water and Wastewater, 1998. American Public Health Association Ed.. 20th ed., Washington, USA. 849 pp. [ Links ]
Statistica 7.0. Stat Soft, Inc., 2004. Statistica (data analysis software system), version 7. [ Links ]
Van der Velde, G.; Th. G. Giesen, y L. Van der Heijden, 1979. "Structure, biomass and seasonal changes in biomass of Nymphoides peltata (Gmel.) O. Kuntze (Menyanthaceae), a preliminary study". Aquatic Botany, 7: 279-300. [ Links ]
Van Reeuwijk, E., 1995. Procedimientos para análisis de suelos (clasificación y correlación). Colegio de Postgraduados. Texcoco, México. 145 pp. [ Links ]
Whigham, D.F.; J. McCormick, R.E. Good, y R.L. Simpson, 1978. "Biomass and Primary Production in Freshwater Tidal Wetlands of the Middle Atlantic Coast". En: Good, R.E. Ed. Freshwater Wetlands. Academic Press, Inc. New York, USA. pp. 3-20. [ Links ]