Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.37 México feb. 2014
Fenología reproductiva y tolerancia a temperaturas altas en Stenocereus queretaroensis
Reproductive phenology and tolerance to high temperatures in Stenocereus queretaroensis
Whaleeha Gudiño1,2, y Erick De la Barrera1,3
1 Centro de Investigaciones en Ecosistemas, Universidad Nacional Autónoma de México, Campus Morelia. Antigua Carretera a Pátzcuaro 8701, Col. Ex-Hacienda de San José de la Huerta, Morelia, Michoacán 58190, México.
2 Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México, Av. Ciudad Universitaria 3000, Del. Coyoacán, Distrito Federal 04360, México.
3 David Rockefeller Center for Latin American Studies y Department of Organismic and Evolutionary Biology, Harvard University, 16 Divinity Ave., Biological Labs 3119, Cambridge, Massachusetts 02138, EEUU. correo electrónico: erick@cieco.unam.mx.
Recibido: 29 mayo 2012.
Aceptado: 16 mayo 2013.
Resumen
Numerosas especies de cactáceas presentan frutos comestibles, por lo que han adquirido un papel importante dentro de la agricultura de zonas áridas y semiáridas, tanto para el comercio regional como para el internacional. Las pitayas son el tercer cultivo más importante dentro de las cactáceas después del nopal y la pitahaya. La fenología reproductiva de Stenocereus queretaroensis requiere condiciones específicas de temperatura y precipitación, así como también de la existencia de los polinizadores para asegurar la producción de frutos. Se cuantificó la producción de botones, flores abiertas y frutos de 2010 a 2012. Y se evaluó el efecto de temperaturas altas en la integridad celular de tejidos florales. Se midió la producción de néctar y la concentración de solutos a través del tiempo durante la antesis. La temperatura letal (LT50) para el ovario en promedio fue de 34.5 ± 0.4°C no varió para los botones y las flores. Por su parte los pétalos de los botones presentan una LT50 21.5 ± 1.6°C y que para el caso de las flores en antesis fue 33% mayor. El desarrollo reproductivo frecuentemente requiere de la acumulación de cierta cantidad de estas unidades de frío. El tejido de estructuras jóvenes tolera más el aumento de la temperatura, que sus contrapartes maduras.
Palabras clave: antesis, botones florales, néctar, permeabilidad de membrana, temperaturas mínimas.
Abstract
Many cacti have edible fruits, so they have acquired an important role in agriculture in arid and semiarid regions, both for regional and international markets. Pitayas are the third most important cactus crop, after cactus pear and pitahaya. Reproductive phenology of Stenocereus queretaroensis requires specific conditions of temperature and precipitation, as well as the presence of pollinators to ensure fruit production. The production of buds, open flowers, and fruits was quantified from 2010 to 2012, it was the effect of high temperatures on floral tissues. There was an evaluated nectar production and concentration of solutes were measured on through the anthesis. The lethal temperature (LT50) averaged 34.5 ± 0.4°C for the ovary and did not change between buds and flowers. In turn, petals of buds had an LT50 of 21.5 ± 1.6°C, which was 33% higher. Reproductive development often requires the accumulation of certain amount of cold units. The tissues of young reproductive organs were better suited to withstand higher components than their mature counterparts.
Key words: anthesis, flower buds, membrane permeability, minimum temperatures, nectar.
Introducción
Como resultado de su situación geográfica, de su topografía y diversidad climática, Michoacán se ha convertido en el principal productor agrícola de México. Por ejemplo, los $39 millardos que esa actividad generó en 2011 superaron por 30% a la producción de Jalisco y Veracruz y casi duplicó la de Chiapas, Guanajuato, Sinaloa y Sonora (Servicio de Información Agroalimentaria y Pesquera 2012). Sin embargo, 42% de dicha producción depende exclusivamente del aguacate, por lo que la preeminencia del estado podría ser vulnerada por causas climatológicas (como el aumento de la temperatura o la alteración de los regímenes de lluvia), biológicas (una plaga o una enfermedad del aguacate) o económicas (un nuevo embargo al aguacate mexicano). El establecimiento y desarrollo de nuevos cultivos aumentaría la resiliencia del sector agrícola en ese estado y podría contribuir a su economía.
Asimismo, considerando que una parte de Michoacán podría tener una reducción en su precipitación pluvial como consecuencia del cambio climático, se deben considerar especies adaptadas a ambientes semiáridos, como las de la familia Cactaceae (Nobel et al., 2002; Sáenz-Romero et al., 2010). El cultivo de nopal (varias especies del género Opuntia) supera el millón de hectáreas en el mundo, en su mayoría dedicadas a la producción de forraje y apenas 10% a la de frutos, principalmente en México e Italia (Nobel, 2000). Por su parte, el cultivo del nopal generó en Michoacán casi $30 millones en 2011, principalmente por la producción de nopalitos, mientras que la contribución del forraje ($33 000) y de las tunas ($24 000) fue marginal (Sistema de Información Agroalimentaria y Pesquera 2012).
Además de las especies del género Opuntia, diversas cactáceas tienen importancia alimentaria para los habitantes de las zonas áridas y semiáridas de México, ya producen frutos comestibles (Gibson y Nobel 1986; Nobel 1988; Bravo-Hollis y Scheinvar 1999; Pimienta-Barrios 1999; Nobel 2002). La comercialización de los frutos va desde mercados locales, hasta internacionales (Nassar et al., 1997; Pimienta-Barrios y Nobel, 1994; Casas et al., 1999 a,b; Otero-Arnaiz et al., 2003; Nobel y de la Barrera, 2004a; Carmona y Casas, 2005).
De las casi 70 especies de cactáceas columnares que son nativas de México (Casas 2002; Valiente-Banuet et al., 2002), 45 presentan algún tipo de manejo (Bravo-Hollis y Sánchez-Mejorada 1991; Casas et al., 1999; Carmona 2001), como las pitayas (Stenocereus spp), siendo Jalisco, Michoacán, Puebla y Oaxaca los estados del país en los que se han establecido plantaciones comerciales (Pimienta-Barrios y Nobel 1994; Neri-Luna et al. , 1999). Por ejemplo, en la región de Tierra Caliente del estado de Michoacán, se consumen los frutos de Stenocereus quevedonis, sin embargo éste no se cultiva, sólo se manejan las poblaciones naturales de algunas zonas de Infiernillo (Com. Per. Casas, 2009; Obs. Pers., 2009).
La cactácea columnar de consumo más extendido en México es el pitayo de Querétaro (s. queretaroensis). Su importancia ha crecido en los últimos tres lustros, pues de las 73 hectáreas que se cultivaban en 1999, únicamente en Jalisco, han aumentado catorce veces más en siete estados (Sistema de Información Agroalimentaria y Pesquera 2012). De hecho, la popularidad de la pitaya se ha incrementado en los últimos 15 años. En Guadalajara, los productores de varias localidades del sur de Jalisco han organizado un mercado de agricultores de temporada, donde las pitayas se venden directamente a los consumidores (Gallardo-Vásquez y De la Barrera, 2007).
El cultivo de S. queretaroensis en Michoacán podría contribuir a mejorar el ingreso de familias rurales en ese estado. Como parte de la valoración de esta especie como posible cultivo nuevo en Michoacán, se observó el desarrollo reproductivo de una colección de individuos de S. queretaroensis que fue establecida en 2008, incluyendo su fenología, antesis y producción de néctar. Asimismo, considerando que el desarrollo reproductivo de esta especie ocurre durante la primavera, cuando la temperatura es máxima en su sitio de distribución, se evaluó la tolerancia térmica de los tejidos de las flores.
Material y métodos
Sitio de estudio y condiciones ambientales
El estudio se desarrolló en el Jardín Botánico del Campus Morelia de la Universidad Nacional Autónoma de México (19° 42' 10" N, 101° 11' 32" O, 1980 m). Para caracterizar las condiciones ambientales prevalecientes en ese lugar se obtuvieron los datos meteorológicos de las cuatro estaciones del Servicio Meteorológico Nacional (2012) existentes en el municipio de Morelia, las cuales se encuentran a distancias de 4.6 km (estación número 16022) a 11.2 km (estación número 16055) del sitio de estudio. Se revisó la integridad y continuidad de los datos de temperatura máxima y mínima y de precipitación para calcular las condiciones climatológicas normales del sitio. Asimismo, para contrastar con la fenología de las plantas, se obtuvieron los datos diarios de temperatura del aire y precipitación de dichas estaciones meteorológicas durante la duración del estudio de 2010 a 2012.
Material vegetal y observaciones de la fenología reproductiva
Se estudió el desarrollo reproductivo de individuos de Stenocereus queretaroensis que forman parte de la colección de cactáceas del Jardín Botánico del Campus Morelia, Universidad Nacional Autónoma de México. Las plantas habían sido colectadas en 2008 en la localidad de Teremendo, Michoacán, a 30 km del Jardín Botánico para formar parte de la colección botánica del mencionado Jardín Botánico.
La producción de botones florales, flores y frutos de S. queretaroensis fue observada diario durante la temporada de desarrollo reproductivo de los años 2010, 2011 y 2012. Una vez concluida la actividad reproductiva, las plantas fueron revisadas una vez a la semana para descartar la formación de botones o flores atemporales y detectar el inicio de la siguiente temporada del desarrollo reproductivo.
Antesis y producción de néctar
El 25 y 26 de febrero de 2011, durante el segundo año del estudio, se registró la hora del comienzo de la antesis, su duración y la hora del cierre de las flores; en botones florales que habían sido cubiertos con bolsas de organza durante la tarde anterior para impedir el acceso de polinizadores y la posible remoción del néctar. Cada hora, a la par de las observaciones de la apertura floral descritas arriba, se cosechó la solución de néctar secretado por cada una de las15 flores excluidas, con una jeringa de insulina (Terumo) de 0.5 ml, hasta que la cosecha fue cero en dos mediciones continuas. Posteriormente se sumaron y promediaron los datos obtenidos para de esta manera obtener el volumen total de néctar producido. Para una mejor apreciación de la gráfica, los datos fueron transformados a microlitros (μl). La concentración de azúcares de la solución de néctar se determinó con un refractómetro Brix 50 (Reichert Inc., Nueva York, EU).
Tolerancia a temperaturas altas
La tolerancia de los tejidos florales de S. queretaroensis a temperaturas elevadas fue determinada el 28 de febrero de 2011 mediante la cuantificación de la fuga de electrolitos, una medida de integridad de la membrana celular (Didden-Zopfy y Nobel, 1982; Drennan, 2009). De cada uno de ocho individuos se tomó un botón floral y una flor en antesis, ambos con exposición hacia el Suroeste. Los órganos fueron envueltos en algodón húmedo y papel aluminio, para evitar su desecación, antes de ser colocados en una incubadora de estado sólido Tropicooler (Boekel Scientific, Feasterville, Pensilvania, EU) donde fueron mantenidos a una temperatura dada durante 1 h. Transcurrido el periodo de incubación, con un sacabocados (3 mm de diámetro) se obtuvieron discos de tejido del ovario y de los pétalos de cada botón o flor incubados. Cada disco fue colocado en un vial de vidrio con 50 ml de agua desionizada y agitado durante 25 minutos a 250 rpm. Al mismo tiempo se obtuvo un segundo disco de tejido de cada botón o flor que fue hervido durante cinco minutos para provocar la desnaturalización de la membrana celular y obtener la fuga máxima de electrolitos. Posteriormente, el disco fue agitado como ya se describió. Después del periodo de agitación se midió la conductividad eléctrica de la solución con un conductivímetro Orion-3 (Thermo Electron Corporation, Marietta, Ohio, EU) y la fuga de electrolitos se expresó como porcentaje del máximo. Una vez obtenidos los discos de tejido, los órganos fueron envueltos nuevamente y regresados a la incubadora donde, a una tasa de 0.5°C min-1 se aumentó la temperatura en 5°C durante un periodo de incubación adicional de 1 h. Este proceso se repitió hasta alcanzar la máxima fuga de electrolitos.
Posteriormente, se identificó la temperatura a la que ocurrió la mitad de la fuga máxima de electrolitos (LT50; véase una descripción detallada en Nobel et al., 2002). Dichas LT50, determinadas en el laboratorio, son buenos estimadores de la tolerancia de las plantas a temperaturas extremas que se registran en el campo (Nobel et al., 2002; Drennan, 2009).
Los análisis estadísticos de los datos fueron realizados con DataDesk 6.3 para Windows. Data Description, Inc. 840 Hanshaw Rd. Second Floor. Ithaca, NY, 14850. Se presenta el promedio ± 1 error estándar (n = tamaño de muestra). Los datos fueron graficado con SigmaPlot10.0 para Windows. Systat Software, Inc. 1735 Technology Drive, Suite 430 San Jose, CA 95110 USA.
Resultados
A partir de los registros de clima de 20092012 obtenidos de las estaciones meteorológicas (n=4) más cercanas al sitio de estudio, se obtuvo la temperatura media anual de 19.3 ± 0.9°C para Morelia. Las temperaturas más bajas anuales se produjeron durante diciembre y enero, con un promedio de 6.5 ± 0.9°C, siendo la mínima histórica de 1°C, observada en enero de 1966. Por su parte, las temperaturas más altas se presentaron en mayo con un promedio de 31.7 ± 0.8°C y la máxima historia fue de 39°C, en mayo de 1998.
En Morelia, la precipitación anual promedio fue de 791 ± 121 mm, observándose 63% de la lámina de junio a septiembre. Asimismo, la máxima precipitación de 252 ± 67 mm ocurre durante el mes de julio. Durante el periodo que duró el presente estudio, la temperatura mínima promedio para 2009 fue de 11.3 ± 0.9°C, esto es 1.5°C más que la temperatura mínima promedio de 9.8°C para el 2010 y 2011 fue 0.5°C mayor que el promedio (fig. 1A). La precipitación para 2010 fue atípica, el año empezó con una lluvia de 164 ± 5 mm, mientras que en el 2009 fue de sólo 9 ± 1.8 mm y en el 2011 no se registró precipitación para el mes de febrero. Para los meses de julio y agosto en el año 2010 fue de 100 ± 13.6 mm, mayor que el 2009. Sin embargo, en 2011 cerca del 50% de la precipitación se concentró en el mes de julio, haciendo de este mes el de mayor precipitación durante el tiempo que duro el estudio (fig. 1B).
Fenología
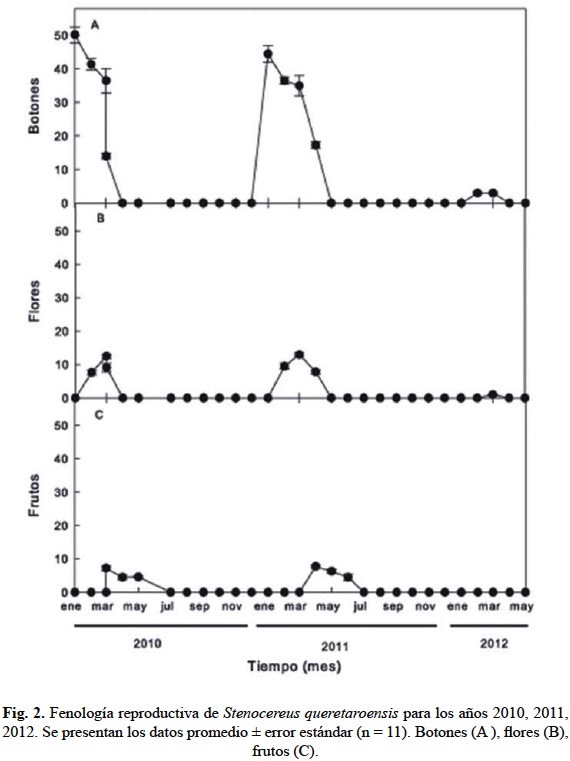
El desarrollo reproductivo de Stenocereus queretaroensis fue comparable durante los primeros dos años del estudio. La producción de botones florales inició y fue máxima en enero y se mantuvo, aunque a una tasa menor, durante los siguientes tres meses (fig. 2A). Con una eficiencia de 20% en 2010 y de 23% en 2011, la antesis floral inició en febrero y fue máxima en marzo (fig. 2B). Por su parte, la fructificación también fue comparable entre 2010 (55%) y 2011 (61%). En este caso, el pico de producción de frutos se observó en abril (fig. 2C). En cambio, el desarrollo reproductivo de S. queretaroensis fue considerablemente menor en 2012 que en los dos años anteriores (fig. 2). Por ejemplo, sólo se produjeron seis botones florales (fig. 2A) y una sola flor se desarrolló hasta alcanzar la antesis (fig. 2B), pero no se desarrolló el fruto (fig. 2C).
El número total de botones para el 2010 fue 142 ± 7.7, en el 2011 fue 133 ± 5.7, mientras que para el 2012 sólo se produjeron seis botones. El total de flores en antesis para el 2010 fue de 29 ± 1.5, en el 2011 fue de 30 ± 1.5, en el 2012 sólo se encontró una flor en antesis. Los resultados en la producción de frutos fue similar el 2011 fue el que presentó una mayor producción 18 ± 0.9.
Antesis y secreción de néctar
La antesis de S. queretaroensis, observada en enero de 2011, inició a las 20:00 h y terminó a las 12:00 h del día siguiente. Por su parte, la secreción de néctar inició a las 22:00 h y fue continua hasta las 6:00 h. El pico de secreción se observó de 23:00 a 01:00 h (fig. 4). Para las flores de los 13 individuos considerados en el presente estudio, la producción total de néctar fue de 1 929 ± 34 μl por flor (n = 15 flores), con una concentración de 20.3 ± 1.2°Brix (n = 15 flores).
Fuga de electrolitos
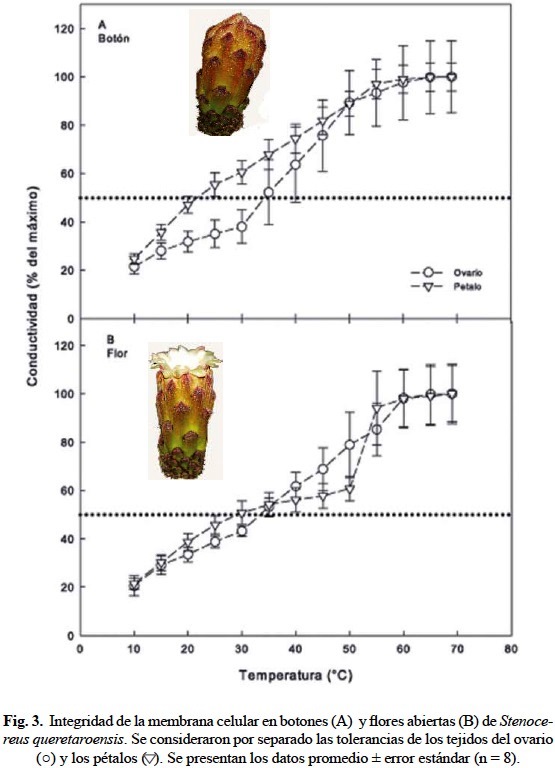
La tolerancia a temperaturas altas (LT50) de los ovarios y pétalos de botones y flores de S. queretaroensis varió significativamente (P < 0.004 de un ANOVA de dos vías; fig. 3). Sin embargo, las pruebas pareadas de Bonferroni (significativas a 0.05) sólo revelaron diferencias en los pétalos de los botones florales, cuya LT50 de 21.5 ± 1.6°C fue menor que para el resto de los tejidos cuyas LT50 alcanzaron los 34.5 ± 0.34°C en promedio.
Discusión
Las condiciones ambientales del sitio de estudio en Morelia fueron comparables con aquellas de la zona de distribución de Stenocereus queretaroensis (Nobel y Pimienta-Barrios, 1995; Neri-Luna et al., 1999; Pimienta-Barrios et al., 2002). Por ejemplo, mientras que la temperatura mínima puede ser de 2°C en Zacatecas y de 8°C en Jalisco (Neri-Luna et al., 1999; Pimienta-Barrios et al., 2002), la temperatura mínima en Morelia fue de 6.5°C. En cambio, las temperaturas máximas, que van de 41°C en Zacatecas a 29°C en Jalisco, apenas superaron la temperatura máxima observada en el sitio de estudio (Nobel y Pimienta-Barrios, 1995; Neri-Luna et al., 1999; Pimienta-Barrios et al., 2002). Esta similitud de las temperaturas sugiere que Morelia y sus alrededores pueden ser adecuados para el establecimiento de plantaciones de S. queretaroensis.
La precipitación, por su parte, varía ampliamente en la zona de distribución natural de S. queretaroensis. Contrastan los 200 mm anuales de Zacoalco de Torres, Jalisco, con los 1 082 mm anuales de Autlán de Navarro, en el mismo estado (Neri-Luna et al., 1999; Pimienta-Barrios et al., 2002). En ambas localidades, que son productoras de pitaya, la precipitación es marcadamente estacional. En ese caso, la supervivencia de S. queretaroensis, y de otras especies vegetales suculentas, así como la posibilidad de establecer plantaciones comerciales exitosas, se debe a su capacidad de almacenar agua durante la estación de lluvia para mantener sus funciones fisiológicas a lo largo del año. Se ha observado que, aunque el riego no estimula el crecimiento vegetativo, la producción de frutos sí se ve favorecida (Pimienta-Barrios et al., 1997; Pimienta-Barrios y Nobel, 1998). La precipitación en el área de estudio, que alcanzó 73% de lo reportado para Autlán, es suficiente para sustentar el desarrollo de flores y frutos, un proceso que requiere grandes volúmenes de agua y ocurre durante la estación seca (Pimienta-Barrios, 1998; de la Barrera y Nobel, 2004). A pesar de que, con el cambio climático, la precipitación en el sitio de estudio podría disminuir hasta 20% en el sitio de estudio (Escenario A2, Modelo Canadiense de Circulación General; Rehfeldt, 2012), el agua disponible también sería suficiente para sustentar la producción de frutos.
La diferenciación de botones florales de S. queretaroensis en Sayula, Jalisco, inicia en febrero y se extiende hasta principios de abril (Pimenta y Nobel, 1998). En este trabajo se observó el desarrollo de botones desde enero, lo cual podría deberse a que la temperatura de invierno en Morelia fue menor que los 5 a 10°C de temperatura mínima promedio que se observan en los sitios donde se cultiva S. queretaroensis. En diversas especies frutales el desarrollo reproductivo está mediado por la vernalización, cuyos cambios fisiológicos requieren de la exposición a periodos específicos de temperaturas bajas (de la Barrera et al., 2009). Por ejemplo, bajo condiciones ambientales controladas, Opuntia ficus-indica tiende a producir botones florales después de ser expuesta durante 14 semanas a una temperatura nocturna de 5°C durante la noche, mientras que la producción de nuevos tallos se favorece cuando la temperatura nocturna es de 25°C (Nobel y Castañeda, 1998). El hecho de que la temperatura mínima del invierno sea menor en Morelia que en el sur de Jalisco podría permitir que las plantas acumulen el frío necesario antes que en sitios más cálidos, permitiendo, así, un desarrollo reproductivo precoz, como ocurre Santa Rosa, Zacatecas (Nobel y Pimienta-Barrios, 1995; Neri-Luna et al., 1999; Pimienta-Barrios et al., 2002).
A pesar de que las condiciones ambientales en el sitio de estudio fueron similares a las condiciones óptimas para el establecimiento y desarrollo de S. queretaroensis y que el desarrollo reproductivo observado fue precoz, la diferenciación de botones florales y la producción de flores apenas alcanzó la mitad de la observada en otros sitios (Domínguez, 1995; Pimienta-Barrios, 1999). Más aún, aunque se produjeron algunos frutos, ninguno alcanzó la madurez, y en la temporada de crecimiento de 2012 apenas se produjo un fruto abortivo. Esto podría deberse a varios factores, incluyendo la edad de las plantas y una posible ausencia de polinizadores.
Si bien la propagación vegetativa de S. queretaroensis permite el establecimiento de plantaciones comerciales, las plantas a pesar de originarse de ramas que ya producían frutos -requieren hasta 10 años para alcanzar una producción estable de frutos (Pimienta-Barrios y Nobel, 1998). Esto también ocurre en otros cultivos, como el de la palma de aceite, la cual empieza a producir hasta el tercer año y alcanza su máxima producción hasta el séptimo año después de la siembra (Carlson et al., 2012). Sin embargo, una vez que S. queretaroensis logra la madurez reproductiva, su productividad puede ser óptima durante más de 30 años y en algunos casos hasta 100 años (Pimienta-Barrios y Nobel 1998).
La ausencia de los frutos también pudo deberse a la falta de polinizadores efectivos en el sitio de estudio. Aquí, la producción de néctar fue nocturna, de manera similar a lo que ocurre en el campo, donde las flores son visitadas por murciélagos y esfíngidos (Lomelí, 1991; Petit ,1995; Valiente y Arizmendi, 1997; Ibarra-Cerdeña, 2005). Sin embargo, la única especie de murciélago que ha sido observada en el sitio de estudio, Myotis velifera es insectívora (Martínez del Río y Búrquez, 1986; com pers. Vázquez-Domínguez y Ayala-Berdon, 2012). Futuros estudios en el Jardín Botánico deberán considerar ensayos de polinización manual de S. queretaroensis y dar seguimiento a lo largo de varios años para verificar si, en efecto, la producción de flores y frutos aumenta con la edad de las plantas.
La tolerancia de los botones y flores de S. queretaroensis a temperaturas altas, determinada mediante la fuga de electrolitos a través de la membrana celular, fue considerablemente menor que la LT50 de 55°C de frutos jóvenes de O. ficusindica, especie cuyas estructuras reproductivas presentan menor tolerancia a temperaturas extremas que sus tejidos fotosintéticos (Nobel y De la Barrera, 2003). La diferencia observada podría ser un reflejo de la temperatura en la que se desarrolló el tejido. Por ejemplo, la LT50 del tejido fotosintético de cerca de 20 cactáceas aumenta 0.53°C por cada grado que aumenta la temperatura ambiental (Drennan, 2009). Sin embargo, probablemente porque su desarrollo es efímero, las LT50 de frutos de cactáceas no presentan aclimatación a temperaturas extremas (Nobel y De la Barrera, 2003; De la Barrera et al., 2009). Fue notable, sin embargo, que el tejido de los pétalos inmaduros en los botones presentara una LT50 10°C menor que el tejido de las flores en antesis, reflejando, también un posible componente ontogenético de la tolerancia a temperaturas extremas, el cual no ha sido reportado en la literatura y que deberá verificarse en futuras investigaciones. Por otra parte, el hecho de que la diferencia en la LT50 sólo se observó en los pétalos y no en los ovarios podría reflejar la importancia relativa de las estructuras reproductivas esenciales, en comparación con las estructuras secundarias.
Por lo que podemos concluir, que estos individuos deben seguir siendo censados a largo plazo, debido a que aún falta realizar observaciones en campo más detalladas, que nos permitan integrar datos más exactos del efecto de los polinizadores en la fecundación de las flores, para de esta forma evaluar si los frutos formados fueron a causa de la polinización cruzada por la visita de abejas, debido a que las flores permanecen abiertas hasta las 12:00 pm. Además de realizar experimentos de polinización manual para descartar la edad de la planta como un factor determinante en la producción de frutos y descartar la falta de polinizadores específicos. Así como evaluar la tolerancia a temperaturas mínimas en el tejido floral, aparte de evaluar la tolerancia a temperaturas extremas del fruto ya que éste es de gran importancia económica y agronómica. Aún con estudios por realizar de la fenología reproductiva, con este trabajo se sentaron las bases para el estudio de tolerancia a la temperatura de tejido floral, y da paso a un estudio a largo plazo de ésta y otras especies de cactáceas que forman parte del jardín Botánico de la UNAM campus Morelia.
Agradecimientos
Agradecemos el patrocinio de la Dirección General del Personal Académico, UNAM (PAPIIT IN224910) y del Fondo Mixto Michoacán-CONACYT (FOMIX-MICH 2009-127128). La ayuda en campo de Omar Hernández-Ordóñez es gratamente apreciada. Whaleeha Gudiño agradece al Consejo Nacional de Ciencia y Tecnología por la beca de doctorado otorgada durante el periodo 2008-2011. Este trabajo fue terminado mientras Erick de la Barrera gozaba de las generosas becas "Antonio Madero" de la Fundación México, en Harvard, y de CONACYT para estancia sabática.
Literatura citada
Anderson, E.F, 2008. The cactus family. 3ed. Timber Press. Londres. [ Links ]
Byrne, D.H., y T.A. Bacon, 1992. "Chilling accumulation: its importance and estimation". The Texas Horticulturist, 18(5): 8-9. [ Links ]
Brandenbur, A.; A. Dell'Olivo, R. Bshary, y C. Kuhlemeier, 2009. "The sweetest thing advances in nectar research". Plant Biology Current Opinion, 12: 486-490. [ Links ]
Bravo-Hollis, H., y H. Sánchez-Mejorada, 1991. Las cactáceas de México. vols. II y III. Universidad Nacional Autónoma de México, México. [ Links ]
Bravo-Hollis, E., y L. Scheinvar, 1999. El interesante mundo de las cactáceas. 2da. ed. Fondo de Cultura Económica. México. [ Links ]
Carmona, A.R., 2001. Variación morfológica en poblaciones silvestres, manejadas y cultivadas de Polaskia chichipe en el Valle de Tehuacán-Cuicatlán. Tesis de maestría. Universidad de Colima, Colima. [ Links ]
Carmona, A., y A. Casas, 2005. "Management, phenotypic patterns and domestication of Polaskia chichipe (Cactaceae) in the Tehuacán Valley, Central Mexico". Journal of Arid Environments, 60: 115-132. [ Links ]
Carlson K.M.; L.M. Currana, D. Ratnasarie, A.M. Pittmana, B.S. Soares-Filhof, G.P. Asnerg, S.N. Triggh, D. A. Gaveaub, D. Lawrencei, y H.O. Rodriguesf, 2012. "Committed carbon emissions, deforestation, and community land conversion from oil palm plantation expansion in West Kalimantan, Indonesia". PNAS, 19: 7559-7564. [ Links ]
Casas, A., 2002. "Uso y manejo de cactáceas columnares mesoamericanas". CONABIO. Biodiversitas, 40: 18-23. [ Links ]
Casas, A.; J. Caballero, y A. Valiente-Banuet, 1999. "Procesos de domesticación en cactáceas columnares de la vertiente del Pacífico sur de México". En: Pimienta-Barrios, E. (Ed.). El pitayo en Jalisco y especies afines en México. Universidad de Guadalajara, Fundación Produce Jalisco, A.C. México. pp. 147-173. [ Links ]
Cruz, M., y A. Casas, 2002. "Morphological variation and reproductive biology of Polaskia chende (Cactaceae) under domestication in Central Mexico". Journal of Arid Environments, 51: 561-576. [ Links ]
De la Barrera, E., y P.S. Nobel, 2004. "Carbon and water relations for developing fruits of Opuntia ficus-indica (L.) Miller, including effects of drought and gebberellic acid". Journal of Experimental Botany, 55: 719-729. [ Links ]
De la Barrera, E.; E. Pimienta-Barrios, y J. Schondube, 2009. "Reproductive ecophysiology". En: De la Barrera, E., Smith, W.K. (Eds.), Perspectives in Biophysical Plant Ecophysiology. Universidad Nacional Autónoma de México, México, pp. 301-336. [ Links ]
Didden-Zopfy, B., y P.S. Nobel, 1982. "High temperature tolerance and heat acclimation of Opuntia bigelovii". Oecologia, 52: 176-180. [ Links ]
Drennan, P.M., 2009. "Temperature influences on plant species of arid and semi-arid regions with emphasis on crassulacean acid metabolism (CAM) suculentes". En Perspectivies in biophysical plant ecophysiology. (Eds) De la Barrera, E. and W.K. Smith. [ Links ]
Domínguez, T.A., 1995. "Efecto del suministro de agua en el desarrollo y esfuerzo reproductivo del pitayo ( Stenocereus queretaroensis)". Tesis de licenciatura. Universidad de Guadalajara. México. [ Links ]
Gallardo-Vásquez, J.C., y E. de la Barrera, 2007. "Environmental an ontogenetic ingfluences on growth, photosynthesis, and survival for young pitayo (Stenocereus queretaroensis) seedling". JPACD, 9: 118-135. [ Links ]
Gibson, A.C., y P.S. Nobel, 1990. The cactus primer. Harvard University Press. Londres, Inglaterra. [ Links ]
Ibarra-Cerdeña, C.N.; L.I. Iñiguez-Dávalos, y V. Sánchez-Cordero, 2005. "Pollination ecology of Stenocereus queretaroensis (Cactaceae), a chiropterophilous columnar cactus, in a tropical dry forest of Mexico". American Journal of Botany, 92(3): 503-509. [ Links ]
Lomelí-Mijes, E., 1991. "Demografía reproductiva y fenología floral en pitayo (Stenocereus queretaroensis (Weber) Buxbaum)". Cactáceas y Suculentas Mexicanas, 38: 13-20. [ Links ]
Martínez del Río, C., y A. Búrquez, 1986. "Nectar production and temperature dependent pollination in Mirabilis jalapa L". Biotropica, 18: 28-31. [ Links ]
Neri-Luna, C.; E. Pimienta-Barrios, y M.C. Arriaga-Ruiz, 1999. "Importancia reproductiva y ecológica de las poblaciones silvestres de pitaya (Stenocereus queretaroensis (Weber) Buxbaum)". En: Pimienta-Barrios E (Ed.), El pitayo en Jalisco y especies afines en México. Universidad de Guadalajara, Fundación Produce Jalisco, A.C. México. pp. 175-187. [ Links ]
Nobel, P.S., 1988. Environmental biology of agave and cacti. Cambridge University Press, Nueva York. [ Links ]
----------, 2005. Physicochemical and environmental plant physiology. Elsevier Academic Press. [ Links ]
Nobel, P.S., y M. Castañeda, 1998. "Seasonal, light, and temperature influences on organ initiation for unrooted cladodes of the prickly pear cactus Opuntia ficus-indica". J. Amer. Soc. Hort., 123(1): 47-51. [ Links ]
Nobel, P.; E. Pimienta-Barrios, J. Zañudo, y B.C. Ramírez, 2000. "Historical aspects and net CO2 uptake for culivated Crassulacean acid metabolism plants in México". Annals of Applied Biology, 140: 133-142. [ Links ]
Nobel, P.S.; E. De la Barrera, D.W. Beilman, J.H. Doherty, y B.R. Zutta, 2002. "Temperature limitations for cultivating edible cacti in California". Madroño, 49: 228-236. [ Links ]
Nobel, P.S., y E. De la Barrera, 2002. "High temperatures and net CO2 uptake growth, and stem damage for hemiepiphytic cactus, Hylocereus undatus". Biotropica, 34: 225-23. [ Links ]
----------, 2004. "CO2 uptake by the cultivated hemiepiphytic cactus, Hylocereus undatus". Annals of Applied Biology, 144: 1-8. [ Links ]
Petit, S., 2001. "The reproductive phenology of three sympatric species of columnar cacti on Curaçao". Journal of Arid Environments, 49: 521-531. [ Links ]
Pimienta-Barrios, E., y P.S. Nobel, 1994. "Pitaya (Stenocereus spp. Cactaceae) an ancient and modern fruit crop of Mexico". Economic Botany, 48: 76-93. [ Links ]
----------, 1995. "Reproductive characteristics of pitayo (Stenocereus queretaroensis) an their relationships with soluble sugars and irrigation". J. Amer. Soc. Hort. Sci., 120(6): 1082-1086. [ Links ]
----------, 1998. "Vegetative, reproductive, and physiological adaptations to aridity of pitayo (Stenocereus queretaroensis, Cactaceae)". Economic Botany, 52: 401-411. [ Links ]
----------, 1998. "Vegetative, reproductive and physiological adaptations to aridity of pitayo (Stenocereus queretaroensis (Weber) Buxbaum)". Economic Botany, 52(3): 391-401. [ Links ]
Pimienta-Barrios, E.; P.S. Nobel, C. Robles-Murguía, L. Mendez-Moran, E. Pimienta-Barrios, y E. Yepez-Gonzalez, 1997. "Ethnobotany, Productivity, and Ecophysiology of Pitaya (Stenocereus queretaroensis)". Journal of the Professional Association for Cactus Development, 2: 29-47. [ Links ]
Rehfeldt, G.E.; N.L. Crookston, C. Sáenz-Romero, y E.M. Campbell, 2012. "North American vegetation model for land-use planning in a changing climate: a solution to large classification problems Ecological Applications", 22: 119-141. [ Links ]
Sáenz-Romero, C.; G.E. Rehfeldt, N.L. Crookston, P. Duval, R. St-Amant, J. Beaulieu, y B.A. Richardson, 2010. "Spline models of contemporary, 2030, 2060 and 2090 climates for Mexico and their use in understanding climate-change impacts on the vegetation". Climatic Change, 102(3-4): 595-623. [ Links ]
Servicio de Información Agroalimentaria y Pesquera 2012. http://www.siap.gob.mx/index.php?option=com_contentyview=categoryylayout=blogyid=6yItemid=335.
Valiente-Banuet, A., y M.C. Arizmendi, 1997. "Interacciones entre cactáceas y animales; polinización, dispersión de semillas y nuevos individuos". En: Suculentas Mexicanas: Cactáceas. México. CONABIO, SEMARNAP, UNAM, CVS. [ Links ]
Valiente-Banuet, A., M.C. Arizmendi, A. Rojas-Martínez y L.Domínguez-Canseco, 1996. "Ecological relationships between columnar cacti and nectar-feeding bats in Mexico". Journal of Tropical Ecology, 12: 103-119. [ Links ]
Valiente-Banuet, A.; M.C. Arizmendi, A. Rojas-Martínez, A., Casas, A., Silva, C., Godínez, H., y Dávila, P., 2002. "Biotic Interactions and population dynamics of columnar cacti". En: Fleming, T. y Valiente-Banuet, A. (Eds). Evolution, Ecology and Conservation of Columnar Cacti and their Mutualists. University of Arizona Press. pp. 225-240. [ Links ]
Wilbur H.M., 1976. "Life history evolution in seven milk-weeds of the genus Asclepias". Journal of Ecology, 64: 223-240. [ Links ]