Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Polibotánica
versão impressa ISSN 1405-2768
Polibotánica no.35 México Fev. 2013
Germinación in vitro e inducción de callo en Rubus adenotrichus Schltdl
In vitro germination and induction of callus in Rubus adenotrichus Schltdl
N.S. Martínez-Cruz, K. Arévalo-Niño, M.J. Verde-Star, A. Oranday-Cárdenas, C. Rivas-Morales, J. Treviño-Neávez y M.E. Morales-Rubio
Facultad de Ciencias Biológicas. UANL, San Nicolás de los Garza, Nuevo León, México. Correo electrónico: mmorales1132000@yahoo.com
Recibido: 25 abril 2012.
Aceptado: 18 diciembre 2012.
Resumen
Una alternativa para resolver problemas de dormancia, obtención masiva de plantas y biomoléculas de interés es el cultivo in vitro, el objetivo de este trabajo fue inducir la germinación y establecer el cultivo de callo de Rubus adenotrichus. Se probaron tres métodos de escarificación: 1) inmersión en ácido sulfúrico (30 y 60 min), 2) inmersión en hipoclorito de sodio (72 h) y 3) remoción de la cubierta de la semilla, este último tratamiento fue el mejor, generando un 68% de porcentaje de germinación, en medio Murashige Skoog (MS) sin reguladores. Las plántulas obtenidas tuvieron un desarrollo similar al de las plantas silvestres. Para la inducción de callo, se emplearon hojas de plantas silvestres como explantes y fueron colocadas en dos tipos de medio: MS, con 1 mg/L de ácido naftalenacético y 0.5 mg/L cinetina) y Woody Plant Medium (WPM) con 0.5 mg/L de ácido 2,4-diclorofenoxiacético y 0.75 mg/L de cinetina. En ambos medios se desarrolló un callo friable y pigmentado. El proceso de escarificación es fundamental para la germinación de esta especie. El empleo de los medios MS y WPM, con los reguladores adicionados son promotores de la producción de callos friables.
Palabras clave: germinación in vitro, callo, Rubus, reguladores de crecimientos, escarificación.
Abstract
An alternative to solve dormancy problems, in vitro clonal propagation and interesting biomolecules isolation, is the tissue culture technique, objective of this work was to induce germination and establish of callus culture of Rubus adenotrichus. Three scarification methods were tested: 1) inmersion in sulfuric acid (30 and 60 min), 2) inmersion in sodium hipoclorite for 72 h, and 3) removal of seed coat. The cover removal was the best scarification treatment, it obtained the highest germination percentage (68%) in media MS without regulators, the developed plants have the morphologic characteristics of wild plants. For callus induction explants of leaves MS and WPM (Woody Plant Medium) media were used. Both, MS (with α-naphthalene-acetic acid 1 mg/L and kinetin 0.5 mg/L) and WPM (with 2,4-dichlorophenoxiacetic acid 0.5 mg/L and kinetin 0.75 mg/L) developed friable and pigmented callus. In this species the scarification process is essential for germination. MS and WPM media and plant growth regulators added are promoter of callus friable.
Key words: germination in vitro, callus, Rubus, growth regulators, scarification.
INTRODUCCIÓN
El género Rubus pertenece a la familia Rosaceae, y comprende más de 700 especies. (Tomczyk and Gudj, 2005; Mertz et al., 2007). Rubus adenotrichus forma parte de la flora silvestre de Veracruz y localmente es apreciada por sus frutos comestibles y por sus propiedades medicinales (Navarro y Avendaño, 2002; Mertz et al., 2007; Barbosa et al., 2007); Acosta-Montoya et al., 2010 y Martínez-Cruz et al., 2011 reportan compuestos fenólicos con actividad antioxidante en esta especie. Sus semillas presentan cubierta dura e impermeable lo que causa un fenómeno de dormancia externa (Jennings, 1988; Nybom, 1980; Ourecky, 1975), este fenómeno aunque optimiza la distribución de la germinación en el tiempo, a veces es considerado un rasgo indeseable (Kermode, 2005). Existen diferentes mecanismos de escarificación para promover la germinación de este tipo de semillas, como son la química, mecánica hormonal entre otras. La inmersión en ácido sulfúrico concentrado de 40 min a 3 h ha sido recomendado por varios autores (Ourecky, 1975; Nybom, 1980; Peacock & Hummer, 1996 y Moore et al., 1974), como método de escarificación química; Ke et al. (1985), recomienda la remoción mecánica de la testa de las semillas de Rubus, sin embargo cuando el lote de semillas es grande esta técnica no es aplicable. El cultivo in vitro ha sido reportado para varias especies del género Rubus: R. idaeus y R. occidentalis (Anderson, 1980), R. idaeus (Borejsza-Wysocki y Hrazdin, 1994), R. idaeus (Erig et al., 2002), R. pubescens (Debnath, 2004), R. glaucus (Solórzano et al., 2004; Martínez et al., 2005), R. geoides (Vater y Arena, 2005), R, chamaemorus (Debnath, 2007; Thiem, 2003). El cultivo in vitro resulta una alternativa para resolver problemas de dormancia (Janick and Moore 1996), plagas y enfermedades (Tsao et al., 2000) obtención masiva de plantas (Martinussen et al., 2004; Wu et al., 2009) así como producción de biomoléculas de interés para la industria (Chung et al., 2007). En el presente estudio se evaluó la efectividad de los tratamientos pregerminativos a base de ácido sulfúrico y remoción de la testa sobre la germinación in vitro de Rubus adenotrichus, así como un protocolo para la inducción de callo para la obtención de metabolitos de interés.
MATERIAL Y MÉTODOS
Plantas silvestres en floración y fructificación de Rubus adenotrichus fueron colectadas en Tlacolulan, Veracruz, México, la identificación taxonómica se realizó en el Herbario del Instituto de Ecología en Xalapa, Ver., y se registró con el voucher número XAL-106448, para referencias futuras.
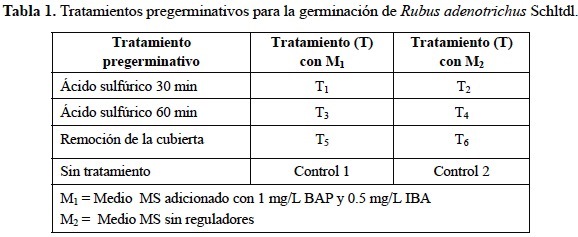
Las semillas fueron sometidas a los siguientes tratamientos de escarificación: ácido sulfúrico concentrado por 30 y 60 min, solución de hipoclorito de sodio 1% por 72 h, y remoción de la cubierta de la semilla, un lote de semillas quedó como control. (tabla 1).
Para el proceso de desinfección de semillas y hojas, el procedimiento consistió en lavar con agua y jabón líquido comercial (Protex, Colgate-Palmolive, México) luego se les dio una inmersión por 10 s en etanol, seguido de un lavado en Cloralex (hipoclorito de sodio 0.7 % por 25 min para semillas y 0.5% por 15 min para hojas) y finalmente un enjuague en la campana de flujo laminar con agua bidestilada estéril. Se sembraron 10 semillas por frasco y 10 frascos por cada tratamiento, se incubaron bajo condiciones de 12 h luz (1 450 lux, medible en un luxómetro, Control Company© 2000) y 22°C + 2°C. Para la inducción de callo las hojas fueron seccionadas transversalmente y colocando un explante por frasco y 10 frascos por cada tratamiento y se incubaron bajo las condiciones antes mencionadas.
Para la germinación se emplearon semillas escarificadas de frutos maduros que fueron colocadas en medio Murashige y Skoog (MS,1962), adicionado con 30 g/L de sacarosa, 7 g/L de agar (BIOXON) y pH 5.7, con dos variantes: medio 1 (M1) al cual se le adicionó 1 mg/L de bencilaminopurina (BAP) y 0.5 mg/L de ácido indolbutírico (AIB), el medio 2 (M2) sin reguladores de crecimiento. Las plántulas obtenidas se subcultivaron en el medio WPM con la adición de ácido L-ascórbico (50 mg/L) y polivinilpirrolidona (PVP) (150 mg/L). Se incubaron bajo condiciones de 12h luz (1450 lux, medible en un luxómetro, Control Company© 2000) y 22°C + 2°C. Se realizaron observaciones periódicas hasta los 60 días después de la siembra para determinar la germinación total.
Los resultados para la germinación se analizaron mediante un análisis de varianza usando el paquete SPSS versión 17, se realizó la comparación múltiple de medias con la prueba de Tukey y la diferencia entre medias fueron consideradas estadísticamente significativas a p ≤ 0.05 como prueba de menor diferencia significativa (LSD).
Para la inducción de callo se emplearon hojas de plantas silvestres que fueron cultivadas en dos medios de cultivo: M3 que está constituido por MS con 1 mg/L de ácido naftalenacético (ANA) y 0.5 mg/L cinetina (K) y M4 que está formado por el medio WPM (Lloyd and McCown 1980) adicionado con polivinilpirrolidona (PVP) (150 mg/L), ácido ascórbico (100 mg/L), 2,4-diclorofenoxiacético (2,4-D) (0.5 mg/L) y K (0.75 mg/L) y 3.5 g/L de phytagel (sigma).
RESULTADOS
La germinación inició en el décimo día en todos los tratamientos. Los resultados del incremento del porcentaje de germinación contra el tiempo se presentan en la figura 1, la velocidad de germinación que presentaron los seis tratamientos probados fueron: T1 0.52, T2 0.64, T3 1.22, T4 1.55, T5 2.37 y T6 3.19 semillas por día.
La germinación total (60 d) se muestra en la figura 2, los resultados indican que T6 produce la mayor tasa de germinación, este tratamiento consiste en remover la cubierta de la semilla y sembrarlas en medio MS sin reguladores de crecimiento, el tratamiento en el que se obtuvo el más bajo porcentaje de germinación fue T2 en el cual las semillas fueron escarificadas por 30 min con ácido sulfúrico y sembradas en medio MS sin reguladores, el control no germinó.
Después de la germinación se obtuvieron brotes y plantas desarrolladas con todas las características morfológicas de la planta silvestre, estas plantas fueron subcultivadas cada seis semanas al medio WPM adicionado con ácido L-ascórbico (50 mg/L), polivinilpirrolidona (150 mg/L) y después de 20 semanas se obtuvieron plantas vigorosas, con hojas y un sistema radical bien desarrollado (Fig. 3).
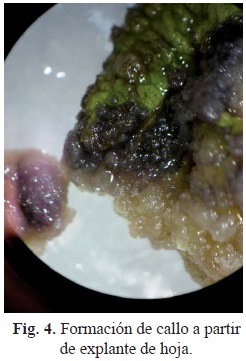
A partir de los explantes de hoja, obtenidos después de dos semanas de incubación en los medios empelados para la inducción de callo, M3 y M4, se inicia la desdiferenciación a callo (Fig. 4.), el cual inicialmente es color café claro con áreas pigmentadas color morado, y continua proliferando hasta formar un callo friable.
DISCUSIÓN
Rubus adenotrichus pertenece al grupo de plantas que produce las frutas conocidas como zarzamoras y que de acuerdo a la literatura presentan mayor dormancia que las frambuesas (Galletta et al., 1989). El tratamiento pregerminativo comúnmente utilizado para incrementar el porcentaje de germinación de las semillas de zarzamoras es el ácido sulfúrico, el tiempo de exposición y la concentración varía de acuerdo a las especies. Las semillas de los tratamientos T1 y T2 (escarificadas con ácido sulfúrico por 30 min), T3 y T4, (escarificadas con ácido sulfúrico por 60 min), mostraron bajos porcentajes de germinación, no existiendo diferencia significativa entre los tratamientos de 30 y 60 min con ácido sulfúrico. Las semillas que fueron sembradas sin tratamiento pregerminativo no germinaron, por lo tanto el ácido sulfúrico incrementa significativamente el porcentaje de germinación de Rubus adenotrichus, y coincide con lo reportado en la literatura (Ourecky, 1975; Moore et al., 1974; Nybom, 1980; Peacock y Hummer, 1996). Los tratamientos T5 y T6 en los cuales parte de la cubierta de la semilla fue removida, tuvieron el mayor porcentaje de germinación a los 60 d (T5 55% y T6 68%), no hay diferencia significativa entre estos tratamientos, confirmándose que la germinación no depende de los reguladores adicionados al medio de cultivo, pero sí depende de los métodos de escarificación empleados. El análisis estadístico muestra que los tratamientos T5 y T6 son significativamente diferentes y mejores que los otros tratamientos evaluados, estos resultados son consistentes con El Hamdouni et al., (2001), donde el corte de aquenios mejora claramente la tasa de germinación para la fresa.
El medio de cultivo MS es el más común para el cultivo in vitro del género Rubus, también ha sido empleado el medio Anderson (Anderson, 1980; Berejsza-Wysecki y Hrazdin, 1994), el N6 (Ambrozic-Turk et al., 1994) y el WPM (Lloyd y McCown, 1980), medio recomendado para plantas leñosas con resultados satisfactorios para Rubus (Castro y Gaviria, 1995). El crecimiento celular fue abundante y se obtuvo un callo friable en medio WPM con 2,4-D, K y 30 g/L sacarosa estos resultados concuerdan con McNicol y Graham (1990), ellos reportaron una moderado producción de callo en el cultivo in vitro en WPM adicionado con BAP, 2,4-D y 20 g/L de sacarosa; Hollmann et al. (2002) obtuvieron callo friable de R. parviflorus, R. spectabilis and R. strigosus en medio MS modificado, ellos usaron diferentes reguladores para cada especie, para R. spectabilis adicionaron ANA y zeatina; en el caso de R. adenotrichus al medio MS adicionaron ANA y K. El desarrollo de callos friables facilita el establecimiento de cultivos de células en suspensión, ya que éstos se disgreguen fácilmente, esta aplicación se emplea para la obtención de metabolitos de importancia biotecnológica.
R. adenotrichus tiene antecedentes en los que se reportan contenidos de compuestos fenólicos y actividad antioxidante (Merzt et al., 2007 y Merzt et al., 2008). En el año 2010, Acosta y colaboradores, también encontraron estos compuestos en R. adenotrichus de Costa Rica. Nuestro grupo de trabajo (Martínez-Cruz et al., 2011), confirmó lo reportado por Acosta et al. (2010) en esta misma especie oriunda de México, en la cual el contenido de antocianinas fue 1.7 veces mayor que en la de Centroamérica. Dado el interés actual por substancias antioxidantes, que pueden prevenir los efectos nocivos de los radicales libres en el cuerpo humano y para tener un proceso controlado de producción de metabolitos secundarios con esta actividad, se justifica el cultivo in vitro para su obtención.
CONCLUSIONES
El mejor método pregerminativo para la germinación in vitro de R. adenotrichus fue remover la cubierta de la semilla. Las plantas germinadas in vitro generaron brotes y raíces con todas las características morfológicas de la planta silvestre en los medios M1y M2. Se desarrolló callo friable y abundante con pigmento morado, en los medios M3 y M4. Se estableció el cultivo in vitro de R. adenotrichus como fuente de producción de metabolitos secundarios con actividad biológica.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología por el apoyo otorgado para la realización este proyecto, becario 46791 y al doctor Francisco Gerardo Lorea Hernández, Director del Herbario del Instituto de Ecología en Xalapa Veracruz, México, por la identificación taxonómica de la planta.
LITERATURA CITADA
Acosta-Montoya, O., Vaillant, F., Cozzano, S., Mertz, C., Pérez, A.M. y Castro, M.V., 2010. "Phenolic content and antioxidant capacity of tropical Highland blackberry (Rubus adenitrichus Schltdl) during three edible maturity stages". Food Chem., 119(4): 1497-1501. [ Links ]
Ambrozic, T.B., Swartz, H.J. y Zimmerman, R.H., 1994. "Adventitious shoot regeneration from in vitro-cultured leaves of Rubus Genotypes". Plant Cell Tiss. Org. Cult., 38: 11-17. [ Links ]
Anderson, W.C., 1980. "Tissue culture propagation of red and black raspberries, Rubus idaeus and Rubus occidentalis". Acta Horticulturae, 112: 13-20. [ Links ]
Barbosa, E., Calzada, F. y Campos, R., 2007. "In vivo antigiardial activity of three flavonoids isolated of some medicinal plants used in Mexican traditional medicine for the treatment of diarrhea". J. Ethnopharmacology, 109: 552-554. [ Links ]
Borejsza-Wysocki, W., Hrazdin, G., 1994. "Establishment of callus and cell suspension cultures of raspberry (Rubus idaeus cv. Royalty)". Plant Cell Tiss. Org. Cult., 37: 213-216. [ Links ]
Castro, R.D., Gaviria. G.B., 1995. Propagación in vitro de especies del género Rubus. Universidad Católica de Oriente Fundación de Fomento Agropecuario Buen Pastor, 4-9 pp. [ Links ]
Chung, I-M, Hong, S-B, Peebles, CAM, Kim, J-A, San, K.Y., 2007. "Effect of the engineered indole pathway on accumulation of phenolic compounds in Catharanthus roseus hairy roots". Biotechnol Prog. , 23: 327-332. [ Links ]
Debnath, S.C., 2004. "Clonal propagation of dwarf raspberry (Rubus pubescens Raf.) through in vitro axillary shoot proliferation". Plant Growth Regul, 43: 179-186. [ Links ]
Debnath, S.C., 2007. "A two-step procedure for in vitro multiplication of cloudberry (Rubus chamaemorus L.) shoots using bioreactor". Plant Cell Tiss. Org. Cult., 88: 185-191. [ Links ]
El Hamdouni, E.M., Lamarti, A. y Badoc, A., 2001. In vitro germination of the achenes of strawberry (Fragaria x ananassa Duch) cvs 'chandler ' and 'tudla'. Bull. Soc. Pharm. Bordeaux, 140: 31-42. [ Links ]
Erig, A.C., De Rossi, A. y De Luces F.G.R., 2002. "6-bencilamine purine and indol butyric acid on the in vitro multiplication of blackberry (Rubus idaeus) cv. Tupy". Ciencia Rural Santa María, 32: 765-770. [ Links ]
Galletta, G.J., Ballington, J.R. y Draper, A.D., 1989. "Pregermination treatment of seeds of species and hybrids in Rubus with sodium hypochlorite". Acta Horticulturae, 262: 1-63. [ Links ]
Hollmann, P.J., Lohbrunner, G.K., Shamoun, S.F. y Lee, S.P., 2002. "Establishment and characterization of Rubus tissue culture systems for in vitro bioassays against phytotoxins from Rubus fugal pathogens". Plant cell Tiss. Org. Cult., 68: 43-48. [ Links ]
Janick, J., Moore, J.N. (eds)., 1996. Fruit Breeding. vol II, "Vine and small fruits". Brambles. Wiley. New York. p. 162. [ Links ]
Jennings, D.L., 1988. Raspberries and blackberries: their breeding, diseases and growth. Academic Press, New York, 229 pp. [ Links ]
Ke, S., Skirvin, R.M., McPheeters, K.D., Otterbacher, A.G., Galleta, G., 1985. "In vitro germination and growth of Rubus seeds and embryos". HortScience, 20: 1047-1049. [ Links ]
Kermode, A.R., 2005. "Role of abscisic acid in seed dormancy". J. Plant Growth Regul., 24: 319-344. [ Links ]
Lloyd, G., McCown, B., 1980. "Commercially feasible micropropagation of mountain laurel, Kalmia latifolia by use of shoot tip culture". Intl. Plant. Prop. Soc. Proc., 30: 421-427. [ Links ]
Martínez Camargo, M.A., Solano, A., Pacheco Maldonado, J., 2005. "Análisis de algunos factores que afectan la embriogénesis somática en tejidos juveniles de Rubus glaucus Bent." J. Colombian Association of Biological Sciences, 17: 95-107. [ Links ]
Martínez-Cruz, N.S., Arévalo-Niño, K., Verde-Star, M.J., Rivas-Morales, C., Oranday-Cárdenas, A., Núñez González, M.A., Morales-Rubio, M.E., 2011. "Antocianinas y actividad antiradicales libres de Rubus adenotrichus Schltdl (zarzamora)". Rev. Mexicana de Ciencias Farmacéuticas, 42(4): 66-71 pp. [ Links ]
Martinussen, I., Nilsen, G., Svenson, L., Junttila, O. y Rapp, K., 2004. In vitro propagation of cloudberry (Rubus chamaemorus)". Plant. Cell. Tiss. and Organ Cult., 78: 43-49. [ Links ]
McNicol, R.J. y Graham, J., 1990. In vitro regeneration of Rubus from leaf and stem segments Plant. Cell. Tiss. and Organ Cult., 21: 45-50. [ Links ]
Mertz, C., Cheynier, V., Günata, Z., Brat, P., 2007. "Analysis of phenolic compounds in two blackberry species (Rubus glaucus and Rubus adeno-trichus) by high-performance liquid chromatography with diode array detection and electrospray ion trap mass spectrometry". J. Agric. Food. Chem., 55: 8616-8624. [ Links ]
Mertz, C., Gancel, A-L, Gunata, Z., Alter, P. Dhuique-Mayer, C., Vaillant, F., Pérez, A.M., Ruales, J. y Brat, P., 2008. "Phenolic compounds carotenoids antioxidant activity of three tropical fruits". J. Food Compos Anal., 22(5): 381-387. [ Links ]
Moore, J.N., Brown G.R., Lundergran, A., 1974. "Effect of duration of acid scarification on endocarp thickness and seedling emergence of blackberries". HortScience, 9: 204-205. [ Links ]
Murashige T., Skoog F., 1962. "A revised medium for rapid growth and bioa-ssays with tobacco tissue cultures". Physiol. Plant, 15: 473-497. [ Links ]
Navarro Pérez, L.C. y Avendaño Reyes, S., 2002. "Flora útil del municipio Astacinga, Veracruz, México". Polibotánica, 14: 67-84. [ Links ]
Nybom, H., 1980. "Germination in Swedish blackberries (Rubus L. subgen Rubus)". Botanika Notisar, 133: 619-631. [ Links ]
Ourecky, D.K., 1975. Brambles. Janick J., Moore J.N. (ed). Advances in fruit breeding. Purdue University Press. West Lafayette, 98-129 pp. [ Links ]
Peacock, D.N. y Hummer, K.E., 1996. "Pre-germination studies with liquid nitrogen and sulfuric acid on several Rubus species". HortScience, 31: 238-239. [ Links ]
Solórzano, C., Linares, S., Marante, R., 2004. "Normalización y estandarización del protocolo para propagación in vitro de mora de castilla (Rubus glaucus)". Revista científica UNET, 16: 47-54. [ Links ]
Thiem, B., 2003. Rubus chamaemorus L. "A boreal plant rich in biologically active metabolites: a review". Biol Lett, 40: 3-13. [ Links ]
Tomczyk, P. y Gudej, J., 2005. "Polyphenolic Compounds From Rubus saxatilis". Chem Nat Compd, 41: 349-351. [ Links ]
Tsao, C.W.V y Reed, B.M., 2002. "Gelling agents, silver nitrate, and sequestrene iron influence adventitious shoot and callus formation from Rubus leaves". In vitro Cell. Dev. Biol. Plant, 38: 29-32. [ Links ]
Tsao, C.W.V., Postman, J.D. y Reed, B.M., 2000. "Virus infections reduce in vitro multiplication of 'Malling Landmark' raspberry". In vitro Cell. Dev. Biol. Plant, 36: 65-68. [ Links ]
Vater, G. y Arena, M.E., 2005. "In vitro propagation of Rubus geoides". New Zealand Journal of Crop andHorticultural Science, 33: 277-281. [ Links ]
Wu, J.H., Miller, S.A., Hall, H.K. y Mooney, P.A., 2009. "Factors affecting the efficiency of micropropagation from lateral buds and shoot tips of Rubus". Plant Cell Tiss Organ Cult, 99: 17-25. [ Links ]