Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Polibotánica
Print version ISSN 1405-2768
Polibotánica n.35 México Feb. 2013
Ciclo de vida de Pellaea ternifolia (Cav.) link subsp. ternifolia (Pteridaceae-Polypodiidae)*
Life cycle of Pellaea ternifolia (Cav.) link subsp. ternifolia (Pteridaceae-Polypodiidae)*
Jorge Huerta-Zavala1, María de la Luz Arreguín-Sánchez2, **, David Leonor Quiroz-García2, ** y Rafael Fernández-Nava2, **
1 Egresado ENCB-IPN.
2 Instituto Politécnico Nacional, Escuela Nacional de Ciencias Biológicas, Plan de Ayala y Carpio, Colonia Santo Tomás, México DF, 11340.
Recibido: 6 agosto 2012.
Aceptado: 8 enero 2013.
Resumen
Se describe el ciclo de vida de Pellaea ternifolia (Cav.) Link subsp. ternifolia. Los especímenes fueron recolectados en un bosque de Pinus perturbado en San Miguel de los Alcanfores, municipio de Tlaxco, Tlaxcala, México. Las esporas fueron sembradas en vasos de unicel de 262 ml con cerámica (barro molido), piedra de río, tela de mosquitero y tres soportes de cultivo (tierra, maquique y musgo), todo previamente esterilizado y cerrado con plástico y alambre de cobre. El ciclo fue isospórico con desarrollo del protalo tipo Adiantum. En la fase cordada se apreciaron gametófitos con anteridios y arquegonio en una proporción cercana al 70% y el otro 30% fueron gametófitos apogámicos. Los esporófitos jóvenes se obtuvieron a partir de los 63 días.
Palabras clave: ciclo de vida, Pellaea ternifolia subsp. ternifolia, desarrollo del gametófito, desarrollo del esporófito, apogamia.
Abstract
We describe the life cycle of Pellaea ternifolia (Cav.) Link subsp. ternifolia. Studied material was collected in a disturbed forest of Pinus in San Miguel de los Alcanfores, Tlaxco municipality, State of Tlaxcala, Mexico. Spores were sown in polyurethane vessel of 262 ml prepared in the following manner: the glasses were layered with ceramic, river stone, mosquito net and three natural substrates (plant litter, maquique and moss), all previously sterilized and enclosed in plastic bags tied with copper wire. The cycle proved to be typically isosporeus with prothallial development corresponding to the Adiantum type. The gametophytes were cordate, 70% of them produced antheridia and archegonia and the other 30% were apogamic. Young sporophytes were obtained around 63 days after sowing.
Key words: life cycle, Pellaea ternifolia subsp. ternifolia, gametophyte development, sporophyte development, apogamy.
INTRODUCCIÓN
Las licofitas y monilofitas (también conocidas como pteridofitas) son traqueofitas que presentan raíces, tallos y hojas de tipo licofilo (micrófilo) o eufilo (megáfilo), presentan ciclos de vida heterospóricos, isospóricos y tipo Equisetum que originan la fase esporofítica y gametofítica independientes entre sí en la madurez. Las esporas se desarrollan en los esporangios que por su morfología y desarrollo pueden ser euesporangios o leptoesporangios, estos últimos son los más abundantes y se caracterizan por presentar un anillo cuya posición puede variar. Smith et al. (2006) reconocen los órdenes Marattiales, Osmundales, Hymenophyllales, Gleicheniales, Schizaeales, Salviniales, Cyatheales y Polypodiales, este último con 22 familias, una de ellas las Pteridaceae. (Judd et al., 2008) considera que el género Pellaea pertenece a la familia Pteridaceae y en total existen entre 220 a 260 géneros de criptógamas vasculares y unas 7 000 especies a nivel mundial.
Mickel y Smith (2004) reconocen 1 080 taxones en la pteridoflora mexicana con representantes en las zonas templadas, zonas frías, zonas tropicales húmedas y de las zonas secas y semisecas donde se albergan algunas de las 15 especies de Pellaea. A nivel mundial estos mismos autores consideran que existen un total de 35 especies de este género. Christenhusz et al. (2011) sitúan al género Pellaea en la división Monilophyta, subclase Polypodiidae, Familia Pteridaceae y Subfamilia Cheilanthoideae.
OBJETIVOS
El propósito de este trabajo es describir las fases del ciclo de vida de Pellaea ternifolia (Cav.) Link subsp. ternifolia (Pteridaceae) como una aportación al conocimiento de la biología de este helecho y como antecedente para su posible cultivo, así como comparar el desarrollo de este ciclo en tres diferentes soportes naturales.
ANTECEDENTES
Entre los estudios de la biología reproductiva del género Pellaea sobresalen los de Pickett y Manuel (1925) quienes describieron el desarrollo del protalo de Pellaea glabella, para lo cual utilizaron el medio de Knop. Picket y Thayer (1927) trabajaron con el gametófito y la formación del esporófito de P. densa y mencionaron el tiempo de germinación de las esporas y la presencia de apogamia en esta especie. En 1964 Nayar y Bajpai estudiaron seis especies y una variedad del género Pellaea, para lo cual utilizaron el medio de agar con solución de Knop y describen la germinación de las esporas así como la presencia de apogamia en algunas de ellas. En 1968 Pray realizó una investigación de los gametófitos de Pellaea sección Pellaea serie estípite-negro, las esporas las sembró en medio de agar con solución de Bristol, posteriomente este mismo autor en 1970 describe los gametófitos de Pellaea estípite claro utilizando el mismo medio y solución que en el trabajo anterior. Tryon (1968) comparó las características de las esporas y gametófitos de diferentes especies sexuales y apogámicas del género Pellaea. Whitter (1968) indujo la apogamia en Pellaea glabella var. glabella adicionando sacarosa al medio de cultivo. Pray 1971 estudió los gametófitos de híbridos del género Pellaea utilizando el medio de Bristol. Rigby (1973) indujo la apogamia en P. glabella var. occidentale adicionando fructosa a los medios de cultivo. Díaz-Espinoza (2002) observó el ciclo de vida de Pellaea cordifolia utilizando como soporte maquique y obtuvo esporofitas a los 386 días. Herrera-Soriano et al. (2011) describieron el ciclo biológico de Pellaea ovata utilizando como soportes maquique y tierra de hoja, los esporófitos no se desarrollaron en el primer soporte mientras que en el segundo se formaron a los 390 días.
MATERIAL Y MÉTODOS
Los esporófitos (Fig. 1) de los cuales se tomaron las esporas para el seguimiento del ciclo de vida presentaron las siguientes características morfológicas: rizoma corto o compacto de 3 a 6 mm de diámetro, cubierto con escamas densas y persistentes de 5 a 6 mm de largo por 0.1 a 0.3 mm de ancho, lineal-lanceoladas, inserción basal, margen levemente eroso, base cordada, ápice agudo, bicoloras, frondes similares de 20 a 30 cm de largo con el peciolo negro lustroso, glabro al igual que el raquis, lámina de contorno lineal de 10 a 25 cm de largo, pinnada en la parte superior, ternada en la inferior, pinnas coriáceas, enteras, lanceoladas a lineal-lanceoladas de 2 a 3 cm de largo por 0.5 a 1.5 cm de ancho, sésiles con la base cordada, ápice mucronado a agudo, margen entero, haz y envés glabro, nerviación libre, esporangios protegidos por el margen reflejo continuo. Es frecuente encontrarla sobre piedras en bosques de encinos, pinos, pinos-encinos y matorrales xerófilos entre los 700 a los 3 00 m.s.n.m.
En México su distribución es: Aguascalientes, Baja California Norte, Chihuahua, Chiapas, Coahuila, Distrito Federal, Durango, Guanajuato, Hidalgo, Jalisco, México, Michoacán, Morelos, Nuevo León, Oaxaca, Puebla, Querétaro, San Luis Potosí, Sonora, Tlaxcala, Veracruz y Zacatecas. En otros países es conocida Argentina, Bolivia, Brasil, Colombia, Costa Rica, Chile, Estados Unidos de Norteamérica, Guatemala, Honduras, Nicaragua, Paraguay, Perú y Venezuela, y (Mickel y Beitel, 1988 y Mickel y Smith, 2004). El nombre común que recibe esta planta es el de helecho o el de pivora por los tarahumaras y la parte aérea se utiliza en enfermedades del hígado y para curar la tos (www.semarnat.gob.mx/pfnm/Pellaeaternifoliawrightii.html).
Los ejemplares fueron colectados en San Miguel de los Alcanfores, municipio de Tlaxco, Tlaxcala, México, el 28 de agosto del 2004, en un bosque perturbado de pino, a 2400 m.s.n.m. El ejemplar de referencia se encuentra depositado en el Herbario de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (ENCB), y el día de la colecta se tuvo especial cuidado de que los ejemplares fueran fértiles y presentaran soros maduros. Una vez recolectado el material se dejó parte de los frondes con soros fértiles en sobres de papel blanco durante 15 días en un lugar seco y oscuro. El material que se herborizó se identificó con literatura especializada en taxonomía de pteridófitas (o monilofitas) como las de (Smith, 1981, Mickel y Beitel, 1988, Mickel, 1992, y Mickel y Smith, 2004). Posteriormente se realizó la siembra de esporas en vasos de unicel de 9.5 x 5.5 cm y se elaboraron preparaciones para el seguimiento del ciclo de vida con base en la técnica de Montoya-Casimiro et al. (2000). Para la toma de fotomicrografías se eligieron las mejores preparaciones que indicaban con claridad la secuencia del ciclo, y posteriormente se tomaron con un microscopio compuesto Xiophot 1 Zeiss, con cámara digital ZVS-47DE y un microscopio estereoscópico Stemi SAV-Zeiss con cámara digital SONY DXC ISIA (640 X 480 líneas) y el programa de captura y procesamiento de imágenes KS-400 Zeiss.
RESULTADOS
En la figura 2 se muestra una síntesis del ciclo de vida completo de Pellaea ternifolia subsp. ternifolia desde la espora hasta la formación de esporófitos por la vía sexual a través de la fecundación de anteridios y arquegonios y por la asexual por medio de apogamia. En las figuras 3 (4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17) a la 18 se muestran los detalles de varias de las etapas reproductivas. En la tabla 1 se incluye el cuadro comparativo de los resultados de los tres soportes.
Esporas. Triletes de forma esférica u oval de 32 a 57 μm de largo por 39 a 49 μm de ancho, la pared o exina está formada de tres capas, la interna o intina menor de 1 μm de espesor, sexina de 2.6 a 3.3 μm, y perina de 3.3 a 5 μm de grosor con ornamentación granular de color castaño claro a oscuro (Figs. 2 y 3).
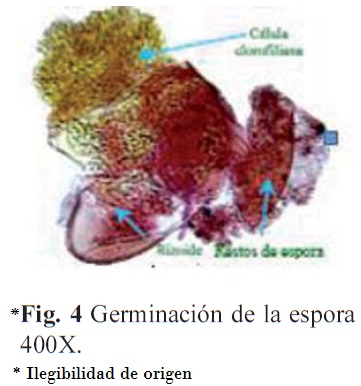
Germinación. En tierra de hoja se apreció entre los 12 a los 15 días después de la siembra, y en maquique y musgo a los 15 días, la germinación fue tipo Vittaria (Nayar y Kaur, 1971) y se observaron restos de la pared de la espora lo que muestra el desarrollo exospórico del gametófito (Figs. 2 y 4). A partir de los 15 días se formó un filamento constituido por dos a seis células y se apreció un rizoide corto.
Gametófito joven o fase espatulada. Se caracteriza por presentar una forma laminar, pero aún no formar la escotadura, es decir, apenas se inicia el desarrollo del meristemo. El desarrollo del gametófito fue de tipo Adiantum (Nayar y Kaur, 1971), y esta fase se observó a los 28 días en tierra de hoja y musgo, mientras que en maquique se presentó a los 53 días. Los protalos jóvenes en maquique y en musgo fueron muy similares, en promedio midieron 444 μm de largo × 190 μm de ancho, se formaron cuatro rizoides de aproximadamente 263 μm de largo cada uno. El gametófito joven en tierra de hoja midió 285 μm de largo × 116 μm de ancho, el número de rizoides fue hasta de cinco por gametófito, el largo de los mismos fue variable, y en promedio midieron 350 μm de largo (Figs. 2, 5 y 6).
Gametófito adulto o cordado. Esta fase se caracterizó por presentar una escotadura bien definida que es la que le confiere al protalo la forma de corazón. En tierra de hoja esta fase se presentó a los 28 días con un promedio de 1066 μm de largo × 1009 μm de ancho, la escotadura tuvo una longitud de 148 μm y presentaron 20 rizoides por gametófito que midieron en promedio 1 251 μm de largo. En maquique los gametófitos se observaron a los 63 días, y su tamaño promedio fue de 728 μm de largo × 649 μm de ancho, la escotadura tuvo una longitud promedio de 121 μm, presentaron alrededor de doce rizoides los cuales midieron en promedio 741 μm. En musgo también se apreciaron antes de los 63 días con un largo promedio de 937 μm × 817 μm de ancho, la escotadura tuvo una longitud de 139 μm y presentaron alrededor de 26 rizoides los cuales midieron en promedio 1512 μm. Se apreciaron gametófitos bisexuales que formaron gametangios y gametófitos apogámicos que no produjeron estructuras reproductoras (Figs. 2 y 7).
Arquegonios. En los tres soportes se observó la presencia de arquegonios a partir de los 63 días y a medida que iba avanzando el ciclo se fueron observando diversos estadios de maduración, los cuales se formaron de acuerdo al patrón de desarrollo de los helechos leptoesporangiados descrito por Foster y Gifford (2000). El largo promedio de los arquegonios maduros fue de 89 μm de largo × 36.5 μm de ancho en la parte más amplia con once células del cuello, cuatro del canal del cuello, una célula ventral y una ovocélula (Figs. 2, 8, 9, 10, 11 y 12).
Anteridios. La formación de estos gametangios difirió según el soporte, en tierra de hoja a partir de los 78 días, en maquique a los 154 días, en musgo a los 63 días, y al igual que los arquegonios la formación se realizó de acuerdo al patrón de desarrollo de helechos leptoesporangiados (Foster y Gifford, 2000). Los anteridios se apreciaron de forma esférica con un diámetro de entre 119 y 198 μm donde se pudieron observar anterozoides maduros e inmaduros (Figs. 2, 11 y 12).
La formación de anteridios y arquegonios se observó en aproximadamente el 70% de los gametófitos muestreados en los tres sustratos y el restante 30% formó yema apogámica.
Apogamia. Este tipo de reproducción asexual se formó a partir de un grupo de células que se localizan por debajo de la escotadura del gametófito y que se dividieron activamente para formar la yema apogámica y a partir de ella primero se comenzó a diferenciar el pedicelo del esporófito joven y la raíz, posteriormente se desarrolló la lámina de la fronde. Cuando se inició la formación de la yema apogámica se aparecieron unos cuantos tricomas alrededor de la misma, los cuales fueron aumentando tanto en tamaño como en número conforme la yema crecía y se diferenciaban los órganos del esporófito joven. Este tipo de reproducción se presentó en los tres soportes y en forma más o menos simultánea a la formación de protalos con anteridios y arquegonios. En tierra de hoja a los 44 días, en maquique y musgo se apreció la apogamia a los 63. Los gametófitos apogámicos en los tres soportes midieron en promedio 1.8 mm de largo × 1.6 mm de ancho con hasta 30 rizoides, que en promedio tenían 1.4 mm de largo, los tricomas que se encontraron en la base de la yema apogámica se apreciaron hialinos y turgentes con 65 μm en promedio de largo (Figs. 2, 13, 14 y 15).
Esporófito joven. Se presentaron en los tres soportes, en tierra de hoja a los 63 días, en maquique y musgo a los 91. En los tres casos, por cada gametófito se observó un esporófito rara vez fueron dos. Los pecíolos midieron entre 1.2 a 1.7 mm de largo, con tricomas de una a dos células, la lámina fue flabelada con un largo de 1.2 y 1.8 mm de largo por 1.3 a 2.3 mm de ancho donde se aprecian las nervaduras dicotómicas (Figs. 2, 16, 17 y 18).
DISCUSIÓN
Con respecto a la información referente a la morfología de las esporas se tiene lo siguiente: Tryon (1968) sugiere que la condición apogámica en los helechos puede ser inferida por la presencia de 32 esporas en cada esporangio así como por el tamaño de las mismas. Por lo general las esporas apogámicas son más grandes que las de origen sexual. En el caso particular de Pellaea la citada autora menciona que lo común es observar esporas triletes, aunque en las formas apogámicas es posible apreciar esporas monoletes disfuncionales. En algunos ejemplares de Pellaea ternifolia var. ternifolia el largo de las esporas oscila entre 33 a 53 μm, y en el caso de ejemplares tetraploides de esta misma especie sus esporas oscilan de 46 a 59 μm de largo, señalando que las esporas de ambos ejemplares son de origen sexual, además indicó que ciertos ejemplares provenientes de Cuernavaca, Morelos, México los especímenes recolectados son diploides con 29 cromosomas y su modo de reproducción es de tipo sexual al igual que los ejemplares provenientes de San Luis Potosí, México, que son tetraploides con un número cromosómico de 58, las cuales también se reproducen de manera sexual.
En este trabajo se contaron las esporas del ejemplar encontrando 32 por esporangio, lo que sugeriría según Tryon (op. cit.) la condición apogámica, y por las dimensiones de las mismas (32 a 57 μm de largo por 39 a 49 μm de ancho), según la autora citada se sugeriría la condición tetraploide del ejemplar con esporas sexuadas, sin embargo, lo que encontramos en este ciclo de vida fueron esporas que desarrollaron gametófitos bisexuados y apogámicos, por lo que se consideró la posibilidad de que en un mismo esporangio se encuentren esporas sexuales y apogámicas, razón por la cual se presenta la variación de medidas (32 a 57 μm de largo) y posiblemente las esporas de un tamaño son las que formen gametófitos apogámicos y las de otro tamaño constituyan prótalos con gametangios. Por los resultados de esta investigación podríamos considerar que cerca de un 70% de las esporas sexuales son n, y que posiblemente sufrieron una meiosis completa formando prótalos n. El resto de esporas fueron 2n desarrollando gametófitos 2n y por lo tanto son apogámicos.
Con respecto a los trabajos referentes a la germinación de las esporas del género Pellaea (tabla 2), Pickett y Manuel (1925) observaron que las esporas de P. glabella germinaron en 10 días en medio de Knop. Pickett y Thayer (1927) encontraron que la germinación de las esporas de P. densa se presenta entre los siete y los 14 días en el mismo medio de Knop. Nayar y Bajpai (1964) trabajaron con seis especies y una variedad del género Pellaea y apreciaron que la germinación de las esporas se presentó entre los tres a los seis días utilizando al igual que las anteriores referencias el medio de cultivo de Knop. Pray (1968) mencionó que en P. mucronata var. mucronata las esporas germinaron en los tres y los seis días utilizando como medio de cultivo el de Briston. Tryon (1968) investigó tres especies de Pellaea, entre ellas P. ternifolia observando que en todas ellas la germinación se presentó entre los seis y 15 días, sin embargo, no menciona el tipo de cultivo que utilizó. La información antes citada aporta datos de los resultados obtenidos en los medios nutritivos de Bristol y Knop, y como puede apreciarse, los tiempos de la germinación en varias especies varían entre los tres y los 14 días. Las posibles causas de estas variaciones pueden atribuirse a que cada especie tiene su propio ritmo de desarrollo.
En el estudio realizado con P. cordifolia por Díaz-Espinoza (2002) las esporas germinaron antes de los doce días en un soporte de maquique. Herrera-Soriano et al. (2011) indicaron que las esporas de P. ovata germinaron entre los 15 y 16 días en el soporte de maquique y, entre los 12 y 15 días en tierra de hoja. En los trabajos realizados por estos dos últimos autores utilizaron soportes naturales, y en ambos casos la germinación se obtuvo entre los 12 y los 16 días.
Al comparar los tiempos de germinación entre los soportes naturales y los medios nutritivos se aprecia que es más rápida en estos últimos. Posiblemente esta diferencia pueda deberse al mayor aporte de nutrientes que tienen los medios, mientras que en los soportes naturales no se tiene un aporte adicional de nutrientes. En la tabla 2 se aprecia que muy pocas especies forman esporófitos en presencia de estos medio, así que aunque la germinación es rápida, el ciclo no logra concluirse debido quizás, a lo que indica Bell (1992) en relación al exceso de nutrientes, y en especial de azúcares que ocasionan aberraciones en los ciclos de vida.
Nayar y Kaur (1971) citan que las esporas de las especies de Pellaea presentan una germinación de tipo Vittaria, lo que concuerda con los resultados obtenidos en los trabajos de Díaz-Espinoza (2002) y Herrera-Soriano et al. (2011). El resto de los trabajos que se citan en la tabla 2 no concluyen al respecto.
Los resultados del presente estudio coinciden con lo obtenido por otros autores, ya que la germinación se efectuó antes de los 15 días. También hubo correspondencia con el tipo de germinación que fue tipo Vittaria, sin embargo en los estudios donde se utilizaron medios nutritivos la germinación se realizó en menos tiempo.
En cuanto a la fase filamentosa (tabla 2) Pickett y Manuel (1925) encontraron que P. glabella presenta de dos a ocho células. Nayar y Bajpai (1964) mencionaron que en las siete especies que estudiaron la fase filamentosa se presentó entre los 10 y 13 días conformada por cuatro a ocho células. Pray (1968) estudió 15 especies de Pellaea estípite negro encontrando filamentos constituidos por tres a seis células a excepción de P. brachyptera que formó hasta ocho células y P. notabilis con dos células. En dos especies no se menciona este dato y en ninguna de las especies se indica a los cuantos días se obtuvo esta fase. Pray (1970) analizó el desarrollo de los gametófitos de tres especies de Pellaea con estípite claro y apreció que los filamentos se encuentran formados por tres a seis células, pero no indica a los cuantos días se desarrollaron. En 2002 Díaz-Espinoza mencionó que los filamentos de dos a seis células de P. cordifolia se desarrollaron a partir del día doce. Herrera-Soriano et al. (2011) encontraron filamentos de P. ovata a partir de los 46 días formados por 9 a 19 células. En esta investigación se presentaron a los 15 días con dos a seis células.
En lo referente a los gametófitos jóvenes (tabla 2) Pickett y Thayer (1927) los encontraron a los 33 días en P. densa. Nayar y Bajpai (1964) mencionaron que en las siete especies de Pellaea que estudiaron los protalos jóvenes se formaron entre los 17 y 20 días. Díaz-Espinoza (2002) mencionó que en P. cordifolia esta fase se presentó a partir del día 12 alcanzando su máximo desarrollo hacia el día 26. Herrera-Soriano et al. (2011) observaron los gametofitos con rizoides unicelulares y con numerosos y pequeños gránulos de forma esférica a todo lo largo entre los 52 a 70 días. Los resultados obtenidos en el presente trabajo concuerdan con los de otros autores, ya que la formación de los gametófitos ocurrió a los 28 días en tierra y en musgo y maquique fue hasta los 53.
En cuanto a los gametófitos cordados del género Pellaea (tabla 2) Pickett y Thayer (1927) mencionaron que en P. densa observaron gametófitos cordados, simétricos y unisexuados a los 33 días, aunque también apreciaron gametófitos cordado-espatulados. Nayar y Bajpai (1964) indicaron que en las siete especies de Pellaea que analizaron, los gametófitos cordados fueron simétricos y bisexuados, aparecen entre los 31 y 34 días. Pray (1968) observó que en las primeras etapas los gametófitos en P. breweri son cordados, bisexuados y simétricos, sin embargo, conforme maduran pierden su forma cordada y toman formas irregulares. Tryon (1968) apreció en las cuatro especies de Pellaea gametófitos cordados bisexuados. Nayar y Kaur (1971) mencionan que los gametófitos de las especies de Pellaea son cordados pudiendo presentar tricomas unicelulares glandulosos. En P. cordifolia Díaz-Espinoza (2002) encontró gametófitos cordados y simétricos a los 131 días, aunque también observó algunos protalos cordado-espatulados. Herrera-Soriano et al. (2011) refieren también en P. ovata gametófitos cordados a cordado-espatulados entre los 197 y 200 días. En el presente trabajo se encontraron gametófitos cordados bisexuados en los tres sustratos: a los 28 días en tierra de hoja, a los 63 en musgo y maquique. Por otra parte, del total de especies y variedades que se presentan en la tabla 2, solamente en cuatro de ellas se informa de la presencia de tricomas en el protalo, en P. ternifolia subsp. ternifolia no se apreciaron.
Con respecto a la formación de los gametangios (tabla 2) Pickett y Manuel (1925) observaron anteridios de Pellaea glabella desde la fase filamentosa, pero no arquegonios. En la fase de gametófitos jóvenes de P. densa formaron anteridios a los 33 días y arquegonios a los 76 (Pickett y Thayer 1927). Nayar y Bajpai (1964) observaron anteridios entre los 31 a 49 días y arquegonios a los 60 días, los cuales presentaban una célula binucleada en el canal del cuello. Pray (1968) encontró que en gametófitos cordados y simétricos de P. mucronata var. mucronata presentaron anteridios a los 29 días, en P. breweri los anteridios y arquegonios aparecen en gametófitos maduros. Con respecto a las otras especies que estudió no especifica si no observó gametangios o si omitió esta información. Tryon (1968) observó anteridios entre los 31 y 49 días y los arquegonios hasta después de la formación de anteridios, pero no menciona fechas. Díaz Espinoza (2002) encontró anteridios en gametófitos cordados de Pellaea cordifolia a los 103 días y los arquegonios a los 311. Herrera-Soriano et al. (2011) observaron anteridios y arquegonios en P. ovata a partir de los 244 días en tierra de hoja, pero en maquique no se formaron.
En el presente estudio se encontró que la formación de arquegonios en P. ternifolia subsp. ternifolia se presentó a partir de los 63 días en los tres sustratos, mientras que los anteridios se formaron en el sustrato de musgo a los 63 días, en tierra de hoja a los 78 días y en maquique a los 154 días. Los gametangios se formaron en aproximadamente el 70% de los gametófitos cordados. Estos datos difieren a los encontrados en otras especies cultivadas en soportes naturales como fue el caso de P. cordifolia estudiada por Díaz-Espinoza (2002), ya que los observó a los 103 días y los arquegonios a los 311 días. El caso de Pellaea ovata Herrera-Soriano et al. (2011) observaron la formación de anteridios y arquegonios en tierra de hoja a partir de los 244 días. En varias de las especies citadas en la tabla 2 no se indica si formaron gametangios, en otras especies como P. densa los gametófitos fueron unisexuados, en P. cordifolia bisexuados o unisexuados, sin embargo, en la gran mayoría de las especies que se incluyen en la tabla 2 fueron bisexuados.
Además de los trabajos mencionados en la tabla 2, autores como Whittier (1968) encontró que en P. glabella var. glabella se observaron dos tipos de anteridios, los de origen sexual que presentaron un diámetro de 36.2 μm y los apogámicos que tuvieron un diámetro de 48.6 μm, además, la formación de los arquegonios sufrió modificaciones por el aumento de la concentración de sacarosa tanto en gametófitos sexuales como apogámicos. Rigby (1973) observó que cuando el medio de cultivo no tenía fructuosa, en P. glabella var. occidentalis los gametófitos no desarrollaban arquegonios. En cambio, a concentraciones bajas el número de gametofitos con arquegonios era alto con aproximadamente un 75% y a concentraciones altas el número disminuía al 30%.
Con respecto a la apogamia (tabla 2) Pickett y Manuel (1925) la observaron en P. glabella a los 100 días. Pickett y Thayer (1927) la encontraron en P. densa a los 162 días. Nayar y Bajpai (1964) señalaron que en todas las especies que estudiaron (con excepción de P. doniana, P. falcata y P. rotundifolia) observaron apogamia entre los 59 a los 62 días, con producción de esporófitos. Pray (1968) encontró la apogamia en seis de las quince especies que estudió y posteriormente el mismo autor en 1970 apreció apogamia en filamentos secundarios de cinco a seis células y gametófitos secundarios cordados de P. ovata, es decir, los primeros gametófitos que se formaron a través de la germinación de la espora, por reproducción asexual produjeron otros protalos (secundarios), no encontró gametangios ni esporófitos. Tryon (1968) observó la apogamia en P. andromedifolia sin dar mayor información. Díaz-Espinoza (2002) encontró gametófitos necrosados de P. cordifolia que formaron por reproducción asexual filamentos secundarios y posteriormente gametófitos secundarios a partir de los 386 días. Herrera-Soriano et al. (2011) mencionan que P. ovata origina gametangios a partir de gametofitos secundarios, que a su vez formarán los esporófitos a partir de los 233 días en tierra de hoja.
En P. ternifolia subsp. ternifolia la fase apogámica se presentó a partir de los 44 días y el tiempo en que se apareció la apogamia fue mucho menor que en otras especies sembradas en sustratos naturales y/o medios nutritivos, también se observó que en nuestro estudio la apogamia consistió en la formación de una yema apogámica a partir de un gametófito cordado, observándose en aproximadamente el 30% del total de los gametófitos. No se apreciaron gametofitos secundarios como fue el caso de Pray (1970), Díaz-Espinoza (2002) y Herrera-Soriano et al. (2011).
Además de los trabajos referidos en la tabla 2, se encontró que Whittier (1968) realizó estudios de la formación de gametófitos apogámicos en P. glabella var. glabella variando la concentración de sacarosa y encontró que la apogamia aumenta con la concentración de este azúcar, y así en los cultivos sin sacarosa se presentó este fenómeno en el 50% de los gametófitos observados, mientras que los cultivos con sacarosa al 1% la apogamia aumentó hasta un 75%. Rigby (1973) indujo la apogamia en P. glabella var. occidentalis agregando a los medios de cultivo fructuosa infiriendo que cuando aumenta la concentración de fructosa la apogamia se ve favorecida.
En cuanto a los esporófitos jóvenes de las especies de Pellaea (Tabla 2), Pickett y Thayer (1927) observaron que en P. densa los esporófitos se formaron a los 92 días. Nayar y Bajpai (1964) describieron esporófitos jóvenes con láminas subcordadas o reniformes con tres a cuatro lóbulos, con vascularización dicotómica y tricomas en el peciolo. Pray (1968) no menciona la formación de esporófitos en ninguna de las quince especies que estudió. Tryon (1968) encontró esporófitos jóvenes de origen sexual con lóbulos simétricos, sólo en P. andromedifolia, en las otras tres especie no se formaron esporófitos. Díaz-Espinoza (2002) mencionó que en P. cordifolia se encontraron esporófitos jóvenes con lámina dividida hasta en ocho lóbulos formada por células parenquimatosas de paredes irregulares y de forma cuadrangular con venación dicotómica y frondes pedicelados a los 305 días. Herrera-Soriano et al. (2011) refieren el desarrollo de esporófitos jóvenes de P. ovata a los 390 días en el soporte de tierra de hoja.
Con respecto a la información proporcionada por otros autores (tabla 2), no se formaron esporofito en P. ternifolia subsp. ternifolia, y un rasgo sobresaliente de este trabajo es que el esporófito de esta entidad taxonómica se desarrolló a partir de los 63 días, por lo cual constituye la especie y subespecie con el menor tiempo de formación de los esporófitos dentro del género. El desarrollo de las plantas en el presente estudio fue más rápido en tierra de hoja (63 días) y en musgo y maquique la formación de esporofitos fue a los 91 días (Tabla 1).
Al comparar los datos bibliográficos (tabla 2) con el presente estudio se observa que P. ternifolia ha sido estudiada por investigadores como Tryon (1968) y Pray (1968), coincidiendo con el primero en la presencia de gametófitos bisexuados, y el segundo autor no los observa. Los trabajos anteriores no mencionan la formación de esporófitos, probablemente debido a que no se desarrollaron, y de ser así, ésta sería la primera vez que se obtienen esporófitos de esta especie en cultivo en un tiempo mucho menor a la de otras especies (63 días). Los esporófitos que se obtuvieron fueron de origen sexual (70%) y de origen apogámico (30%), estrategias reproductivas citadas por primera vez para una especie del género.
En la tabla 2 aparecen datos de especies como P. atropurpurea y P. doniana observadas por Nayar y Bajpai (1964) y P. densa estudiada por Pickett y Thayer (1927), ambos trabajos encontraron gametófitos con anteridios, arquegonios, apogamia y el desarrollo de esporófitos, sin embargo, no se hace mención si los esporófitos son de origen sexual, apogámico o de ambos.
Por último, se puede apreciar que de los 36 ejemplares estudiados (tabla 2) que comprenden 22 especies diferentes, sólo en nueve casos se formaron esporófitos, situación que es importante recalcar ya que es indicativo de que no son los medios o las condiciones físicas apropiadas para su desarrollo. En el caso particular de P. ternifolia subsp. ternifolia se puede apreciar en la tabla antes referida que Pray (1968) y Tryon (1968) estudiaron la misma especie de esta investigación y no los obtuvieron.
CONCLUSIONES
Con respecto a los estudios de otros autores con especies del género Pellaea, encontramos que los rasgos más sobresalientes de P. ternifolia subsp. ternifolia son que el esporófito se forma a partir de los 63 días, lo cual constituye la especie y subespecie que presenta la formación de esporófitos en menor tiempo con relación a las estudiadas hasta ahora del género.
El crecimiento fue mucho más rápido en tierra de hoja, sin embargo, en musgo se presentó una mayor germinación y desarrollo de los gametófitos y esporófitos jóvenes, en el caso del maquique tanto la germinación como el desarrollo y formación de los esporófitos fueron escasos.
En esta especie se formaron gametófitos bisexuales en aproximadamente el 70% de los prótalos y en los restantes no se formaron estructuras reproductoras y los esporófitos se desarrollaron por apogamia.
La formación de yemas apogámicas se presentaron en 22 especies y seis variedades o subespecies, las cuales comienzan a formarse a partir de los 59 hasta los 386 días, mientras que en P. ternifolia subsp. ternifolia esta etapa se formó a partir de los 44 días, por lo que es el taxón del género que presenta la formación de yemas en menor tiempo.
La formación de los esporófitos fue a partir de los 63 días, por lo que es posible recomendar la especie estudiada para un posible cultivo y aprovechamiento comercial, el mejor soporte para la siembra de sus esporas es la tierra de hoja.
* Proyecto apoyado por la Dirección de Estudios de Posgrado del Instituto Politécnico Nacional, clave 20110410.
**Becarios de COFAA.
LITERATURA CITADA
Bell, P.R., 1992. "Apospory and apogamy: Implications for understandingthe life cicle". Int. J. Plant Sci., 153(3): S123-S136. [ Links ]
Christenhusz, M.J.M.; X. Zhang and H. Schneider, 2011. "A linear sequence of extant families and genera of lycophytes and ferns". Phytotaxa, 19: 7-54. [ Links ]
Díaz-Espinoza, A.J., 2002. "Ciclo biológico de Diplazium lonchophyllum Kunze (Pteridophyta-Woodsiaceae) y Pellaea cordifolia (Sessé y Mociño) A. R. Smith (Pteridophyta-Pteridaceae)". Tesis profesional, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, México. 94 pp. [ Links ]
Gifford, E. and A. Foster, 2000. "Morphology and evolution of vascular plants". W.H. Freeman & Co.. New York, USA. 626 pp. [ Links ]
Herrera-Soriano, A.; M.L. Arreguín-Sánchez, S. Rojas-Velasco y L.A. Lepe-Becerra, 2011. "Biología reproductiva de Pellaea ovata (Desv.) Weath. (Pteridaceae-Pteridophyta)". Polibotánica, 31: 51-59. [ Links ]
Judd, S.W.; Campbell, S.C., Kellogg, E.A., Stevens, F.P., y Donoghue, J.M., 2008. Plant Systematics. A phyllogenetic approach. 3a. ed. Sinauer Associates, Inc. Massachusetts, USA. 185-206 p. [ Links ]
Mickel, J.T. y J.M. Beitel, 1988. "Pteridophyte flora of Oaxaca, México". Mem. N. Y. Bot. Garden, 46: 270-273, 434-437. [ Links ]
Mickel, J., 1992. "Pterydophytes". In: Flora Novo-Galiciana. The University of Michigan Herbarium Ann. Arb., 17: 319-325. [ Links ]
Mickel, J.T. and A.R. Smith, 2004. "The pteridophytes of Mexico". Mem. N. Y. Bot. Garden, 88: 443-451. [ Links ]
Montoya-Casimiro, M.C.; R. Álvarez-Varela. S. Pérez-Hernández y M.L. Arreguín-Sánchez, 2000. "Ciclos biológicos de Blechnum occidentale L. var. occidentale (Blechnaceae-Pterydophyta) y Thelypteris resinifera (Desv.) Proctor (Thelypteridaceae-Pteridophyta)". An. Esc. Nac. Cienc. Biol., 46(3): 317-339. [ Links ]
Nayar, B.K. y N. Bajpai, 1964. "Morphology of the gametophytes of some species of Pellaea and Notholaena". J. Linn. Soc. (Bot.), 59: 63-76. [ Links ]
Nayar, B.K. y S. Kaur, 1971. "Gametophytes of homosporous ferns". Bot. Rev., 37: 295-396. [ Links ]
Pickett, F.L. y M.E. Manuel, 1925. "Development of prothallium and apogamous embryo in Pellaea glabella Mettenius". Bull. Torrey Botanical Club, 54: 507-514. [ Links ]
Pickett, F.L. y L.A. Thayer, 1927. "The gametophyte development of certain ferns: Polypodium vulgare var. occidentale and Pellaea densa". Bull. Torrey Botanical Club, 54: 249-255. [ Links ]
Pray, T.R., 1968. "The gametophytes of Pellaea section Pellaea: dark-stiped series". Phytomorphology, 18: 113-143. [ Links ]
Pray, T.R., 1970. "The gametophytes of Pellaea section Pellaea: light-stiped series". Phytomorphology, 20: 137-144. [ Links ]
Pray, T.R., 1971. "The gametophytes of natural hybrids in the fern genus Pellaed". Amer. Fern J., 63: 158-163. [ Links ]
Rigby, S.J., 1973. "Introduction of apogamy in Pellaea glabella var. occidentalis". Amer. Fern J., 63: 158-163. [ Links ]
Smith, A.R., 1981. "Flora of Chiapas. Pteridophytas". Calif. Academy of Scienc., 22: 59-60. [ Links ]
Smith, A.R.; K.M. Pryer, E. Schuettpelz, P. Korall, H. Schneider and P.G. Wolf, 2006. "A classification for extant ferns". Taxon, 55(3): 705-731. [ Links ]
Tryon, A.F., 1968. "Comparisons of sexual and apogamous races in the fern genus Pellaea". Rhodora, 70: 1-24. [ Links ]
Whitter, D.P., 1968. "Rate of gametophyte maturation in sexual and apogamous forms of Pellaea glabella". Amer. Fern J., 58: 12-19. [ Links ]
www.semarnat.gob.mx/pfnm/Pellaeaterni-foliawrightii.html., consultado 30 de junio 2006.