Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.35 México feb. 2013
Descomposición foliar in situ de heliconia marginata en un humedal herbáceo (Barlovento, Venezuela)
In situ leaf decomposition of heliconia marginata in a herbaceous wetland (Barlovento, Venezuela)
Rubén Torres1, 2, Carlos Lugo2, 3, Elizabeth Gordon2, 4 y Lourdes Suárez-Villasmil2, 4
1 Laboratorio de Plancton, Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela, AP 47058, Av. Los Ilustres, San Pedro, Caracas 1041-A, Venezuela. Correo electrónico: ruben.torres@ciens.ucv.ve
2 Postgrado en Ecología, Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela, AP 47058, Av. Los Ilustres, San Pedro, Caracas 1041-A, Venezuela. Correo electrónico: profcarloselugo@gmail.com; elizabeth.gordon@ciens.ucv.ve; lourdes.suarez@ciens.ucv.ve
3 Laboratorio de Ecología Humana. Instituto Pedagógico de Caracas, Universidad Pedagógica Experimental Libertador. El Paraíso, Caracas 1020, Venezuela.
4 Laboratorio de Ecología de Plantas Acuáticas. Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela, AP 47058, Av. Los Ilustres, San Pedro, Caracas 1041-A, Venezuela.
Recibido: 19 enero 2011.
Aceptado: 8 febrero 2012.
Resumen
Los humedales herbáceos se encuentran entre los ecosistemas más productivos del planeta debido a procesos biogeoquímicos particulares originados por plantas emergentes, lo que se traduce en magnificación de la producción de biomasa viva y deposición continua de materia orgánica muerta. Se hizo un experimento de campo en un humedal herbáceo de la región de Barlovento para cuantificar el coeficiente de descomposición foliar de Heliconia marginata (Heliconiaceae) en condiciones naturales. Heliconia marginata conforma una zona de vegetación monoespecífica a lo largo del borde suroeste del humedal. Se recolectaron hojas de H. marginata, las que una vez secas se colocaron en bolsas de descomposición y se incubaron in situ durante 68 días. A diferentes intervalos de tiempo se retiraron las bolsas para determinar el peso seco libre de cenizas. Simultáneamente se midieron algunas variables fisicoquímicas (pH, conductividad, temperatura y oxígeno disuelto) y la profundidad del agua, las mismas no mostraron diferencias significativas entre los días transcurridos del experimento. La descomposición foliar de H. marginata mostró dos etapas: descomposición moderadamente rápida durante los primeros cuatro días, con un porcentaje de pérdida de 13% del peso seco libre de cenizas, y otra donde la descomposición ocurrió lentamente. El coeficiente de descomposición de H. marginata fue 0.0068 días-1, valor comparable con los de otras especies emergentes con coeficientes altos. La vida media (t50) o tiempo para la descomposición de 50% del material vegetal fue de 147 días, pero el periodo de incubación sólo comprendió lavado de material. Una fauna folívora y detritívora casi ausente hace suponer que las características estructurales de H. marginata determinan una descomposición y reciclado de materia orgánica lentos dentro del ecosistema.
Palabras clave: descomposición, procesos en el ecosistema, fraccionamiento foliar, humedal herbáceo, plantas emergentes, Heliconia marginata, Venezuela.
Abstract
Herbaceous wetlands are among the most productive ecosystems in the world; this is due to the biogeochemical processes associated with emergent plants, their high production and continuous decay of dead organic matter. We did a field experiment on an herbaceous wetland in Barlovento (Venezuela) to quantify the Heliconia-marginata (Heliconiaceae) decomposition coefficient under natural conditions, in a zone where this plant forms a monoespecific community across the southwest border of the wetland. The leaves were collected, dried, stored on decomposition bags and incubated in situ for 68 days. At specific times the bags were taken to quantify the ash-free dry weight. Also, we measured some abiotic variables (pH, conductivity, temperature, dissolved oxygen, and water depth). The abiotic variables did not change in a statistically significant way during the experiment. The leaf decomposition of H. marginata showed two stages: moderately fast decomposition during the first four days, with 13% loss of the initial ash-free dry weight, and a second stage with a lower weight loss. The decomposition rate of H. marginata was 0.0068 days-1, in agreement with figures of other emergent species with high decomposition rates. The mean time required to break down 50% of vegetal biomass (t50) was 147 day, but the incubation period only included washing of the sample. A folivorous and detritivorous fauna was almost absent; this suggests that the H. marginata low decomposition rate could be explained by the structural characteristics of the litter, which produces a slow decomposition and recycling rate of the organic matter.
Key words: decomposition, ecosystem process, leaves fractionation, herbaceous wetlands, emergent plants, Heliconia marginata, Venezuela.
INTRODUCCIÓN
Los humedales herbáceos están dominados por un número relativamente pequeño de especies de plantas emergentes (helófitas), responsables de gran parte de la producción de materia orgánica de estos ecosistemas (Bradbury y Grace, 1983; Wetzel, 1990; Cronk y Fennessy, 2001), de la cual sólo una fracción pequeña es consumida y asimilada por animales y la restante al morir entra a la cadena de detritus. Las plantas emergentes poseen concentraciones altas de polímeros estructurales (celulosa, hemicelulosa y lignina) referidos como lignocelulosa (Benner et al., 1985; Kuehn y Suberkropp, 1998, Gamage y Asaeda, 2005) que constituyen 80-90% de la biomasa (Benner et al., 1986). Estas plantas son importantes en la biogeoquímica de los humedales a través del aporte y descomposición de hojarasca (Kuehn y Suberkropp, 1998; Gamage y Asaeda, 2005), lo que contribuye a la formación de la fracción orgánica en humedales de agua dulce y hábitats litorales (Wetzel, 1990; Kuehn et al., 2000). Asimismo, en numerosas especies de plantas la abscisión no es completa, consecuentemente al iniciarse la descomposición foliar en posición aérea sin desprendimiento de la planta, grandes cantidades de material muerto en pie pueden acumularse en los pantanos de agua dulce (Kuehn y Suberkropp, 1998; Kuehn et al., 2004; Longhi et al., 2008); este material, eventualmente, al depositarse en la superficie de la interfase agua-sedimentos (Findlay et al., 1990) entra al componente detritus del ecosistema convirtiéndose en un sistema cuya dinámica se basa en la cadena de consumidores de detritus (Mitsch y Gosselink, 2007).
La descomposición vegetal es el resultado de varios procesos que actúan en forma simultánea, e incluye todos los cambios físicos y químicos (lavado, fragmentación mecánica, colonización microbiana, procesamiento por invertebrados) que ocurren después de la senescencia y muerte del tejido vegetal, empezando por moléculas orgánicas complejas y culminando en moléculas inorgánicas simples (Brinson et al., 1981, Webster y Benfield 1986, Oliver et al., 2002, Chimney y Pietro, 2006). El proceso de descomposición se realiza en tres fases que actúan al mismo tiempo, con tasas de reacción que se dan de forma rápida a lenta, en la secuencia: lavado/autolisis > rompimiento de materiales lábiles > fraccionamiento de materiales recalcitrantes (Swift et al., 1979; Godshalk y Wetzel, 1978).
Investigaciones para identificar variables que controlan y explican el mecanismo de descomposición abundan (Webster y Benfield, 1986; Kominková et al., 2000; Kuehn et al., 2004; Ruppel et al., 2004; Langhans y Tockner, 2006; Haitao et al., 2007; Romeiro y Bianchini Jr., 2008). Como proceso complejo es regulado por factores internos (características químicas y físicas de los tejidos vegetales), externos físicos y químicos (temperatura, oxígeno, pH, régimen de inundación, estatus trófico del ecosistema, etc.) y biológicos (actividad microbiológica, presencia y abundancia de invertebrados y acción de vertebrados herbívoros) (Brinson et al., 1981; Webster y Benfield, 1986; Magee, 1993, Langans y Tockner, 2006; Galizzi y Marchese, 2007), así como de la técnica empleada (Webster y Benfield, 1986; Chimney y Pietro, 2006; Menéndez, 2008; Reddy y DeLaune, 2008). No obstante, estudios de descomposición en humedales herbáceos tropicales son escasos, al menos en lo referente a descomposición in situ de plantas emergentes en ambientes dulceacuícolas, de modo que permita destacar su importancia como proceso clave en el reciclaje de nutrientes y flujo de energía, y consecuentemente en el funcionamiento y dinámica de estos ecosistemas (Howard-Williams y Davies, 1979; Davis et al., 2006; Haitao et al., 2007; Bianchini Jr. et al., 2008), así como evaluar los efectos de las actividades antropogénicas en los mismos (Webster y Benfield, 1986; Kuehn et al., 2004).
En Venezuela, las investigaciones de descomposición foliar de plantas emergentes básicamente se han realizado en condiciones de laboratorio (Rivera y Bastardo, 1991; Peña et al., 2000), por lo que la determinación del coeficiente y patrón de descomposición foliar de Heliconia marginata (Griggs) Pittier (Magnoliophyta: Heliconiaceae; platanillo) en condiciones naturales ofrece un modelo para la comprensión de la dinámica de nutrientes en humedales tropicales, donde se espera que el proceso tenga mayor relación con la naturaleza del material vegetal y el hidroperiodo que con otros factores, como la temperatura, más determinantes en humedales de latitudes medias. En este trabajo se evaluó la descomposición foliar in situ de H. marginata, que involucró la medición de variables fisicoquímicas del agua y caracterización de la comunidad de protistas e invertebrados asociados a la hojarasca en un humedal herbáceo de la región de Barlovento, estado Miranda, Venezuela.
MATERIAL Y MÉTODOS
Área de estudio
El humedal geomorfológicamente es una cubeta de decantación de 65 ha, el cual se ubica en la planicie de inundación del río Tuy, Barlovento, específicamente en la localidad El Clavo, a 10 m.s.n.m., 10° 15' 34'' N y 66° 7' 28'' O (Fig. 1). La zona posee una temperatura media anual de 24°C. La precipitación total anual es de 2 355 mm con distribución bimodal, que comprende una máxima entre julio-agosto y otra entre noviembre-diciembre; la estación seca es corta y ocurre entre febrero-marzo (Fuente: Estación Meteorológica Panaquire, Ministerio del Ambiente y Recursos Naturales, registros entre 1942 y 1999).
La zona de vida corresponde a un bosque húmedo tropical (Gordon y Feo, 2007; Suárez-Villasmil, 2010), con especies arbóreas como Attalea butyracea (Mutis ex L. f.) Wess. Boer (Arecaceae), Brownea grandiceps Jacq. (Caesalpinaceae), Lecythis ollaria Loefl. (Lecythidaceae), Genipa americana L. (Rubiaceae), Aspidosperma sp. (Apocynaceae) y Bauhinia sp. (Caesalpinaceae), entre otras, con portes de hasta 25-30 m de altura en buen estado de conservación. En general, en el área de estudio el impacto humano es bajo, puesto que la población local utiliza algunos recursos de pesca y caza de subsistencia en el área pantanosa y bosque circundante, pero no se observan actividades de repercusión mayor sobre el ecosistema como pastoreo, cultivos permanentes y actividad maderera.
En el humedal, en disposición perpendicular al gradiente de profundidad del agua, la vegetación se diferencia en tres zonas: la primera situada en el borde del humedal, que yace bajo el dosel del bosque húmedo tropical, dominada por Heliconia marginata (Heliconiaceae); la siguiente zona dominada por Hymenachne amplexicaulis (Rudge) Nees (Poaceae) y la última caracterizada por la presencia de H. amplexicaulis y Polygonum acuminatum Kunth (Polygonaceae). Otras especies de plantas presentes en el área de estudio fueron reportadas por Gordon y Feo (2007) y Suárez-Villasmil (2010). La textura de los suelos en la zona dominada por H. marginata es arcillosa (60% arcilla, 25% limo y 16% arena), con pH del suelo 6,4 (ligeramente ácido) (Suárez-Villasmil, 2010). Las condiciones ambientales del humedal cambian espacial y temporalmente en respuesta a variaciones estacionales anuales en la profundidad del agua (Gordon y Feo, 2007 y 2009; Suárez-Villasmil, 2010).
Heliconia marginata es una hierba perenne y emergente, que forma comunidades cerradas y monoespecíficas tanto en humedales ribereños como lacustrinos, cuyos individuos alcanzan hasta 5 m de altura.
Métodos
El experimento de campo se hizo con empleo del método de las bolsas de descomposición (Crossley y Hoglund, 1962), y los datos se ajustaron a un modelo exponencial negativo (Olson, 1963), que considera el efecto combinado de la descomposición abiótica (fragmentación y lavado) y biótica (Reddy y DeLaune, 2008). Para homogeneizar el tejido foliar en cuanto a su estructura y tiempo de muerte, y disminuir la acción del lavado (Ruppel et al., 2004; van Ryckegem et al., 2007; Longhi et al., 2008), se emplearon hojas verdes completamente expandidas, de áreas foliares similares e insertadas en posición terminal en las plantas muestreadas, las cuales una vez recolectadas en la zona dominada por H. marginata se trasladaron al laboratorio. Las hojas se lavaron con agua de chorro para remover sedimentos o cualquier tipo de material adherido y se descartaron el pecíolo y el raquis central de la hoja, pues tienen tasas de descomposición más lentas que las láminas foliares (Gamage y Asaeda, 2005; Reddy y DeLaune, 2008). La lámina foliar de H. marginata representa 72 ± 4% (intervalo: 67-80%) del peso seco total de la hoja.
Aun cuando el secado de las hojas a 105°C puede afectar la pérdida de peso seco y liberación de nutrientes (Poi de Neiff et al., 2006), el material se secó a dicha temperatura hasta peso constante. La masa foliar seca se cortó en piezas de 10 cm2, aproximadamente, se homogeneizó y colocó en bolsas de nylon con apertura de malla de 2 mm y tamaño de 20 cm × 25 cm. Cada bolsa contenía 20 g de material seco. En la zona de H. marginata se colocaron 15 bolsas de descomposición sobre la interfase agua-sedimentos y hojarasca, durante la transición lluvia-sequía, entre el 26 de enero y 4 de abril de 2008, para un lapso total de incubación de las muestras de 68 días. La época escogida para el estudio permitió observar la evolución del proceso de descomposición foliar a lo largo de un gradiente temporal de disminución de la lámina de agua, desde un periodo de inundación por lluvias hasta la desaparición absoluta de la lámina por la sequía.
En un área de 5 m × 5 m se establecieron aleatoriamente tres parcelas de 1 m2, donde previamente se contaron los individuos de H. marginata y se estimó el porcentaje de cobertura total de plantas y de la hojarasca en el suelo. En cada parcela se ubicaron cinco bolsas con recolección de tres bolsas por día de muestreo, una por parcela a los 4, 12, 19, 34 y 68 días, para determinar los cambios en la pérdida de peso seco. Las bolsas se trasladaron refrigeradas al laboratorio y posteriormente fueron lavadas con agua de chorro para eliminar los restos de detritus sobre el material vegetal. Luego, las bolsas se colocaron en estufa a 105°C hasta peso constante. Posteriormente se determinó el peso seco libre de cenizas, para ello se escogió 1 g de cada muestra que se incineró en una mufla a 500°C durante dos horas.
En forma simultánea al desarrollo del experimento en campo se midieron la profundidad del agua con una vara graduada y las variables fisicoquímicas: pH, oxígeno disuelto, conductividad eléctrica y temperatura del agua con un equipo digital YSI Mod. 85. Para hacer estas determinaciones, el electrodo se colocó bajo la superficie de la lámina de agua, en los mismos sitios donde se colocaron las bolsas.
En sitios adyacentes a los puntos de ubicación de las bolsas de descomposición, se levantaron tres parcelas de 20 cm x 20 cm, donde se removió toda la hojarasca presente; una vez embolsada, se agregó solución de formalina al 10% v/v para fijar la biota animal. En laboratorio, las muestras se lavaron con agua filtrada sobre malla de plancton (ø poro = 27 μm), siendo posteriormente concentradas en envases pequeños y nuevamente fijadas con formalina. Las observaciones de los organismos (protistas e invertebrados) presentes en la hojarasca se hicieron en una cámara Bogorov bajo microscopio estereoscópico y se empleó la bibliografía disponible para su identificación taxonómica (Deflandre, 1959; Elster y Ohle, 1978; Infante, 1980; Dussart, 1984; Reid, 1985; Zoppi de Roa et al., 1985; Zoppi de Roa y Vásquez, 1991; Zoppi de Roa, 1993).
Finalmente, en aguas libres contiguas a los sitios de incubación de las bolsas en la zona de H. marginata se tomaron tres muestras de zooplancton con una botella LaMotte de 1 L, las cuales se preservaron in situ con solución de formalina al 10% v/v. Estas muestras completaron el espectro de estudio de la fauna de invertebrados y protistas asociados a la hojarasca y partes anegadas, y se procesaron de manera homóloga al procedimiento ya referido para el estudio de la fauna asociada a la hojarasca.
Análisis de datos
Los análisis estadísticos se hicieron con empleo del programa Statistica para Windows ver. 8.0 (Statsoft, 2008). Para evaluar diferencias en las variables fisicoquímicas (pH, profundidad de la lámina, oxígeno disuelto y conductividad), se utilizó un ANOVA no paramétrico (α = 0.05) de Kruskall-Wallis (Siegel y Castellan, 2001).
El coeficiente de descomposición (k) se estimó ajustando los datos de pérdida de peso seco libre de cenizas del material vegetal a un modelo exponencial negativo (Olson 1963), a través de la ecuación:
Wt = W0e-kt
Donde: Wt = peso seco (g) de la muestra de hojarasca en el tiempo (t); W0 = peso seco inicial (g) del material vegetal; e = base del logaritmo natural; t = tiempo (días); k = coeficiente de descomposición o de pérdida de peso seco (1/tiempo) debido al efecto combinado de la descomposición abiótica (fragmentación y lavado) y biótica (Reddy y DeLaune, 2008). El cálculo del t50 (tiempo estimado para la descomposición del 50% del material vegetal) se hizo a partir de la expresión t50 = Loge (2)/k (Chimney y Pietro, 2006).
RESULTADOS
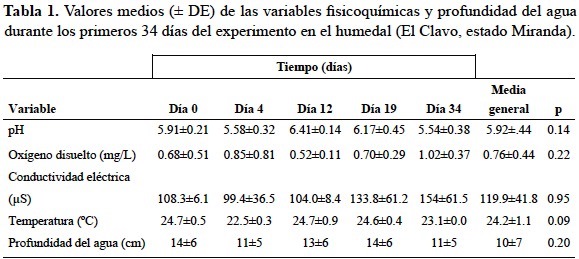
En general, de acuerdo a la prueba de Kruskal-Wallis las variables fisicoquímicas y profundidad del agua no presentaron diferencias significativas (p > 0.05) entre los días transcurridos del experimento (tabla 1). La profundidad del agua fue cediendo conforme avanzó la estación seca, la cual durante los primeros 40 días varió entre 11 y 14 cm, mientras que a los 68 días de finalizar el estudio la lámina de agua estuvo ausente, lo que se corresponde con el periodo de sequía de la localidad. Sin embargo, el suelo permaneció saturado, como también lo observaron Gordon y Feo (2007) y Suárez-Villasmil (2010). El pH del agua varió entre 5.54 y 6.41, resultando un sistema ligeramente ácido. La conductividad del agua tuvo valores entre 99 y 154 μS, con tendencia al aumento durante los días transcurridos de descomposición. La temperatura del agua cambió entre 22 y 25°C. La concentración de oxígeno en el agua varió entre 0.52 y 1.02 mg/L.
En la zona dominada por H. marginata, las plantas alcanzaron una altura media de 3 m, cobertura de 50% y densidad poblacional conformada por seis a nueve individuos o tallos/m2, estos dos últimos valores estuvieron dados por los espacios amplios que existen entre los tallos, producto de las grandes hojas expandidas y dispuestas en rosetas terminales. En dicha zona la cobertura de la hojarasca en el suelo estuvo comprendida entre 80 y 100%, gran parte de ella posiblemente proviene del arrastre de las aguas de escorrentías del bosque adyacente a la cubeta durante la temporada lluviosa.
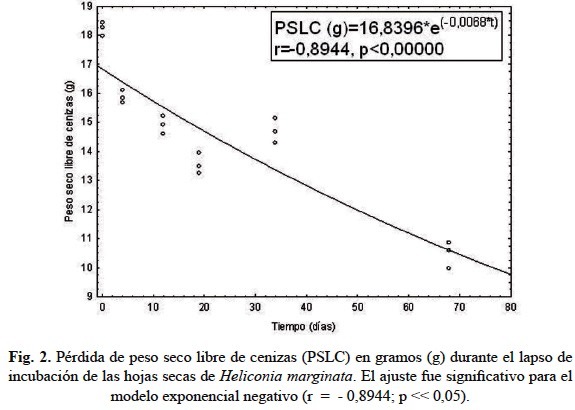
La relación entre el peso seco libre de cenizas (PSLC) y el tiempo (t) de acuerdo al modelo exponencial negativo (Olson, 1963) produjo la siguiente expresión matemática (relación exponencial negativa) para dichas variables: PSLC = 16,8396 x e (-0,0068 t), con un buen ajuste (r = - 0.8944) y diferencias significativas entre los periodos de muestreo (p < 0.05). Con base en este modelo, el coeficiente de descomposición (k) tuvo un valor de 0.0068 días-1 y el tiempo estimado para la descomposición del 50% del material vegetal, t50, fue de 147 días, tiempo que excede por más del doble al periodo total de incubación. La dinámica del proceso durante los primeros cuatro días indica que el porcentaje de pérdida de peso seco libre de cenizas (PPPSLC) fue de 13% (PPSRLC-porcentaje peso seco remanente libre de cenizas 87%) con una tasa diaria de pérdida de 3.22%/día transcurrido. Para los días 12, 19 y 34 el suelo estuvo inundado (tabla 1), en dicha etapa los PPPSLC fueron en orden correspondiente 18, 26 y 19% (PPSRLC: 82, 74, 81%), con tasas de pérdida de 1.51, 1.35 y 0.57%/día transcurrido, respectivamente. El día 68, cuando la lámina de agua estuvo ausente, el PPPSLC fue de 43% (PPSRLC: 57%), con una tasa diaria de pérdida de 0.63%/día transcurrido. La figura 2 muestra la dinámica de descomposición foliar durante los 68 días de incubación.
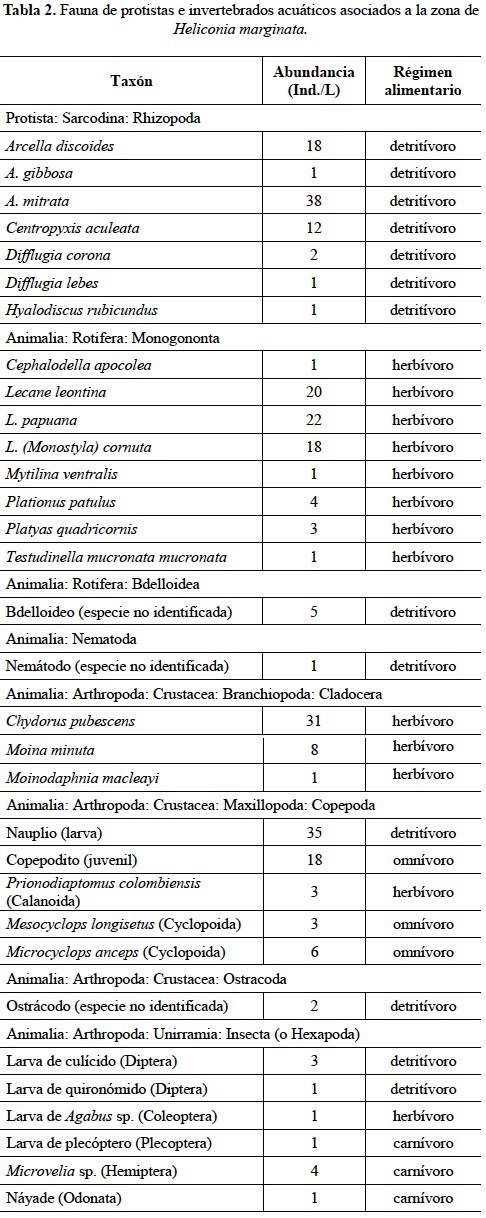
En la zona de estudio hubo gran cantidad de hojarasca esparcida, 80-100% de cobertura sobre el suelo, que en principio provee un hábitat ideal para el establecimiento de fauna folívora y detritívora, así como refugio de depredadores. No obstante, la presencia de estos organismos resultó escasa; sólo se observaron unos pocos rizópodos (Protista: Sarcodina) pertenecientes a las especies Arcella discoides (25 Ind./m2) y Difflugia tuberculata (50 Ind./m2).
La tabla 2 muestra la totalidad de taxa identificados en agua libre, la mayoría hasta la categoría de especie, así como sus regímenes alimentarios, destacando una fauna zooplanctónica más numerosa y diversa que la encontrada en la hojarasca. La composición de individuos por litro (Ind./L) estuvo conformada por 43% de rizópodos con siete especies (destacó A. mitrata con 38 Ind./L); 26% de copépodos (Crustacea: Maxillopoda), la mayoría en fases inmaduras (nauplios, 35 Ind./L, y copepoditos) y tres especies (un calanoide y dos ciclopoides); 20% de rotíferos, con ocho especies; 10% de cladóceros (Crustacea: Branchiopoda), tres especies (destacó Chydorus pubescens con 31 Ind./L). Como grupos menores (<1% de abundancia total) están los insectos [meroplancton: larvas de dípteros, coleópteros y plecópteros; perifiton: náyade de odonato; micronecton: Microvelia sp. (Hemiptera)], ostrácodos (Crustacea: Ostracoda) y nemátodos. La mayor parte de los organismos mencionados consumen materia vegetal verde, fitoplancton y/o detritus; los ciclopoides adultos son omnívoros y también pueden asimilar detritus.
DISCUSIÓN
La trayectoria de descomposición foliar de Heliconia marginata siguió la tendencia encontrada por varios autores para distintas especies de plantas y en diferentes ambientes (Magee, 1993; Poi de Neiff et al., 2006; Menéndez, 2008; Chimney y Pietro, 2006), donde al inicio hay una fase ligeramente rápida de pérdida de peso seco, que luego se hace más lenta a medida que el tiempo transcurre. Esto se explica porque el tejido vegetal está compuesto de fracciones lábiles y recalcitrantes cuyas tasas de descomposición son variables. La rapidez al principio es atribuida al lavado de compuestos orgánicos y rompimiento de fracciones lábiles, mientras que la degradación de fracciones recalcitrantes ocurre sobre largos periodos de tiempo (Godshalk y Wetzel, 1978; Poi de Neiff y Bruquetas de Zoraya, 1991; Peña et al., 2000; Ribeiro et al., 2004; Chimney y Pietro, 2006; Haitao et al., 2007).
Las características fisicoquímicas del agua medidas in situ en la zona de estudio casi no variaron durante los primeros 34 días, lo que permitió suponer que poco o nada influyeron en el proceso de descomposición. En ese lapso la concentración de oxígeno resultó baja, lo que pudo limitar el crecimiento de la biomasa microbiana (bacterias aerobias) y originar una disminución de la dinámica de descomposición foliar en el tiempo. A partir del día 34, la lámina de agua estuvo ausente, el ambiente consecuentemente más oxigenado y por ende debió aumentar la pérdida de peso seco. De este modo, durante los primeros 34 días cuando el suelo estuvo inundado, el porcentaje de pérdida de peso seco libre de cenizas fue de 19%, mientras que en los 34 días restantes con ausencia de lámina de agua la pérdida de peso seco libre de cenizas fue de 29%. Langhans y Tockner (2006) indicaron que la sequía y la humedad definen la naturaleza física del ambiente donde ocurre la descomposición, altera la calidad del material vegetal y cambia las condiciones de nutrientes. La descomposición puede ser retrasada por condiciones anóxicas o deposición de sedimentos, o aumentada por factores físicos (lavado o fragmentación por acción del agua o alternancia de los ciclos sequía/humedad) y procesos biológicos (actividad microbiológica o consumo por invertebrados). No obstante, existen inconsistencias respecto al efecto del régimen hidrológico, puesto que puede haber tasas de descomposición altas, bien sea en ambientes con régimen hidrológico fluctuante (intermitente o temporal) o permanentemente inundado (Langhans y Tockner, 2006).
En la zona dominada por H. marginata se encontró gran cantidad de hojarasca que proporciona un hábitat ideal para la fauna folívora y detritívora, pero prácticamente no se encontró evidencia de la misma, y sobre todo resultó extraño no hallar densidades elevadas de organismos detritívoros comunes y muy asociados a este tipo de ambientes, como los rizópodos (Dussart, 1966). La ausencia de organismos animales en la hojarasca, como insectos folívoros, puede deberse a que el material vegetal no es laxo, las hojas son resistentes, lo que no favoreció la producción de material particulado, que constituye la base alimentaria de rizópodos y otros microorganismos que se nutren del detritus.
Lo anterior apoya la idea de que el material foliar de H. marginata es coriáceo, debido a sus características estructurales que ofrecen una fuente poco palatable o aprovechable para los gremios consumidores. Según diferentes autores citados por Chimney y Pietro (2006), una incipiente actividad de fragmentación mecánica de las hojas va en detrimento de la actividad a posteriori de los microorganismos descomponedores (bacterias y hongos). Webster y Benfield (1986) mencionan que los mayores flujos de energía en todos los ecosistemas ocurren en las cadenas de detritívoros, por ende, la poca actividad de la comunidad de animales y protozoarios que fragmentan la materia foliar deben suponer una descomposición orgánica pobre o muy lenta.
En el zooplancton tampoco se encontraron especies detritívoras que faciliten el proceso de fragmentación de la materia orgánica particulada en el sedimento, pues las especies halladas se nutren de material fino encontrado en suspensión. Los ostrácodos y bdelloideos observados principalmente son organismos del bentos y sedimentos, y también son miembros incidentales del zooplancton (tychoplancton), por lo que estos animales pudiesen explotar la materia particulada del fondo, pero dada su escasez, los aportes de sus actividades detritívoras quizá no fueron relevantes.
Cotejar el coeficiente de descomposición de H. marginata con distintas especies de plantas emergentes de otros lugares, incluyendo la zona tropical, es difícil debido a que crecen en una amplia variedad de ambientes (orillas de ríos, lagunas, esteros) con diferentes condiciones fisicoquímicas que inciden en el proceso de descomposición. Asimismo, el patrón y tasa de descomposición varían entre especies y tejidos de una misma especie (Brinson et al., 1981; Álvarez, 2005; Mitsch y Gosselink, 2007; Reddy y DeLaune, 2008). A lo anterior se suma el efecto de la técnica empleada (método de las bolsas de descomposición) señalada entre otros por Webster y Benfield (1986) y Reddy y DeLaune (2008). Chimney y Pietro (2006) consideran que cualquier análisis de los coeficientes de descomposición mostrada en la literatura es complicada, debido a la dificultad en distinguir la varianza asociada con la metodología de la relacionada con factores ambientales y fisiológicos de las plantas.
Chimney y Pietro (2006) recopilaron datos de coeficientes de descomposición de tejido aéreo de 467 especies de plantas herbáceas de humedales de agua dulce, las cuales se diferenciaron por la forma de vida y eran provenientes de estudios de campo y laboratorio conducidos en hábitats localizados desde el trópico hasta el ártico. Estos autores hallaron que las especies emergentes tenían una media de coeficiente de descomposición (0.0083 días-1) menor que las especies flotantes (0.0473 días-1) y sumergidas (0.0382 días-1), esto atribuido a que las primeras contienen mayor porcentaje de celulosa, hemicelulosa y lignina.
Al comparar el coeficiente de descomposición de H. marginata (0.0068 días1) con los coeficientes de otras especies emergentes (tabla 3) y los reportados por Chimney y Pietro (2006), el mismo se ubica en valores comparativamente superiores a los de otras especies tropicales y templadas, a pesar del corto periodo de incubación de las muestras. Longhi et al. (2008) señalaron que la duración del tiempo de incubación de las bolsas es un parámetro clave en la estimación del coeficiente de descomposición. Entre más corto es el periodo de incubación in situ de las bolsas, más alto resulta el riesgo de sobreestimar el valor de k, probablemente como consecuencia del lavado del material vegetal, el cual es un proceso que está limitado a la primera fase de la descomposición (<100 días), y que es independiente de la actividad microbiológica y temperatura.
Esto produce una pérdida rápida de peso seco y liberación de nutrientes al agua y/o sedimentos, de modo que la masa remanente formada por compuestos refractarios tiene descomposición lenta (Longhi et al., 2008).
Usualmente en los experimentos de descomposición es común emplear hojas senescentes y secas (Chimney y Pietro, 2006), en otros se emplean hojas verdes (Ruppel et al., 2004; Chimney y Pietro, 2006; Longhi etal., 2008) (tabla 3). Las hojas senescentes pierden peso seco más rápido que el material verde durante los primeros días a semanas de exposición (Brock et al., 1982); contrariamente, Nelson et al. (1990) hallaron que las hojas verdes se descomponen más rápidamente que las senescentes, esto debido a que contienen más componentes fácilmente degradables. Brock et al. (1982) señalaron que más allá de que el material sea fresco o seco, lo más importante es el tiempo de incubación de las muestras.
De acuerdo al coeficiente de descomposición obtenido para H. marginata, el tiempo requerido para la descomposición del 50% del peso seco foliar de esta especie (147 días) fue superior al reportado por Chimney y Pietro (2006) para especies emergentes (84 días), pero comparable al reportado para especies emergentes investigadas in situ en humedales herbáceos (tabla 3).
Los resultados obtenidos permiten sugerir que bajo las condiciones ambientales imperantes en la zona de estudio, la descomposición puede ser explicada por factores internos relacionados con las características intrínsecas del material vegetal, que incluyen estado fenológico de las plantas, grado de desecación de los tejidos, tamaño de las partículas y contenido de fibras y compuestos hidrosolubles del tejido vegetal (Romeiro y Bianchini Jr., 2008). También hay que considerar el efecto integrador del tiempo, que implica cambios en la tasa de descomposición debido a modificaciones en la calidad del material, por lo que el efecto endógeno puede influir más sobre la descomposición que el exógeno (Ribeiro et al., 2004).
En resumen, el coeficiente de descomposición de H. marginata comparativamente puede considerarse alto. El hidroperiodo prolongado trajo como consecuencia lentitud en el proceso de descomposición foliar dentro de la zona anegada, debido a que imperaron condiciones de anoxia. El tiempo de incubación resultó insuficiente para detectar el proceso de descomposición foliar en forma integral, el mismo sólo comprendió la fase inicial de lavado. Por otra parte, la carencia de organismos folívoros y detritívoros hace suponer que las características estructurales de la hoja determinan procesos lentos e ineficientes de descomposición y reciclado de materia orgánica, precisamente debido a una actividad de fragmentación de material incipiente. Tal situación permite explicar la presencia de suelos ubicados en la categoría de mineral-orgánico (transición entre un suelo orgánico y uno mineral) debido a la acumulación de material poco fragmentado (Mitsch y Gosselink, 2007), ya que los mismos tienen 19±5% de materia orgánica (9.5 ± 2.5% CO) y textura arcillosa (Suárez-Villasmil, 2010).
CONCLUSIONES
Las variables fisicoquímicas, el régimen hidrológico, fauna folívora ausente y detritívora escasa señalan condiciones ambientales no idóneas para una actividad microbiana eficiente en el proceso de descomposición foliar.
El coeficiente de descomposición foliar de Heliconia marginata se ubica en valores altos, atribuibles a que el periodo de incubación sólo comprendió el lavado de material. La dureza de la lámina foliar resultó un factor determinante en el proceso de descomposición orgánica.
AGRADECIMIENTOS
A Yeni Barrios y Adriana Moreno, estudiantes de la asignatura Ecología de Humedales del Posgrado en Ecología de la Facultad de Ciencias, por su participación en el trabajo de campo y de laboratorio, que permitió la elaboración de este manuscrito. Al Laboratorio de Ecología de Plantas Acuáticas por proporcionar los equipos y logística para la realización del trabajo de campo y de laboratorio. A Manuel Machado por su asistencia como guía de la zona de estudio.
LITERATURA CITADA
Álvarez, S., 2005. "La descomposición de materia orgánica en humedales: la importancia del componente microbiano". Ecosistemas, 14: 17-29. [ Links ]
Benner, R.; M.A. Moran y R.E. Hodson, 1985. "Effects of pH and plant source on lignocellulosic biodegration rates in two wetland ecosystems, the Okefenokee Swamp and Georgia salt marsh". Limnol. Oceanogr., 30: 486-499. [ Links ]
Benner, R.; A.E. Maccubbin y R.E. Hodson, 1986. "Temporal relationship between the deposition and microbial degradation of lignocellulosic detritus in a Georgia salt marsh and the Okefenokee Swamp". Microb. Ecol., 12: 291-298. [ Links ]
Bianchini, Jr., I.; M.B.Cunha-Santino y A.M. Peret, 2008. "Oxygen demand during mineralization of aquatic macrophytes from an oxbow lake". Brazilian Journal of Biology, 68(1): 61-67. [ Links ]
Bradbury, I.K. y J. Grace, 1983. "Primary production in wetlands". En: Gore, A.J.P. (ed.). Ecosystems of the World. 4A. Mires, Swamp, Bog, Fen and Moor. Elsevier, Amsterdam. 285-310. [ Links ]
Brinson, M.M.; A.E. Lugo y S. Brown, 1981. "Primary productivity, decomposition and consumer activity in freshwater wetlands". Annual Review of Ecology and Systematics, 12: 123-161. [ Links ]
Brock, C.M.; C.A.M. Huijbregts, M.J.H.A. Van de Steeg-Huberts y M.A. Vlassak, 1982. "In situ studies on the breakdown of Nymphoides peltata (Gmel.) O. Kuntze (Menyanthaceae); some methodological aspects of the litter bag technique". Aquatic Ecology, 1: 35-49. [ Links ]
Chimney, M.J. y K.C. Pietro, 2006. "Decomposition of macrophyte litter in a subtropical constructed wetland in south Florida (USA)". Ecological Engineering, 27: 301-321. [ Links ]
Cronk, J.K. y M.S. Fennessy, 2001. Wetland Plants: Biology and Ecology. CRC Press/Lewis Publishers. Boca Raton, FL. 440 pp. [ Links ]
Crossley, D.A. Jr. y M.P. Hoglund, 1962. "A litter-bag method for the study of microarthropods inhabiting leaf litter". Ecology, 43: 571-574. [ Links ]
Davis, C.B. y A.G. van der Valk, 1978. "Litter decomposition in prairie glacial marshes". En: Good, R.E.; D.F. Whigham y R.L. Simpson (eds.). Freshwater Wetlands: Ecological Processes and Management Potential. New York, New York, USA: Academic Press. 99-113. [ Links ]
Davis, S.E.; D.L. Childers y B.N. Gregory, 2006. "The contribution of leaching to the rapid release of nutrients and carbon in the early decay of wetland vegetation". Hydrobiologia, 569: 87-97. [ Links ]
Deflandre, G., 1959. "Rhizopoda and Actinopoda". En: Edmondson, W.T. (ed.). Fresh-Water Biology. Second Edition. John Wiley & Sons, New York. 1248 pp. [ Links ]
Dussart, B.H., 1966. Limnologie: l'étude des eaux continentales. Gauthier-Villars, Paris. 677 pp. [ Links ]
----------, 1984. "Some Crustacea Copepoda from Venezuela". Hydrobiologia, 113: 25-67. [ Links ]
Elster, H.J. y W. Ohle, 1978. Rotatoria: Die Radertiere Mitteleuropas. Gebrüder Borntraeger, Berlin Stuttgart. 234 pp. [ Links ]
Findlay, S.; K. Howe y H.K. Austin, 1990. "Comparison of detritus dynamics in two tidal freshwater wetlands". Ecology, 71: 288-295. [ Links ]
Galizzi, M.C. y M. Marchese, 2007. "Descomposición de hojas de Tessaria integrifolia (Asteraceae) y colonización por invertebrados en un cauce secundario del río Paraná Medio". Interciencia, 43: 535-540. [ Links ]
Gamage, N.P.D. y T. Asaeda, 2005. "Decomposition and mineralization of Eichhornia crassipes litter under aerobic conditions with and without bacteria". Hydrobiologia, 541: 13-27. [ Links ]
Godshalk, G.L. y R.G. Wetzel. 1978. "Decomposition of aquatic angiosperms. III. Zostera marina L. and a conceptual model of decomposition". Aquatic Botany, 5: 329-354. [ Links ]
Gordon, E. y Y. Feo, 2007. "Dinámica de crecimiento de Hymenachne amplexicaulis en un humedal herbáceo en el estado Miranda (Venezuela)". Acta Botánica Venezuélica, 30: 1-18. [ Links ]
----------, 2009. "Dinámica del nitrógeno en un humedal herbáceo (estado Miranda, Venezuela) dominado por Hymenachne amplexicaulis". Acta Botánica Venezuélica, 32: 311-331. [ Links ]
Haitao, W.; L. Xianguo, Y. Qing, J. Ming y T. Shouzheng, 2007. "Early-stage litter decomposition and its influencing factors in the wetland of the Sanjiang Plain, China". Acta Ecológica Sinica, 27: 3-28. [ Links ]
Howard-Williams, C. y B.R. Davies, 1979. "The rates of dry matter and nutrient loss from decomposing Potamogeton pectinatus in a brackish south-temperate coastal lake". Freshwater Biology, 9: 13-21. [ Links ]
Infante, A. 1980. "Los cladóceros del Lago de Valencia". Act. Cient. Venezolana, 31: 593-603. [ Links ]
Kominková, D.; K.A. Kuehn, N. Büsing, D. Steiner y M.O. Gessner, 2000. "Microbial biomass, growth, and respiration associated with submersed litter of Phragmites australis decomposing in a littoral reed stand of a large lake". Aquatic Microbial Ecology, 22: 271-282. [ Links ]
Kuehn, K.A. y K. Suberkropp, 1998. "Decomposition of standing litter of the freshwater emergent macrophyte Juncus effusus". Freshwater Biology, 40: 717-727. [ Links ]
Kuehn, K.A.; M.J. Lemke, K. Suberkropp y R.G. Wetzel, 2000. "Microbial biomass and production associated with decaying leaf litter of the emergent macrophyte Juncus effusus". Limnological Oceanographic, 45: 862-870. [ Links ]
Kuehn, K.A.; D. Steiner y M.O. Gessner, 2004. "Diel mineralization patterns of standing-dead litter implications for CO2 flux from wetlands". Ecology, 85: 2504-2518. [ Links ]
Langhans, S.D. y K. Tockner, 2006. "The role of timing, duration, and frequency of inundation in controlling leaf litter decomposition in a river-floodplain ecosystem (Tabliamento, northeastern Italy)". Oecologia, 147: 501-509. [ Links ]
Longhi, D.; M. Bartoli y P. Viaroli, 2008. "Decomposition of four macrophytes in wetland sediments: Organic matter and nutrient decay and associated benthic processes". Aquatic Botany, 89: 303-310. [ Links ]
Magee, P.A., 1993. "Detrital accumulation and processing in wetlands". USFWS Fish and Wildlife Leaflet, 13.3.14: 1-6. [ Links ]
Menéndez, M., 2008. "Leaf growth, senescence and decomposition of Juncus maritimus Lam. in a coastal Mediterranean marsh". Aquatic Botany, 89: 365-371. [ Links ]
Mitsch, W.J. y J.G. Gosselink, 2007. Wetlands. 4th ed., John Wiley & Sons, Inc., New York. 582 pp. [ Links ]
Nelson, J.W.; J.A. Kadlec y H.R. Murkin, 1990. "Seasonal comparisons of weight loss for two types of Typha glauca Godr. leaf litter". Aquatic Botany, 37: 299-314. [ Links ]
Oliver, L., M.E. Pérez-Corona y F. Bermúdez de Castro, 2002. "Degradación de la hojarasca en un pastizal oligotrófico mediterráneo del centro de la Península Ibérica". Anales de Biología, 24: 21-32. [ Links ]
Olson, J.S., 1963. "Energy storage and the balance of producers and decomposers in ecological systems". Ecology, 44: 322-331. [ Links ]
Peña, C.; E. Gordon. y A. Ramírez, 2000. "Descomposición de Montrichardia arborescens (L.) Schott (Araceae)". En: Péfaur, J.E. (ed.). Ecología Latinoamericana. Memorias III Congreso Latinoamericano de Ecología, Mérida. 153-161. [ Links ]
Poi de Neiff, A. y Y. Bruquetas de Zoraya, 1991. "Colonización por invertebrados de macrófitos emergentes durante su descomposición en el río Paraná". Revista de Hidrobiología Tropical, 24: 209-216. [ Links ]
Poi de Neiff, A., J.J. Neiff y S.L. Casco, 2006. "Leaf litter decomposition in three wetland types of the Parana River floodplain". Wetlands, 26: 558-566. [ Links ]
Reid, J.W., 1985. "Chave de identificacao e lista de referencias bibliográficas para as espécies continentais sulamericanas de vida livre da ordem Cyclopoida (Crustacea, Copepoda)". Boletim de Zoologia, Universidade de Sao Paulo, 9: 17-143. [ Links ]
Reddy, K.R. y R. DeLaune, 2008. Bio-geochemistry of Wetlands. CRC Press, New York. 774 pp. [ Links ]
Rejmánková, E. y D. Sirová, 2007. "Wetland macrophyte decomposition under different nutrient conditions: Relationships between decomposition rate, enzyme activities and microbial biomass". Soil Biology and Biogeochemistry, 39: 526-238. [ Links ]
Ribeiro, O.M.D.; M.A. Cobelas, P. Riolobos y S. Cirujano, 2004. "Descomposición de helófitos en un humedal semiárido hipertrófico". Anales del Jardín Botánico de Madrid, 61: 53-61. [ Links ]
Rivera, C. J. y H. Bastardo, 1991. "Desaparición de componentes lignocelulósicos en gramíneas tropicales". Acta Biol. Venez., 13: 65-74. [ Links ]
Romeiro, F. e I. Bianchini Jr., 2008. "Kinetic pathways for the anaerobic decomposition of Ludwigia inclinata". Hydrobiologia, 607: 103-111. [ Links ]
Ruppel, R., K.E. Setty y M. Wu, 2004. "Decomposition rates of Typha spp. in a Northern Freshwater Wetlands over a stream-marsh peatland gradient". Discip. Sci., 1: 26-37. [ Links ]
Siegel, S. y N.J. Castellan, 2001. Estadística no paramétrica. 4a. ed., Editorial Trillas, México. 437 pp. [ Links ]
StatSoft, Inc., 2008. STATISTICA (data analysis software system), versión 8.0. www.statsoft.com. [ Links ]
Suárez-Villasmil, L., 2010. "Dinámica de la vegetación herbácea en un humedal dulceacuícola del estado Miranda". Trabajo de Ascenso a la categoría de Profesor Asistente. Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela. Caracas. 70 pp. [ Links ]
Swift, M.J., O.W. Heal y J.M. Anderson, 1979. "The influence of resource quality on decomposition processes". En: Anderson, D.J., P. Greig-Smith y F.A. Pitelka (eds.). Studies in Ecology. vol. 5, Decomposition in Terrestrial Ecosystems. University of California Press, Berkeley. [ Links ]
Van Ryckegem, G., M. Gessner y A. Verbeken, 2007. "Fungi on leaf blades of Phragmites australis in a brackish tidal marsh: diversity, succession, and leaf decomposition". Microb Ecol, 53: 600-611. [ Links ]
Webster, J.R. y E.F. Benfield, 1986. "Vascular plant breakdown in freshwater ecosystems". Annual Review of Ecology and Systematic, 17: 567-594. [ Links ]
Wetzel, R.G., 1990. "Land-water interfaces: Metabolic and limnological regulators". Verhandlungen Internationale Vereinigung Limnologie, 24: 6-24. [ Links ]
Zoppi de Roa, E., F. Michelangelli y L. Segovia, 1985. "Cladocera (Crustacea, Branchiopoda) de sabanas inundables de Mantecal, estado Apure, Venezuela". Acta Biol. Venez., 12(1): 43-55. [ Links ]
Zoppi de Roa, E. y E. Vásquez, 1991. "Additional cladoceran records for Mantecal and new for Venezuela". Hidrobiologia, 22: 45-62. [ Links ]
Zoppi de Roa, E., 1993. "Nuevas adiciones a la fauna de rotíferos de Venezuela". Rev. Hydrobiol. Trop., 26(3): 165-173. [ Links ]