Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.34 México ago. 2012
Caracterización de las proteínas de reserva y composición mineral de la semilla de capulín (Prunus serotina)
Storage proteins characterization and mineral composition of black cherry seed (Prunus serotina)
J.C. Raya-Pérez1, C.L. Aguirre-Mancilla1, R. Tapia-Aparicio2, J.G. Ramírez-Pimentel1 y J. Covarrubias-Prieto1
1 Instituto Tecnológico de Roque, División de Estudios de Posgrado e Investigación. Km 8 Carretera Celaya-Juventino Rosas, CP 38110, Celaya, Gto. Tel/Fax 01461 6117757. Correo electrónico: juancarlos.raya@gmail.com
2 Instituto Tecnológico Superior de Uruapan. Carretera Uruapan-Carapan 5555, Col. La Basilia, Uruapan, Michoacán. México.
Recibido: 11 agosto 2011.
Aceptado: 27 abril 2012.
Resumen
La almendra de capulín es muy apreciada y consumida en el centro de México. Esta semilla representa un recurso muy valioso desde el punto de vista económico y nutricional, pues tiene un buen contenido de proteína y aceite. Pese a ser conocida la producción de amigdalina por estas semillas, las personas de la región la consumen en buenas cantidades sin que haya problemas de intoxicación. La caracterización de sus proteínas de reserva indica que tiene un alto contenido en albúminas. A valores de pH 6, 7 y 12 se observa la mayor solubilidad de la proteína. En cuanto a la composición elemental, el contenido es: azufre (0.11%), fósforo (0.17%), calcio (0.07%), magnesio (0.13%), potasio (0.68%) y sodio (0.10%); tiene valores similares al de los componentes de otras semillas (cuadro 1), la almendra presentó un elevado contenido de lípidos (la almendra de la ciudad de México 38%, y el de Uruapan 45%, el de la Meseta Tarasca 41.5%) y un contenido de proteína del 28%. Los datos muestran diferencias entre las semillas donde se consumen éstas (centro de México) y donde no son aprovechadas (Uruapan, Meseta Tarasca). El estudio de las propiedades alimenticias, nutracéuticas y funcionales podría permitir un uso más amplio y el aprovechamiento allí en las regiones donde ahora se desaprovecha.

Palabras clave: globulinas, prolaminas, fracciones proteicas, inhibidores de proteasas.
Abstract
Black cherry kernels is greatly appreciated and consumed in central Mexico. This seed represents a valuable resource from the economic point of view and nutrition as it has a good content of protein and oil. Despite being known for the amygdalin production of these seeds, people of the region consume it without any problems of intoxication. Storage proteins characterization indicates that it has a high content of albumin. Protein solubility is better shown at pH values 6, 7 and 12. The elemental composition presents levels similar to other seed components such as sulfur (0.11%), phosphorus (0.17%), calcium (0.07%), magnesium (0.13%), potassium (0.68%) and sodium (0.10%); the almond shown a high lipid content (almonds from Mexico city 38%, from Uruapan 45%, from Tarascan Plateau 41.5%) and also shows 28% in protein content. Preliminary studies show differences between the seeds are consumed (central Mexico) and where they are not exploited (Uruapan, Tarascan upland). A further characterization could enable wider use and use in regions where there is now wasted.
Key words: globulins, prolamins, protein fractions, protease inhibitors.
INTRODUCCIÓN
En los países en vías de desarrollo la proteína de origen animal es escasa y cara; esto obliga a la búsqueda de fuentes de proteína vegetal de buena calidad (Akintayo et al. , 1998). Los cereales siguen siendo la principal fuente de proteínas para la humanidad y entre el trigo, el arroz y el maíz proveen el 85% de la proteína consumida a nivel mundial (Shewry, 2007). Aunque la soya suple una gran cantidad de proteína usada en la alimentación humana y en la elaboración de alimento para animales monogástricos, su calidad no satisface los requerimientos nutricionales de éstos. Además, a fin de incrementar la utilización de proteínas de origen vegetal, se deben conocer sus atributos, tales como capacidad de emulsificación, gelificación, hidratación, capacidad para unir grasa (Tian et al., 1999; Meng y Ma, 2002). En esta búsqueda de alternativas para obtener proteínas de origen vegetal, la proveniente de Lupinus angustifolius (altramuz azul) es muy comercializada, pues se le considera versátil y de buena calidad a precios competitivos. Se le usa en raciones para puercos, aves, borregos, bovinos e incluso en la alimentación humana. Sin embargo esta semilla tiene efectos tóxicos y retarda el crecimiento (Rahman, 2000). Aunado a todo lo anterior, existe la necesidad de alimentar a la población en crecimiento, para lo cual se calcula que para el año 2050 habrá 10 000 mil millones de habitantes en el planeta (Andrade, 1998). Y aunque se han liberado ya cultivos transgénicos con calidad nutricional mejorada, no parecen competir ventajosamente con los obtenidos mediante fitomejoramiento convencional y, por otra parte, estos cultivos están protegidos mediante patentes. Así, se propone como una de las alternativas para los países subdesarrollados, el uso de cultivos marginados que pueden ser fuentes valiosas de proteína, e incluso de genes para mejorar otros cultivos (Shewry, 2007; Mandal y Mandal, 2000).
Algunos de estos cultivos marginados ya han recibido atención, como los del género Chenopodium que presentan buenas propiedades funcionales y rendimiento potencial en áreas marginales (Bonifacio, 2003). Otras especies, como la de la calabaza (Cucurbita) son sólo parcialmente aprovechadas; mientras en México la semilla de este cultivo es ampliamente utilizada y consumida, en otros países esta semilla se desperdicia por no tener la tradición para su aprovechamiento.
El uso de la almendra de capulín como alimento tiene un historial antiguo y es muy consumida en los estados de México, Hidalgo, Tlaxcala y el Distrito Federal, México; en esta región del centro del país existe un comercio muy importante de huesito de capulín y en mercados como el de la Merced, uno de los más grandes de la ciudad de México, es posible observar costales llenos de huesito, tostado o crudo. En otros lugares, como Texcoco, el comercio de huesito de capulín es cotidiano e importante. El hecho de ser una proteína usada en la alimentación humana desde tiempos antiguos, permite suponer que su toxicidad es escasa o nula, a diferencia de otras ya presentes en el mercado, aunque vale la pena mencionar que la presencia de cianuro en los alimentos, en dosis pequeñas, puede provocar dolor de cabeza o mareo, vértigo, pérdida del apetito y trastornos del sueño. La ingesta prolongada de dosis pequeñas ocasiona neuropatías periféricas (Rahman, 2000).
Aquí se presenta la caracterización de las proteínas de reserva de la almendra del huesito de capulín (Prunus serotina), un recurso subutilizado o no utilizado en muchas regiones de México y de Latinoamérica, pero cuyo uso en la región central de México es muy antigua y amplia, lo que podría facilitar su uso incluso con fines industriales. Adicionalmente su contenido de aceite podría ser de interés para distintos fines (Tian et al., 1999; Meng y Ma, 2002). Dada la amplia distribución de este árbol, su utilización podría ser igualmente amplia (McVaugh, 1951).
MATERIAL Y MÉTODOS
La semilla de capulín, se adquirió en el mercado de la Merced de la ciudad de México. Adicionalmente y a fin de comparar algunas características, se adquirió fruta de capulín en la región de la meseta tarasca, se extrajo la semilla, se lavó y se secó a temperatura ambiente. Se extrajeron las almendras, se trituraron en mortero y se desgrasaron usando una mezcla de cloroformometanol (2:1 v/v). Las harinas desgrasadas se usaron para la extracción de las fracciones proteicas.
Extracción y fraccionamiento de las proteínas. Las proteínas de reserva se extrajeron usando 1 g de harina desgrasada en 10 ml de solución de extracción por 1 h con agitación a temperatura ambiente (25°C), con agua destilada, para extraer albúminas, el sobrenadante se recuperó mediante centrifugación a 14 000 g y la harina precipitada se resuspendió en cloruro de sodio 0.5 M en tris 50 mM pH 8, para la extracción de globulinas siguiendo las mismas condiciones de extracción que fueron usadas para la extracción de la fracción albumina, el sobrenadante fue recuperado mediante centrifugación y la harina precipitada fue resuspendida en 2-propanol al 55% para extraer la fracción prolamina bajo las mismas condiciones en que fueron extraídas las anteriores fracciones proteicas y finalmente se resuspendió la harina precipitada proveniente de la fracción prolamina en amortiguador de boratos 0.1 M con SDS al 0.5%, pH 9 para la extracción de la fracción glutelina (Syros et al., 2003). Para la extracción de proteína a diferentes valores de pH (2, 4, 6, 7, 8, 10, 12) se pesó 1 g de harina desgrasada y se agregaron 5 ml de agua destilada y se llevó al pH correspondiente agregando pequeñas cantidades de NaOH o HCl (1N o 0.1N), se completó el volumen a 10 ml, se incubó con agitación durante 1 h y se centrifugó 1 h a 18 000 rpm en centrífuga (Meng y Ma, 2002; Tavano y Neves, 2008). La proteína de las diferentes extracciones se cuantificó por triplicado mediante el método de Bradford (1976).
Electroforesis. Para la separación de proteínas se emplearon geles de poliacrilamida al 10% en condiciones desnaturalizantes, con amortiguador de tricina (Schagger y von Jagow, 1987), los geles se fijaron con una mezcla de metanol-ácido acético-agua (4:1:5), después se tiñeron con azul de coomassie al 0.1% disuelto en ácido acético al 10%.
Composición elemental. Se elaboraron pastillas de la harina haciendo uso de una prensa hidráulica (CARVER) las cuales fueron analizadas mediante un microscopio electrónico de barrido (JEOL JMS-6480LV), acoplado a una sonda dispersiva de rayos X (INCAx-sight Oxford Instruments).
Determinación de actividad inhibitoria de proteasas. La actividad de tripsina fue determinada con la técnica de Erlanger y col. (1961), midiendo el incremento en absorbencia a 253 nm con el programa Kinetics Beckman, en espectrofotómetro. Se incubó 30 min a 30°C una alícuota (60μl) por separado de cada fracción proteica con solución de tripsina bovina (10μl) 200 μg/ml, en 2.8 ml de amortiguador de Tris-HCl 0.15 M pH 8.1, y posteriormente se agregó 50 μl del sustrato sintético (BAEE-Ester etílico de N-benzoil-l-arginina 0.014M pH 8.1) y se incubo tres minutos a 30°C, leyendo finalmente en espectrofotómetro. Una unidad de enzima es definida como un incremento de 0.01 de absorbencia a 253 nm. La actividad inhibitoria es definida como el número de unidades de enzima inhibidas. Se calcula con la siguiente fórmula:

Donde:
Abs Enz = absorbencia Enzima (Control)
Abs Enz + muestra = absorbencia Enzima + fuente de inhibidores de proteasas
Extracción de grasas. Se utilizaron 8 g de pulpa seca de fruta extraída con n-hexano en Soxhlet durante 5 h, la grasa extraída se utilizó para correr en placa fina (TLC) usando el sistema de solventes cloroformo-metanol-agua 65-25-4, revelado con sulfato de cobre II, éste se preparó usando 15.6 g de sulfato de cobre II pentahidratado y se le agregó 9.4 ml de ácido fosfórico al 85% en agua (p/v) y se aforó a 100 ml con agua destilada (Raya-Pérez et al., 2010).
Contenido de proteína. Fue determinado por el método de Kjeldahl usando el factor de conversión de 6.25 (N x 6.25).
Contenido de humedad. El contenido de humedad se determinó pesando 20 semillas e incubando a 80 °C durante 24 h (Da Silva-Fialho et al., 2006). El peso de fruta y semilla de Uruapan y de la ciudad de México se comparó utilizando un diseño de bloques completos al azar.
Los datos de peso de fruto y peso de semilla fueron analizados usando el programa estadístico SAS.
RESULTADOS
De la semilla de capulín se extrajo 17% de proteína soluble, de la cual el 13.46% corresponde a la fracción albúmina, 2.3% a la fracción globulina, 0.46% a la fracción prolamina y 0.72% a la fracción glutelina. En cuanto al patrón electroforético de proteínas en ausencia de 2-mercaptoetanol, se observan dos bandas abundantes a la altura de los marcadores de 45 y 31 kDa, tanto en la fracción albúminas como en la de globulinas, otra banda abundante se observa entre los marcadores de 31 y 21.5 kDa (carriles 2 y 3; Fig. 1). Cuando no se añade 2-mercaptoetanol a las fracciones de proteína aparece una gran banda de proteína entre los marcadores de 66 y 97 kDa en la fracción de albúminas (carril 2), al parecer por no separarse las proteínas que dan las bandas que aparecen entre los marcadores de 66 y 45 kDa, además de la de 31 kDa (carril 6), que también deja de verse cuando no se agrega el reductor de puentes disulfuro. Las globulinas muestran un comportamiento similar (carriles 3 y 7). Las prolaminas dan dos bandas conspicuas un poco por debajo del marcador de 97 kDa, que desaparecen en presencia de 2-mercaptoetanol (carriles 4 y 8). Las proteínas tipo glutelinas muestran un comportamiento similar, lo que indica que están compuestas por subunidades, como se ha reportado para las proteínas de reserva de otras especies (Dunwell, 2005; Shewry, 2007). En conclusión, el peso molecular de las albúminas varió entre 65 y 20 kDa, globulinas entre 65 y 14 kDa y el de las prolaminas y glutelinas entre 65 y 12 kDa.

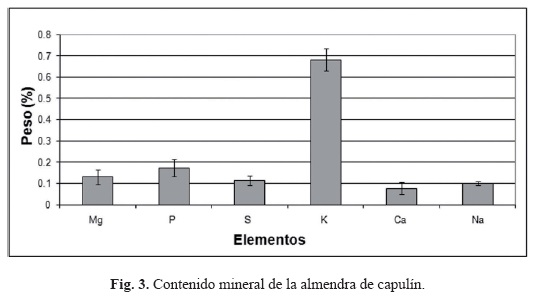
La actividad inhibitoria contra enzimas tipo tripsina se reduce considerablemente cuando la semilla es tostada; de 1 921 unidades de inhibición baja a 162 en la fracción de albúminas, la que presenta la actividad más alta; las glutelinas extraídas de harina cruda tienen 1 477 unidades de inhibición pero en la harina de semilla tostada esta actividad decae hasta 22 unidades. Esta pérdida de la capacidad de inhibición de las enzimas proteolíticas sin duda está también relacionada con la desnaturalización que sufren las proteínas con la temperatura alcanzada durante el tostado y que también explicaría la escasa o nula toxicidad debida a la producción de amigdalina, pues para que este compuesto se produzca se requiere de la participación de enzimas. El pericarpio acumula amigdalina, pero es acianogénico por carecer de las enzimas para liberar el cianuro (Swain et al., 1992), también se ha reportado la purificación de este tipo de enzimas a partir de la semilla de capulín (Yemm y Poulton 1986). La solubilidad de la proteína de almendra de capulín, como se puede apreciar en los geles (Fig. 2), es escasa a valores de pH de 2 y 4, aumentando considerablemente su solubilidad a pH 6, 7 y siendo aún mayor a pH 12, observándose un comportamiento muy similar tanto con harina tostada como con harina cruda. La purificación de las principales proteínas de reserva de las distintas fracciones permitirá una mejor caracterización de las subunidades, su digestibilidad, y composición de aminoácidos (Montoya et al., 2008; Tavano y Neves, 2008). Se ha reportado que las proteínas de semillas ricas en aceite son poco solubles a pH ácido, como lo observamos con las de almendra de capulín (Wolf y Sathe, 1998). En cuanto a la composición elemental, su contenido de minerales es comparable a otras semillas, por ejemplo su contenido de potasio es cercano al 1% (Fig. 3), pero dentro de los valores reportados para frijol silvestre y asilvestrado de México (Guzmán-Maldonado et al., 2000). El alto contenido de carbono sin duda refleja su alto contenido en grasas, mayor a la media estimada para el material de origen vegetal (Raya-Pérez y Aguirre-Mancilla, 2009). Esta técnica de cuantificación da resultados equiparables a otras y ha sido utilizada para muestras biológicas (Liu et al., 2007; Raya-Pérez y Aguirre-Mancilla, 2009).

A fin de hacer una exploración preliminar sobre la semilla de la región tarasca y la del centro del país, se adquirió fruta en ambas regiones y se tomó el peso tanto de la fruta completa como de la semilla, la cereza proveniente de la ciudad de México fue más grande, Uruapan incluido. Cabe señalar que la diferencia en tamaños se aprecia a simple vista. Si restamos el peso promedio de la semilla al peso promedio de la fruta completa veremos que, en promedio, se obtiene más pulpa del capulín comprado en la ciudad de México (1.491 g), que el comprado en la región tarasca (1.08 g), lo cual es indicativo de la importancia que se les da en una y otra región (cuadros 2 y 3). Las diferencias se pueden apreciar también a nivel de árboles, sobre todo entre los árboles de la región central y el altiplano de México y Guatemala con los de los Estados Unidos (McVaugh, 1951). En un recorrido entre Uruapan y Zamora, México, fue posible observar que había árboles con mucha fruta, sin que nadie se preocupara por cosecharla. El mayor tamaño de la fruta del centro del país podría usarse, a priori, para la introducción de este tipo de árboles en otras regiones. O sea que no sólo se obtiene una semilla más grande, si no también, mayor cantidad de pulpa.


El análisis de varianza (cuadro 2) mostró diferencias altamente significativas entre el peso de la fruta proveniente de la meseta tarasca (1.256 g) con respecto a la de la ciudad de México (1.748 g) y Uruapan (1.669 g). Entre estas últimas dos localidades no hay diferencias. En cuanto al peso de la semilla el análisis estadístico señalado, indica que las tres localidades son diferentes, resultando con mayor peso la proveniente de la ciudad de México (0.25 g) seguida de la de Uruapan (0.19 g) y la de la meseta tarasca con 0.17 g (cuadro 3).
El contenido de grasa puede variar entre 41.2% para el capulín comprado en la ciudad de México hasta 49% para el de Puebla. Obviamente, esta variabilidad permitiría seleccionar para incrementar el contenido de aceite y/o proteína.
El contenido de humedad de la semilla de capulín fue de 4.22% para el de la meseta tarasca y 4.94% de Uruapan y el de la ciudad de México 7.04%.
DISCUSIÓN
De la semilla de capulín se extrajo más proteína soluble en agua (fracción albumina) que con los otros solventes, aunque también se logró extraer una buena cantidad con solución salina y con boratos. Esto concuerda con lo reportado por otros autores, ya que las dicotiledóneas presentan como principales proteínas de reserva albúminas y globulinas (Mandal y Mandal, 2000). Las bandas reportadas para Prunus dulcis son de 44, 42, 27 y 25 kDa de masa molecular, pesos muy cercanos a los reportados en este trabajo para P. serotina (Wolf y Sathe, 1998).
El que con agua se extraiga la mayor parte de las proteínas de reserva solubles, 13.46%, podría ser una ventaja, ya que no se tendría que desalinizar o neutralizar como con otras proteínas provenientes de otras fuentes, si se consideraran para uso industrial (Tian et al. , 1999). Para las proteínas de almendra (P. dulcis) se reporta que el cloruro de sodio no tiene efecto sobre la solubilidad de las proteínas de reserva (Wolf y Sathe, 1998).
Otro punto a considerar es el hecho de que las globulinas son la fracción que más impacto tiene sobre la salud humana, en cuanto a alergias, que en el capulín, con el método utilizado, representan un 2.3% (Dunwell, 2005). Las prolaminas apenas alcanzan un 0.46% y las glutelinas un 0.72%. Estos datos indican que con el método de extracción se obtiene alrededor de un 17% de proteínas solubles y aunque falta una mejor caracterización, apuntan a un muy buen contenido proteico en la semilla de capulín si, como en caso del frijol, la proteína soluble representa aproximadamente el 50% del contenido total (Montoya et al., 2008). Para la proteína de frijol rojo (bean red) se reporta un mínimo de solubilidad a pH 5, con la mayor solubilidad a valores de pH extremos. De acuerdo con los autores la alta solubilidad de la proteína de este frijol se debería a la baja hidrofobicidad de su superficie; asimismo, se señala que su alta solubilidad a pH neutro y ácido posibilita su uso en bebidas y alimentos líquidos (Meng y Ma, 2002). Algo similar se observa para la proteína de capulín, siendo ésta insoluble sólo a pH muy ácido. En cambio la vicilina de Cicer arietinum L. es poco soluble a pH 4.5 y 6 (Tavano y Neves, 2008), semejante a la de almendra (P. dulcis), cuya proteína es muy poco soluble a valores de pH entre 3 y 5 (Wolf y Sathe, 1998).
Ya que la proteína cruda presenta una buena actividad inhibitoria sería interesante caracterizar el o los inhibidores, pues estas semillas poco estudiadas pueden dar actividades noveles; en C. arietinum la actividad inhibitoria contra tripsina se concentra en la fracción de albúmina, aunque, como ocurre con la actividad inhibitoria en proteína de almendra de capulín, ésta desaparece cuando se calienta a 121°C durante 15 min (Aguirre et al., 2009; Tavano y Neves, 2008). Ya que los inhibidores de proteasas son resistentes a la desnaturalización, es de esperarse que la acción del calor sobre las enzimas que liberan cianuro en la semilla de capulín fuera más efectiva para su desnaturalización. Es deseable investigar los posibles efectos de la almendra de capulín sobre la salud de los consumidores, sea que pudiera tener un efecto positivo debido a la composición del aceite o negativo por el potencial de la producción de cianuro. Otra vertiente igualmente interesante es la de explorar la generación y presencia de péptidos con actividades nutraceúticas (Megías et al., 2007). La almendra de capulín aporta por cada 100 g de almendra, cerca de un quinceavo de la ingesta diaria recomendada de calcio, un tercio de la de magnesio, un cuarto de la de potasio, un séptimo de la de fósforo y un veinteavo de la de sodio, esto de acuerdo a las tablas publicadas por el Instituto Nacional de la Nutrición.
Los datos aquí presentados permiten considerar a la almendra de capulín como una fuente valiosa de proteína, minerales y aceite, con un gran potencial para su aprovechamiento. El análisis del aceite de la almendra de capulín permite proponerlo como una fuente de aceite para usos especiales; el ácido aeleostearico podría servir como preventivo en los procesos de inflamación crónica y en general su composición le da un carácter semisecante, susceptible de usarse en pinturas y barnices, por ejemplo, para artesanías (Alveano-Aguerrebere et al., 2011).
CONCLUSIONES
Se obtuvo el perfil electroforético de las proteínas de reserva de la almendra de capulín. Se encontró que la fracción mayoritaria son las albúminas. La solubilidad de las proteínas se incrementa a pH alcalino.
La actividad inhibitoria contra enzimas tipo tripsina prácticamente desaparece cuando la semilla es tostada.
Se determinó el contenido de aceite y la composición elemental de la almendra.
Se encontraron diferencias estadísticamente significativas en el peso de las semillas obtenidas en la ciudad de México (donde se le consume) y las colectadas en la meseta tarasca (donde la semilla no es aprovechada).
LITERATURA CITADA
Aguirre, C., J.L. Castro-Guillen, L. Contreras, E. Mendiola-Olaya, L. González de la Vara y A. Blanco-Labra, 2009. "Partial characterization of a chymotrypsin-like protease in the larger grain borer (Prostephanus truncatus (Horn)) in relation to activity of Hyptis suaveolens (L.) trypsin inhibitor". J. Stored Prod. Res., 45: 133-138. [ Links ]
Alveano-Aguerrebere I., Rojas-Molina A., Dave-Oomah B., Drover J.C.G, 2011. "Characteristics of Prunus serotina seed oil". Food Chem., 124: 983-990. [ Links ]
Andrade, F.H., 1998. "Posibilidades de expansión de la producción agrícola". Interciencia, 23: 218-226. [ Links ]
Akintayo, E.T., Esuoso, K.O., Oshodi, A.A., 1998. "Emulsifying properties of some legume proteins". Int. J. Food Sci. Tech., 33: 239-246. [ Links ]
Bradford, M.M., 1976. "A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding". . Anal. Biochem., 72: 248-252. [ Links ]
Bonifacio, A., 2003. "Chenopodium sp.: genetic resources, ethnobotany, and geographic distribution". Food Rev. Int., 19: 1-7. [ Links ]
Da Silva Fialho, L., Monteze Guimaraes, V., Goncalvez de Barros, E., Alves Moreira, M., Dos Santos Dias, L.A., De Almeida Oliveira, M.G., Chamel Jose, I. y Tavares de Rezende, S., 2006. "Biochemical composition and indigestible oligosaccharides in Phaseolus vulgaris L. seeds". Plants Food Hum. Nutr., 61: 87-89. [ Links ]
Dunwell, J.M., 2005. "Structure, function, and evolution of vicilin and legumin seed storage proteins". Steinbüchel, Alexander/Marchessault, Robert H (Eds). Polisaccharides andpolyamides in the food industry: propierties, production, and patents. Wiley-VCH, Weinheim. pp. 707-737. [ Links ]
Erlanger B., Kokowsky, N., Come, W., 1961. "The preparation and propierties of two new chromogenic substrates of trypsin". Arch. Biochem. Biophys., 95: 271-278. [ Links ]
Fonseca-Márquez, M.F. y Bora P.S., 2000. "Composición química y análisis de aminoácidos de alubias". Ciencia y Tecnología Alimentaria, 2: 248-252. [ Links ]
Guzmán-Maldonado, H.S., Acosta-Gallegos, J. y Paredes-López, O., 2000. "Protein and mineral content of a novel collection of wild and weedy common bean (Phaseolus vulgaris L.)". J. Sci. Food Agrie, 80: 1874-1881. [ Links ]
Liu, D., Kottke, I. y Adam, D., 2007. "Localization of cadmium in the root cells of Allium cepa by energy dispersive X-ray analysis". Biol. Plantarum, 51: 363-366. [ Links ]
Maldonado, S. y Sammán, N., 2000. "Composición química y contenido de minerales de leguminosas y cereales producidos en el noroeste argentino". Archivos Latinoamericanos de Nutrición, 50: 195-199. [ Links ]
Mandal, S. y Mandal, R.K., 2000. "Seed storage proteins and approaches for improvement of their nutritional quality by genetic engineering". Curr. Sci. India, 79: 576-589. [ Links ]
McLean Jr. W.C., López de Romaña G., Placko R.P. y Graham G.G., 1981. "Protein quality and digestibility of sorghum in preschool children: balance studies and plasma free amino acids". J. Nutr., 111: 1928-1933. [ Links ]
McVaugh, R., 1951. "A revision of the North American black cherries (Prunus serotina (EHRH. and relatives)". Brittonia, 7(4):279-315. [ Links ]
Megias, C., Pedroche, J., Yust M.M., Giron-Calle, J., Alaiz M., Millan F. y Vioque J., 2007. "Affinity purification of copper chelating peptides from sunflower protein hydrolysates". J. Agric. Food Chem., 55: 6509-6514. [ Links ]
Meng, G. y Ma, C-Y., 2002. "Characterization of globulin from Phaseolus angularis (red bean)". Int. J. Food Sci. Tech., 37: 687-695. [ Links ]
Montoya, C. A., Leterme, P., Victoria, N.F., Toro, O., Souffrant, W. B., Beebe, S. y Lailles, J.P., 2008. "Susceptibility of phaseolin to in vitro proteolysis is highly variable across common bean varieties (Phaseolus vulgaris)". J. Agric. Food Chem., 56: 2183-2191. [ Links ]
Narváez-González E.D., Figueroa-Cárdenas J.D., Suketoshi T., Castaño-Tostado E. y Rincón-Sánchez F., 2006. "Relationships between the microstructure, physical features and chemical composition of different maize accessions from Latin America". Cereal Chem., 83: 595-604. [ Links ]
Rahman, M.H., 2000. "The nutritional toxicity of sweet lupin (Lupinus Angustifolius) seed proteins". J. Sci. Food Agr., 80: 72-78. [ Links ]
Raya-Pérez, J.C., Aguirre-Mancilla, C.L., Gil-Vega, K. y Simpson J., 2010. "La domesticación de plantas en México: Comparación de la forma cultivada y silvestre de Byrsonima crassifolia (Malpighiaceae)". Polibotánica, 30: 239-256. [ Links ]
Raya-Pérez, J.C. y Aguirre-Mancilla, C.L., 2009. "Composición elemental de algunas plantas silvestres mexicanas". Revista Chapingo serie ciencias forestales y del ambiente, 15: 95-99. [ Links ]
Schagger, H. y von Jagow, G., 1987. "Tricine-sodium dodecyl sulfate polyacrylamide gel electrophoresis for the separation of protein in the range from 1-100 kDa". Anal. Biochem., 166: 368-379. [ Links ]
Shewry, P.R., 2007. "Improving the protein content and composition of cereal grain". J. Cereal Sci., 46: 239-250. [ Links ]
Swain, E., Li, C.P. y Poulton, J.E., 1992. "Tissue and subcellular localization of enzymes catabolizing (R)-amygda-lin in mature Prunus serotina seeds". Plant Physiol., 100: 291-300. [ Links ]
Syros, T., Yupsanis, T. y Economou, A., 2003. "Fractionation and electrophoretic patterns of Ebenus cretica. A preliminary survey as a tool in taxonomy". Biol. Plantarum, 46: 435-443. [ Links ]
Tapia-Blacido, D., Mauri A.N., Menegalli, F.C., Sobral, P.J.A. y Añon M.C., 2007. "Contribution of the starch, protein and lipid fractions to the physical, termal, and structural properties of amaranth (Amaranthus caudatus), flour films". J. Food Sci., 72: E293-E300. [ Links ]
Tavano, O.L. y Neves, V.A., 2008. "Isolation, solubility and in vitro hidrolysis of chickpea vicilin-like protein". Food Sci. Techol., 41: 1244-1251. [ Links ]
Tian, S., Kyle, W.S.A. y Small, D.M., 1999. "Pilot scale isolation of proteins from field peas (Pisum sativum L.) for use as food ingredients". Int. J. Food Sci. Tech., 34: 33-39. [ Links ]
Wolf, W.J. y Sathe S.K., 1998. "Ultracentrifugal and Polyacrylamide Gel Electrophoretic Studies of Extractability and Stability of Almond Meal Proteins". J. Sci. FoodAgric., 78: 511-521. [ Links ]
Yemm R.S. y Poulton J.E., 1986. "Isolation and characterization of multiple forms of mandelonitrile lyase from mature black cherry (Prunus serotina Ehrh.) seeds". Arch. Biochem. Biophys., 247: 440-445. [ Links ]














