Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Polibotánica
versão impressa ISSN 1405-2768
Polibotánica no.34 México Ago. 2012
Evaluación del efecto de cadmio sobre la germinación y elongación radical de semillas bacterizadas de Axonopus affinis y Festuca rubra
The cadmium effect evaluation on germination and root elongation of Axonopus affinis and Festuca rubra bacterized seeds
S. Escalante-Campos1, A. Rodríguez-Dorantes1*, M.S. Vásquez-Murrieta2*, A.V. Rodríguez-Tovar2*, L.A. Guerrero-Zúñiga3, N.O. Pérez2**, M.O. Franco-Hernández4* y A. Ponce-Mendoza5
1 Lab. Fisiología Vegetal, Departamento de Botánica. Correo electrónico: anrodo2000@hotmail.com
2 Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, IPN.
3 Dirección de Seguridad y Medio Ambiente, Instituto Mexicano del Petróleo.
4 Departamento de Ciencia Básica, Unidad Profesional Interdisciplinaria de Biotecnología, IPN.
5 Departamento El Hombre y su Ambiente, Universidad Autónoma Metropolitana- Xochimilco, México, DF.
Recibido: 4 agosto 2011.
Aceptado: 18 mayo 2012.
Resumen
Se han reportado diferentes índices para biomonitorear los efectos de fitotoxicidad de metales en plantas y uno de esos indicadores está basado en la germinación y desarrollo de las plántulas; así mismo, la promoción de las raíces es uno de los principales marcadores con los que se mide el efecto benéfico de las rizobacterias promotoras del crecimiento vegetal. El presente estudio analizó el efecto de la bacterización sobre la germinación y elongación radical de Axonopus affinis (Chase) y Festuca rubra L., como mecanismos de protección y promoción del crecimiento ante la exposición a un metal pesado.
La bacterización de las semillas con la rizobacteria Pseudomonas sp. Sp7D en ambas especies reflejó tanto su potencial promotor del crecimiento en la germinación y el crecimiento de las plántulas, donde éstos fueron mayores para Festuca rubra; como su potencial protector ante la presencia de cadmio (Cd) para ambas especies; no obstante que Axonopus affinis (Chase) mostró también una respuesta hormética ante la presencia del metal y la tolerancia a éste.
Palabras clave: germinación, rizobacterias promotoras del crecimiento vegetal, cadmio.
Abstract
There has been reported different index to biomonitoring the phytotoxic effects of metals in plants; one of them is based on the germination and plant lets growth, even though the root promotion is a major marker which measures the beneficial effect of plant growth promoting rhizobacteria. The present study analyzed the bacterization effect on germination and root elongation of Axonopus affinis (Chase) and Festucarubra L., as protection and promoting plant growth mechanisms at the exposition to a heavy metal. The seeds bacterization with the rhizobacteria Pseudomonas sp. Sp7D of both species, showed its promoting potential in the germination and the plantlets grown as its protecting potential in cadmium presence for both species; even that A. affinis (Chase) showed too a hormetic response with cadmium and the tolerance to it.
Key words: germination, plant growth promoting rhizobacteria, cadmium.
INTRODUCCIÓN
Las semillas contienen al embrión que es una nueva planta en miniatura y éstas poseen dos funciones principales: la reproducción y la dispersión; la formación de las semillas completa el proceso de la reproducción de las plantas y con su germinación, comienza la siguiente generación de plantas.
La cubierta seminal o testa provee de cierta protección contra el estrés por metales antes de la germinación; la literatura sugiere que la germinación de las semillas se afecta por los metales de dos maneras: por su toxicidad general y por su inhibición en la absorción de agua. La mayoría de los trabajos reportados muestran que los tratamientos con metales ocasionan una reducción de la germinación dependiente de la concentración de éstos en muchas especies de plantas. Estudios derivados de la exposición de semillas a metales pesados y su relación con la germinación y el desarrollo de las plántulas, muestran que se presenta una variación inter e intraespecífica tanto en la germinación de las semillas, como en la respuesta de las plántulas al estrés por metales (Li et al., 2005; Kranner y Colville, 2011).
Todas aquellas bacterias que influyen sobre el crecimiento de las plantas de manera positiva indirecta o directamente por cualquier mecanismo se denominan rizobacterias promotoras del crecimiento vegetal (PGPR por sus siglas en inglés: Plant Growth Promoting Rhizobacteria) (Kloepper et al., 1989; Frankenberger y Arshad, 1995; Arshad y Frankenberger, 1998; Ahmad et al., 2008). La aplicación del bioensayo de la medición de la promoción de la elongación radical conocido como PREP (Plant Root Elongation Promotion), basado en la evaluación de la actividad promotora del crecimiento radical de las plántulas como indicador del efecto de la acción sinergística entre la rizobacteria y la plántula (Dell' Amico et al., 2008), se ha empleado para evaluar el análisis del efecto de las PGPR's tolerantes a metales sobre el crecimiento de plántulas en presencia de metales pesados.
La fitoremediación asistida o rizoremediación es una disciplina prometedora para mejorar la remediación al emplear microorganismos asociados con plantas para potenciar su crecimiento y con ello, favorecer su tolerancia al estrés (Zhuang et al., 2007; Dowling y Doty, 2009; Epelde et al., 2010; Koo et al., 2010).
El cadmio no obstante que no es un elemento esencial para las plantas, se absorbe y se distribuye rápidamente a través del sistema vascular ocasionando en forma general una depresión del crecimiento de éstas e incluso su muerte. La toxicidad del cadmio en las plantas, presenta varios síntomas; con frecuencia altera los procesos fotosintéticos, la respiración y el metabolismo del nitrógeno; así como también reducen la absorción de agua y nutrientes esenciales (Clijtsters y Van Assche, 1985; Barceló y Poschenrieder, 1990; Hart et al., 1998; Ruiz et al., 2009) y dentro de los efectos observados, se tienen entre ellos también la inhibición de la germinación de semillas y el desarrollo de raíces (Kiran y §ahin, 2006). En varios tratamientos realizados a semillas con Cd se redujo la germinación total (Smiri et al., 2010) y el crecimiento de las plántulas con una correlación negativa entre la concentración del metal y la germinación total. Las afectaciones de la semilla que se han observado en estos tratamientos son mayormente en el crecimiento radical, seguida del crecimiento de brotes y la germinación, siendo esta última afectada significativamente sólo a concentraciones altas de Cd, causando altos niveles de estrés oxidativo (Schützendübel y Polle, 2002; Kranner y Colville, 2011).
Sin embargo, con concentraciones bajas de Cd se puede observar una ligera estimulación de la germinación que puede atribuirse a un exceso de producción de especies reactivas del oxígeno (ROS) y especies reactivas del nitrógeno (RNS), lo que estimula la germinación (Smiri et al., 2010; Kranner y Colville, 2011).
Los mecanismos de las formas reactivas de oxígeno por metales pesados tales como plomo, cadmio y zinc es poco clara; una posible función de las peroxidasas en el tratamiento de metales pesados es su contribución en plantas acumuladoras de metales, tal es el caso de la especie acuática Nymphaea que emplea peroxidasas para producir polímeros fenólicos que atrapan cadmio y lo aislan en forma de cristales de Ca-Cd en sus glándulas situadas sobre el lado acuático de las hojas (hidropotos) (Lavid et al., 2001). No obstante que las peroxidasas claramente se inducen bajo la presencia de metales pesados y otros químicos tóxicos; se presenta dificultad para asignarles un papel preciso en la fitoremediación; sin embargo, éstas se han utilizado como enzimas para fitomonitorear áreas industriales y densamente urbanizadas por su sensibilidad a la contaminación atmosférica, lo que puede clasificarlas como otro de los biomarcadores clásicos; esto se ha observado también con metales pesados presentes en el suelo (Cho y Park, 2000; Geebelen et al., 2002). Las peroxidasas pertenecen a una gran familia mutigénica por su gran número de isoformas; así como también por la regulación heterogénea de su expresión y están involucradas en un amplio número de procesos fisiológicos a lo largo del ciclo de vida de las plantas al modular su actividad y expresión seguido de un estímulo interno o externo; en particular durante las primeras fases de su crecimiento, lo que incluye cuando se encuentran en una condición de estrés, que bien puede ser la presencia de contaminación química por metales pesados (Passardi et al., 2005).
La expresión de las peroxidasas da como resultado una defensa en las plantas; ya sea de forma pasiva, con la construcción de paredes celulares fuertes, o activa con la producción de formas reactivas de oxígeno contra el ataque de agentes bióticos (Passardi et al., 2005).
Como un indicador de la fitotoxicidad de metales, varios autores han reportado diferentes índices para biomonitorear estos efectos, uno de ellos está basado en la germinación y desarrollo de las plántulas (Baki y Anderson, 1973; Mhatre y Chaphekar, 1982). La promoción de las raíces es uno de los principales marcadores con los que se mide el efecto benéfico de las PGPR's (Glick et al., 1995), las fitohormonas estimuladoras del crecimiento de plantas, producidas por este tipo de rizobacterias dentro de la zona radical, incrementan la densidad y longitud de los pelos radicales. El rápido establecimiento de las raíces; ya sea por elongación de las raíces primarias o por la proliferación de las raíces laterales y adventicias, resulta ventajoso para las plántulas conforme incrementan su habilidad de anclaje al suelo y con ello, esto también les permite la absorción de agua y nutrientes (Volkman y Bremer, 1998).
El presente estudio analizó el efecto de la bacterización sobre la germinación y elongación radical de Axonopus affnis (Chase) y Festuca rubra L., como mecanismos de protección y promoción del crecimiento ante la exposición a un metal pesado.
MATERIAL Y MÉTODOS
Mantenimiento de la rizobacteria productora de sideroforos Pseudomonas sp. Sp7D.
La rizobacteria Pseudomonas sp Sp7D (productora de fitohormonas y sideróforos) que se empleó como inoculante, proviene de la rizósfera de Viguiera dentata (Cav.) Spreng, crecida en un sitio contaminado con metales pesados localizado en Villa de la Paz en San Luís Potosí (23° 41'N y 100° 42' O), en esta localidad los metales pesados más abundantes en la zona son As, Cu, Pb y Zn (Vásquez-Murrieta et al., 2006). Esta rizobacteria se mantuvo con resiembras en placas con medio sólido LB (Luria-Bertani), para la preparación del inóculo bacteriano. Bacterización de las semillas de Axonopus affinis (Chase) y Festuca rubra L. (Poaceae) y establecimiento de los bioensayos con la presencia del metal pesado.
Los bioensayos realizados para evaluar el efecto de la presencia del metal pesado sobre la germinación y desarrollo de las plántulas de Axonopus affinis (Chase) (Poaceae) y Festuca rubra L. (Poaceae) se establecieron siguiendo el método modificado por Sheng y Xia (2006) al bioensayo de la medición de la promoción de la elongación radical conocido como PREP (Plant Root Elongation Promotion) de Dell' Amico et al. (2008). Para la preparación del inóculo bacteriano, se tomó con una asa estéril una colonia de la rizobacteria que se resuspendió en agua destilada estéril para obtener un inóculo de 4.6 x 106 UFC/mL. De esta suspensión bacteriana se tomó una alícuota de 3mL o de agua estéril (considerando ésta como control sin inocular) y se depositó en una caja de Petri con papel filtro estéril. Las semillas de A. affnis (Chase) y F. rubra L. se desinfestaron previamente con 10 mL de hipoclorito de sodio al 10 % por 15 minutos, se enjuagaron cinco veces con agua destilada estéril y después se depositaron sobre el papel filtro. Se consideró también la adición de 3 mL de una solución del metal pesado seleccionado: Cd (3CdSO4 • 8H2O) a la concentración de 1 mM, con experimentos con y sin la adición del metal pesado y con la adición de la rizobacteria.
Los bioensayos se realizaron con tres réplicas (20 semillas/caja) para cada experimento y al término de la incubación de las placas a 37°C durante 10 días, se obtuvo el material vegetal y se realizaron mediciones de la longitud radical y del coleoptilo y la biomasa radical se empleo para la determinación enzimática de dos fenoloxidasas. Así mismo, se determinó el índice de vigor (IV) de las especies seleccionadas, no solamente para evaluar el efecto de la presencia de los metales pesados, sino la promoción del crecimiento de las plántulas inoculadas con esta rizobacteria. La determinación del índice de vigor (Cokkizgin y Cokkizgin, 2010) se calculó a partir de la fórmula: IV= (promedio de la longitud radical + promedio de la longitud foliar) (% germinación).
Determinación del índice de tolerancia (IT) de Axonopus affinis y Festuca rubra a cadmio
A partir de la medición realizada de las longitudes radicales y del coleoptilo, tanto de las plantas inoculadas como de las plantas testigo, se realizó la determinación del índice de tolerancia (IT) (Wilkins 1978; Burd et al., 1998), por la expresión: IT = LRm / LRc, donde: LRm: es la longitud radical de las plántulas que crecieron en presencia del metal específico adicionado y LRc: es la longitud radical de las plántulas crecidas en ausencia del metal, lo mismo con la longitud del coleoptilo. Se consideraron también los experimentos de ambas especies con y sin el inóculo bacteriano.
Análisis de la actividad de enzimas indicadoras de estrés en el sistema radical de Axonopus affinis (Chase) y Festuca rubra L.
Determinación de la actividad enzimática de guaiacol peroxidasas
La determinación de la actividad de guaiacol La determinación de la actividad de heperoxidasas, se realizó empleando el método espectrofotométrico de la oxidación de guaiacol. Se colocaron directamente tres puntas de raíces en un tubo eppendorf con 1.5 mL de regulador de fosfato de potasio 0.1M, pH 6.0 + 32 mL de guaiacol 0.2M + 32 mL de peróxido de hidrógeno 0.03M, la reacción se realizó a temperatura ambiente con la evidencia de la actividad de las enzimas a través del desarrollo de la coloración café-rojiza característica propia de la oxidación y polimerización del guaiacol y se leyó la absorbancia a 436 nm, a los 30 minutos. La actividad enzimática específica se calculó empleando la ecuación de Hendry y Grime (1993):

Donde: R = volumen total del ensayo: 1.5 mL de regulador de fosfato de potasio + 0.032 mL guaiacol + 0.032 mL de peróxido de hidrógeno + volumen de la muestra 3 cm2 (1 cm2 por cada raíz por ensayo), S = volumen de la muestra: 3 cm2 (1 cm2 por cada raíz por ensayo) = 3, t = tiempo de incubación de la reacción enzimática: 30 minutos. Se transformaron las lecturas de As 436nm, utilizando el coeficiente de extinción molar del guaiacol (ε436 = 6.4 x 103 M-1 cm-1), la actividad enzimática específica de las guaiacol peroxidasas de la superficie radical se expresó como la cantidad de guaiacol oxidado (nM guaiacol oxidado/min/cm2). Para ajustar el espectro-fotómetro se utilizó como testigo una celda con 1.5 mL de regulador de fosfato de potasio 0.1 M + 32 mL de guaiacol 0.2M + 32mL de peróxido de hidrógeno 0.03M.
Determinación de la actividad enzimática de hemoperoxidasas
La determinación de la actividad de hemoperoxidasas, se realizó empleando el método espectrofotométrico de la oxidación de tetrametilbencidina (TMBZ). Se colocaron directamente tres puntas de raíces en tubos eppendorf con 1.5mL de regulador de acetato de sodio 0.20M pH= 5.3 + 100 μL de TMBZ (preparada en 2 mg/L de metanol, diluida en regulador de acetato de sodio 0.20M pH= 5.3, a la concentración de 660μg/mL) + 50μL de peróxido de hidrógeno 0.03M. Los tubos se incubaron por 30 minutos a temperatura ambiente; se evidenció la actividad de las enzimas a través del desarrollo de la coloración azul turquesa característica de la oxidación y polimerización de la TMBZ.
La actividad enzimática específica se calculó empleando la ecuación de Hendry y Grime (1993):
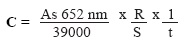
Donde: R = volumen total del ensayo: 1.5 mL de regulador de acetatos + 0.1 mL de TMBZ + 0.050 mL de peróxido de hidrogeno + volumen de la muestra 3 cm2 (1 cm2 por cada raíz por ensayo), S = volumen de la muestra: 3 cm2 (1 cm2 por cada raíz por ensayo) = 3, t = tiempo de incubación de la reacción enzimática: 30 minutos. Las lecturas de absorbancia a 652 nm, se transformaron utilizando el coeficiente de extinción molar de la TMBZ (ε652 = 3.9 x 104 M-1 cm-1), la actividad enzimática específica de las hemoperoxidasas de la superficie radical se expresó como la cantidad de nM de TMBZ oxidada/min/cm2. Para ajustar el espectrofotómetro se utilizó como testigo una celda con 1.5 mL de regulador de acetato de sodio 0.20M pH = 5.3 + 100μL de TMBZ + 50 μL de peróxido de hidrógeno 0.03M.
Análisis estadístico de los resultados
A todos los resultados obtenidos, se les aplicó un análisis de varianza (ANOVA) y prueba de Tukey-Kramer de comparación múltiple, empleando el paquete estadístico GraphPadInStat, V2.03 (Aceves, 1993).
RESULTADOS
Efecto de la inoculación de semillas con una rizobacteria promotora del crecimiento vegetal sobre la germinación y desarrollo de las plántulas de Axonopus affinis (Chase) y Festuca rubra L.
La primera respuesta de las especies bajo estudio se refiere a la germinación de las semillas inoculadas con la rizobacteria Pseudomonas sp. Sp7D; en términos generales se promovió la germinación en las semillas de F. rubra L., en comparación con las semillas de esta especie sin inocular. En cuanto al efecto de la presencia de cadmio sobre la germinación, ésta se inhibió en las semillas de F. rubra L.; lo que no sucedió con las semillas de A. affinis (Chase) con un porcentaje mayor de germinación. La inoculación de las semillas expuestas al metal mostró en los resultados que la rizobacteria podría ejercer un efecto protector sobre la semilla ante el metal; ya que el porcentaje de germinación en las semillas bacterizadas fue mayor que en las semillas solamente expuestas a cadmio. Para A. affinis, la respuesta del porcentaje de germinación fue menor que las semillas germinadas en agua y con la rizobacteria (Figs. 1 y 2).
Evaluación del crecimiento y determinación del índice de tolerancia (IT) a cadmio de las plántulas de A. affinis (Chase) y F. rubra L. inoculadas con la rizobacteria
La promoción del crecimiento radical fue mucho mayor en las dos especies de pastos que el crecimiento del coleoptilo (Figs. 3a y 3b).
El índice de tolerancia de A. affinis (Chase) tanto a nivel radical como foliar, mostró que las plántulas de esta especie toleraron la concentración de este metal pero también presentaron un incremento significativo comparadas con el testigo (el valor del índice de tolerancia = 1 implica que las plántulas expuestas al metal crecieron del mismo tamaño que las testigo, un valor < 1 que las plántulas expuestas al metal crecieron menos que las plántulas testigo y un valor > 1, que las plántulas crecieron más que las plántulas testigo). Para esta especie, la inoculación de las semillas con la rizobacteria también promovió la tolerancia al metal; no mayor que la intrínseca de esta especie a cadmio. La tolerancia de F. rubra L. al metal fue mayor en el sistema radical cuando las semillas de esta especie se inocularon con la rizobactera (tabla 1).

Determinación del índice de vigor (IV) de las plántulas de las especies seleccionadas, respuesta global ante la inoculación con la rizobacteria y la exposición a cadmio
El índice de vigor (IV) expresa la relación numérica obtenida del producto de la suma de las longitudes radicales y foliares promedio por el porcentaje de germinación obtenido bajo las diferentes condiciones experimentales. Este índice finalmente asocia no solamente el éxito de la inoculación de las semillas con la rizobacteria; sino también la promoción del crecimiento, además del efecto de la exposición ante el metal pesado (tabla 2).

Los resultados obtenidos mostraron que las plántulas de A. affinis (Chase) presentaron un mayor índice de vigor ante la presencia del contaminante comparadas con las plántulas testigo promoviendo su crecimiento; mientras que para el caso F. rubra L. el vigor de las plántulas fue mayor en las semillas inoculadas y las semillas inoculadas y expuestas al metal comparadas con las plántulas testigo y las plántulas crecidas solamente bajo la presencia del metal presentaron un menor vigor.
Evaluación de la actividad enzimatica de fenoloxidasas de las raíces de A. affinis (Chase) y F. rubra L. y el efecto de la presencia de cadmio
En términos generales, la presencia del metal indujo una mayor actividad de las guaiacol peroxidasas radicales superficiales comparada con la actividad de las raíces testigo en ambas especies; así mismo, la presencia de la bacteria no solamente indujo también una mayor actividad enzimática (caso particular en F. rubra L.), sino también ante la presencia de cadmio las raíces mostraron también una mayor actividad de estas enzimas. Para las hemoperoxidasas, la mayor actividad se presentó en las raíces de A. affinis (Chase), mientras que en las raíces de F. rubra L., la actividad de estas enzimas fue menor, detectada desde las plántulas testigo. La respuesta de la mayor actividad de hemoperoxidasas en las raíces de A. affinis (Chase) fue en las raíces expuestas a cadmio, disminuyendo la actividad en las raíces de las plántulas inoculadas con la rizobacteria y finalmente en las raíces de las plántulas inoculadas y expuestas a cadmio (Figs.4a y 4b).
DISCUSIÓN
No obstante que el crecimiento tanto radical y foliar se abatió con la presencia de cadmio en las plántulas de F. rubra (Chase), para A. affinis L. se presentó un efecto promontorio tanto de la longitud del coleoptilo como de la raíz, comparadas con el testigo. La inoculación de las semillas con la rizobacteria Pseudomonas sp. Sp7D con la adición de cadmio, amortiguo el efecto de la presencia del metal, favoreciendo su crecimiento del coleoptilo y radical para las plántulas de F. rubra L., lo que también sucedió para A. affinis (Chase), pero con un crecimiento menor que las plántulas testigo, que coincide con lo reportado por Lefevre et al. (2009) para cadmio, con una ligera estimulación de la germinación y el crecimiento de las plántulas a bajas concentraciones de este metal; lo que sugiere la posible producción de especies reactivas de oxígeno (Gapper y Dolan, 2006) como efecto contrario en las plantas por el daño provocado por los metales, dando como resultado un ligero nivel de estrés oxidativo que estimula la germinación (Lefevre et al., 2009).
Se tienen diversos resultados sobre ensayos en plantas expuestas con cadmio sobre la germinación de semillas; Karahooagil (2002) reportó la germinación reducida e inhibición del crecimiento radical y las plántulas de Sorghum bicolor L., expuestas a diferentes concentraciones del metal. En particular, los resultados comparativos de Scherbatskoy et al. (1987), han reportado también que el cadmio reduce la germinación de las semillas de Lolium perenne y los de Hsu y Chou (1992) que evaluaron el efecto del cadmio empleando como fuente el 3CdSO4 • 8H20 sobre la germinación y el crecimiento de plántulas de Miscanthus floridulus, este metal fue el más tóxico para la germinación (60%) y el que presentó un efecto de menor tolerancia en sus concentraciones entre otros metales pesados probados.
Dell'Amico et al. (2008) evaluaron el efecto de la presencia de cadmio (CdCl2) sobre semillas bacterizadas de Brassica napus, para evaluar la elongación radical; la adición de Cd2+ a la concentración de 0.4mM inhibió ésta en un 24% comparada con el control, donde el efecto de promoción de las PGPR's varía dependiendo de la cepa bacteriana.
Belimov et al. (2005) también analizaron la respuesta de semillas de Brassica juncea L. Czern, inoculadas con una rizobacteria productora de AIA: Ralstonia sp. 2P-2 y expuestas a cadmio (8 liM de CdCl2), en sus resultados se presentó un efecto de promoción de la longitud radical en presencia del metal, empleando el bioensayo de la determinación de la actividad promotora de la elongación radical (Plant Root Elongation Promoting (PREP) activity) de Belimov et al. (2001). Este resultado puede asociarse con el decremento en la toxicidad de las plantas a través de la producción de algunos sustancias inmovilizadoras de metales, producidas por la bacteria. La habilidad que presentan algunas cepas de PGPR's para inmovilizar cadmio en el medio de cultivo (Belimnov et al., 2005) y en el suelo (Pishchik et al., 2002), se ha descrito previamente.
Los resultados obtenidos en este ensayo con la inoculación de las semillas de A. affinis (Chase) y F. rubra L. empleando la rizobacteria Pseudomonas sp. Sp7D, que además de producir sideróforos produce AIA, mostraron similitud con lo reportado por estos autores; ya que en relación con el porcentaje de germinación obtenido, este fue mayor en las semillas de F. rubra L. con un 10% más que las semillas germinadas en presencia de la concentración de cadmio probada.
En cuanto a la elongación radical, ésta también fue mayor para esta especie, con radículas con mayor alargamiento. Cabe mencionar también que no obstante que esta especie presentó una respuesta de crecimiento menor al testigo resultaron más tolerantes a esta concentración de cadmio que los resultados reportados.
También es importante hacer notar que los resultados en términos de las longitudes medidas para el coleoptilo y la radícula en términos del efecto de los metales pesados; éstos muestran que la respuesta pudo deberse a la presencia de inhibidores químicos a altas concentraciones del metal y con ello, su reducción en el crecimiento de las plántulas (Kumar y Singh, 1991; Fargasova, 1994: Shukla et al., 2003). Así mismo, conjuntamente dependiendo de las condiciones del crecimiento radical; éste se estimuló por el AIA producido por las PGPR's unidas a las semillas ó a las raíces (Patten y Glick, 2002; Cokkizgin y Cokkizgin, 2010). Finalmente, también es de tomarse en cuenta que los patrones de germinación pueden diferir entre especies y también entre variedades (McWilliam y Phillips, 1971); lo que se puso en evidencia con el índice de vigor mucho mayor de las semillas de F. rubra L. en tres de las cuatro condiciones probadas, comparadas con A. affinis (Chase); no obstante que ésta especie fue menos susceptible al cadmio que F. rubra L.
En este estudio, la presencia de cadmio a esta concentración en términos de la inducción de la actividad de las dos fenoloxidasas analizadas, evidenció una mayor actividad de las guaiacol peroxidasas en las dos especies de pastos probadas; en particular, bajo la presencia de cadmio, seguida de las semillas inoculadas con la rizobacteria y expuestas al metal; mientras que las hemoperoxidasas presentaron una mayor actividad en las raíces de las plantas testigo de A. affinis (Chase), seguida de las raíces de las semillas expuestas a cadmio.
Holzapfel et al. (2010) analizaron la actividad de fenoloxidasas en raíces emergentes de algunos pastos, en particular del género Bromus conocido por su gran potencial invasivo, que difiere de otros taxa de pastos. La importancia de las enzimas radicales es que destruyen compuestos fenólicos protegiendo a las plantas contra la inhibición alelopática; ya que es conocido que los compuestos fenólicos que exudan las raíces, están implicados en las interacciones alelopáticas entre las plantas.
La función de las fenoloxidasas en las raíces de Bromus, no se explicó del todo; ya que entre las hipótesis obvias sobre detoxificación (Grambow y Langenbeck-Schwich, 1983), una enzima que funciona para defender a las plantas contra compuestos tóxicos en el suelo, se espera que posea un amplio espectro de especificidad por el sustrato; así mismo, si su actividad está relacionada con la transducción de señales; esto es que la enzima forme parte de un mecanismo de detección que alerte a la planta de la presencia de compuestos fenólicos específicos, no requeriría de grandes cantidades de ésta (Bais et al., 2004). Más aún, para este propósito la enzima probablemente se localice en las puntas de las raíces (Holzapfel et al., 2010).
Cabe mencionar que la presencia del metal generó como se tiene en lo reportado, una inducción en la actividad de estas enzimas, que bien puede responder a esta condición de estrés que sea indicadora de una respuesta protectora ante las condiciones de toxicidad, lo que presentó como consecuencia una mayor longitud radical en las plántulas de A. affinis (Chase) en particular para las hemoperoxidasas y un efecto inverso de menor longitud radical y mayor actividad de guaiacol peroxidasas; en ambos casos enzimáticos, la distribución de la evidencia enzimática no solamente se dio en la zona de la cofia sino a lo largo de la longitud radical de las raíces medidas para las dos especies, no en una zona determinada de las raíces (zona apical, de elongación o de diferenciación).
CONCLUSIONES
Se han reportado diferentes índices para biomonitorear los efectos de fitotoxicidad de metales en plantas y uno de esos indicadores está basado en la germinación y desarrollo de las plántulas; así mismo, la promoción de las raíces es uno de los principales marcadores con los que se mide el efecto benéfico de las rizobacterias promotoras del crecimiento vegetal.
La bacterización de las semillas con la rizobacteria Pseudomonas sp. Sp7D en Axonopus affinis (Chase) y Festuca rubra L. reflejó tanto su potencial promotor del crecimiento en la germinación y el crecimiento de las plántulas; donde éstos fueron mayores para F. rubra L.; así como su potencial protector ante la presencia de cadmio para ambas especies; no obstante que A. affinis (Chase) mostró una respuesta sinergística con la rizobacteria, ésta especie presentó una respuesta hormética (término que se emplea para referirse a los efectos estimulantes a concentraciones bajas de agentes tóxicos) ante la presencia del metal y la tolerancia a éste, que a bajas concentraciones del metal se puede inducir un crecimiento mayor de las plantas comparadas con el testigo. Así mismo, la actividad enzimática de las guaiacol peroxidasas y las hemoperoxidasas se incrementó cuando las plántulas de ambas especies se encontraron en una condición de estrés; en este caso dada por el cadmio.
AGRADECIMIENTOS
El segundo autor agradece a la Secretaría de Investigación y Posgrado del IPN, el apoyo financiero otorgado al Proyecto SIP: 20101639, para la realización de este trabajo.
LITERATURA CITADA
Aceves, J., 1993. "GraphPad Software". GraphPad InStat, V2.03. [ Links ]
Ahmad, F.; I. Ahmad, M.S. Khan, 2008. "Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities".Microbiol. Res., 163: 173-181. [ Links ]
Arshad, N.; Wt. Jr. Frankenberger, 1998. "Plant growth regulating substances in the rhizosphere: microbial production and functions". Adv. Agron., 62: 146-151. [ Links ]
Bais , H.P.; S.W. Park, T.L. Weir, R.M. Callaway e J.M. Vivanco, 2004. "How plants communicate using the underground information superhighway". Trends Plant Sci., 9: 26-32. [ Links ]
Baki, A.A.; J.D. Anderson, 1973. "Vigour determination in soybean by multiple criteria". Crop Sci., 13: 630-633. [ Links ]
Barceló, J.; C. Poschenrieder, 1990. "Plant water relations as affected by heavy metals: a review". J. Plant Nutr.,13: 1-37. [ Links ]
Belimov, A.A.; V.I. Safronova, T.A. Sergeyeva, T.N. Egorova, VA. Matveyeva, V.E. Tsyganov, A.Y. Borisov, I.A. Tikhonovich, C. Kluge, A. Preisfeld, K.J. Dietz, V.V. Stepanok, 2001. "Characterization of plant growth-promoting rhizobacteria isolated from polluted soils and containing 1-amino-cyclopropane 1-carboxylate deaminase". Can. J. Microbiol., 47: 642-652. [ Links ]
Belimov, A.A.; N. Hontzeas, V.I. Safronova, S.V. Demchinskaya, G. Piluzzac, S. Bullittac, B.R. Glick, 2005. "Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.)". Soil Biol. Biochem., 37: 241-250. [ Links ]
Burd ,G.I.; D.G. Dixon, B.R. Glick, 1998. "A plant growth-promoting bacterium that decreases nickel toxicity in seedlings". Appl. Environ. Microbiol., 64: 3663-3668. [ Links ]
Cho, U.; J. Park, 2000. "Mercury-induced oxidative stress in tomato seedlings". Plant Sci., 156: 1-9. [ Links ]
Clijtsters, H.; F. Van Assche, 1985. "Inhibition of photosynthesis by metals". Photosynth. Res., 7: 31-40. [ Links ]
Cokkizgin, A.; H. Cokkizgin, 2010. "Effects of lead (PbCl2) stress on germination of lentil (Lens culinaris Medic.) lines". Afr. J. Biotechnol., 9: 8608-8612. [ Links ]
Dell'Amico, E.; L. Cavalca, V. Andreoni, 2008. "Improvement of Brassica napus growth under cadmium stress by cadmium-resistant rhizobacteria". Soil Biol. Biochem., 40: 74-84. [ Links ]
Dowling, D.N.; S.L. Doty, 2009. "Improving phytoremediation through biotechnology". Curr. Opin. Biotech., 29: 1-3. [ Links ]
Epelde, L.; J.M. Becerril, O. Barrutia, J.A. González-Oreja, C. Garbisu, 2010. "Interactions between plant and rhizosphere microbial communities in a metalliferous soil". Environ. Pollut., 158: 1576-1583. [ Links ]
Fargasova, A., 1994. "Effect of Pb, Cd, Hg, As and Cr on germination and root growth of Sinapis alba seeds". B. Environ. Contam. Tox., 52: 452-456. [ Links ]
Frankenberger, Wt. Jr. ; M. Arshad, 1995. Phytohormones in soil: microbial production and function. N.Y., USA Marcel Dekker, Inc. [ Links ]
Gapper, C.; L. Dolan, 2006. "Control of plant development by reactive oxygen species". Plant Physiol., 141: 341-345. [ Links ]
Geebelen,W.; J. Vangronsveld, D.C. Adriano, L.C. Van Poucke, H. Clijsters, 2002. "Effects of Pb-EDTA and EDTA on oxidative stress reactions and mineral uptake in Phaseolus vulgaris". Physiology Plant., 115: 377-384. [ Links ]
Glick, B.R.; D.M. Karaturovic, P.C. Newell, 1995. "A novel procedure for rapid isolation of plant growth promoting pseudomonads". Can. J. Microbiol., 41: 533-536. [ Links ]
Grambow, H.J.; B. Langenbeck-Schwich, 1983. "The relationship between oxidase activity, peroxidase activity, hydrogen peroxide, and phenolic compounds in the degradation of indole-3-acetic acid in vitro". Planta, 157: 132-137. [ Links ]
Hart, J.J.; R.M.Welch, W.A. Norvell, L.A., Sullivan, L.V. Kochian,1998. "Characterization of Cd binding, uptake and translocation in intact seedlings of bread and durum wheat cultivars". Plant Physiol., 116: 1314-1420. [ Links ]
Hendry, G.A.F.; J. P. Grime, 1993. Methods in comparative plant ecology. Willey & Sons,Co. [ Links ]
Holzapfel, C.; P. Shahrokh,, D. Kafkewitz, 2010. "Polyphenol oxidase activity in the roots of seedlings of Bromus (Poaceae) and other grass genera". Am. J. Bot., 97: 1-5. [ Links ]
Hsu, F.H.; Ch.H. Chou,1992. "Effects of heavy metals on seed germination and seedling growth of Miscanthus species". Bot. Bull. Acad. Sci., 33: 335-342. [ Links ]
Karahooagil, P., 2002. Agricultural Economics Research Institute, 1:5, Ankara. [ Links ]
Kiran, Y.; A. §ahin, 2006. "The effects of cadmium on seed germination, root development and mitotic of root tip cells of Lentil (Lens culinaris Medik)". World J. Agric. Sci., 2: 196-200. [ Links ]
Kloepper, J.W.; R. Lifshitz, R.M. Zablotowicz, 1989. "Free-living bacterial inocula for enhancing crop productivity". Trends Biotechnol., 7: 39-43. [ Links ]
Koo, S.Y.; S.H. Hong, H.W. Ryu, K. Cho, 2010. "Plant Growth-Promoting trait of rhizobacteria isolated from soil contaminated with petroleum and heavy metals". J. Microbiol. Biotechnol., 20: 587-593. [ Links ]
Kranner, I.; L. Colville, 2011. "Metals and seeds: Biochemical and molecular implications and their significance for seed germination". Environ. Exp. Bot.,72: 93-105. [ Links ]
Kumar, G.; R.P. Singh,1991. "Nitrate assimilation and biomass production in Sesamum indicum L. seedlings in a lead enriched environment". Water Air Soil Poll., 66: 163-171. [ Links ]
Lavid, N.; A. Schwartz, O. Yarden, E. Tel-Or, 2001. "The involvement of polyphenols and peroxidase activities in heavy-metal accumulation by epidermal glands of the waterlily (Nymphaeaceae)". Planta, 212: 323-331. [ Links ]
Lefevre, I.; G. Marchal, E. Correal, A. Zanuzzi, S. Lutts, 2009. "Variation in response to heavy metals during vegetative growth in Dorycnium pentaphyllum Scop". Plant Growth Regul., 59: 1-11. [ Links ]
Li, W.Q.; M.A. Khan, S. Yamaguchi, Y. Kamiya, 2005. "Effects of heavy metals on seed germination and early seedling growth ofArabidopsis thaliand". Plant Growth Regul., 46: 45-50. [ Links ]
McWilliam, J.R.; P.J. Phillips, 1971. "Effect of osmotic and matric potentials on the availability of water for seed germination". Aust. J. Biol. Sci., 24: 423-431. [ Links ]
Mhatre, G.N.; S.B. Chaphekar, 1982. "Effect of heavy metals on seed germination and early growth". J. Environ. Biol., 3: 53-63. [ Links ]
Passardi, F.; C. Cosio, C. Penel, C. Dunand, 2005. "Peroxidases have more functions than a Swiss army knife". Plant Cell Rep., 24: 255-265. [ Links ]
Patten, C.L.; B.R. Glick, 2002. "The role of bacterial indoleacetic acid in the development of the host plant root system". Appl. Environ. Microb., 68: 3795-3801. [ Links ]
Pishchik, V.N.; N.I. Vorobyev, I.I. Chernyaeva, S.V. Timofeeva, A.P. Kozhemyakov, Y.V. Alexeev, S.M. Lukin, 2002. "Experimental and mathematical simulation of plant growth promoting rhizobacteria and plant interaction under cadmium stress". Plant Soil., 243: 173-186. [ Links ]
Ruiz, J.M.; B. Blasco, J.J. Ríos, L.M. Cervilla, M.A. Rosales, M.M. Rubio-Wilhelmi, E. Sánchez-Rodríguez, R. Castellano, L. Romero, 2009. "Distribución y eficiencia de la fitoextracción de cadmio por diferentes quelatos orgánicos". Terra Latinoamericana, 27: 295-301. [ Links ]
Scherbatskoy, T.R.; M.G. Klein, J. Badger, 1987. "Germination response of forest tree seed to acidity and metal ions". Environ. Exp. Bot., 27: 157. [ Links ]
Schützendübel, A.; A. Polle, 2002. "Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by micorrhization". J. Exp. Bot., 53: 1351-1365. [ Links ]
Sheng, X.F.; J.J. Xia, 2006. "Improvement of rape (Brassica napus) plant growth and cadmium uptake by cadmium-resistant bacteria". Chemosphere., 64: 1036-1042. [ Links ]
Shukla, A.K.; S. Prasad, S.K. Srivastava, S.P. Singh, R.P. Singh, 2003. "Allelopathic effect of thatch grass (Imperata cylindrica L.) on various Kharif and Rabi season crops and weeds". Indian J. Weed Sci., 35: 163-166. [ Links ]
Smiri, M., Chaoui, A., Rouhier, N., Gelhaye, E., Jacquot, J.P., Ferjani, E., 2010. "Oxidative damage and redox change in pea seeds treated with cadmium". Comp. Rendus Biolog., 333: 801-807. [ Links ]
Vásquez-Murrieta, M.S., I. Migueles-Garduño, O. Franco-Hernández, B. Govaerts, L. Dendooven, 2006. "C and N mineralization and microbial biomass in heavy metal-contaminated soil". Eur. J. Soil Biol., 42: 89-98. [ Links ]
Volkmar, K.M.; E. Bremer, 1998. "Effects of seed inoculation with a strain of Pseudomonas fluorescens on root growth and activity of wheat in well-watered and drought-stressed glass-fronted rhizotrons". Can. J. Plant Sci., 78: 545-551. [ Links ]
Wilkins, D.A., 1978. "The measurement of tolerance to edaphic factors by means of root growth". New Phytol., 80: 623-633. [ Links ]
Zhuang, X.; J. Chen, H. Shim, Z. Bai, 2007. "New advances in plant-growth-promoting rhizobacteria for bioremediation". Environ. Int., 33: 406-413. [ Links ]
*Becarios de la Comisión de Operaciones y Fomento de Actividades Académicas (COFAA-IPN).
**Dirección actual: Probiomed, SA de CV














