Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.31 México mar. 2011
Bioprospección de la actividad antimicótica de extractos metanólicos de Ariocarpus kotschoubeyanus y Ariocarpus retusus
Bio-prospecting for antifungal activity of methanolic extracts of Ariocarpus kotschoubeyanus and Ariocarpus retusus
R.G. Rodríguez-Garza1, G.M. González-González2, M.J. Verde-Star1, M.E. Morales- Rubio1, C. Rivas-Morales1, A. Oranday-Cárdenas1, M.A. Núñez-González1 y J.F. Treviño-Neávez1
1 Depto. de Biología Celular y Genética, Facultad de Ciencias Biológicas. Universidad Autónoma de Nuevo León. Tel. y Fax: (81) 83-29-41-10 ext. 6468.
2 Centro Regional de Control de Enfermedades Infecciosas, Facultad de Medicina. Universidad Autónoma de Nuevo León. Tel. y Fax: (81) 83-29-41-10 ext. 6468.
Correspondencia:
qbp_fcb@yahoo.com.mx
Recibido: 12 febrero 2010.
Aceptado: 5 octubre 2010.
Resumen
Se determinó la actividad antifúngica in vitro de extractos metanólicos de Ariocarpus kotschoubeyanus y Ariocarpus retusus, plantas xerófitas del noreste del país, usadas en la medicina tradicional, sobre los hongos dermatofitos Trichophyton tonsurans, Microsporum canis y Microsporum cookei. Los metabolitos presentes se identificaron por tamizaje fitoquímico empleando pruebas para grupos funcionales, la determinación de actividad antifúngica se realizó por el método de difusión en placa empleando microdiscos, con la finalidad de entender la química y eficacia de estos productos vegetales, las dosis evaluadas de estos extractos fueron 125, 250 y 500 mg/mL. Los extractos resultaron positivos para grupos carbonilo, oxidrilos fenólicos, esteroles y metilesteroles, cumarinas, sesquiterpenlactonas, saponinas, flavonoides y alcaloides. El extracto que presentó mayor actividad fue el de Ariocarpus retusus (tallo) contra Trichophyton tonsurans y Microsporum cookei. El análisis estadístico de varianza univariante reveló que en cuanto a la actividad antifúngica, existe diferencia significativa entre hongos, medios de cultivo y dosis evaluadas de los extractos con respecto al control positivo de ketoconazol. Estos resultados sirvieron para validar el conocimiento empírico que se tiene acerca de estas plantas en la medicina tradicional. Siendo estos estudios una base para nuevas investigaciones sobre la búsqueda de compuestos bioactivos y el descubrimiento de medicamentos potenciales de productos herbales.
Palabras clave: tamizaje fitoquímico, actividad antifúngica, extractos metanólicos, Ariocarpus, xerófitas.
Abstract
The antifungal activity of methanolic extracts from Ariocarpus kotschoubeyanus and A. retusus, two native xerophytes of northeastern Mexico, was determined on the fungal dermatophytes Trichophyton tonsurans, Microsporum canis and Microsporum cookei. Putative active metabolites were identified by phytochemical screening using evidence for functional groups; determination of antifungal activity was conducted by the disk-diffusion plate method as part of the process of understanding the chemistry and efficacy of these plant products. Doses tested were 125, 250 y 500 mg/mL. Extracts were positive for carbonyl groups, phenolic oxhidrils, sterols and methyl sterols, coumarins, sesquiterpenlactones, saponins, flavonoids and alkaloids. Extract from A. retusus (stem) yielded the greatest activity against Trichophyton tonsurans and Microsporum cookei. Univariate analysis of variance revealed that with regard to antifungal activity there were significant differences between fungi, culture media and analyzed doses with respect to positive control of ketoconazole. These results served to validate empirical knowledge about these plants in traditional medicine. These studies form a basis for further research in the search for bioactive compounds and the discovery of potential herbal medicaments.
Key words: phytochemical screening, antifungic activity, methanolic extracts, Ariocarpus, xerophytes.
INTRODUCCIÓN
El fácil acceso y el uso inapropiado de fármacos para combatir las infecciones causadas por microorganismos patógenos, facilita la selección, persistencia y diseminación de microorganismos resistentes (Manzano et al., 2008). En las últimas décadas se ha observado un incremento notable en las infecciones causadas por hongos, debido probablemente a la resistencia de éstos a los diferentes antimicóticos que se utilizan en la práctica médica. Esta situación ha llevado a la búsqueda de nuevos antifúngicos de origen natural (Mesa et al., 2004).
Las micosis cutáneas son causadas por un grupo de hongos llamados dermatofitos que se han especializado evolutivamente en la explotación de la queratina, estando presentes en animales y en el humano (Carrillo et al., 2004). Estos hongos representan más de 40 especies clasificadas en tres géneros: Microsporum, Trichophyton y Epidermophyton (Freedberg et al., 1999; Arenas, 1993). Actualmente, en México, las dermatofitosis constituyen del 70-80% de todas las micosis y tienen una frecuencia del 20-25% en la consulta dermatológica (Arenas, 2002).
La farmacoterapia eficaz contra los hongos plantea problemas especiales; dado que éstos pertenecen a los eucariotes, por lo que la mayor parte de su maquinaria celular es similar a la del hombre y los animales, por lo que los agentes farmacológicos que afectan rutas metabólicas en hongos a menudo interfieren con las correspondientes rutas en las células hospederas, de ahí la toxicidad de estos medicamentos (Manzano et al., 2008).
Entre los fármacos utilizados para tratar diferentes tipos de micosis se encuentran el ketoconazol, itraconazol, terbinafina, nitrato de miconazol, tolnaftato, clotrimazol (Madigan et al., 2004); no obstante la aparición de cepas resistentes, en México se presenta ya como un problema emergente, hecho que justifica la búsqueda de nuevos medicamentos sintéticos o naturales para el control de dichas enfermedades (Manzano et al., 2008). Las plantas sintetizan dos tipos de metabolitos: los primarios, esenciales para su crecimiento y desarrollo; los secundarios que son aquellos derivados del metabolismo primario de las plantas y que les aportan diferentes propiedades, en este grupo tenemos los flavonoides, alcaloides, aceites esenciales, glucósidos, saponinas y taninos; las propiedades medicinales, como lo es la actividad antifúngica de algunas plantas se debe principalmente a estos compuestos (Phillipson, 1994).
En la actualidad se dispone de variados agentes antimicóticos que se han obtenido de algunas plantas, los cuales han sido evaluados tanto in vitro como in vivo, mostrando resultados favorables, tal es el caso de la planta Malaleuca alternifolia, de donde se obtiene el aceite esencial del árbol del té (tea tree oil), un fitofármaco que ha mostrado actividad antimicótica por la acción directa de los componentes activos, terpinen-4-ol y 1,8-cineol, a una concentración que varía del 29 al 45% y del 4.5 al 16.5% respectivamente, contra las estructuras de las membranas celulares, no sólo en hongos sino también en bacterias. El aceite se utiliza para el tratamiento de infecciones en la piel por hongos de los géneros Candida y Malassezia, y en las onicomicosis causadas por dermatofitos (Carson et al., 2001).
En los extractos alcohólicos, los aceites esenciales y los compuestos de naturaleza sulfúrica aislados de los bulbos del ajo (Allium sativum) se ha demostrado un importante efecto antimicótico, atribuido a los componentes activos alicina y ajoeno, sobre especies de los géneros Candida, Malas-sezia, Cryptococcus y Aspergillus, así como contra especies de dermatofitos y el hongo Paracoccidioides brasiliensis. La alicina, aunque es efectiva, ve limitado su uso por su inestabilidad; en contraste, el ajoeno, producto de la degradación de la alicina, es un compuesto más estable y la formulación tópica para el tratamiento de tinea pedis, cruris y corporis ha mostrado resultados considerables (Ledezma et al., 2000).
Moléculas producidas por las plantas como las fitodefensinas, de naturaleza peptídica y ricas en cisteína, tienen la capacidad de inhibir el crecimiento de hongos al producir en ellos cambios morfológicos y daño en algunas de sus estructuras celulares (De Lucca et al., 2000).
Ruiz et al. (2009), reporta que en cuanto a la actividad antibacteriana y antifúngica de los extractos metanólicos de las plantas Amphypteringium adstrigens, Castella tortuosa, Coutarea latiflora, Ibervillea sonorae, Jatropha cuneata y Selaginella lepidophylla, usadas en México en la medicina tradicional, sólo el extracto metanólico de Jatropha cuneata, mostró una completa inhibición antibacteriana sobre S. flexneri a una concentración de 90 Lig/mL, empleando el método de microdilución en caldo y una marcada actividad antifúngica sobre el crecimiento de Fusarium verticillioides y Aspergillus niger con el ensayo de inhibición del crecimiento radial.
Las plantas de zonas desérticas, por el tipo de hábitat en el que se desarrollan (estrés hídrico y altas temperaturas) producen una gran variedad de metabolitos secundarios, mismos que presentan amplios usos, por lo que en épocas recientes, el estudio de las plantas xerófitas ha cobrado importancia; en un estudio realizado con Stenocereus pruinosus (Cactácea) se demostró la actividad antifúngica del extracto metanólico contra Tricophyton tonsurans, Tricophyton mentagrophytes, Microsporum canis, Mi-crosporum gypseum y Microsporum cookei (Maldonado et al., 2009), por otro lado, Morales et al. (2007) reportan actividad bactericida y citotóxica de extractos de Lophocereus schottii.
En la presente investigación se evaluó la actividad antifúngica de las especies Ariocarpus kotschoubeyanus y Ariocarpus retusus (familia Cactácea), plantas de hábitat desértico que han sido empleadas en la medicina tradicional en ciertos padecimientos infecciosos, lo que permitirá validar científicamente su uso, figura 1.

MATERIAL Y MÉTODOS
Material biológico
Plantas: Ariocarpus kotschoubeyanus y Ariocarpus retusus.
Hongos dermatofitos: Trichophyton tonsu-rans, Microsporum canis y Microsporum cookei.
Colecta de material vegetal
La recolección de las especies se realizó con el permiso de la Corporación para el Desarrollo Agropecuario de Nuevo León Oficio N° 139.0.DDR2.22 (2006). Ariocarpus kotschoubeyanus se colectó en el municipio de Mina, Nuevo León y Ariocarpus retusus se colectó en el ejido El Potosí del municipio de Galena, Nuevo León, en el mes de junio del 2006. Los ejemplares fueron identificados por el doctor Marco Antonio Guzmán Lucio del Laboratorio de Fanerógamas, ya secos y montados fueron depositados en el Herbario de la Facultad de Ciencias Biológicas UANL, el cual extendió el registro correspondiente, para la especie: Ariocarpus retusus núm. 025523 y Ariocar-pus kotschoubeyanus núm. 025522.
Extracción del material vegetal
La extracción del material vegetal se llevó a cabo primero lavando el material vegetal para eliminar el exceso de tierra y partículas extrañas que se pudieran presentar, después las plantas se cortaron en trozos pequeños, para posteriormente secarse en un horno (Despatch Termostato de 20-550°C) a 40°C, para después triturarse en un molino (Wiley). Se utilizaron plantas adultas de ambas especies. Posteriormente, se tomaron 100 g de cada especie y se depositaron por separado en un matraz Erlenmeyer de 500 mL y se le adicionaron 300 mL de metanol (CTR Scientific), se sellaron herméticamente para evitar evaporación del solvente durante la extracción, se dejaron en agitación constante por siete días en un agitador (Dual Action Shaker Lab-Line). Una vez transcurrido el tiempo de la extracción el solvente se separó del resto de la muestra mediante filtración en papel Wathman núm.1 (Whatman International Ltd. England), obteniendo de esta manera los extractos libres de residuos, los cuales fueron desgrasados con hexano (CTR Scientific) y se evaporaron hasta sequedad a presión reducida en un rotaevaporador (Büchi 461) a 40°C y 60 rpm, con el fin de agilizar la evaporación (Cannel, 1998).
Métodos químicos para la identificación de grupos funcionales
Para la determinación inicial de los compuestos presentes en los extractos, se realizaron pruebas químicas de identificación (Domínguez, 1979). Las soluciones de los extractos se prepararon a una concentración de 50 mg/mL disueltos en metanol (CTR Scientific). Se utilizaron placas de cerámica de 12 pozos para las reacciones. Las pruebas realizadas fueron las siguientes: Prueba del KMnO4 para insaturaciones. Disolver 1-2 mg de la muestra en 1 mL de metanol, se añade gota a gota una solución de KMnO4 al 2% en agua. La prueba es positiva si se observa decoloración o formación de precipitado café, resultado de la formación de dióxido de magnesio. Prueba de la 2,4-dinitrofenilhidracina para grupo carbonilo. Disolver 1-2 mg de la muestra en metanol, se le añade una solución saturada de 2,4-dinitrofenilhidracina en HCl 6N, la formación de un precipitado amarillo o naranja indica la presencia del grupo carbonilo. Prueba del FeCl3 para oxidrilos fenólicos. Disolver 1-2 mg de la muestra en 1 mL metanol, después se añaden unas gotas de FeCl3 al 12.5% en agua. La aparición de un precipitado rojo, azul-violeta o verde es considerado positivo. Prueba de Salkowski para esteroles y triterpenos. Disolver 1-2 mg del extracto con 1 mL de ácido sulfúrico, colores amarillo o rojo para esteroles y metilesteroles. Prueba de las coumarinas. Disolver 1-2 mg de muestra en NaOH al 10%, si aparece una coloración amarilla que desaparece al acidular es positiva. Solución alcohólica de hidróxido de sodio al 10%, para lactonas. Disolver 1-2 mg de muestra en solución alcohólica de NaOH al 10%. Un color amarillo o anaranjado que se pierde o desaparece al agregar unas gotas de HCl indica la presencia de un anillo lactónico. Prueba de Baljet para sesquiterpenlactonas. Disolver 1-2 mg del extracto, agregar 3-4 gotas de la solución mezcla, siendo positiva si se torna de color naranja a roja oscura. Prueba del H2SO4 para flavonoides. Disolver 1-2 mg de la muestra en H2SO4, si se observa coloración amarilla indica la presencia de flavonoles, naranja-guinda para flavonas, rojo-azuloso para chalconas y rojo-púrpura para quinonas. HCl 2N en propanol-1 para leucoantocianinas. Disolver 1-2 mg de muestra con HCl 2N en propanol-1, durante 15 a 30 minutos. La aparición lenta de una coloración roja o violeta se considerará positiva. Prueba de Dragendorff para alcaloides. Disolver 1-2 mg de muestra, añadir 2 a 3 gotas de los reactivos A (nitrato de bismuto y ácido acético glacial) y B (yoduro de potasio), la aparición de una coloración naranja a rojiza, se considera positiva. Prueba del bicarbonato de sodio 10% para saponinas. Disolver 1-2 mg de la muestra metanol, se le agregan de 2-3 gotas de ácido sulfúrico concentrado. Se agita ligeramente. Luego se agregan 2-3 gotas de la solución de bicarbonato de sodio. La aparición de burbujas y su permanencia por más de un minuto indican la presencia de saponinas. Prueba de Salkowski para saponinas. Disolver 1-2 mg de la muestra en 1 mL de cloroformo, se añade 1 mL de ácido sulfúrico. La prueba es positiva si hay aparición de color rojo. Prueba de H2SO4 y formaldehído para aromaticidad. Mezclar 1 mL de ácido sulfúrico concentrado con una gota de formaldehído y agregar a 1 mg de la muestra, si aparece un color rojo-violeta, es positiva la prueba (Harborne, 1998).
Cultivo y estandarización celular de las cepas de hongos dermatofitos
Las cepas de hongos dermatofitos empleadas para el estudio (Trichophyton tonsurans, Microsporum canis, Microsporum cookei), fueron aislados clínicos de pacientes, las cuales fueron cultivadas en agar papa dextrosa (PDA) de siete a 14 días a 30°C, proporcionadas por el Centro Regional de Control de Enfermedades Infecciosas de la Facultad de Medicina de la UANL.
Para obtener las suspensiones de inóculo se utilizaron cultivos puros obtenidos a partir del crecimiento de siete a 14 días en medio de agar papa dextrosa (PDA-DIFCO) a 30°C. Se emplearon colonias maduras para obtener por arrastre de la superficie con 2 mL de solución salina 0.85% de NaCl (CTR Scientific) y Tween (Fisher Scientific) al 80% los elementos fúngicos que serán usados como inóculo. Posteriormente, la suspensión de conidios y fragmentos de hifas se retiraron con la ayuda de una pipeta y fue transferida a tubos de vidrio estériles. Las partículas pesadas se retiraron por precipitación (1520 minutos a temperatura ambiente) y el sobrenadante fue homogeneizado con un vortex mixer (Daigger Genie 2) durante 15 segundos. Se ajustó la turbidez del sobrenadante con solución salina hasta 0.5 del nefelómetro de Mc Farland, correspondiente a una transmitancia del 68% a 70% medida a 530 nm de longitud de onda (Espectrofotómetro Spectronic Genesys 5). Se obtuvieron y utilizaron recuentos de 1 x 106 UFC/mL en placa de PDA tras incubar siete días a 30°C, para validar el ensayo, la presencia de Tween (Fisher Scientific) en la solución salina, permitió obtener con mayor facilidad una suspensión de inóculo homogénea, previa observación al microscopio. Tras agitar los tubos con las suspensiones de conidias ya homogeneizadas, se tomó un inóculo de 100 liL y se sembró en tres direcciones en agar papa dextrosa (PDA-DIFCO) y agar Mueller Hinton por triplicado y se dejó secar durante 20 a 30 minutos, posteriormente se colocaron los discos impregnados con los extractos y se incubaron de siete a 14 días a 30°C (Cermeño y Torres, 1998; Carrillo et al., 2004 y Ruiz et al., 2009).
Preparación de los extractos para ensayo de actividad antifúngica
Se pesó el equivalente a 125, 250 y 500 mg/ mL de cada uno de los extractos metanólicos y se disolvieron en 1 mL de metanol (CTR Scientific). Las soluciones de prueba se esterilizaron por filtración con membranas de 0.25 m (filtro Milipore). Cada disco de papel Whatman núm. 1 (Whatman International Ltd. England) estéril de 6 mm de diámetro, se cargó con 10 μL de cada extracto metanólico correspondiente (carga final por disco 1.25, 2.5 y 5 mg, respectivamente). Para el control positivo se pesó el equivalente a 10 μg de ketoconazol (recetario magistral) puro y se disolvió en 1600 μ L de metanol destilado al 98% para obtener una concentración de 6.25 x 10-3 μg/ μL. Cada disco de papel Whatman núm. 1 (Whatman International Ltd. England) estéril, se cargó con 10 μL de la solución (carga final por disco 6.25 x 10-2μ g/ μL. Los halos de inhibición se midieron en centímetros. Para el control negativo se utilizó metanol al 98% de pureza (Carrillo et al., 2004).
RESULTADOS
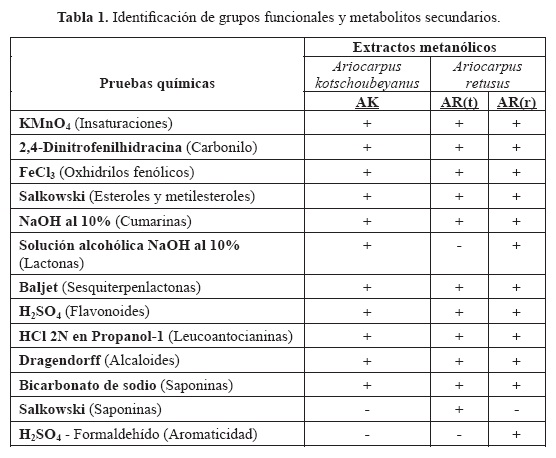
En la tabla 1 se muestran los resultados de las pruebas químicas para grupos funcionales y metabolitos secundarios presentes en los extractos metanólicos de las especies evaluadas. Se encontró la presencia de insaturaciones, grupos carbonilo, oxhidrilos fenólicos, esteroles y metilesteroles, cumarinas, saponinas, sesquiterpenlactonas, flavonoides y alcaloides en los extractos; la prueba de Salkowski para saponinas fue positiva sólo en el extracto de A. retusus (tallo), Solamente se encontraron grupos aromáticos en el extracto de A. retusus (raíz).
En la tabla 2 se muestran los resultados de la actividad antifúngica de los extractos de A. kotschoubeyanus, A. retusus (tallo) y A. retusus (raíz). El extracto que presentó mayor actividad antifúngica a una dosis de 500 mg/mL fue A. retusus (tallo). Como control positivo se utilizó ketoconazol y como control negativo se utilizó metanol. La actividad antifúngica se midió en cm, figura 2.
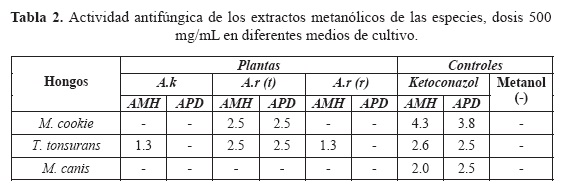


Con base en los resultados obtenidos para A. retusus (tallo), se decidió probar estos extractos a las dosis 125 y 250 mg/mL, encontrándose actividad solamente en M. cookie y T. tonsurans (tabla 3), figura 2.

Análisis de varianza univariante relación hongos, extractos y medios de cultivo
Con el propósito de comparar la diferencia de los halos de inhibición (tratamiento-control) con base en los extractos, se realizó un análisis de varianza de dos vías (extractos y medios), con una hipótesis nula de igualdad de medias de dichas diferencias para cada factor y la interacción de ambos. Habiéndose encontrado que la hipótesis se rechaza, posteriormente se aplicó la prueba de Tukey para determinar entre qué pares de medias existe las diferencia significativa. En la tabla 4 se presentan los resultados de tales pruebas.
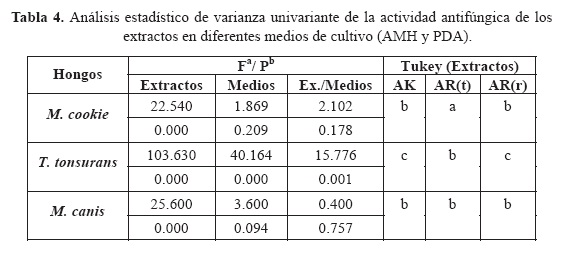
En la prueba de Tukey las letras diferentes marcan diferencia significativa (P < 0.05).
DISCUSIONES
Las plantas evaluadas en este estudio fueron seleccionadas con base en diferentes criterios: 1) por sus características etnofarmacológicas; 2) por su distribución en el estado de Nuevo León y 3) por consideración a reportes previos de actividad antifúngica de otras especies de esta familia (Maldonado et al, 2009 y Morales et al, 2007).
Los extractos metanólicos de A. kotschobeyanus y A. retusus, presentaron diversos compuestos de los tres grupos principales, en donde Kuklinski (2000) clasifica a los metabolitos secundarios, isoprenoides: terpenos, saponinas; derivados fenólicos: fenoles y ácidos fenólicos, flavonoides, antocianinas y alcaloides.
Maldonado (2009) menciona que en los extractos metanólicos de las especies Stenocereus pruinosus, A. kotschoubeyanus y E. stramineus, de la familia (Cactácea), las pruebas para grupos funcionales indicaron la presencia de insaturaciones, oxidrilos fe-nólicos, alcaloides y antioxidantes, lo cual es comparable con los resultados obtenidos en este trabajo, en donde también se encuentran presentes este grupo de compuestos, al igual que Garza et al. (2004) obtuvieron extractos con solventes de polaridad creciente del "nopal estrella" Acanthocereus occidentalis y realizaron un estudio fitoquímico que indicó la presencia de insaturaciones, oxidrilos fenólicos, esteroides, triterpenos, carbohidratos, sesquiterpenlactonas, flavonas y alcaloides.
Morales et al. (2004) encontraron que la pitaya agria, cactácea que se distribuye en Baja California y en la costa de Sonora, presenta diversos usos en la medicina tradicional para combatir algunas enfermedades como úlceras y diversos tipos de cáncer. Obtuvo extractos de polaridad creciente a partir de tallos y frutos. Los resultados del estudio fitoquímico de los tallos, indicaron la presencia de compuestos como: esteroles, carbohidratos, sesquiterpenlactonas, flavonas y alcaloides; mientras que en los frutos se encontraron flavonas y leucoantocianinas (antioxidantes naturales), saponinas y alcaloides, concluyendo que estos compuestos pueden ser una alternativa para ser utilizados en la industria alimentaria, cosmetológica y farmacéutica.
Maldonado et al., 2009, menciona que el extracto metanólico de Stenocereus pruino-sus (Cactácea) presentó actividad fungicida sobre hongos dermatofitos; en el presente trabajo, A. retusus (Cactácea) tiene actividad antifúngica en la dosis más baja 125 mg/mL sobre el crecimiento de Microsporum cookei y Trichophyton tonsurans, esta actividad podría estar relacionada a la presencia de saponinas en el extracto, se sabe que estas moléculas han mostrado diversas actividades biológicas como antimicrobianos, antitumorales, citotóxicos, ictiotóxicos, molusquicidas, antihelmínticos, espermicidas, antiinflamatorios y antihepatotóxicos (Okazaki et al, 2007).
El análisis estadístico de varianza univariante para la actividad de los hongos dermatofitos reveló que en cuanto a la actividad de los extractos con respecto a las cepas probadas de hongos, existe diferencia significativa entre hongos y dosis evaluadas de los extractos con respecto al control positivo de ketoconazol. Además de que existe diferencia significativa en cuanto a los medios utilizados (AMH y APD). Con respecto a las cepas de hongos probadas, y en cuanto a la relación de extractos contra medios y hongos se observó que solamente T. tonsurans muestra diferencia significativa entre los medios, los extractos y las cepas probadas. Las diferentes especies de hongos dermatofitos crecieron en agar Mueller Hinton en un tiempo menor que en el agar papa dextrosa.
CONCLUSIONES
La naturaleza es fuente de una amplia variedad de moléculas bioactivas que podrían ser utilizadas como base para el diseño y la formulación de nuevas generaciones de medicamentos con el fin de solucionar diversos problemas de salud. El objetivo para esta búsqueda debe ser el descubrimiento de fármacos con mayor espectro, menos efectos secundarios y un menor costo que los medicamentos actuales. Se debe pensar en llevar a cabo estudios de bioprospección que, a largo plazo, contribuyan al mejoramiento del arsenal de fármacos antimicóticos disponibles.
Con base en los resultados obtenidos, el extracto de A. retusus (tallo) puede ser una alternativa para la obtención de fitofármacos como antifúngicos. Se requiere seguir con estudios para la elucidación estructural de los metabolitos activos.
AGRADECIMIENTOS
Al apoyo del Consejo Nacional de Ciencia y Tecnología CONACYT. Becario núm. 191639.
LITERATURA CITADA
Arenas, R., 1993. Micología Médica Ilustrada Dermatofitosis, Interamericana-McGraw-Hill: México, pp. 57-52. [ Links ]
Arenas, R., 2002. "Dermatofitosis en México". Rev. Iberoam. de Micol., México DF (12), pp. 63-67. [ Links ]
Cannel, R.J.P., 1998. "Methods in Biotechnology. Natural Products Isolation". Glaxo Wellcome & Development, Stevenage, UK. Humana Press Inc. Totowa, N.J. Vol. 4: 1-285. [ Links ]
Carrillo, M.A.J., Santos, P. Del Valle O., Casals, J.B. y Quindós, G., 2004. "¿Es activa la amfotericina B frente hongos dermatofitos y Scopulariopsis brevicaulis? Rev Esp de Quimioterap, 17(3): 244-249. [ Links ]
Carson, C.F., Riley, T.V., 2001. "Safety, efficacy and provenance of tea tree (Malaleuca alternifolia) oil". Contact Dermatitis, 45: 65-67. [ Links ]
Cermeño, VJ., Torres, R.J., 1998. "Método espectrofotométrico en la preparación del inóculo de hongos dematiáceos". Rev. Iberoam. de Micol., 15: 155-157. [ Links ]
De Lucca, A., Walsh, T., 2000. "Antifungal peptides: Origin, activity, and therapeutic potential". Rev. Iberoam. de Micol., 17: 116-120. [ Links ]
Domínguez, X.A., 1979. Fitoquímica. 1a ed., Editorial Limusa. México, DF, pp. 94. [ Links ]
Domínguez, S.X.A., Rojas, M.G.N., De Lara, A.G., 1969. "Estudio químico preliminar de 31 cactáceas". Rev Soc Quim, Méx., 13: 8-12. [ Links ]
Freedberg, I.M., Eisen, A.Z., Wolff, K., Austen, K.F., Goldsmith, L.A. y Katz, S., 1999. "Fitzpatrick's Dermatology in General Medicine". McGraw-Hill. Washington DC. [ Links ]
Garza Padrón, R.A., M.E. Morales Rubio, A. Oranday, J.F. Treviño Neávez., 2004. "Preliminares fitoquímicos del "bajinco" o "nopal estrella", Acanthocereus occidentalis Britton and Rose". Revista Salud Pública y Nutrición (RESPYN). UANL. Edición Especial No. 1. [ Links ]
Harborne, J.B., 1998. Phytochemical Methods a guide to modern techniques of plant analysis. 3a ed. Chapman & Hall, London, pp. 1-32. [ Links ]
Kuklinski, C., 2000. Farmacognosia. Estudio de las drogas y sustancias medicamentosas de origen natural. Editorial Omega S.A. pp. 106-183. [ Links ]
Ledezma, E., Marcano, K., Jorquera, A. y col., 2000. "Efficacy of ajoene in the treatment of tinea pedis: A doble-blind and comparative study with terbinafine". Journal of the American Academy of Dermatology; 43: 829-832. [ Links ]
Madigan, M.T., Martinko, J.M., Parker, J., 2004. Brock. Biología de los microorganismos. 10a ed. Pearson Educación. Madrid, España. [ Links ]
Maldonado, V. Ma. de los Ángeles, 2009. "Actividad fungicida y análisis fitoquímico de tres especies de cactáceas: Ariocarpus kotschoubeyanus (Lemaire ex K. Schumann), Echinocereus stramineus (Engelmann) y Stenocereus pruinosus. (Otto)". Revista Salud Pública y Nutrición (RESPYN). UANL. Edición Especial No. 4. [ Links ]
Manzano, G.P., Méndez, T.L.J., Hernández, H.F., López, M.R., 2008. "Antifungal resistance an emerging problem in México". Gac. Med. Mex., 144(1):23- 26. [ Links ]
Mesa, A.A.C., Bueno, S.J.G. y Betancur, G.L.A., 2004. "Productos naturales con actividad antimicótica". Rev Esp Quim Prous Science, S.A. Soc Esp de Quimioterap., Vol. 17 (núm. 4): 325-331. [ Links ]
Morales Rubio, M.E., J. Verde Star, A. Oranday Cárdenas, Rivas Morales C., J.F. Treviño Neávez, 2004. "Estudio fitoquímico de tallos y frutos de la pitaya agria de Baja California". Revista Salud Pública y Nutrición (RESPYN). UANL. Edición Especial No. 1. [ Links ]
Morales, R.M.E., Verde S.M.J., Oranday C. A., Rivas M.C., Arévalo N.K., Treviño N.J.F., Carranza R.P., y Cruz V.D. E., 2007. "Actividad Biológica de Lophocereus schottii (Engelman) Britton and Rose". Revista Salud Pública y Nutrición (RESPYN). UANL. Edición Especial núm. 7, pp.1-3. [ Links ]
Okazaki, S., Kinoshita K., Koyama K., Kunio T., Hiroshi Y., 2007. "New triterpene saponins from Stenocereus eruca (Cactaceae)". Journal of Natural Medicines, 61(1):24-29. [ Links ]
Phillipson, J. D., 1994. "Natural's products as drugs". Transactions of the Royal Society of Tropical Medicine and Hygiene, 88 supplement 1, pp. 17-19. [ Links ]
Ruiz, B.E., Velázquez C., Garibay E.A., García Z., Plascencia J.M., Cortez R.M., Hernández M.J., Robles Z.R., 2009. "Antibacterial and antifungal activities of some Mexican medicinal plants". Journal of Medicine Food, 12(6): 398-402. [ Links ]














