Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Polibotánica
Print version ISSN 1405-2768
Polibotánica n.30 México Sep. 2010
Actividad amebicida, antioxidante y perfil fitoquímico de extractos metanólicos de Astrophytum myriostigma obtenidos de cultivo de callo y del cactus silvestre
Amoebicid and antioxidant activity and phytochemical profile of methanolic extracts of callus and stem of the cactus Astrophytum myriostigma
R.A. Garza-Padrón1, M.J. Verde-Star2, M.E. Morales-Rubio1, A. Oranday-Cárdenas2, C. Rivas-Morales2, M.A. Núñez-González2 y M.P. Barrón-González1
1 Departamento de Biología Celular y Genética, Lab. de Micropropagación y Lab. de Biología Celular.
2 Departamento de Química, Lab. Fitoquímica y Lab. de Química Analítica. Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León. Correo electrónico: ruthgarza@hotmail.com, mmorales1132000@yahoo.com.
Recibido: 12 enero 2010.
Aceptado: 14 mayo 2010.
Resumen
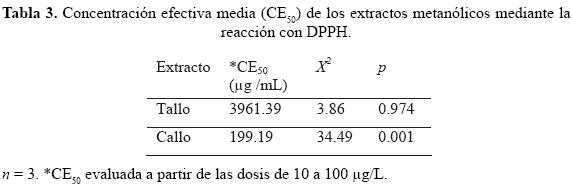
Se determinó la actividad amebicida, antioxidante y perfil fitoquímico de extractos metanólicos de callo cultivado in vitro y secciones de tallo de planta ex vitro de Astrophytum myriostigma. Se obtuvieron extractos metanólicos de ambos tejidos para evaluar la actividad amebicida sobre Entamoeba histolytica HM1-IMSS, la actividad antioxidante (DPPH 2,2-diphenyl-1-picrylhydrazyl) y su perfil fitoquímico. Para ambos extractos, la actividad amebicida resultó satisfactoria con una concentración inhibitoria media menor de 100 μg/mL. Los resultados del perfil fitoquímico indican la presencia de metabolitos secundarios diferentes en callo y tallo, mientras que el callo, posee oxidrilos fenólicos y flavonoides, en tallo no están presentes, lo que puede ocasionar la diferencia en los resultados de la actividad antioxidante, para callo una concentración efectiva media de 199.19 μg/mL y para tallo de 3961.39 μg/mL. La presencia de estos metabolitos en callo de Astrophytum myriostigma, se debe probablemente a las condiciones y a los nutrientes presentes en el medio in vitro.
Palabras clave: cactácea, cultivo in vitro, extractos metanólicos, Astrophytum myriostigma, actividad biológica.
Abstract
Methanolic extracts were obtained from both in vitro and ex vitro tissues of Astrophytum myriostigma to develop a phytochemical profile, probe antioxidant activity (DPPH 2, 2-diphenyl-1-picryl-hydrazyl) and evaluate amoebicid activity against Entamoeba histolytica HM1-IMSS. The phytochemical profile results indicate the presence of different secondary metabolites in callus and stem; whereas the callus has phenolic oxidrils and flavonoids, these are not present in the stem, which may cause the difference in the antioxidant activity between callus with an IC50 of 199.19 μg/mL and stem with 3961.39 μg/mL. The amoebicid activity was satisfactory with an IC50 of <100μg/mL for both extracts. The presence of these metabolites in callus of Astrophytum myriostigma is probably due to conditions and nutrients present in media.
Key words: cactus, tissue culture, methanolic extracts, Astrophytum myriostigma, biological activity.
INTRODUCCIÓN
Desde tiempos remotos, las plantas se han utilizado como nuevos agentes terapéuticos y sus usos se han transmitido de generación en generación, de forma oral o escrita. La importancia de los productos naturales en medicina, se basa no solamente en sus efectos farmacológicos o quimioterapéuticos, sino en la posibilidad que ofrecen para poder desarrollar a partir de sus estructuras, nuevas drogas. Por lo cual México ha ido sumándose a la corriente mundial en la búsqueda de nuevos compuestos y a lo largo del país existen instituciones científicas que se dedican a la búsqueda de nuevos fitofármacos.
La familia cactácea es endémica de América (Rojas y Vázquez, 2000). Muchas de sus especies son de gran importancia, ya que los pueblos indígenas les han dado usos muy variados siendo uno de ellos el medicinal, se han utilizado como: analgésicos, antibióticos, diuréticos, antitusivos, afecciones cardiacas y nerviosas entre otras, debido a estos usos, las investigaciones sobre esta familia se han incrementado (Anderson, 2001; Bravo-Hollis y Scheinvar, 1995). Otra característica importante de esta familia es la gran cantidad de compuestos químicos que presenta, entre los que podemos mencionar flavonoides, alcaloides, saponinas, taninos, ceras, mucílagos, entre otros (Bravo-Hollis y Sánchez, 1978). Estudios recientes realizados por diferentes grupos de trabajo validan mucha de la información referida empíricamente, como es el caso de la actividad bactericida y citotóxica de Lophocereus schottii (Morales, 2006), actividad citotóxica de Pereskia bleo (Malek et al., 2009), actividad antioxidante de Echinocereus stramineus (Treviño, 2009), Opuntia humifusa Raf (Cho et al., 2006) y Opuntia ficus-indica (Saleem et al., 2006), efecto protector de Opuntia ficus indica (Hfaiedh et al., 2008), como alternativa en el tratamiento de la isquemia y el estrés oxidativo inducido por las enfermedades neurodegenerativas (Huang et al., 2009). Sin embargo este conocimiento, incrementa la utilización de estos recursos vegetales, por lo que es importante tener alternativas para el uso sustentable de estos recursos y no ponerlos en riesgo de sobreexplotación; una alternativa para evitarlo, es la biotecnología a través del cultivo de tejidos vegetales, que consiste en colocar secciones de la planta en medios nutritivos adecuados, en forma aséptica y bajo condiciones controladas (Hurtado y Merino, 1987).
En el sector salud, actualmente a nivel mundial, existen graves problemas, en particular en los países en vías de desarrollo, las enfermedades parasitarias causan grandes pérdidas económicas (WHO, 2007; Barrón-González et al., 2008). Entamoeba histolytica es un protozoario parásito intestinal que ocasiona aproximadamente 100 000 muertes al año (Van Hal et al., 2007; Gonzales et al., 2009). Existen pocas alternativas para el tratamiento de la enfermedad, durante décadas se ha utilizado el metronidazol contra parásitos incluyendo E. histolytica (Leitsch et al., 2007). Se tienen reportes de resistencia al metronidazol, así como efectos secundarios en el humano y en ratones es mutagénico y carcinogénico (Samarawickream et al., 1997). Muchas especies de plantas son empleadas en enfermedades diarreicas, como es el caso de Artemisia ludoviciana que se utiliza en infusión, para su validación científica se evaluaron extractos de hojas de plantas adultas, teniendo actividad antiparasitaria contra Entamoeba histolytica y Giardia lamblia en condiciones in vitro (Said et al., 2005), mientras que Castela texana logra inhibir un 50% en el enquistamiento de Entamoeba invadens (Calzada et al., 2001); también es efectiva contra E. histolytica, con una CI50 de 218.5 μg/mL (Barrón-González et al., 2008).
Otra propiedad importante que se aprovecha de las plantas es la presencia de compuestos antioxidantes, los que están relacionados específicamente con oxidrilos fenólicos, metabolitos que actúan contra los radicales libres, moléculas que desempeñan un importante papel como mediadores en la regulación de varios procesos fisiológicos, sin embargo, frente a agresiones externas tales como infecciones y/o contaminantes ambientales, tienden a incrementarse y volverse dañinos para las células (Dröge, 2002). Conocer este tipo de propiedades presentes en las plantas, nos permite tener además de un nuevo fitofármaco un compuesto que favorece la captura de radicales libres.
Astrophytum myriostigma (Fig. 1) es una cactácea de tallo simple o cespitoso, distribuida en matorrales rosetófilos en los estados de San Luis Potosí, Coahuila, Nuevo León y Tamaulipas (Bravo-Hollis y Sánchez, 1991; Anderson, 2001; Gómez, 2001). Sobre esta especie, se tienen principalmente estudios de ecología, ya que es una especie muy apreciada como ornamental, por lo que el presente trabajo tuvo la finalidad de determinar la actividad amebicida y antioxidante, así como el perfil fitoquímico de los extractos metanólicos de tallo y callo de Astrophytum myriostigma, para así contribuir al conocimiento y utilización de esta especie.

MÉTODOS
Material biológico
Plantas adultas de Astrophytum myriostigma fueron adquiridas en la empresa denominada Semillas y Plantas Desérticas de México en Saltillo, Coahuila. Los especímenes fueron identificados en el Laboratorio de Fanerógamas de la Facultad de Ciencias Biológicas de la Universidad Autónoma de Nuevo León, para luego ser depositados en el herbario de esta facultad, en donde se le asignó el folio núm. 025519.
Entamoeba histolytica HM1-IMSS
Los cultivos in vitro de E. histolytica HM1-IMSS, fueron proporcionados por el Laboratorio de Biología Celular del Departamento de Biología Celular y Genética, de la Facultad de Ciencias Biológicas de la UANL.
Métodos
Inducción de callo de A. myriostigma
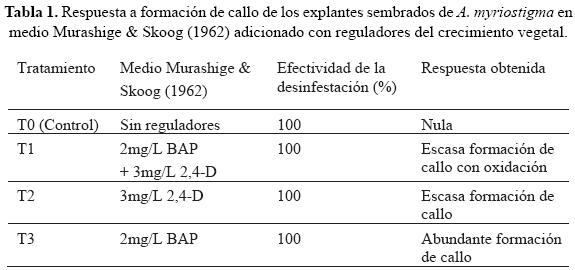
Se utilizaron frascos de boca ancha con tapón de rosca de 250 mL, en los cuales se depositaron 30 mL de medio de cultivo Murashige & Skoog (1962) adicionado con 30 g/L de sacarosa y 7 g/L de agar, con base en tres tratamientos: T1: MS con 2mg/L de bencilaminopurina (BAP) y 3 mg/L de ácido 2,4 diclorofenoxiacético (2,4-D), T2: MS con 3mg/L de 2,4-D y T3: MS con 2mg/L de BAP y además un control T0: MS sin reguladores de crecimiento.
Desinfestación y establecimiento del cultivo in vitro
Para el establecimiento aséptico del cultivo, se siguió el procedimiento recomendado por Morales (2006), modificando concentración y tiempo de exposición al desinfectante. Los explantes (secciones de tallo) se lavaron en agua corriente por 30 min, después se sumergieron en etanol absoluto por 30 s, posteriormente se colocaron en una solución de hipoclorito de sodio comercial a 15% v/v con 100 mg/L de ácido ascórbico y 5 gotas de detergente no iónico (Tween 20) por 10 min en agitación constante, dentro de la campana de flujo laminar se enjuagaron tres veces con agua bidestilada estéril. Para la siembra, los explantes se cortaron en fragmentos de 1 cm3 aproximadamente, se sembró un explante por frasco y se realizaron 10 repeticiones para cada tratamiento. Los frascos fueron colocados bajo condiciones controladas de luz (12 horas) (1450 lux, medible en un luxómetro, Control Company© 2000) y a una temperatura de 22°C ± 2 por un periodo de tiempo de cinco meses, subcultivándose cada mes.
Obtención de extractos a partir de tallo
Se pesaron 50 g de tallo fresco de A. myriostigma y se colocaron en matraces Erlenmeyer con 100 mL de metanol, para su posterior extracción por maceración a temperatura ambiente y agitación constante (250 rpm) en un agitador (Dual Action Shaker Lab Line) durante 3 d. Transcurrido éste tiempo, el extracto se fi ltró con papel Whatman núm. 2; para concentrarlo posteriormente en un rotavapor (Büchi 461) y se almacenó a 4°C, hasta el momento de su uso.
Obtención de extractos a partir de cultivos in vitro
Se siguió el mismo procedimiento que para el tallo, excepto que se utilizaron 20 g de callo y 50 mL de solvente.
Pruebas cualitativas de perfil fitoquímico
A los extractos obtenidos, se les realizaron las pruebas establecidas por Domínguez (1973), utilizando placas de cerámica de 12 pozos.
Las pruebas realizadas fueron las siguientes:
Prueba del KMnO4 para insaturaciones. Se disuelve 1-2 mg de la muestra en 1 mL de agua, acetona o metanol y se añade gota a gota una solución de KMnO4 al 2% en agua. La prueba es positiva si se observa decoloración o formación de precipitado café, resultado de la formación de dióxido de magnesio.
Prueba de la 2-4 dinitrofenilhidracina para grupo carbonilo. De 1-2 mg de la muestra se disuelven en etanol, se le añade una solución saturada de 2-4- dinitrofenilhidracina en HCl 6N, la formación de un precipitado amarillo o naranja indica la presencia del grupo carbonilo.
Prueba del FeCl3 para oxidrilos fenólicos (taninos vegetales). Se disuelven 1-2 mg de la muestra en 1 mL de agua o etanol y posteriormente se añaden unas gotas de cloruro de fierro al 12.5% en agua. La aparición de un precipitado rojo, azul-violeta o verde es considerado positivo.
Prueba de Liebermann-Burchard para esteroles y triterpenos. Se mezcla 1 mL de anhídrido acético y uno de cloroformo, se enfría a 0ºC y se le añade una gota de ácido sulfúrico. Gota a gota se añade este reactivo a la muestra o su solución clorofórmica. Si hay formación de colores azul, verde, rojo, anaranjado, etc., los que cambian con el tiempo, la prueba será positiva.
Prueba de Salkowski para esteroles y triterpenos. Similar a la de Liebermann-Burchard, 1-2 mg del extracto se pone en contacto con 1 mL de ácido sulfúrico, se desarrollan colores amarillo o rojo para esteroles y metilesteroles.
Prueba de Molish para carbohidratos. En un tubo de ensaye de 13 x 100 mm se coloca 1-2 mg de la muestra, se le agrega gota a gota el reactivo de Molish (alfa-naftol al 1% en etanol), luego 1 mL de ácido sulfúrico por las paredes. La prueba es positiva cuando se forma un anillo coloreado en la interfase de color púrpura.
Prueba de las coumarinas. Se disuelve 1-2 mg de muestra en NaOH al 10%, si aparece una coloración amarilla que desaparece al acidular es positiva.
Prueba de Baljet para sesquiterpenlactonas. A 1-2 mg del compuesto se les agregan 3-4 gotas de la solución mezcla, siendo positiva si se torna de color naranja a rojo oscuro.
Prueba del H2SO4 para flavonoides. Se disuelve 1-2 mg de la muestra en H2SO4, si se observa coloración amarilla indica la presencia de flavonoles, naranja-guinda para flavonas, rojo-azuloso para chalconas y rojo-púrpura para quinonas.
Prueba de Shinoda para flavonoides. En un tubo de ensaye 13 x 100 mm se coloca 1-2 mg de la muestra y 1 ml de etanol, se agrega una limadura de magnesio y después se le agregan unas gotas de HCl. Se considera la prueba positiva si se presentan colores naranja, rojo, rosa, azul y violeta.
Prueba de Dragendorff para alcaloides. A 1-2 mg de muestra, se le añaden 2 a 3 gotas de los reactivos A (nitrato de bismuto y ácido acético glacial) y B (yoduro de potasio), la aparición de una coloración naranja a rojiza, se considera positiva.
Evaluación de la actividad biológica sobre Entamoeba histolytica Medio de cultivo
Se siguió el método empleado por Barrón-González et al., (2008). Se preparó medio de cultivo para amibas a base de peptona de caseína, extracto de levadura, L-cisteína, ácido ascórbico, citrato férrico de amonio y D-glucosa anhidra, se mezclaron todos los componentes y se disolvieron en 62.5 mL de extracto de hígado y páncreas y se aforó a 500 mL con agua desionizada. El pH se ajustó a un valor de 7.0 con NaOH 10N, el medio se colocó en tubos de ensaye de borosilicato de 13 x 100 mm con tapón de rosca conteniendo 5 mL del medio de cultivo adicionado con 0.05 mL de solución de penicilina-estreptomicina (para evitar la contaminación bacteriana) y 0.5 mL de suero bovino y se esterilizó en autoclave por 20 min a 121°C/15 lb de presión, después se dejaron enfriar a temperatura ambiente y se almacenaron a 4°C hasta su empleo.
Actividad amebicida
Para la evaluación de la actividad amebicida, los extractos se resuspendieron en dimetilsulfóxido (DMSO), se ajustaron a las concentraciones de 0.01, 0.1, 0.3 y 0.7 mg/mL y fueron esterilizados. Cada tubo con medio de cultivo se inoculó con 1×104 trofozoítos/mL y fueron incubadas a 37°C por 96 h, en una incubadora Binder. Se utilizó como control positivo el metronidazol y como negativo DMSO. Después del periodo de incubación se contabilizó el número de trofozoítos/mL con una cámara de Neubauer. Cada concentración se evaluó en tres eventos independientes por triplicado, comparándose contra el crecimiento de las cepas con el control negativo. Después del periodo de incubación se contabilizó el número de trofozoítos/mL con una cámara de Neubauer. La CI50 se calculó mediante el método estadístico Probit, con el programa SPSS versión 17.
Evaluación de la actividad antioxidante
Se utilizó el método de Cottele et al. (1996). La solución estándar se preparó a una concentración de 0.1 mM de DPPH (2,2diphenyl-1-picryl-hydrazyl, Sigma-Aldrich) en etanol absoluto. Se prepararon soluciones metanólicas de los extractos concentrados del tejido in vivo e in vitro a una concentración de 5 mg/5 mL, a partir de éstas se elaboraron las diluciones correspondientes para obtener concentraciones de 10, 20, 50 y 100 μg/mL. La mezcla de reacción se realizó en tubos de ensaye, a los que se adicionaron 750 μL de DPPH y 250 μL de las disoluciones de cada extracto. Se hicieron cuatro repeticiones por cada concentración de cada tipo de extracto, en dos eventos independientes. Se utilizó como blanco la solución estándar de DPPH y como control positivo ácido ascórbico. Las mezclas de reacción se mantuvieron en agitación a temperatura ambiente por 30 min. La absorbancia se midió después de 30 min a una longitud de onda de 517 nm en un espectrofotómetro Spectronic Genesys 5 (Tamil et al., 2003). Se determinó la concentración de inhibición media (CE50), la cual nos indica la concentración necesaria para reducir el 50% del radical DPPH mediante el método estadístico Probit (SPSS versión 17).
RESULTADOS
Cultivo in vitro de A. myriostigma
Se obtuvo un porcentaje de desinfestación del 100% para todos los tratamientos, como se muestra en la tabla 1; un mes después, se produjo la desdiferenciación hacia callo, en el medio T3 adicionado con BAP 2 mg/L (Fig. 2), mientras que en el resto de los tratamientos se observó oxidación y escasa producción de callo.

Metabolitos secundarios presentes en la planta y tejido in vitro
Las pruebas cualitativas de tamizaje fitoquímico en ambos extractos, resultaron positivos para insaturaciones, triterpenos y esteroles, carbohidratos, alcaloides, en el tejido in vitro fue positivo para la reacción de oxidrilos fenólicos y flavonoides, mientras que en tallo no se detectan.
Determinación de la concentración de inhibición media (CI50) de extracto metanólico de tallo y callo de A. myriostigma sobre E. histolytica
Los resultados obtenidos se muestran en el tabla 2. La CI50 de los extractos metanólicos de tallo y callo se calcularon con base en el análisis Probit mediante el programa SPSS versión 17.

Determinación de la concentración efectiva media (CE50) de los extractos mediante DPPH
En el tabla 3 se muestran los resultados obtenidos para la actividad antioxidante. Para determinar la CE50 de los extractos de A. myriostigma, se utilizó el análisis Probit, mediante el programa SPSS versión 17.
DISCUSIÓN
El procedimiento de desinfestación para el establecimiento del cultivo in vitro de A. myriostigma fue adecuada, ya que el porcentaje de eficiencia de esterilidad fue del 100%, semejante al obtenido por Morales (2006). En cuanto a la formación de callo, el tratamiento que indujo la mayor proliferación de este tejido fue el de BAP 2 mg/L, aun cuando este regulador es una citocinina que fomenta la división celular y la brotación, es importante tomar en cuenta que la respuesta morfogenética del explante está también influenciada por las concentraciones endógenas de fitohormonas, así como por las condiciones in vitro; por otro lado, Gallegos y Vega (2002) obtuvieron mejor rendimiento celular de callo para Astrophytum asterias con MS (1962) adicionado de 3 mg/L de 2,4-D y 2 mg/L de BA.
Mediante las pruebas de tamizaje fitoquímico se determinó la presencia de insaturaciones, triterpenos, carbohidratos y alcaloides para ambos extractos, mientras que el extracto de callo fue positivo para oxidrilos fenólicos y flavonoides, al respecto, las condiciones in vitro pueden favorecer la síntesis de ciertos metabolitos, que en condiciones naturales no ocurriría, se ha reportado la presencia de oxidrilos fenólicos en otras especies de cactáceas (Treviño, 2009; Morales, 2006).
El potencial amebicida del extracto de tallo y callo es relevante, otros autores han reportado actividad de diversas especies de plantas sobre este protozoario, pero no en miembros de la familia cactácea (Calzada-Flores, 2001; Said et al., 2005).
Los resultados de la actividad antioxidante son relevantes, sobre todo por la diferencia de los valores entre el extracto de callo y el de tallo; sin embargo, debido a los escasos trabajos existentes sobre el tema y esta familia de plantas en particular es difícil discutir con otros autores los datos obtenidos.
Podemos concluir que los resultados de la presente investigación contribuyen en el conocimiento del perfil fitoquímico, actividad amebicida y antioxidante de los extractos metanólicos del tejido in vivo e in vitro de A. myriostigma.
Se recomienda continuar con la investigación para evaluar diferentes componentes del medio y modificar las condiciones del cultivo in vitro para así incrementar la producción de los metabolitos de interés y tener este sistema como una alternativa sustentable para la utilización de la especie sin demeritar nuestros recursos vegetales.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca otorgada para la realización de este trabajo. Becario núm. 191654.
LITERATURA CITADA
Anderson, E.F., 2001. The Cactus Family. Timber Press. Hong Kong. p. 18-19, 120-121. [ Links ]
Barrón-González, M.P.; L. Villarreal-Treviño, D. Reséndez-Pérez, B.D. Mata-Cárdenas, M.R. Morales-Vallarta, 2008. "Entamoeba histolytica: cyst-like structures in vitro induction". Exp Parasitol, 118: 600-603. [ Links ]
Bravo-Hollis, H., H. Sánchez-Mejorada, 1978. Las Cactáceas de México. Universidad Autónoma de México. Tomo 1. p. 62-78. [ Links ]
----------, 1991. Las Cactáceas de México. Universidad Autónoma de México. Tomo 2, p. 91-101, 252-263. [ Links ]
Bravo-Hollis, H., L. Scheinvar, 1995. El interesante mundo de las cactáceas. Fondo de Cultura Económica. México. p. 155-175. [ Links ]
Calzada-Flores, C.C., 2001. "Determinación de la actividad de la Castela texana (Torr & Gray) Rose en los procesos de enquistamiento y desenquistamiento de Entamoeba in vitro". Tesis doctoral. Facultad de Ciencias Biológicas, UANL. México. 75 pp. [ Links ]
Cho, J.Y.; S.C. Park, T.W. Kim, K.S. Kim, J.C. Song, S.K. Kim, H.M. Lee, H.J. Sung, H.J. Park, Y.B. Song, E.S. Yoo, C.H. Lee, M. H. Rhee, 2006. "Radical scavenging and anti-inflammatory activity of extracts from Opuntia humifusa Raf". J. Pharm. Pharmacol., 58: 113-119. [ Links ]
Cottele, N.; J.L. Bernier, J.P. Catteau, P. Pommery, J.C. Wallet, E.M. Gaydou,1996. "Antioxidants properties of hydroxyl-flavones". Free Radical Biol. Med., 20: 35-43. [ Links ]
Domínguez, X.A., 1973. Métodos de Investigación Fitoquímica. Editorial Limusa. México. p. 39-44, 141-143, 211-228, 246. [ Links ]
Dröge, W., 2002. "Free radicals in the physiological control of cell function". Physiol. Rev., 82: 47-95. [ Links ]
Gallegos-Barajas, A., J. Vega Pérez, 2002. "Regeneración in vitro de Astrophytum asterias (Zucc.) Lem". V Simposio Argentino de Biotecnología Vegetal. Argentina. Octubre 20-22. [ Links ]
Gómez, S. A., 2001. Enciclopedia Ilustrada de los Cactus y otras Suculentas. Impreso en España. 12 pp. [ Links ]
Gonzales, M.L.; L.F. Dans, E.G. Martinez, 2009. "Antiamoebic drugs for treating amoebic colitis". Cochrane Database Syst. Rev., 15: CD006085. [ Links ]
Hfaiedh, N.; M.S. Allagui, M. Hfaiedh, A.E. Feki, L. Zourgui, F. Croute., 2008. "Protective effect of cactus (Opuntia ficus indica) cladode extract upon nickel-induced toxicity in rats". Food Chem Toxicol., 46: 3759-3763. [ Links ]
Huang, X.; Q. Li, H. Li, L. Guo, 2009. "Neuroprotective and antioxidative effect of cactus polysaccharides in vivo and in vitro". Cell Mol. Neurobiol., 29: 1211-1221. [ Links ]
Hurtado, D., M. Merino, 1987. Cultivo de tejidos vegetales. México. 232 pp. [ Links ]
Leitsch, D.; D. Kolarich, I.B. Wilson, F. Altmann, M. Duchêne, 2007. "Nitroimidazole action in Entamoeba histolytica: a central role for thioredoxin reductase". PLoS Biol., 5: e211. [ Links ]
Malek, S.N.; S.K. Shin, N.A. Wahab, H. Yaacob, 2009. "Cytotoxic components of Pereskia bleo (Kunth) DC. (Cactaceae) leaves". Molecules, 14: 1713-1724. [ Links ]
Morales Rubio, M.E., 2006. "Extractos de Lophocereus schottii (Engelm) Britton and Rose y Stenocereus gummosus (Engelmann) Gibson y Horak con actividad antibacteriana y antineoplásica sobre líneas celulares humanas". Tesis doctoral. Facultad de Ciencias Biológicas, UANL. p. 36-52. [ Links ]
Murashige, T., F. Skoog, 1962. "A revised medium for rapid growth and bioassays with tobacco tissue cultures". Physiologia Plantarum, 15: 437-497. [ Links ]
Rojas Aréchiga, M., C. Vázquez-Yanes, 2000. "Cactus seed germination: a review". J. of Arid Environm., 44: 85-104. [ Links ]
Said Fernández, S.; M.C. Ramos Guerra, B.D. Mata Cárdenas, J. Vargas Villarreal, L. Villarreal Treviño, 2005. "In vitro antiprotozoal activity of the leaves of Artemisia ludoviciana". Fitoterapia, 76: 466-468. [ Links ]
Saleem, M.; H.J. Kim, C.K. Han, C. Jin, Y.S. Lee, 2006. "Secondary metabolites from Opuntia ficus-indica var. saboten". Phytochemistry, 67: 1390-1394. [ Links ]
Samarawickream, N.A., D.M. Brown, J.A. Upcroft, N. Thammapalerd, P. Upcroft, 1997. "Involvement of superoxide dismutase and pyruvate: ferredoxin oxidoreductase in mechanisms of metronidazole resistance in Entamoeba histolytica". Journal Antimicrob. Hemother., 40: 833-840. [ Links ]
Tamil Selvi, A.; G.S. Joseph, G.K. Jayaprakasha, 2003. "Inhibition of growth and aflatoxins production in Aspergillus flavus by Garcinia indica extract and antioxidant activity". Food Microbiol., 20: 455-460. [ Links ]
Treviño Neávez, J.F., 2009. "Actividad biológica y componentes presentes en Ariocarpus kotschoubeyanus (Lemaire ex K. Schumann), Echinocereus stramineus (Hengelmann) y Stenocereus pruinosus, (Otto)". Tesis doctoral. Facultad de Ciencias Biológicas. UANL. p. 58-69. [ Links ]
Van Hal, S.J.; D.J. Stark, R. Fotedar, D. Marriott, J.T. Ellis, J.L. Harkness, 2007. "Amoebiasis: current status in Australia". Med. J. Aust., 186: 412-416. [ Links ]
WHO, 2007. "News and activities". Bulletin of the World Health Organization, 75: 22291-22292. [ Links ]














