Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.30 México sep. 2010
Establecimiento de protocolos para la propagación in vitro de plantas de Acourtia cordata (Cerv.) Turner (Compositae), colectadas en la Sierra de Guadalupe
Establishment of protocols for in vitro propagation of Acourtia cordata (Cerv.) Turner (Compositae), plants collected in the Sierra de Guadalupe
Gabriela Gómez-Serrano1, Eliseo Cristiani-Urbina2 y Thelma Lilia Villegas-Garrido1
Instituto Politécnico Nacional, Escuela Nacional de Ciencias Biológicas, Plan de Ayala y Carpio, Col. Santo Tomás, México, DF, 11340.
1 Depto. de Biofísica, Laboratorio de Cultivo de Tejidos Vegetales.
2 Depto. de Ingeniería Bioquímica, Laboratorio "Ing. Pablo Hope y Hope". Correo electrónico: tvilleg@encb.ipn.mx.
Recibido: 7 diciembre 2009.
Aceptado: 12 mayo 2010.
Resumen
La Sierra de Guadalupe (SG) es una de las cadenas montañosas que se encuentran dentro de la cuenca de México, localizada en su porción centro-norte. Actualmente la SG ha sido declarada Área Natural Protegida y se ha convertido en una zona estratégica de gran importancia para la región, por lo que los esfuerzos para conservar a su flora nativa serán determinantes para su sustentabilidad. El objetivo de este trabajo fue establecer protocolos de propagación in vitro de plantas de Acourtia cordata, conocidas desde épocas precolombinas por sus propiedades medicinales y, actualmente, por la presencia de un colorante en sus raíces, colectadas en dos localidades de la SG; a través del cultivo de yemas axilares y apicales y de la inducción de procesos de morfogénesis. Se establecieron dos protocolos para la multiplicación in vitro de esta especie, partiendo de yemas, hojas e internodos derivados de plántulas desarrolladas por germinación in vitro de semillas colectadas de plantas silvestres. En un protocolo, las plantas fueron obtenidas por inducción de organogénesis indirecta en el medio Murashige y Skoog (MS), con 5 mg/L de AIA y 0.5 mg/L de BAP, seguido del enraizamiento de los brotes generados en presencia de la auxina AIB y en el segundo protocolo se generaron plantas por enraizamiento en el mismo tratamiento de los brotes desarrollados por morfogénesis. Con la combinación de los dos protocolos, a partir de cada semilla germinada in vitro, se generaron en promedio 22 ± 2 plantas en 6.5 meses, preparadas para ser transferidas a condiciones ex vitro, adicionalmente a que los índices de germinación de las semillas fueron prácticamente del 100%. Los resultados de este trabajo apoyan la importancia que tienen los sistemas de cultivo in vitro en la conservación y propagación de recursos genéticos valiosos, como es el caso de A. cordata, especie para la cual no existen reportados protocolos de propagación in vitro, que podrían contribuir al fortalecimiento de sus hábitats naturales, así como generar la posibilidad de desarrollar procesos de producción de sus metabolitos de importancia tecnológica por sistemas de cultivo, para evitar el deterioro de sus poblaciones naturales.
Palabras clave: Acourtia, Perezia, cultivo in vitro, micropropagación, Sierra de Guadalupe.
Abstract
The Guadalupe Range (GR) is one of several volcanic complexes within the Mexico Basin. Located in the north-central portion of the basin, GR is now a Protected Natural Area. Therefore, it has become a strategic zone of major importance within the region, for which efforts to preserve its native flora will determine range sustainability. The objective of this work was to establish in vitro plant regeneration protocols for Acourtia cordata, a plant known since pre-Columbian times for its medicinal properties and nowadays for the presence of a dye in its roots. Plants were collected at two localities of the GR and propagated through apical and axillary bud culture, as well as the induction of morphogenetic processes. Two protocols for in vitro plant multiplication were developed; the explants came from buds, leaves and internodes of donor plants obtained from in vitro germination of seeds collected from wild plants. In one protocol plants were formed after indirect shoot organogenesis induced in MS medium containing 5 mg/L of IAA and 0.5 of BAP, followed by rooting in presence of the auxin IBA. In the second one, plants were regenerated by rooting the shoots developed from apical and axillary buds in the same medium used in the morphogenetic processes. The combination of both protocols yielded, from each seed germinated in vitro (germination indices were practically 100%), an average of 22 ± 2 plantlets after 6.5 months, ready for their ex vitro transfer. Results of this study support the importance of the use of in vitro culture systems for the conservation and propagation of valuable genetic resources such as A. cordata, for which there have been no previously reported protocols for in vitro propagation. Such propagation methods can be a valuable tool for the enhancement of natural habitats, to say nothing of their potential to multiply genotypes of useful plants that are sources of technologically important secondary metabolites without damaging their natural populations.
Key words: Acourtia, Perezia, in vitro plant culture, micropropagation, Guadalupe Range.
INTRODUCCIÓN
La llamada cuenca de México es una cuenca endorreica volcánico-tectónica, localizada en el extremo occidental de la porción Este del cinturón transvolcánico de la república mexicana, con una elevación media de 2 240 m.s.n.m. Dentro de la cuenca de México se encuentran dos cordilleras principales de tipo volcánico, una de ellas es la Sierra de Guadalupe (SG), situada entre 19º 30' y 19º 38' N de latitud y entre 99º 00' y 99º 12' W de longitud, situada en la porción centro-norte de la cuenca y con una topografía casi circular (García-Palomo et al., 2006).
Esta sierra está conformada por un agregado de domos y volcanes de alturas variadas, con elevación máxima de 3000 y 2930 m.s.n.m., que presentan los Picos Tres Padres y Moctezuma respectivamente (Fig. 1a). Actualmente la Sierra de Guadalupe, con un área de 6 503 hectáreas se encuentra inmersa dentro de la Zona Metropolitana del Valle de México, con 82% de su territorio en el Estado de México, dentro de cuatro municipios: Coacalco de Berriozábal, Ecatepec de Morelos, Tlalnepantla de Báez, Tultitlán y con 18% en el Distrito Federal, ubicada en la Delegación Gustavo A. Madero (Gaceta Oficial del Distrito Federal, 2003).

Es un hecho conocido que durante las últimas décadas, la población en el área metropolitana del Valle de México se ha incrementado considerablemente y los asentamientos en las inmediaciones de la Sierra de Guadalupe han experimentado un crecimiento demográfico importante, lo anterior sumado a los cambios en el clima, la intensa desforestación y la erosión de sus suelos, han provocado el gran deterioro actual que presenta la sierra en general, tanto en su geomorfología, como en su vegetación.
La Sierra de Guadalupe está considerada actualmente como área natural protegida, con la categoría de zona sujeta a conservación ecológica (Gaceta Oficial del Distrito Federal, 2003), debido en parte, a que es albergue de una diversidad biológica importante de especies vegetales, conformada fundamentalmente por bosques de encino, matorrales xerófilos y de encino, pastizales y bosques de eucaliptos, estos últimos introducidos en años recientes. Aunado a lo anterior y no menos importante, la sierra actúa como filtro natural ya que retiene contaminantes en la parte norte de la ciudad de México y adicionalmente, es un área capaz de filtrar el agua de lluvia al subsuelo y como consecuencia impactar significativamente en los mantos freáticos de la cuenca de México (García-Palomo et al., 2006).
Debido a lo anterior, esta sierra se ha convertido en una zona estratégica de gran importancia para el Norte del Distrito Federal y los municipios colindantes del Estado de México, por lo que los esfuerzos de conservación y cuidado de su flora serán determinantes tanto para la ecología de la zona, como para la sustentabilidad hidrológica del Valle de México. La diversidad e importancia de las plantas existentes en la Sierra de Guadalupe, con 530 especies que se agrupan en 81 familias y 299 géneros (Tejero Díez y Medina Lemus, 2006), así como las presiones ambientales a las que está sujeta esta flora, fundamenta nuestro interés en proponer alternativas biotecnológicas, que promuevan un mejor manejo y uso controlado de sus valiosos recursos naturales.
Una alternativa de gran impacto y viabilidad la constituye el cultivo de tejidos vegetales (George y Debergh, 2008), a través del establecimiento de sistemas de micropropagación por cultivo in vitro de las especies vegetales de importancia para la sierra. Con el desarrollo de protocolos de cultivo, es posible aumentar la proliferación y disminuir los tiempos de propagación de plantas, partiendo de explantes como yemas, fragmentos de hoja o tallos (Tisserat, 1987), y contribuir a la conservación de la biodiversidad y a la preservación de hábitats naturales, lo que tendría impacto directo en la conservación de germoplasmas valiosos y en la ecología de la zona.
Dentro de las plantas de importancia estratégica que se localizan en la Sierra de Guadalupe, se encuentran algunas poblaciones del género Acourtia, cuyas plantas son conocidas por su uso medicinal desde épocas precolombinas (Flores, 1982).
Fuentes históricas clásicas sobre herbolaria medicinal indígena comunican su uso en México desde finales del siglo XVI. En 1852, el doctor Leopoldo Río de la Loza, célebre investigador mexicano, reportó una sustancia extraída de estas plantas, que llamó ácido pipitzóico, notable por sus efectos purgantes en el cuerpo humano y por la propiedad de servir como indicador de la presencia positiva de las sales de sodio, sustancia que posteriormente fue reportada por servir como colorante para teñir fibras de lana, seda y algodón (Urbán y Aceves, 2001).
El género Acourtia comprende unas 50 especies, en su mayoría mexicanas, extendiéndose desde el suroeste de los Estados Unidos hasta Honduras (Rzedowski, G.C. de, J. Rzedowski et al., 2001), mismas que durante mucho tiempo fueron tratadas como miembros del género Perezia (Bacigalupi, 1931). Las plantas de este género se conocen con el nombre común de "Pipitzáhuac", nombre náhuatl que se relaciona con las características raíces fibrosas, delgadas y largas de sus plantas (Lozoya y Lozoya, 1982).
Las poblaciones naturales de estas plantas en la Sierra de Guadalupe son pequeñas y aunado a lo anterior presentan un deterioro considerable, debido a la continua devastación de sus hábitats naturales y a que los esfuerzos para domesticarla y establecer cultivos agrícolas han fracasado, por lo que desarrollar sistemas de producción por cultivo in vitro, establecería la posibilidad de conservar y regenerar a las poblaciones naturales de este género.
De manera general, en el género Acourtia donde algunas de sus poblaciones se encuentran bajo serias presiones ambientales, no se han desarrollado sistemas que permitan su conservación. Se ha reportado la propagación por semilla y por esquejes de plantas nativas de Acourtia recurvata que crecen en la Patagonia Austral y que tienen potencial ornamental (Mascó et al., 2003). Sin embargo, el establecimiento de sistemas de cultivo in vitro con fines de propagación y conservación, no ha sido reportado, a pesar de que los sistemas de cultivo in vitro ofrecerían, entre otras ventajas, la posibilidad de desarrollar cultivos agrícolas.
En nuestro laboratorio, el cultivo in vitro de algunas especies de Perezia, se inició con el trabajo de Alcántara (1992), quien logró establecer por primera vez un sistema de cultivo in vitro de P. cuernavacana, en el que se indujo la formación de un callo y donde el extracto hexánico derivado de la biomasa, presentó absorbancia a 400 nm, que indicaba la presencia de análogos estructurales del ácido pipitzóico. Posteriormente con el trabajo de Arellano et al. (1996), se desarrollaron y estudiaron sistemas de cultivos de raíces transformadas de P. cuernavacana.
Garrocho (2001) desarrolló sistemas de cultivo in vitro de plantas de A. hebeclada colectadas en el Municipio de Tlalnepantla, Estado de México y profundizó en el estudio y caracterización de los compuestos que presentaban absorbancia a 400 nm tanto en los cultivos, como en las plantas desarrolladas. Sin embargo, hasta el momento no se han reportado estudios del cultivo in vitro de especies de este género localizadas y creciendo en la Sierra de Guadalupe, así como tampoco el establecimiento de protocolos para su micropropagación, que permitan obtener individuos en cantidades suficientes para conservar, mejorar y fortalecer a sus poblaciones naturales.
OBJETIVO
Establecer protocolos para la micropropagación por Cultivo de Tejidos Vegetales, de plantas de Acourtia cordata que crecen y se desarrollan en hábitats naturales de la Sierra de Guadalupe.
METODOLOGÍA
Colecta del material biológico
Plantas completas y semillas de Acourtia cordata fueron colectadas en hábitats naturales correspondientes a dos localidades de la Sierra de Guadalupe, dentro de los terrenos del paraje "Joya de Nieves", localizado en la porción sur de la Sierra de Guadalupe, al NE de Cuautepec, en la Delegación Gustavo A. Madero, con la amable intervención y apoyo del Programa Ambiental Politécnico. Dentro de este paraje, se encuentra el "Centro de Educación Ambiental Joya de Nieves", cuya localización determinada por un geoposicionador está a 19º 33.743' de latitud Norte y 99º 06.863' de longitud Oeste.
Las dos localidades de colecta denominadas como "A" y "B", fueron seleccionadas con base en el tipo de terreno y vegetación donde se encontraban creciendo las plantas: en la localidad A, localizada 2 km al Este del Centro de Educación Ambiental Joya de Nieves, el terreno presentaba una pendiente prolongada y la vegetación correspondía a bosque de eucaliptos; en la localidad B, localizada 5 km al Sur del mencionado Centro, el terreno era plano, cerca de un camino de terracería y la vegetación estaba conformada de bosque de eucalipto y de matorral espinoso (Fig. 1b). Las colectas se realizaron durante los meses de diciembre, cuando las plantas se encontraban en floración y en febrero, cuando sus semillas se encontraban maduras.
Las plantas colectadas fueron secadas y preparadas para ser identificadas por el equipo de investigadores del Herbario de la Escuela Nacional de Ciencias Biológicas y un ejemplar (Fig. 1c), quedó depositado en el Herbario de dicha Institución.
Con las semillas colectadas, se iniciaron los estudios de micropropagación por cultivo in vitro. Para los siguientes protocolos y a menos que se indique otra cosa, todos los cultivos in vitro se mantuvieron con fotoperiodo de 16 horas luz y 8 horas oscuridad, con iluminación proporcionada por lámparas de luz fluorescente de día, con 364 μmol m-2 s-1 (equivalente a 78 watts de radiación fotosintéticamente activa, PAR) y a temperatura de 25-26º C.
Germinación de semillas
A las semillas se les eliminó el vilano, se lavaron con agua y jabón, se desinfectaron superficialmente por tratamiento durante un minuto con etanol al 70%, seguido de inmersión durante 15 minutos, en una solución de hipoclorito de sodio con una concentración de cloro activo de 1.5%, con enjuague y remojo en agua destilada durante 24 horas, repitiendo el procedimiento una vez transcurrido este tiempo. La siembra de las semillas se realizó en campana de flujo laminar, colocando 12 semillas en cada frasco y se determinaron: el tiempo de inicio de la germinación, el tiempo en el cual se alcanzó el 50% de germinación en las cinéticas de germinación.
Para la germinación de las semillas, se usaron frascos de vidrio conteniendo 20 mL. de medio MS (Murashige y Skoog, 1962), al 50% y sin reguladores de crecimiento, adicionado con 30 g/L de sacarosa, el pH se ajustó a 5.8, se adicionaron 7 g/L de agar como agente gelificante. Los frascos fueron esterilizados en autoclave a 15 lb/in2 durante 20 minutos.
Inducción de respuestas morfogenéticas
Con las plántulas desarrolladas de la germinación in vitro de las semillas de sendas localidades, se iniciaron los experimentos para determinar las condiciones de cultivo y la combinación de reguladores de crecimiento capaces de inducir respuestas morfogenéticas de los explantes derivados de estas plántulas, para lo cual se desarrolló un diseño factorial, tomando como base el medio MS basal al 100%, adicionado de: sacarosa 30 g/L, agar 7 g/L y ajustando el pH a 5.8, se prepararon frascos de cultivo con 15 tratamientos, con combinaciones diferentes de auxinas y de citocininas, adicionadas en concentraciones de 5 mg/L y 0.5 mg/L respectivamente, con base en el esquema que se muestra en la tabla 1.

Se colocaron en cada frasco con un determinado tratamiento, cinco fragmentos de hoja de aproximadamente 1 cm2, cinco fragmentos de raíz con aproximadamente 1 cm de longitud y cinco fragmentos de internodo también con aproximadamente 1 cm de longitud. Se realizaron cuatro repeticiones para cada tratamiento con una combinación específica de auxina y de citocinina para asegurar consistencia en las respuestas. Se hicieron evaluaciones y registros semanales de las respuestas desarrolladas por los diferentes explantes en cada combinación de reguladores de crecimiento, para los cultivos correspondientes a cada localidad de colecta.
Inducción de raíz en los brotes
Los brotes generados por organogénesis indirecta en aquellos cultivos in vitro que favorecieron dicha respuesta, se separaron de los callos y se trasplantaron al medio de cultivo basal (MS al 100%) donde se probaron cinco tratamientos, que consistieron en diferentes combinaciones y concentraciones de reguladores de crecimiento, seleccionados con base en los resultados obtenidos de enraizamiento en el diseño factorial, los cuales se denominaron: M-2 (AIB 5 mg/L y KIN 0.5 mg/L), M-8 (ANA 5 mg/L y BAP 0.5 mg/L) y M-12 (AIB 5 mg/L); los medios: MH (AIB 2 mg/L) y MS sin reguladores de crecimiento, fueron usados como controles.
Todos los medios, contenidos en frascos de vidrio fueron esterilizados en autoclave a 15 lb/in2 de presión durante 15 min. Se sembraron cinco brotes por frasco y se realizaron cinco repeticiones para cada tratamiento probado. Se evaluó la formación y el desarrollo de la raíz semanalmente.
Desarrollo y enraizamiento de yemas
Para inducir el enraizamiento de los brotes desarrollados de las yemas axilares y apicales, separadas de las plántulas provenientes de semillas germinadas in vitro, se probaron los mismos tratamientos utilizados para inducir el enraizamiento de los brotes generados por morfogénesis, descritos anteriormente.
Como explantes se sembraron las yemas apicales de las plántulas desarrolladas in vitro y fragmentos de internodo con una yema axilar, estructuras generalmente conocidas como nodos. Se colocaron cuatro nodos y una yema apical por cada tratamiento de cultivo probado, incluyendo al control y se realizaron cuatro repeticiones para cada uno. El seguimiento de la respuesta de inducción de raíz y el desarrollo de plantas completas se realizó semanalmente.
Análisis estadístico
Los datos experimentales de respuesta y rendimientos obtenidos, fueron analizados por análisis de varianza con apoyo del Programa Estadístico Sigma Stat Versión 3.5, en el análisis por comparación múltiple de medias se aplicó el método de Tukey. Para la determinación de las interacciones entre reguladores de crecimiento, se realizó análisis bifactorial de los rendimientos para cada una de las respuestas presentadas por los explantes después de seis semanas en cultivo. También se realizó un análisis bifactorial para cada una de las respuestas obtenidas in vitro, con el fin de determinar la existencia de diferencias significativas en los niveles de respuesta entre los diferentes tratamientos, así como entre el tipo de explantes sembrados en ellos, y un análisis trifactorial, para determinar las interacciones entre los tratamientos aplicados, el tipo de explante sembrado y las localidades de colecta. Para los análisis estadísticos los valores expresados como porcentaje fueron transformados por arcoseno y se fijó un nivel de significancia de 5% para todas las pruebas.
RESULTADOS Y DISCUSIÓN
Identificación de las plantas colectadas
Las plantas colectadas en las localidades A y B de la Sierra de Guadalupe anterior-mente descritas, fueron identificadas por el doctor J. Rzedowski como Acourtia cordata (Cerv.) Turner.
Germinación de las semillas in vitro
En las figuras 2a, 2b y 2c, se observan respectivamente, el aspecto de las semillas colectadas de las plantas en sus hábitats naturales mostrando su vilano, las semillas colocadas en los frascos para su germinación in vitro, y el desarrollo de las plántulas germinadas en los cultivos bajo condiciones asépticas, mismas que alcanzaron en promedio 15 cm. de altura en un periodo de 12 semanas. Se observó que las semillas colectadas iniciaron su proceso de germinación in vitro dos días después de haber sido colocadas en los frascos de cultivo, registraron en promedio un 50% de germinación a los cuatro días y alcanzaron el 100% de germinación a los 10 días de cultivo.

Durante las diferentes siembras realizadas de semillas, la contaminación fue muy baja, con registro promedio de 0.5%. Adicionalmente, no se encontraron diferencias significativas entre los índices de germinación, expresados como porcentaje, entre los diferentes lotes de semillas colectadas correspondientes a una misma localidad (p = 0.502), así como tampoco hubo diferencias significativas entre las localidades A y B, tanto en lo referente a los índices de germinación (P = 0.333), como en los tiempos promedio de germinación de las semillas.
Los resultados anteriores resultan interesantes si se toma en consideración que se partió de semillas colectadas de plantas creciendo de manera silvestre en la Sierra de Guadalupe, las cuales comúnmente se encuentran muy contaminadas y presentan serios problemas de oxidación.
Adicionalmente los índices de germinación fueron muy altos, porque en todos los cultivos realizados germinaron prácticamente el total de las semillas sembradas, fenómeno que no ocurre en los hábitats naturales, donde la pérdida de semillas es alta y sus índices de germinación son bajos. Lo anterior representa una ventaja competitiva muy importante para el establecimiento de sistemas de micropropagación in vitro.
Inducción de respuestas en los cultivos
Las respuestas que presentaron los explantes derivados de las plántulas correspondientes a las dos localidades A y B, desarrolladas a partir de la germinación de sus semillas in vitro, en los diferentes tratamientos de cultivo que conformaron el diseño factorial, se evaluaron durante ocho semanas después de la colocación de los explantes en los tratamientos correspondientes. En prácticamente todas las siembras realizadas, la contaminación fue muy baja: 0.2%. Adicionalmente, no se detectaron procesos de oxidación en los tejidos sembrados.
Se observó la inducción de tres tipos de respuestas in vitro, tanto en los explantes derivados de internodos, como en los derivados de hojas: el desarrollo de callos, que comenzó durante la 2ª semana en cultivo y la inducción de brotes o de raíces entre la 5ª y la 6ª semana en cultivo, ambos a través de procesos de organogénesis indirecta es decir, posterior a la formación de callo. Los explantes derivados de raíces, no presentaron respuesta alguna en todos los tratamientos estudiados. Por otro lado, en el total de los tratamientos donde hubo morfogénesis indirecta, no todos los callos desarrollados por los explantes la presentaron.
Un diseño factorial como el planteado como estrategia experimental, permite explorar combinaciones de reguladores de crecimiento y su efecto sobre los diferentes tipos de respuesta inducida en los explantes colocados en los cultivos in vitro, lo que representa la ventaja de poder desarrollar diferentes tipos de sistemas de cultivo, dependiendo de objetivos de investigaciones que deriven de este trabajo, como por ejemplo, el desarrollo de cultivos en suspensión para el estudio de la producción de los metabolitos de importancia.
En las figuras 2d, 2e, 2f y 2g, se observa el aspecto de los explantes sembrados en los diferentes tratamientos de cultivo, así como la morfología representativa de los callos, brotes y raíces desarrollados como respuesta a las diferentes combinaciones de reguladores de crecimiento en el diseño factorial.
En la tabla 2 se reporta un concentrado de las respuestas desarrolladas por los explantes de hoja e internodo derivados de plántulas correspondientes a las localidades "A" y "B", para cada uno de los tratamientos probados, así como sus niveles de respuesta, es decir, los rendimientos promedio correspondientes a cada tratamiento, por tipo de explante y por localidad. Estos últimos expresados como el promedio del porcentaje de explantes que presentaron esa respuesta, respecto del número total de explantes sembrados en cada repetición con un tratamiento particular.
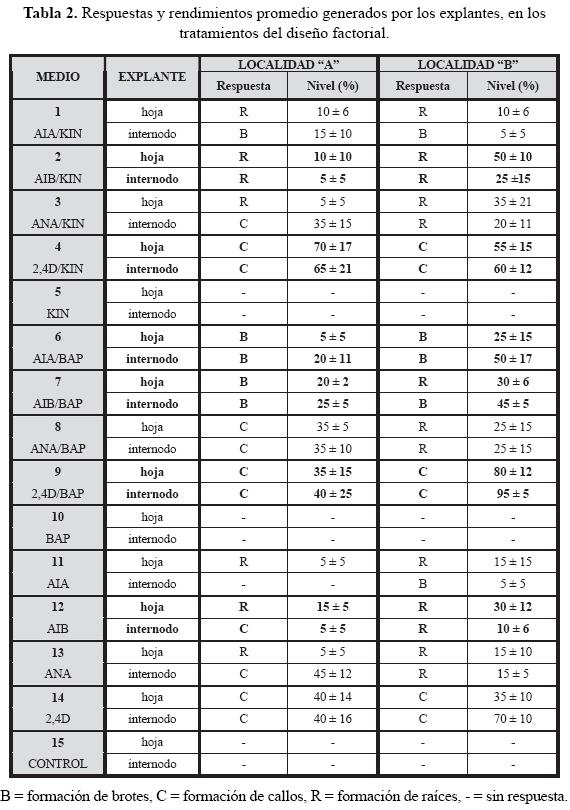
En todos los casos, el tipo de respuesta inducida en los cultivos fue determinada por la presencia de reguladores de crecimiento, así como por la combinación particular de auxinas y citocininas presentes, lo que se confirma por el hecho de que en el tratamiento control (M-15), sin reguladores de crecimiento, los explantes tanto de hoja como de internodo no desarrollaron respuesta alguna, fenómeno que se repitió en los tratamientos donde no había auxina (M-5 y M-10).
Se encontró que en general el tipo de respuesta desarrollada por los explantes para cada tratamiento particular, fue similar entre las dos localidades, con excepción del tratamiento M-8 donde los explantes de las plántulas de la localidad B desarrollaron raíces a partir de los callos y los de las plántulas de la localidad A no lo hicieron.
Sin embargo, si bien el tipo de respuesta fue similar, los rendimientos obtenidos y la calidad de las respuestas generadas, entendida esta última como el aspecto, vigor y grado de desarrollo de los callos, brotes o raíces generados, mostraron importantes diferencias entre las dos localidades y entre el tipo de explante sembrado. Se determinó que la calidad de callos, brotes y raíces generados de los explantes de plántulas de la localidad B, fue superior en todos los tratamientos.
Se encontró que los rendimientos para cada tipo de respuesta, fueron afectados por las diferentes combinaciones de reguladores de crecimiento presentes en los tratamientos que la generaron, hecho que se apoya en los resultados del análisis estadístico, cuyos resultados con la correspondiente comparación múltiple de medias en los casos donde se encontró significancia estadística, se muestran en la tabla 3.
En la tabla 4 se muestran los resultados del análisis estadístico donde se determinó la existencia de diferencias significativas entre los rendimientos correspondientes a los diferentes tratamientos que generaron un tipo de respuesta (callo, brotes y raíces), así como los resultados de la comparación múltiple de medias en aquellos casos donde existió significancia estadística.

Con base en los resultados obtenidos, los análisis realizados y considerando tanto criterios cuantitativos de rendimiento, como cualitativos de calidad, se seleccionaron a los tratamientos conteniendo a la auxina 2,4D (M-4, M-9), para el desarrollo de callos friables no morfogéneticos, de aspecto vigoroso y crecimiento rápido y donde no se encontraron diferencias importantes en las características mencionadas, entre los callos desarrollados a partir de hojas con los de internodos. Cabe mencionar que aun cuando se obtuvieron diferencias significativas con el tratamiento M-14, éste no se seleccionó debido a la calidad inferior de su respuesta.
Estos cultivos de callos podrían ser empleados en el establecimiento de sistemas de células en suspensión, para estudiar la producción de los metabolitos secundarios de estas plantas.
En la búsqueda de morfogénesis para establecer protocolos de propagación in vitro, se determinó que en los tratamientos conteniendo a las auxinas AIA y AIB en combinación con la citocinina BAP (M-6 y M-7), se formaron brotes vigorosos, bien desarrollados, con rendimientos significativamente mayores a los otros tratamientos. Es importante mencionar que aun cuando en la tabla 2 se reporta la formación de brotes en algunos otros tratamientos, el rendimiento y la calidad de los mismos no resultaron adecuados para considerarlos en el desarrollo de protocolos de micropropagación.
En este caso, los rendimientos en la formación de brotes, fueron significativamente mayores en los callos derivados de internodos respecto a los callos generados de hojas y además, la calidad de los brotes generados en el tratamiento M-6, fue mejor.
Por otro lado, las respuestas de inducción de morfogénesis indirecta de raíces que mostraron diferencias con significancia estadística en sus rendimientos, se obtuvieron en los tratamientos de cultivo M-2 y M-12, donde la presencia de la auxina AIB fue importante para la formación de raíces, adicionalmente, en estos tratamientos se observó el crecimiento de pequeñas raíces secundarias.
En estos tratamientos los rendimientos en la producción de raíces fueron significativamente mayores en los callos derivados de hojas, respecto a los callos formados a partir de los internodos, contrariamente a lo reportado para la organogénesis de brotes.
En el caso particular de los explantes derivados de las plántulas correspondientes a la localidad B, donde también hubo inducción de organogénesis indirecta de raíces en los tratamientos con la auxina ANA (M-3 y M8), se consideró como una desventaja, que esta respuesta morfogenética se encontró acompañada del desarrollo paralelo de abundante callo. En los otros tratamientos donde se formaron raíces, se encontró que tanto los rendimientos obtenidos, como la calidad de las mismas resultaron inferiores.
Considerando que en general, la calidad de las respuestas en cultivo in vitro fueron mejores para la localidad B, se decidió trabajar en lo sucesivo con las plantas de esta localidad, teniendo como ventajas adicionales de mayor accesibilidad a las zonas de colecta y de contar con mayor número de ejemplares adultos en su hábitat natural, lo que podría ser reflejo de su grado de adaptabilidad.
Inducción de raíces en brotes
Para el desarrollo de los protocolos de micropropagación, se seleccionó al tratamiento M-6 para la inducción y desarrollo de brotes por organogénesis indirecta, mismos que fueron trasplantados a los tratamientos: M-2, M-8 y M-12, por ser éstos donde se obtuvieron los mayores rendimientos en la generación de raíces. Los mismos tratamientos fueron empleados para el enraizamiento de los brotes desarrollados de yemas axilares y apicales derivados de plantas germinadas y desarrolladas in vitro. Como se ha mencionado, se usaron los medios MS y MH, como controles.
Los resultados de inducción de raíces y desarrollo de plantas completas en cultivo in vitro, se registraron a la 6ª semana de haber colocado a los brotes en los tratamientos de enraizamiento, aun cuando se observó la formación de raíces en los tratamientos que favorecieron dicha respuesta, desde la 3ª semana de cultivo.
En la figura 3 se observa el aspecto de las raíces desarrolladas por los brotes generados por organogénesis indirecta y por los brotes desarrollados de las yemas axilares y apicales y en la tabla 5 se muestran los rendimientos obtenidos, expresados como el promedio del porcentaje de brotes que enraizaron, respecto del número total de brotes sembrados en cada repetición de los tratamientos seleccionados. Se observa que en los brotes desarrollados de las yemas apicales o axilares colocados en el tratamiento M-8, no hubo inducción de raíces.


El análisis estadístico reveló diferencias significativas entre el tipo de explantes (p = 0.009) y de la comparación múltiple de medias se infiere que los brotes desarrollados por procesos de morfogénesis y los desarrollados de yemas apicales, presentaron mayores rendimientos de enraizamiento respecto a los brotes de yemas axilares; esto último podría deberse a que las yemas axilares probablemente requieren de mayor tiempo para romper su latencia.
También se registraron diferencias significativas entre tratamientos (p < 0.001), en este caso la comparación de medias mostró que los brotes sembrados en los tratamientos conteniendo a la auxina AIB (M-2, M-12 y MH), presentaron niveles de enraizamiento superiores respecto al medio control MS. Sin embargo no se encontraron diferencias significativas entre los rendimientos de enraizamiento correspondientes a los tratamientos mencionados.
Resulta interesante mencionar que las interacciones entre el tipo de explante y los tratamientos no fueron significativas (p = 0.552), de donde se infiere que el efecto en la inducción y desarrollo de raíces por los tratamientos que dieron respuesta positiva, no está determinada por el factor de que los brotes fueran generados de yemas o de procesos de morfogénesis.
De los resultados anteriores, para el establecimiento de protocolos de micropropagación in vitro de plantas de Acourtia cordata, a través de procesos morfogenéticos y por desarrollo de yemas en cultivo, se seleccionó al medio M-12, donde se obtuvo un nivel promedio de 61% de brotes enraizados, en virtud de que adicionalmente al rendimiento, el aspecto y vigor de las raíces desarrolladas fueron superiores.
Los resultados obtenidos abren la posibilidad de profundizar los estudios como por ejemplo, la aplicación de los fundamentos del diseño de biorreactores en la micropropagación (Curtis, 2005), para mejorar tanto el rendimiento, como la calidad de los brotes y de las raíces desarrolladas en los cultivos in vitro, que dicho sea de paso, representa una de las áreas fundamentales de investigación dentro del cultivo de tejidos vegetales, porque de ello depende en gran medida la aclimatación y adaptación posterior de las plantas en condiciones ex vitro.
El establecimiento de protocolos de micropropagación ha captado el interés de muchos grupos de investigación debido a las importantes alternativas que ofrece para el estudio y conservación de genotipos valiosos, ya sea por su importancia ornamental como es el caso de Mercardonia tenella, planta herbácea que presenta un follaje verde intenso con gran cantidad de flores de color amarillo (Alderete et al., 2006), o por su importancia medicinal, como productoras de sustancias con actividad farmacológica, como Phyllanthus niruri L., planta empleada en la expulsión de cálculos biliares y renales (Jiménez et al., 2007), o como Castilleja tenuiflora Benth, planta también conocida como hierba del cáncer (Salcedo-Morales et al., 2009), donde el desarrollo de protocolos que permitan propagar y conservar a esta especie, representa un importante esfuerzo por rescatar y conservar los importantes recursos genéticos con que cuenta México.
El establecimiento de protocolos que permitan conservar y propagar in vitro de especies del género Acourtia, como es el caso de A. cordata, tiene gran importancia en virtud de que en la amplia búsqueda en la literatura realizada, no se encontraron reportes acerca del establecimiento de protocolos de micropropagación in vitro para estas plantas.
Adicionalmente, en el caso particular de A. cordata, el establecimiento de sistemas de cultivo in vitro, adquiere mayor relevancia, por representar una alternativa viable para la conservación de un recurso genético importante de la Sierra de Guadalupe.
Factor de propagación in vitro
Con los explantes y los tratamientos de cultivo definidos, los tiempos de respuesta determinados y las condiciones de incubación establecidas, se realizó una estimación del factor de propagación de las plantas de Acourtia cordata por cultivo in vitro:
A partir de cada semilla germinada se desarrolla en 12 semanas una plántula de 15 cm de altura en promedio, de la cual se derivan 36 ± 5 explantes de hoja y 41 ± 6 explantes de internodo en promedio, mismos que en ocho semanas de cultivo, generan por morfogénesis indirecta 22 ± 3 brotes, considerando como el rendimiento promedio obtenido en todas las siembras realizadas durante este estudio: 20% de respuesta para los explantes derivados de hojas y 37% para los derivados de internodos. Los brotes al ser transferidos al medio de enraizamiento con un 76% de rendimiento promedio de desarrollo de raíces, generan 17 ± 2 plantas completas en seis semanas.
Paralelamente, con el cultivo de las yemas axilares y apicales, donde se encontró que prácticamente todas las yemas sembradas desarrollan brotes, de cada plántula en promedio se obtienen una yema apical y 10 ± cuatro yemas axilares, las que en seis semanas de cultivo, con 50% de respuesta promedio de enraizamiento, generan cinco ± dos plántulas completas por cada planta donadora.
Por lo que en lugar de contar con una planta germinada de cada semilla, por procesos biotecnológicos y combinando los dos protocolos de cultivo para Acourtia cordata, se determinó un factor de propagación promedio de 22 ± 2 plantas generadas in vitro en un periodo de 6.5 meses por cada semilla germinada, mismas que están preparadas para ser aclimatadas ex vitro para continuar su desarrollo en invernadero antes de ser trasplantadas a sus hábitats naturales.
Los sistemas de cultivo in vitro desarrollados para esta especie, pueden emplearse en investigaciones posteriores, como ejemplo, el escalamiento futuro de estos protocolos de micropropagación a través de cultivo en biorreactores adecuados, o el estudio, caracterización y optimización de la producción de los compuestos de interés producidos por estas plantas.
CONCLUSIONES
De los resultados obtenidos y con base en los análisis estadísticos de los resultados cuantitativos realizados y en la evaluación cualitativa de la calidad de las respuestas, se establecieron dos protocolos de micropropagación para plantas de Acourtia cordata que crecen de manera silvestre en hábitats naturales de la Sierra de Guadalupe.
El primero de ellos a partir del desarrollo in vitro de brotes de yemas apicales y axilares derivadas de plántulas germinadas en cultivo y su posterior enraizamiento en los medios de cultivo descritos; este protocolo cuyos explantes son yemas ya formadas, favorece la estabilidad fenotípica entre las plantas desarrolladas in vitro.
El segundo protocolo genera plantas a través de la inducción de brotes en explantes derivados de hojas e internodos a través de procesos de organogénesis indirecta y su posterior enraizamiento en los medios y condiciones ya referidas, en este caso al formarse y desarrollarse callo por divisiones sucesivas antes de producirse la morfogénesis de los brotes, se favorece la variación fenotípica en las plantas generadas en los cultivos.
La combinación de los dos protocolos, permite aprovechar a todos los explantes derivados de las plantas donadoras, lo que aunado al alto porcentaje de germinación in vitro que presentan las semillas, ofrece la alternativa de contar con sistemas de multiplicación in vitro muy eficientes para las plantas de Acourtia cordata cuyo hábitat se localiza en la Sierra de Guadalupe.
Este estudio podría servir de base para la conservación y la propagación in vitro de otras especies de este importante género, que probablemente existen y son factibles de ser identificadas y estudiadas al ampliar las áreas de exploración y colecta hacia otras regiones de la sierra, considerando la gran extensión de la misma.
El estudio realizado, permite proponer estrategias para la protección, restauración y conservación de germoplasmas valiosos que crecen en áreas naturales protegidas que están sujetas a grandes presiones ecológicas como es el caso de la Sierra de Guadalupe.
AGRADECIMIENTOS
Los autores desean agradecer a la doctora María de la Luz Arreguín Sánchez y al doctor Jerzy Rzedowski Rotter, por su valiosa colaboración en la identificación de las plantas colectadas, al maestro en ciencias Jacinto Elías Sedeño Díaz del Programa Ambiental Politécnico y al Biólogo Gustavo Figueroa del Centro de Educación Ambiental "Joya de Nieves", por todo el apoyo recibido para la realización de las colectas tanto de las semillas, como de las plantas que sirvieron de punto de partida para la realización de este trabajo. Este trabajo fue subsidiado por la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional. Los autores: E. Cristiani U. y T.L. Villegas G. son becarios de la COFAA.
LITERATURA CITADA
Alcántara-Salazar, S., 1992. "Cultivo in vitro de Perezia cuernavacana para el estudio de la producción de un colorante". Tesis Profesional, ENCB-IPN, México. 91 pp. [ Links ]
Alderete, L. M., Mori, M., Kato, A., Escandón, A.S., 2006. "Establishment of an in vitro micropropagation protocol for Mercardonia tenella". Electronic J. of Biotech., 9(3): 263-266. [ Links ]
Arellano, J., Vazquez, F., Villegas, T., and Hernández, G., 1996. "Establishment of transformed root cultures of Perezia cuernavacana producing the sesquiterpene quinone perezone". Plant Cell Reports, 15: 455-458. [ Links ]
Bacigalupi, R., 1931. "A monograph of the genus Perezia, section Acourtia, with a provisional key to the section Euperezia". Contr. Gray Herb., 97: 1-81. [ Links ]
Curtis. W. C., 2005. "Application of bioreactor design principles to plant micropropagation". Plant Cell Tissue and Organ Culture, 81: 255-264. [ Links ]
Flores, F., 1982. "Historia de la Medicina en México desde la época de los indios hasta el presente". Facsimilar, IMSS, vol. 3, México. 472 pp. [ Links ]
Gaceta Oficial del Distrito Federal, 2003. "Acuerdo por el que se aprueba el Programa de Manejo del Área Natural Protegida con la categoría de Zona Sujeta a Conservación Ecológica denominada 'Sierra de Guadalupe'". Órgano de Gobierno del Distrito Fed., Décima Tercer Época, 94: 35-50. [ Links ]
García-Palomo, A., Carlos-Valerio, V., López-Miguel, C., Concha-Dimas, A., 2006. "Landslide inventory map of Guadalupe Range, north of the Mexico Basin". Boletín de la Soc. Geológica mexicana. Número Especial de Geología Urbana, Tomo LVIII, núm. 2: 195-204. [ Links ]
Garrocho-Villegas, V., 2001. "Desarrollo de un sistema de cultivo in vitro de plantas del género Acourtia, que permita el escalamiento en la producción del colorante perezona". Tesis de Maestría, ENCB-IPN, México. 93 pp. [ Links ]
George, E.F. y Debergh, P.C., 2008. "Micropropagation: Uses and Methods". Plant propagation by Tissue Culture. 3rd Edition. Vol. 1. Edited by Edwing F. George, Michael A. Hall and Geert-Jan De Klerk. Springer. 504 pp. [ Links ]
Jiménez, M., Alvarenga, S., Alan, E., 2007. "Establecimiento del protocolo de micropropagación para la planta medicinal Phyllanthus niruri L. (Euphorbiaceae)". Tecnología en marcha, vol. 20: 32-40. [ Links ]
Lozoya, X. y M. Lozoya, 1982. "Flora medicinal de México". Primera parte: Plantas indígenas. Instituto Mexicano del Seguro Social, México. pág. 309. [ Links ]
Mascó, M., Kofalt, R., Franchini, C., Oliva, G., Zerpa, D., Mazzoni, A. y Humano, G., 2003. "Propagación de Perezia recurvata (Vahl) Lessing (Asteraceae), un subarbusto tapizante patagónico". En Botánica Argentina, boletín 38. pág. 45. [ Links ]
Murashige, T. and F. Skoog, 1962. "A revised medium for rapid growth and bioassays with tobacco cultures". Physiol. Plant., 15: 473-497. [ Links ]
Rzedowski, G.C. de y J. Rzedowski y colaboradores, 2001. Flora Fanerogámica del Valle de México. 2ª Edición. Instituto de Ecología, A.C. y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Pátzcuaro (Michoacán), México. 1406 pp. [ Links ]
Salcedo-Morales, G., Rosas-Romero, G., Nabor-Correa N., Bermúdez-Torres, K., López-Laredo, A. R., Trejo-Tapia, G., 2009. "Propagation and conservation of Castilleja tenuiflora Benth. ("hierba del cáncer") through in vitro culture". Polibotánica, 28: 119-137. [ Links ]
Tisserat, B., 1987. "Embryogenesis, Organogenesis and Plant regeneration". In Plant Cell Culture, a practical approach. Edited by R.A. Dixon. IRL Press, Oxford, England. 450 pp. [ Links ]
Tejero Díez, J.D. y Medina Lemus, J.G., 2006. "Flora y Vegetación del Parque Estatal Atizapán-Valle Escondido, Estado de México, México". Polibotánica, 21: 1-43. [ Links ]
Urbán-Martínez, A. y Aceves-Pastrana, P.A., 2001. "Leopoldo Río de la Loza en la institucionalización de la Química Mexicana". Rev. de la Soc. Química de México, 45(1): 35-39. [ Links ]














