Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Polibotánica
Print version ISSN 1405-2768
Polibotánica n.29 México Mar. 2010
Evaluación de la promoción del crecimiento de Cynodon dactylon L. por rizobacterias productoras de fitohormonas aisladas de un suelo contaminado con hidrocarburos derivados del petróleo
Evaluation of growth promotion of Cynodon dactylon L., by phytohormone-producing rhizobacteria isolatede from soil contaminated with petroleum hydrocarbons
Adriana Rojas Contreras1, Angélica Ma. Rodríguez Dorantes1*, Silvano Montes Villafán1, Sandra Pérez Jiménez1, Aída Rodríguez Tovar2*, L. Angélica Guerrero Zúñiga3
1 Lab. Fisiología Vegetal, Departamento de Botánica, Escuela Nacional de Ciencias Biológicas, IPN, Prol. Carpio y Plan de Ayala s/n. CP 11340, México, DF Correo electrónico: anrodo2000@hotmail.com.
2 Lab. Micología Médica, Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, IPN, Prol. Carpio y Plan de Ayala s/n. CP 11340, México, DF.
3 Dirección de Seguridad y Medio Ambiente, Instituto Mexicano del Petróleo, Eje Central Lázaro Cárdenas 152, CP 07730, México, DF.
Recibido: 16 enero 2009.
Aceptado: 13 octubre 2009.
Resumen
El analizar rizobacterias por su potencial in vitro de producción de auxinas puede proveer de una base rentable para la selección de cepas efectivas, particularmente si esta capacidad se emplea en combinación con el análisis de su actividad promotora del crecimiento. Este estudio consistió en la caracterización de la producción intrínseca de rizobacterias aisladas de un suelo contaminado con hidrocarburos derivados del petróleo de producir ácido indolacético y el efecto de éstas sobre el crecimiento in vitro de Cynodon dactylon L, inoculada con estas rizobacterias en sistemas hidropónicos. Las rizobacterias aisladas I, II y III resultaron altas productoras in vitro de ácido indolacético. Se evidenció también la promoción del crecimiento de las plantas de Cynodon dactylon L. con la inoculación de las rizobacterias I y II. En experimentos con la adición de triptofano al medio y la inoculación con la rizobacteria III se observó la acción directa de la presencia del precursor en la biosíntesis de ácido indolacético que favoreció el desarrollo radical y foliar de las plantas.
Palabras clave: ácido indolacético, rizobacterias promotoras del crecimiento vegetal, Cynodon dactylon.
Abstract
The selection of plant growth-promoting rhizobacteria (PGPR) can be based on the in vitro analysis of their auxin-producing and growth-promoting capabilities. This study determined the intrinsic production of indole acetic acid (IAA) by rhizobacteria isolated from petroleum-contaminated soil and tested its potential for growth promotion. The three isolated rhizobacteria (I, II and III) were high producers of indole acetic acid in vitro. Cynodon dactylon L. was inoculated with these isolates in hydroponic systems. The Rhizobacterium spp. strains I and II showed plant growth promotion without the addition of Trp (a common precursor in the biosynthesis of IAA), whereas strain III required the addition of Trp to promote foliar development in C. dactylon.
Key words: indoleacetic acid, plant growth-promoting rhizobacteria, Cynodon dactylon.
INTRODUCCIÓN
La rizosfera se define como: "el volumen del suelo que recibe influencia de la raíz". Esta capa delgada que circunda la raíz de la planta (cerca de 1 a 2 mm de espesor) ha sido estudiada intensamente en los últimos años. En esta zona residen la mayoría de los microorganismos del suelo, atraídos por los metabolitos que la planta exuda, lo que ocasiona el incremento de las poblaciones microbianas y con ello su actividad (Kuiper et al., 2004).
Las interacciones entre bacterias y las raíces pueden ser benéficas, dañinas o neutras para las plantas (Tenuta, 2003). A partir del conocimiento de la rizosfera se ha visto la necesidad de dividir este espacio en endorizosfera y ectorizosfera; si se coloniza sólo la superficie de la raíz se conoce como rizoplano, que pertenece a la ectorizosfera y si invade las células de las capas superficiales de la raíz corresponde a la zona conocida como endorizosfera (Pérez et al., 2002; Tsavkelova et al., 2006).
Todas aquellas bacterias que habitan en las raíces de las plantas y que influyen sobre el crecimiento de éstas de manera positiva indirecta o directamente por cualquier mecanismo, se denominan o refieren como rizobacterias promotoras del crecimiento vegetal (RPCV) (Ahmad et al., 2008; Arshad & Frankenberger, 1998; Frankenberger & Arshad, 1995; Kloepper et al., 1986, 1989).
Estas bacterias afectan significativamente el crecimiento vegetal al suprimir la acción de patógenos, al producir antibióticos, sideróforos, sustancias antagonistas de bacterias y hongos e incrementar la disponibilidad de nutrientes al producir sustancias biológicamente activas como hormonas vegetales (Lynch, 1995). Dentro de los géneros de bacterias de este tipo se tienen a Pseudomonas, Azospirillum, Azotobacter, Serratia, Bacillus, Klebsiella, Enterobacter y Xanthomonas, que se ha demostrado que promueven el crecimiento vegetal (Ahmad et al., 2005; Khalid, et al., 2004) y que como ejemplo de interacción interorganísmica se tiene la producción microbiana de hormonas vegetales como auxinas, citocininas y giberelinas; las cuales permiten la interacción entre ciertas bacterias y la acción directa sobre la fisiología de la planta (Lambrecht et al., 2000).
El mecanismo más significativo de la promoción del crecimiento radical de las RPCV es la producción de ácido indolacético (AIA); no obstante esto, se tiene como hipótesis que existen múltiples mecanismos que operan simultáneamente o en sucesión y que pueden explicar el efecto de la promoción del crecimiento de las plantas por las bacterias (Bashan et al., 2004).
Como otras fitohormonas, las auxinas también se sintetizan endógenamente por las plantas; sin embargo, sus efectos hormonales se han elucidado por sus aplicaciones exógenas. También se tiene una amplia evidencia de que algunos microorganismos del suelo están involucrados activamente en la síntesis de auxinas (Arshad & Frankenberger, 1998; Sarwar & Kremer, 1995).
El L-triptofano (L-Trp) es un aminoácido que se tiene como precursor fisiológico para la biosíntesis de auxinas en plantas y microorganismos (Frankenberger & Arshad, 1995). Los exudados radicales son fuente natural del Trp para la microbiota rizoférica, la cual puede potenciar la biosíntesis de auxinas en la rizosfera (Krauchenko et al., 1991). Se sabe que las auxinas de origen microbiano en la vecindad de las raíces de las plantas, pueden dar también una respuesta fisiológica para la planta hospedera. El AIA es la principal auxina de las plantas, que controla una variedad de procesos importantes que incluyen el alargamiento y división celular, la diferenciación tisular y las respuestas fisiológicas a la luz y la gravedad (Silverstone et al., 1993). Los productores bacterianos de AIA, poseen el potencial para interferir en cualquiera de los procesos anteriores, incorporando AIA en la poza de auxinas de las plantas. La consecuencia de esto para las plantas, está relacionado con la cantidad de AIA que se produce y la sensibilidad del tejido vegetal para cambiar de acuerdo con la concentración de AIA; actualmente se han realizado numerosas investigaciones sobre la genética y bioquímica de la producción bacteriana de esta auxina (Lambrecht et al., 2000; Leveau & Lindow, 2005). El analizar las rizobacterias por su potencial in vitro de producción de auxinas, puede proveer una base rentable para la selección de RPCV efectivas, particularmente si esta capacidad se emplea en combinación con el análisis de las rizobacterias por su actividad promotora del crecimiento (Khalid et al., 2004).
La fitoremediación asistida con endófitos o rizoremediación, es una disciplina prometedora para mejorar la remediación al emplear microorganismos asociados con plantas para potenciar su crecimiento y con ello favorecer su tolerancia al estrés (Dowling & Doty, 2009).
No obstante que las RPCV se han empleado para promover el crecimiento y para el control de enfermedades en plantas, se ha centrado su atención en la bioremediación (Huang et al., 2004, 2005; Narasimhan et al., 2003); por ello, el aislamiento de bacterias capaces de promover el crecimiento y degradar compuestos orgánicos en asociación con plantas, juega un papel muy importante a futuro (Zhuang et al., 2007). Este estudio consistió en la caracterización de la producción intrínseca de rizobacterias aisladas de un suelo contaminado con hidrocarburos derivados del petróleo de producir ácido indolacético y el efecto de éstas sobre el crecimiento in vitro de Cynodon dactylon L, inoculada con estas rizobacterias en sistemas hidropónicos.
MATERIAL Y MÉTODOS
Reactivación e identificación de bacterias aisladas de un suelo contaminado con hidrocarburos derivados del petróleo
Las bacterias seleccionadas fueron aisladas de diferentes zonas de un suelo contaminado con hidrocarburos derivados del petróleo, cuya concentración de hidrocarburos de fracción ligera (HCFL) es de 90 ppm, de hidrocarburos de fracción media (HCFM) de 100 ppm y de hidrocarburos de fracción pesada (HCFP) de 450 ppm. Las cepas se reactivaron para la conservación de su capacidad productora de AIA, se resembraron y conservaron en placas con agar nutritivo suplementado con 5 mg/L de L-triptofano y se incubaron a 28°C por cinco días.
Se realizó la caracterización de la morfología macroscópica y microscópica (morfología bacteriana, afinidad tintorial y arreglo celular empleando la técnica de tinción de Gram) de los aislados bacterianos. También se efectuó una prueba para determinar la presencia de la actividad de la enzima L-alanina-aminopeptidasa empleando el Kit de Diagnóstico BioFix® (No. 960003) y también la presencia de la actividad de la enzima citocromo-oxidasa, con las tiras reactivas del Kit de Diagnóstico BioFix® (No. 960001), ambas pruebas se llevaron a cabo de acuerdo con las indicaciones del fabricante (Macherey-Nagel GmbH Co. KG Dueren Germany).
Para la determinación del género de las rizobacterias aisladas, se llevó acabo la amplificación del gen 16S rRNA como marcador molecular para la identificación y clasificación microbiana usando herramientas moleculares y bioinformáticas.
En este caso se emplearon los iniciadores universales fD1 y rD1 que fueron diseñados por Weisburg et al. (1991). Se obtuvo DNA genómico de cada aislado bacteriano usando el método descrito por Allers & Lichten (2000). Se llevó a cabo la amplificación del marcador molecular 16S rRNA con la siguiente mezcla de reacción: 50 ng de DNA genómico, 200 mM de dNTPs, 3 mM de Mg++, 50 pmol de cada iniciador y 2.5 U de la enzima Taq polimerasa (Invitrogene, CA). Dicha mezcla de reacción se sometió a las siguientes condiciones de amplificación: una desnaturalización inicial de 5 minutos a 95°C, seguido de 30 ciclos a 95°C por 2 minutos, 42°C por 40 segundos y 72°C por 4 minutos, finalmente un ciclo de polimerización de 72°C por 20 minutos. Los productos de PCR fueron separados por electroforesis en geles de agarosa al 1% y teñidos con bromuro de etidio, estos productos se purificaron y se obtuvo la secuencia de nucleótidos (Unidad de Biotecnología y Prototipos de la FES-Iztacala UNAM). Las secuencias resultantes se compararon con las secuencias reportadas en el banco de genes disponible en la página http://www.ncbi.nlm.nih.gov utilizando la herramienta BLAST con la finalidad de conocer la similitud con otras secuencias ya reportadas y tener entonces una identificación de los aislados.
Caracterización de las bacterias por su producción de fitohormonas
La evaluación cuantitativa de la producción de AIA se realizó de acuerdo con el método modificado de Ahmad et al. (2005) por Campos et al. (2007) por el cual se midió la capacidad intrínseca de estas bacterias para producir AIA en presencia de diferentes concentraciones de triptofano. Se emplearon tubos de ensaye con tapón de rosca de 20 mL de capacidad y 4.9 mL de caldo nutritivo adicionado de L-triptofano a diferentes concentraciones: 1, 2 y 5 mg/L y como testigo una serie de tubos con caldo nutritivo sin L-triptofano, los tubos se inocularon con 0.1 mL del inóculo bacteriano a una concentración de 4.6 x 106 UFC/mL. Se incubaron por 96 horas a 28°C; como control se manejaron tubos inoculados y no inoculados.
Después del periodo de incubación, los cultivos se centrifugaron a 3 000 r.p.m. por 30 minutos a 25°C y el contenido de auxinas se cuantificó como equivalentes de AIA por un análisis espectrofotométrico.
El análisis se llevó a cabo mezclando en un tubo, 1 mL del sobrenadante de los cultivos bacterianos con 2 mL del reactivo de Salkowski (2% (w/v) de FeCl3 0.5M disuelto en ácido perclórico al 35%), se incubó a temperatura ambiente por 20 minutos y el desarrollo de una coloración rosada indicó la presencia de AIA el cual se cuantificó leyendo su absorbancia a 535 nm de longitud de onda y la lectura se interpoló en una curva tipo de AIA a partir de una concentración patrón de 100 μg/mL.
Evaluación de la promoción del crecimiento vegetal de Cynodon dactylon L.
Para la evaluación de la promoción del crecimiento vegetal de Cynodon dactylon L., se establecieron los cultivos hidropónicos en frascos de vidrio con tapa magenta, con 25 mL de medio mineral que contenían las siguientes sales: 0.20 M NH4H2PO4, 0.50 M NH4NO3, 1.15 M Ca(NO3)2, 0.26 M CaCl2, 0.20 M MgCl2·6H2O, 0.20 M Mg(NO3)2·6H2O, 0.40 M MgSO4·7H2O, 0.20 M KH2PO4, 1.20 M KNO3, 0.50 M K2SO4, 0.040 M FeCl3·6H2O, 1.2 x 10-2 M H3BO3, 1.2 x 10-4 M CuCl2·H2O, 2.3 x 10-3 M ZnCl2, 4.4 x 10-4 M MnCL·4H2O, 6 x 10-6 M Na2MoO4·H2O, EDTA y FeSO4·7H2O, con un pH de 6 y con la adición de agar bacteriológico al 6% (medio mineral blando).
Una colonia de los aislados bacterianos productores de AIA, se resuspendió en 5 mL de agua destilada estéril para obtener un inóculo a la concentración de 4.6 x 106 UFC/mL, con estas suspensiones se inocularon 20 semillas de Cynodon dactylon L. previamente desinfestadas. La desinfestación consistió en usar 10 mL de alcohol absoluto por tres minutos y 10 mL de hipoclorito de sodio al 10% y se enjuagaron cinco veces con agua destilada estéril. Posteriormente las semillas se dejaron embebidas por 30 minutos en cada una de las suspensiones bacterianas preparadas.
También se embebieron 20 semillas de Cynodon dactylon L. (previamente desinfestadas) en agua destilada estéril por 30 minutos, antes de colocarlas sobre la superficie del medio mineral blando.
Se evaluó la promoción del crecimiento vegetal por las cepas rizobacterianas productoras de AIA en los experimentos, con y sin la adición de L-triptofano a las concentraciones de 2 y 5 mg/L, para la inducción de la síntesis de AIA.
La siembra de las semillas en el medio mineral blando y con los tratamientos se llevó a cabo en condiciones de esterilidad. Los cultivos con el material seminal se mantuvieron en un cuarto de incubación bajo condiciones controladas de temperatura (+/- 36°C) y un fotoperiodo (12: 12), por 28 días. Los ensayos se realizaron por triplicado.
Una vez concluido el tiempo de incubación de los cultivos, se extrajeron las plántulas crecidas para la medición de la longitud foliar y la longitud radical, tanto de las plantas inoculadas como de las plantas testigos. Con estos resultados se calculó el índice de crecimiento (IC) con la expresión:

donde:
LRCTrp es la longitud radical o foliar de las plántulas que crecieron en presencia de triptofano.
LRSTrp es la longitud radical o foliar de las plántulas crecidas en ausencia de triptofano.
Considerando también los experimentos de las plantas de C. dactylon L. con y sin el inóculo bacteriano.
Análisis estadístico de los resultados
A todos los resultados obtenidos se les aplicó un análisis de varianza (ANOVA) y prueba de Tukey-Kramer de comparación múltiple, empleando el paquete estadístico GraphPad InStat, V2.03 (Aceves, 1993) y el paquete estadístico de diseños experimentales FAUANL.ver.1.4 (Olivares, 1989).
RESULTADOS Y DISCUSIÓN
Caracterización e identificación de las rizobacterias productoras de ácido indolacético (AIA) aisladas del suelo contaminado con hidrocarburos derivados del petróleo
De 23 aislados bacterianos que se obtuvieron del suelo contaminado con hidrocarburos derivados del petróleo, se seleccionaron tres aislados de rizobacterias las cuales se denominaron rizobacterias I, II y III, productoras de ácido indolacético. La morfología microscópica mostró que las tres cepas bacterianas son bacilos esporulados grampositivos: la cepa I es un bacilo corto y las cepas II y III son bacilos largos. Los resultados de la determinación de las actividades enzimáticas tanto para la L-alanina-aminopeptidasa como para la citocromo oxidasa, fueron negativos para las tres rizobacterias.
De los resultados del análisis molecular, la búsqueda y alineamiento de las secuencias amplificadas del gen 16S rRNA de las tres rizobacterias seleccionadas con las secuencias incluidas en el banco de genes, se obtuvo como resultado un alto porcentaje de similitud con el género Bacillus sp.: la rizobacteria I con un 76%, la rizobacteria II con un 85% y la rizobacteria III con un 89%.
Estos resultados son una identificación por similitud de secuencias parciales del gen ribosomal 16S rRNA. Esto concuerda con los datos obtenidos de la morfología macro y microscópica ya que las tres rizobacterias son bacilos grampositivos esporulados. Para llevar a cabo una identificación más precisa es necesario usar métodos polifásicos de taxonomía microbiana para describir la especie a la que corresponden que pueden estar ya reportadas o bien posiblemente describir nuevas especies del genero Bacillus (Rosselló-Mora & Amann, 2001; Vandamme et al., 1996).
Determinación de la producción de AIA en presencia de L-triptofano de las rizobacterias aisladas
Las bacterias benéficas sintetizan predominantemente AIA por una vía alterna dependiente de Trp a través del ácido indolpirúvico. Los resultados obtenidos de la producción del ácido indolacético de las rizobacterias I, II y III, fueron muy similares en todas éstas; ya que a mayor concentración de L-triptofano mayor fue la producción de AIA (fig. 1), efecto similar al reportado por Barazani & Friedman (2000) y Xie et al. (1996), donde la producción de AIA que se obtuvo fue dependiente del tipo de aislamiento bacteriano y la concentración de triptofano. Esta evidencia sugiere que puede tener una aplicación práctica directa, no obstante la habilidad intrínseca de las bacterias aisladas para producir esta auxina, depende de la disponibilidad de los precursores y de su incorporación del AIA microbiano por las plantas (Ahmad et al., 2008; Arshad & Frankenberger, 1998).
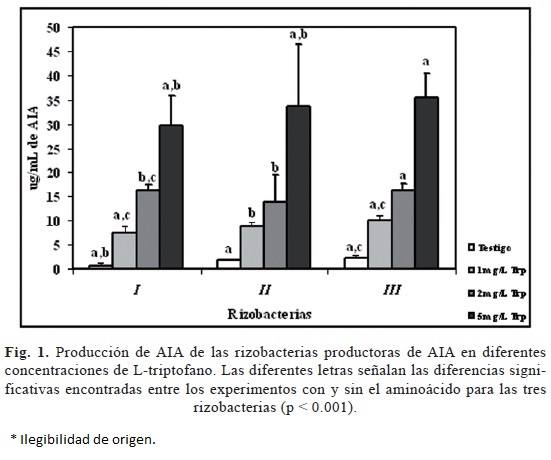
Basados en la producción de auxinas in vitro, se pueden catalogar a las rizobacterias en tres grupos principales: las bajas productoras de auxinas de 1 a 10 μg/mL, medianas productoras de 11 a 20 μg/mL y altas productoras de 21 a 30 μg/mL de AIA (Khalid et al., 2004).
La cantidad de AIA producido por las rizobacterias aisladas del suelo contaminado con hidrocarburos derivados del petróleo, fue mayor por la rizobacteria III (35.49 μg/mL), seguida de la rizobacteria II (33.74 μg/mL) y de la rizobacteria I (29.59 μg/ mL). Aquí las tres se clasificaron, según Khalid et al. (2004), en el grupo de altas productoras de AIA.
Efecto de la presencia de rizobacterias productoras de AIA y triptofano, sobre el crecimiento de Cynodon dactylon L.
En la fig. 2, se muestran las plántulas de Cynodon dactylon L. con y sin la rizobacteria II y las plántulas crecidas con y sin la adición de 2 y 5 mg/L de triptofano.

La fig. 3 (a, b y c) muestra los resultados del crecimiento de Cynodon dactylon L. con y sin la inoculación con las rizobacterias I, II y III y la adición de triptofano con las concentraciones de 2 y 5 mg/L. La promoción del crecimiento radical es uno de los principales marcadores por los cuales se puede medir el efecto benéfico de las bacterias promotoras del crecimiento vegetal. El establecimiento rápido de las raíces que se da por la elongación de las raíces primarias, es un proceso ventajoso para las plántulas conforme incrementa su habilidad para anclarse al suelo y obtener agua y nutrientes de su ambiente (Patten & Glick, 2002). Las plántulas con 2 y 5 mg/L de triptofano presentaron una longitud radical menor a la longitud obtenida, en comparación con las plantas tratadas con la rizobacteria I y en ambos casos cuando se creció bajo la presencia de esta rizobacteria, la longitud foliar fue mayor.

Para la rizobacteria II y 2 mg/L de triptofano la longitud radical fue mayor que la longitud foliar; en el caso de las plántulas con 5 mg/L de triptofano. Las plántulas sin la rizobacteria desarrollaron una mayor longitud foliar que radical y con la presencia de ésta, la longitud radical fue mucho mayor que la longitud foliar.
Las plántulas que crecieron con y sin la rizobacteria III, en presencia de 2 mg/L de triptofano, presentaron una longitud foliar mucho mayor que la longitud radical, en la concentración de 5 mg/L de triptofano. Las plántulas sin la rizobacteria III mostraron una longitud radical menor a la longitud foliar, y con la rizobacteria III la longitud radical fue menor que la longitud foliar.
Los bioensayos con C. dactylon L. mostraron que en presencia del aminoácido Trp a las dos concentraciones de 2 y 5 mg/L, el crecimiento radical de las plantas con respecto a las plantas sin Trp, presentaron un incremento en la longitud radical, lo que pudo deberse a la respuesta intrínseca de la especie.
La inoculación de las semillas con las rizo-bacterias I, II y III y la adición de triptofano en los bioensayos, mostró que la presencia de triptofano como precursor de AIA, dio un incremento en el crecimiento radical de las plantas inoculadas con la rizobacteria II con triptofano a las concentraciones de 2 y 5 mg/L y con la rizobacteria III con 5 mg/L de triptofano.
En cuanto al crecimiento foliar, éste se promovió bajo la presencia de la rizobacteria I y la rizobacteria III, también con la concentración de triptofano de 5 mg/L; no obstante, la respuesta con la rizobacteria III no fue evidente solamente con su presencia, ya que el incremento en la longitud radical y foliar fue mucho mayor que las plantas testigo con una concentración de Trp de 5 mg/L, lo que favoreció la síntesis del AIA y que como consecuencia se incrementó el crecimiento de las plantas. Tsavkelova et al. (2006) mencionan que este tipo de auxinas estimulan tanto el crecimiento vegetal como el desarrollo de las poblaciones microbianas.
Determinación del índice de crecimiento (IC) de las plantas de Cynodon dactylon L., crecidas con triptofano
Se calculó el índice de crecimiento (IC) tanto para la longitud radical como para la foliar de las plantas que crecieron en presencia y ausencia de Trp y las plantas con y sin inóculo bacteriano; todos los casos se multiplicaron x 100 para determinar el porcentaje de crecimiento, comparado con los experimentos testigo. Estos resultados se muestran en la tabla 1.
Los efectos morfogénicos de las plantas pueden ser también el resultado de diferentes niveles de hormonas vegetales producidas por las raíces, así como por las bacterias rizosféricas (Muller et al., 1989). Se presume que las RPCV que producen fitohormonas, pueden jugar un papel crítico en la promoción del crecimiento vegetal. Los efectos de éstas que incluyen al AIA sobre las plantas, son dependientes de la concentración (Ahmad et al., 2005).
En los bioensayos de las plantas de C. dactylon L. inoculadas con las tres rizobacterias aisladas, el incremento en el crecimiento radical fue mayor en las plantas inoculadas con la rizobacteria II (130%) y el crecimiento foliar se dio en mayor proporción bajo la presencia de la rizobacteria I (187%).
En esta comparación del crecimiento promovido por las cepas productoras de AIA, cabe mencionar que como en el caso de los experimentos con Sesbania aculeata y Vigna radiata (Ahmad et al., 2005; Arshad & Frankenberger, 1991), los efectos de las auxinas producidas sobre las plántulas de C. dactylon L., fueron dependientes de AIA, en donde a baja concentración se estimula el crecimiento, mientras que una alta concentración de la hormona puede ser inhibitoria, lo que revela una respuesta diferencial tanto a las concentraciones variables de auxinas como al tipo de microorganismos analizados (Sarwar & Frankenberger, 1994).
No obstante, para la rizobacteria I, la adición de triptofano de 2 y 5 mg/L, produjo una reducción en la respuesta del crecimiento de las plantas de C. dactylon L. que coincide con lo reportado por Barazani & Friedman (1999) donde el triptofano puede ser considerado como un inhibidor del desarrollo vegetal si éste se encuentra en concentraciones elevadas. Esto se corroboró con el porcentaje de clorosis medida en las plantas de 51.90% para la concentración de 2 mg/L y de 52.04% para la concentración de 5 mg/L de triptofano. En algunos casos, como en los reportados por Malhotra & Srivastava (2009), la presencia de la rizobacteria productora de AIA Azospirillum brasilense MS- sobre algunas especies vegetales probadas, mostraron que después de dos semanas del tratamiento, no solamente benefició a las plantas de sorgo, maíz y trigo, dando un mejoramiento significativo en su longitud radical y la ramificación de las raíces, sino que también produjo un incremento marginal en la longitud del material foliar.
Para el caso de cebada, esta última no respondió a la bacterización de la semilla con las rizobacterias en estudio, lo que indica que en algunos casos se presenta un espectro limitado de la acción bacteriana.
Sin embargo, la adición de triptofano y la presencia de las rizobacterias productoras de AIA, benefició el desarrollo de las plantas de C. dactylon L. para el crecimiento foliar de las plantas con las concentraciones de 2 mg/L y 5 mg/L de triptofano, y las plantas inoculadas con la rizobacteria I mostraron un crecimiento del 119% y 115% respectivamente, comparadas con las plantas testigo sin inóculo y sin el aminoácido con un porcentaje de crecimiento de 123% y 127% para 2 y 5 mg/L, respectivamente, considerando la comparación con las plantas testigo solamente con triptofano.
Para la rizobacteria III, un incremento foliar a la concentración de 5 mg/L de Trp sin inocular de 116% y con esta rizobacteria y triptofano a esta concentración un porcentaje de crecimiento de las plantas de 136%. Para el caso del crecimiento radical, éste se promovió con las dos concentraciones de Trp, para las plantas inoculadas con las rizobacterias II y III.
Las plantas inoculadas con la rizobacteria II y con concentraciones de 2 y 5 mg/L de Trp presentaron un porcentaje de crecimiento radical de 118% y 105%, respectivamente, en comparación con las plantas testigo; mientras que con la rizobacteria III solamente un 111% bajo la concentración de 5 mg/L.
Las plantas inoculadas y con la mayor concentración de Trp para la rizobacteria II, presentaron un porcentaje de crecimiento radical de 170% y la rizobacteria III de 133%, comparadas por separado con las plantas testigo inoculadas y adicionadas con triptofano.
Los resultados obtenidos coinciden con los que se reportan en los trabajos de Dobbelaere et al. (2003) donde Azospirillum produce AIA que es la auxina más importante para esta bacteria y que por lo tanto beneficia directamente al sistema radical de las plantas al promover el desarrollo de las raíces laterales y las divisiones de los meristemos apicales, que contribuyen en la longitud de las raíces; así mismo, Malhotra & Srivastava (2006, 2008, 2009) trabajaron con la cepa de Azospirillum brasilense SM- , donde observaron que la biosíntesis de AIA se presentó de manera dependiente del triptofano, ya que la provisión exógena de este aminoácido favorece que las células mantengan una alta concentración del aminoácido que es empleado para la biosíntesis de esta fitohormona; además se menciona que la propiedad de canalizar el Trp hacia esta biosíntesis es importante en el ambiente natural, ya que se ha visto que éste es un componente de los exudados radicales liberados por las plantas hospederas a las cuales están asociadas las bacterias; el consumo de los componentes de los exudados radicales por las cepas de la rizosfera no solamente favorece el incremento en la tasa de exudación (Somers et al., 2004), sino también que el Trp disponible puede convertirse a AIA, por ello las plantas y los microorganismos pueden regular la síntesis y liberación del AIA en la rizosfera, si ésta interacción da lugar a un incremento en la disponibilidad de AIA para la planta, entonces éste se puede traducir en un mejoramiento del crecimiento (Dobbelaere et al., 2003).
CONCLUSIONES
Las bacterias que habitan la rizosfera pueden influir en el crecimiento de las plantas al contribuir a la poza endógena de fitohormonas, tales como las auxinas. La producción de una auxina importante, el ácido indolacético se da ampliamente entre las bacterias asociadas con las plantas.
Las rizobacterias I, II y III identificadas como Bacillus sp, que se aislaron de un suelo contaminado con hidrocarburos derivados del petróleo, resultaron rizobacterias con una alta producción de AIA in vitro. El efecto de promoción del crecimiento de las plantas de Cynodon dactylon L. se evidenció con la inoculación in vitro con las rizobacterias I y II; sin embargo, en experimentos evaluados en combinación con la adición de triptofano al medio y la inoculación de las plantas con las rizobacterias aisladas, se observó la acción directa de la presencia del precursor que participa en la biosíntesis de ácido indolacético, que favoreció el desarrollo radical y foliar de las plantas de C. dactylon L., principalmente aquellas inoculadas con la rizobacteria III. Esto demostró un efecto sinérgico entre la planta y la rizobacteria que favoreció su desarrollo ante la presencia del aminoácido.
AGRADECIMIENTOS
El segundo autor agradece a la Secretaría de Investigación y Posgrado del IPN, el apoyo financiero otorgado al Proyecto SIP: 20080061, para la realización de este trabajo.
LITERATURA CITADA
Aceves, J., 1993. GraphPad Software. GraphPad InStat, V2.03. [ Links ]
Ahmad, F., I. Ahmad & M.S. Khan, 2005. "Indole acetic acid production by the indigenous isolated of Azotobacter and fluorescent Pseudomonas in the presence and absence of tryptophan". Turk. J. Biol., 29: 29-34. [ Links ]
----------, 2008. "Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities". Microbiol. Res., 163: 173-181. [ Links ]
Allers, T. & M. Linchen, 2000."A method for preparing genomic DNA that restrains branch migration of Holiday junctions". Nucleic Acids Res., 15: 28-36. [ Links ]
Arshad, N. & Wt. Jr. Frankenberger, 1991."Microbial production of plant hormones". Plant Soil, 133: 1-8. [ Links ]
----------, 1998. "Plant Growth regulating substances in the rhizosphere: microbial production and functions". Adv. Agron., 62: 146-151. [ Links ]
Barazani, O. & J.I. Friedman,1999. "Is IAA the major root growth factor secreted from plant growth-mediating bacteria?". J. Chem. Ecol., 25: 2397-2406. [ Links ]
Barazani, O. & J.I. Friedman, 2000. "Effect of exogenously applied L-tryptophan on allelochemical activity of plant growth promoting rhizobacteria (PGPR)". J. Chem. Ecol., 26: 343-349. [ Links ]
Bashan, Y., G. Holguin & L.E. de Bashan, 2004. "Azospirillum plant relationships: physiological, molecular, agricultural and environmental advances (1997-2003)". Can. J. Microbiol., 50: 521-577. [ Links ]
Campos G.A., Guerrero Z.A., Rodríguez D.A. & Montes V.S., 2007. "Evaluación de la producción de ácido indol acético de rizobacterias aisladas de un suelo contaminado con hidrocarburos derivados del petróleo y su aplicación en fitoremediación". 2° Taller Internacional de Biotecnología y 2° Encuentro Internacional de Energías Alternativas, Pachuca, Hidalgo, México. [ Links ]
Dobbelaere, S., J. Vanderleyden & Y. Okon, 2003. "Plant growth-promoting effects of diazothoprhs in the rhizosphere". Crit. Rev. Plant Sci., 22: 107-149. [ Links ]
Dowling, D.N. & S.L. Doty, 2009. "Improving phytoremediation through biotechnology". Curr. Opin. Biotech., 29: 1-3. [ Links ]
Frankenberger, Wt. Jr. & M. Arshad, 1995. Phytohormones in soil: Microbial production and function. N.Y., USA Marcel Dekker, Inc. [ Links ]
Huang, X.D., Y. El-Awlawi, D.H. Penrose, B.R. Glick & B.M. Greenberg, 2004. "A multiprocess phytoremediation system for removal of polycyclic aromatic hydrocarbons from contaminated soils". Environ. Pollut., 130: 465-476. [ Links ]
Huang, X.D., Y. El-Awlawi, J. Gurska, B.R. Glick & B.M. Greenberg, 2005. "A multiprocess phytoremediation system for decontamination of persistent total petroleum hydrocarbons (TPH's) from soils". Microchem. J., 81: 139-147. [ Links ]
Khalid, A., M. Arshad & Z.A. Zahir, 2004. "Screning plant growth-promoting rhizobacteria for improing growth and yield of wheat". J. Appl. Microbiol., 96: 473-480. [ Links ]
Kloepper, J.W., F.M. Scher, M. Laliberte & B. Tipping, 1986. "Emergence-pro-motingrhizobacteria: decription and implications for agriculture". In: Swinburne T.R. (ed.). Iron, Siderophores and Plant Disease. Plenum, N.Y. CRC Press Inc. Fl. USA, Boca Raton. [ Links ]
Kloepper, J.W., R. Lifshitz & R.M. Zablotowicz, 1989."Free-living bacterial inocula for enhancing crop productivity". Trends Biotechnol., 7: 39-43. [ Links ]
Krauchenko, L.V., A.V. Borovkov & Z. Pshikvil, 1991."The possibility of auxin biosynthesis in wheat rhizosphere by associated nitrogen-fixing bacteria". Mikrobiologiya, 60: 927-931. [ Links ]
Kuiper, I., E.L. Lagendik, G.V. Bloemberg & B.J. Lugteberg, 2004. "Rhizoremediation: A Beneficial Plant-Microbe Interaction". Mol. Plant Microbe In., 17: 6-15. [ Links ]
Lambrecht, M., Y. Okon, A. Vanderbroek & J. Vanderleyden, 2000."Indole-3-acetic acid: a reciprocal signaling molecule in bacteria-plant interactions". Trends Microbiol., 8: 298-300. [ Links ]
Leveau, J.H. & S.E. Lindow, 2005."Utilization of the plant hormone indole-3-acetic acid for growth by Pseudomonas putida strain 1290". Appl. Environ. Microbiol., 71: 2365-2371. [ Links ]
Lynch, J.M.,1995. "Origin, nature and biological activity of aliphatic substances and growth hormones found in soil". In: Vaughan, D. and Malcom R.E. (eds.). Soil Organic Matter and Biological Activity. Martinus Nijhoff / Dr. W. Junk Publishers, Dordrecht, Boston, Lancaster. [ Links ]
Malhotra, M. & Sh. Srivastava, 2006."Targeted engineering of Azospirillum brasilense SM with indole acetamide pathway for IAA over-expression". Can. J. Microbiol., 52: 1078-1084. [ Links ]
----------, 2008."An ipdc gene knockout of Azospirillum brasilense strain SM and its implications in indole-3-acetic acid biosynthesis and plant growth promotion". Anton. Leeuw. In. J.G., 10: 1365-1373. [ Links ]
----------, 2009. "Stress-responsive indole-3-acetic acid biosynthesis by Azospirillum brasilense SM and its ability to modulate plant growth", Eur. J. Soil Biol., 45: 73-80. [ Links ]
Muller, M., C. Deigele & H. Ziegler, 1989."Hormonal interactions in the rhizospheres of maize (Zea mays L.) and their effect on plant development". Z. Pflanzenernaher. Bodenfd., 152: 247-254. [ Links ]
Narasimhan, K., C. Basheer, V.B. Bajic & S. Swarup, 2003. "Enhancement of plant-microbe interactions using a rhizosphere metabolomics-driven approach and its application in the removal of polychlorinated biphenyls". Plant Physiol., 132: 146-153. [ Links ]
Olivares, S.E.,1989. Paquete de diseños experimentales FAUNL. Versión 1.4. Facultad de Agronomía UANL. Marín, N.L. México. [ Links ]
Patten, C.I. & B.R. Glick, 2002. "Role of Pseudomonas putida indole acetic acid in development of the host plant root system", App. Environ. Microbiol., 68: 3795-3801. [ Links ]
Pérez, V.J., E.G. García & G.F. Esparza, 2002. "Papel ecológico de la flora rizosférica en fitorremediación". Avance y Perspectiva, 21: 297-300. [ Links ]
Rosselló-Mora, R. & R. Amann, 2001. "The species concept for prokaryotes", FEMS. Microbiol. Rev., 25: 39-67. [ Links ]
Sarwar, M. & Wt. Jr. Frankenberger, 1994. "Tryptophan dependent biosynthesis of auxins in soil", Plant Soil, 160: 97-104. [ Links ]
Sarwar, M. & R.J. Kremer, 1995. "Determination of bacterially derived auxins using a microplate method", Lett. Appl. Microbiol., 20: 282-285. [ Links ]
Silversone, S.E., D.G. Gilchrist, R.M. Bostock & T. Kosuge, 1993."The 73-Kb pIAA plasmid increases competitive fitness of Pseudomonas syringe subspecies sava sanoi in olcander". Can. J. Microbiol., 39: 659-664. [ Links ]
Somers, E., J. Vanderleyden & M. Srinivasan, 2004. "Rhizosphere bacterial signaling: a love parade beneath our feet". Crit. Rev. Microbiol., 30: 2005-240. [ Links ]
Tenuta, M., 2003."Plant Growth Promoting Rhizobacteria: Prospects for Increasing Nutrient Acquisition and Disease Control". tenutam@ms.umanitoba.ca. [ Links ]
Tsavkelova, E.A., S. Y. Klimova, T.A. Cherdyntseva & A.I. Netrusov, 2006."Microbial producers of plant growth stimulators and their practical use: a review". Appl. Biochem. Microbiol., 42: 117-126. [ Links ]
Vandamme, P., B. Pot, M. Gillis, P. de Vos, K. Kesters, & J. Swings, 1996. "Polyphasic taxonomy, a consensus approach to bacterial systematic". Microbiol. Rev., 60: 407-438. [ Links ]
Weisburg, W.G., S.M., Barns, D.A. Pelletier & D.J. Lane, 1991. "16 Ribosomal DNA amplification for phylogenetic study", J. Bacteriol., 131: 697-703. [ Links ]
Xie, H., J.J. Pasternak & B.R. Glick, 1996."Isolation and characterization of mutants of plant growth promoting rhizobacterium Pseudomonas putida GR 12-2. that over produce indole acetic acid", Curr. Microbiol., 32: 67-71. [ Links ]
Zhuang, X., J. Chen, H. Shim & Z. Bai, 2007. "New advances in plant growth-promoting rhizobacteria for bioremediation", Environ. Int., 33: 406-413. [ Links ]
*Becarios de la Comisión de Operaciones y Fomento de Actividades Académicas (COFAA-IPN).














