Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Polibotánica
versión impresa ISSN 1405-2768
Polibotánica no.27 México abr. 2009
Diversidad, estructura y productividad de bosques templados de Durango, México
Diversity structure and productivity of temperate forests of Durango, Mexico
José de Jesús Návar–Cháidez y Socorro González–Elizondo
Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional–IPN; Unidad Durango. Calle Sigma s/n. Fracc. 20 de Noviembre II. Durango, Dgo., México. 34220. Tel & Fax 618 8142091. Correo electrónico: jnavar@ipn.mx
Recibido: 21 mayo 2008
Aceptado: 10 febrero 2009
Resumen
Existe poca evidencia cuantitativa sobre la importancia de la complejidad estructural y la diversidad arbórea en la productividad de los ecosistemas forestales templados. Nuestras observaciones indican que distribuciones en altura balanceadas, sesgadas en diámetro y la diversidad arbórea incrementan la productividad del rodal. Aunque se requiere de investigación adicional para entender la influencia de estos controles a largo plazo, estas observaciones preliminares deben de considerarse en las prácticas silvícolas de los bosques templados de coníferas para mantener niveles óptimos de productividad de los ecosistemas forestales.
Palabras clave: índices de diversidad, estructuras en altura y diámetro, productividad de biomasa.
Abstract
There is little quantitative evidence of the effect of diversity and structural complexity on stand productivity of temperate coniferous forests of northern Mexico. Our observations indicate that well–balanced canopy strata, unequal diameter structure and tree diversity enhance stand productivity. Although further research is required to understand the long term effect of tree diversity and canopy structure on stand productivity, these preliminary observations emphasize the importance of promoting silvicultural practices to maintain stand structure and diversity in forest management plans and silvicultural prescriptions that aim to maintain ecosystem functions, diversity and productivity.
Key words: diversity indices, height and diameter structure, biomass productivity.
INTRODUCCIÓN
Los bosques diversos son más productivos que los bosques simples (Hooper y Vitousek, 1997; Hiura, 2001; Vilá et al., 2007). Observaciones similares se han encontrado para los pastizales americanos y europeos (Tilman et al., 1997; Hector et al., 1999). Además de la diversidad de especies, la complejidad estructural (i.e., la variabilidad espacial en el eje tridimensional de un bosque; altura y diámetro) también controla la productividad de ecosistemas forestales (Hiura, 2001; Ishii et al., 2000; 2002; 2004). En ecosistemas mixtos, donde la sucesión cambia la diversidad, Caspersen y Pacala (2001) y Vila et al., (2007) notaron que la mayor productividad se encuentra en bosques en etapas sucesionales tempranas.
La complementariedad fenológica, la asincronía de las especies en el uso de los recursos y el crecimiento pueden explicar cómo la diversidad de las especies influye en la función de los ecosistemas (Stevens y Carson, 1999a; b; Hooper y Vitousek, 1997). La complejidad estructural de las comunidades de árboles se explica por el uso diferencial de los recursos; por ejemplo los árboles que ocupan estratos diferentes en el bosque que hacen uso de la luz en una forma diferente o los estratos del suelo que ocupan diferencialmente las especies.
A pesar de esta información científica, no se han realizado estudios en los bosques templados de México tendientes a entender los controles de la productividad para poder prescribir las prácticas silvícolas coherentes con el manejo sustentable de ecosistemas forestales. La Sierra Madre Occidental posee una de las mayores riquezas de diversidad biológica en Norte América y contiene cerca de dos tercios de la trocería de México (na0302_full.html). Aproximadamente 23 especies diferentes de pino y más de 100 de encino residen dentro de esta cadena de montañas. Muchas especies evolucionaron como resultado de la altitud, la temperatura, la precipitación y la pendiente. Extensas áreas de bosques de pino–encino se distribuyen a lo largo de las laderas orientales de la Sierra.
Los objetivos de este reporte de investigación fueron: a) medir la diversidad biológica arbórea, b) medir los parámetros que describen la diversidad estructural horizontal y vertical, c) estimar la productividad y d) relacionar la productividad con los parámetros de la diversidad biológica y la estructura vertical y horizontal de las comunidades forestales del predio Veredas, de Durango,
México. Las hipótesis planteadas fueron: a) que la diversidad y la productividad no se encuentran relacionadas a través de los modelos unimodal, en forma de U y monotónico y b) que la diversidad estructural y la productividad no se encuentran relacionadas estadísticamente.
MATERIAL Y MÉTODOS
El presente trabajo de investigación se realizó en la serie de 36 sitios de investigación silvícola denominada 'Cielito Azul', ubicados en el lote 4 del predio 'Veredas', cerca de San Miguel de Cruces en el municipio de San Dimas, Durango, México (figura 1).
El área de estudio se caracteriza por poseer un clima templado semifrío, subhúmedo, con lluvias en verano y precipitación invernal escasa, generalmente mayor a 10 mm. La precipitación y temperatura anual oscilan en los 1 000 mm y 14°C, respectivamente. La vegetación arbórea dominante está constituida por el género Pinus (Pinus cooperi, P. leiophylla, P. ayacahuite, P. teocote) combinado con los géneros asociados Quercus (Quercus sideroxylla), Arbutus (Arbutus chiapensis), Alnus (Alnus acuminata), Juniperus (Junipersus spp) y Pseudotsuga (Pseudotsuga menziesii). Los suelos del área corresponden a Litosoles y Rendzinas, que son suelos someros, cuyas profundidades varían desde los 10 hasta los 30 cm. Son ricos en materia orgánica, de textura franca y con cantidades importantes de rocas.
En el año 1967 en las 36 parcelas de una ha cada una, se seleccionaron al azar seis parcelas para ajustar seis diferentes tratamientos. El diseño experimental consistió en un cuadro latino con seis repeticiones y seis tratamientos. Los tratamientos consistieron en la aplicación de diferentes intensidades de corta, 0%, 20%, 30%, 50%, 70% y 100% de remoción de área basal. Se realizaron mediciones dasométricas de los árboles remanentes durante 1982, 1986, 1993 y 2004 en subparcelas centrales de 50 m x 50 m. Las mediciones consistieron en clasificar los individuos en número, estado actual, especie, posición sociológica y las variables dasométricas: diámetro normal, altura del fuste, altura total, cobertura y posición en coordenadas, entre otras.
Se calcularon los índices de diversidad de: (1) riqueza de especies (2) Margalef, (3) Menhinick, (4) McIntosh, (5) Shanon Wiener, (6) Simpson, (7) Brillouin y (8) Berger–Parker.
El índice de diversidad de Margalef de acuerdo con Clifford y Stephenson (1975) es:
Dmg = (S–1) / 1n N
Donde: S = número de especies recolectadas, N = número total de individuos sumando todos los de las S especies.
El índice de diversidad de Menhinick se reportó por Whittaker (1972) como:
Dmn = S / √ N
donde: S = especies recolectadas, N = número total de individuos sumando todos los de las S especies.
Los índices de abundancia relativa de especies pretenden resolver la riqueza y la uniformidad en una expresión sencilla. Magurran (1989) define que están referidos como medidas de dominancia ya que se ponderan según la abundancia de las especies más comunes. La abundancia puede ser apreciada desde dos puntos de vista: la abundancia relativa que contribuye a la abundancia total y la abundancia absoluta definida por el número de individuos, biomasa o productividad. De acuerdo a lo anterior, existen dos índices que se expresan de la siguiente manera: el índice de diversidad de Shannon y Wiener (Pielou, 1975, 1997), el cual se describe en forma matemática como sigue:
H = Σ pi 1n pi
donde: pi = abundancia proporcional de la i–ésima especie: (ni/N), 1n = x√2.71828.
El índice de Brillouin, de acuerdo con Pielou (1975), se describe a continuación:
HB = 1n N! – Σ 1n ni !/N
Existen índices de dominancia los cuales se ponderan según la abundancia de las especies más comunes. Se utilizaron tres de estos índices:
El índice de dominancia de Simpson (1949).
D = Σ pi2
donde: p = abundancia proporcional de la i–ésima especie: (n/N).
El índice de diversidad de McIntosh (1981) es:

El índice de Berger–Parker (1970) es:
d = Nmáx / N
donde Nmáx = abundancia máxima, N = abundancia o densidad total.
Los modelos de diversidad–abundancia de las especies describen la distribución de la abundancia específica (Magurran, 1989) y se clasifican en cuatro grandes clases: (a) barra rota, (b) serie geométrica, (c) serie logarítmica y (d) modelo normal–logarítmico.
El modelo de la serie geométrica. La expresión que toma el modelo de la serie geométrica es el siguiente:
ni = NCk k(1–K)i–1
donde: K = proporción del espacio de nicho disponible o recursos que cada especie ocupa, N = número de individuos en la i–ésima especie, N = número total de individuos.
Ck = (1 – (1–K)S)i–1 es una constante que asegura que Σ n i = N.
El modelo de la serie logarítmica. De acuerdo con Fisher et al. (1943) este modelo describe matemáticamente las relaciones entre el número de especies y el número de individuos en esas especies, y según Magurran (1989) este modelo y el de la serie geométrica se encuentran estrechamente relacionados. La expresión del modelo es la siguiente:
αx, αx2/2, αx1/3,.... αxn/n
donde: αx = número de especies con un individuo, αx2 = número de especies con dos individuos.
El modelo de la barra rota. McArthur (1957) y Franco et al. (1989) establecen que este modelo predice la abundancia relativa de las especies en comunidades o fracciones de comunidades en las cuales las especies son comparables en tamaño, fisiología y mantienen sus tamaños poblacionales en un cierto equilibrio, de tal forma que la abundancia relativa permanece aproximadamente constante. Le expresión del modelo de McArthur es la siguiente:
S (n) = (S(S–1) /N) (1–n / N)s–1
donde: S (n) = número de especies en la clase de abundancia con n individuos.
El modelo log normal. Las poblaciones tienden a aumentar su tamaño en forma geométrica más que en forma aritmética, de ahí que la variable natural de abundancia puede situarse sobre una escala logarítmica más que en una lineal, así mismo lo común o raro de una especie es un aspecto relativo, por lo que podría decirse que una cierta especie es tantas veces más común o más rara que otra (Preston, 1948). De esta manera se construyó la distribución especie–abundancia agrupando los datos en octavas o grupos situados sobre una escala log2 de abundancia (Preston, 1948). Con base en lo anterior el modelo toma la siguiente expresión:
S (R) = S0 exp (– a2 R2)
donde: S (R) = número de especies en la R–ésima octava (= clase) a la derecha e izquierda de la curva simétrica, S0 = número de especies en octava modal, a = (2σ2)1'2 = amplitud inversa de la distribución.
Los cuatro modelos descritos anteriormente se ajustaron a los datos empíricos de diversidad y abundancia al nivel de cada sitio permanente de monitoreo correspondiente a cada tratamiento y de cada año de medición. La hipótesis probada fue que los modelos describen adecuadamente la estructura de la abundancia en función de la diversidad. Las hipótesis fueron probadas a través de una prueba de X2, con un nivel de significancia del 95% o un nivel de error del 5%.
La productividad se estimó a partir del ajuste de ecuaciones de biomasa reportadas por Návar (2009) y ajustadas a cada uno de los individuos en cada parcela. Se calculó el diferencial de la cantidad de biomasa entre periodos de estudio sobre el número de años entre periodos de estudio para cada una de las parcelas como un indicador de la productividad (Clark et al., 2001).
Las relaciones entre la productividad y la diversidad de especies se estudiaron de la graficación y ajuste de modelos a las relaciones estadísticas. Para la relación diversidad–productividad se ajustaron los modelos unimodal, monotónico y en forma de U. Para esto se empleó la regresión del tipo lineal y polinomial cuadrática de segundo grado, donde se utilizó la productividad aérea, P, para predecir la diversidad de especies, S, como ejemplo [(S = a + b(P) + c(P)2]. Esta es la forma convencional de relacionar estos dos componentes y para esto se pueden referir al trabajo de investigación de Mittelbach et al. (2001). El ajuste de esta ecuación y la validez de los parámetros estadísticos definen el tipo de modelo al cual se ajusta la relación de la diversidad en función de la productividad. Por ejemplo, la significancia estadística de a, b y c define que la relación sigue un modelo unimodal o en forma de U dependiendo del signo de los coeficientes b y c. La falta de significancia en c indica que la diversidad–productividad sigue el modelo monotónico. Adicionalmente se desarrollaron dos modelos de incremento y rendimiento que incluyen el efecto binario de las especies (pinos y encinos, como géneros dominantes en la mezcla de especies) en la productividad. Para esto se ajustaron los típicos modelos de incremento y rendimiento de Schumacher (1939) con la inclusión de un índice de existencias volumétricas de encinos sobre las existencias volumétricas de pinos.
Se ajustó la distribución Weibull a los datos de altura y diámetro al nivel de la parcela para describir la complejidad estructural vertical y horizontal por los parámetros que definen la función de densidad. La distribución Weibull como función de densidad probabilística simple y acumulativa se presentan a continuación (Haan, 2002);

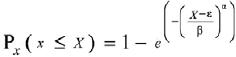
Donde: Px(x) = es la probabilidad de la variable aleatoria x. α, β y ε son los parámetros de forma, escala y localización de la distribución, respectivamente.
Los parámetros α, β y ε se estimaron por medio de la técnica de momentos, como sigue:
Haan (2002) reportó que el coeficiente de asimetría o sesgo (γ) se relaciona con el parámetro de forma (α) por medio de la siguiente ecuación:
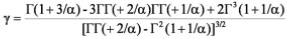
Donde: µ y σ son el promedio y la desviación estándar de la variable aleatoria x, y Γ(x) es la función gamma. El parámetro de forma se resuelve iterativamente por la estimación primero del coeficiente de asimetría y resolviendo por el parámetro de forma. Una vez que se tiene este parámetro se resuelve por el parámetro de escala y posición por medio de las siguientes ecuaciones:
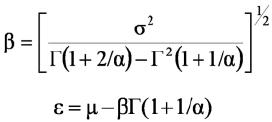
Para las relaciones entre la productividad y la diversidad estructural se ajustaron las relaciones matemáticas a los datos de productividad en función de los parámetros alfa (forma) y beta (escala) de la distribución Weibull para las distribuciones diamétricas (estructura horizontal) y en altura (estructura vertical).
RESULTADOS Y DISCUSIÓN
La especie Pinus cooperi colonizó las parcelas que fueron tratadas con matarrasa (100% remoción de área basal) en conjunto con Quercus sideroxylla en las parcelas con remociones parciales en área basal. Las especies secundarias que se establecieron debajo de P. cooperi fueron P. teocote,
P. leiophylla, P. ayacahuite, Arbutus spp, Alnus spp, Juniperus spp, Pseudotsuga menziesii y Quercus sideroxylla. Esta última especie se establece en sitios abiertos por las remociones pero también debajo del dosel del género Pinus. La riqueza de especies se encuentra en un estado de aceleración en tiempo, mientras que la abundancia inició su desaceleramiento por efecto de la competencia intraespecífica.
Los índices de diversidad disminuyen con el aumento en el área basal removida (cuadro 1). Por ejemplo, para la riqueza de especies, este valor aumenta en promedio desde 5.67 especies hasta 7.0 especies para el monitoreo de 1982 cuando la remoción del área basal disminuye desde el 100% hasta el 0%. De igual manera, la riqueza de especies aumenta en el tratamiento control (0% corta de área basal) desde 7.0 hasta 7.8 especies desde 1982 hasta 2004. La presencia de las especies secundarias, tolerantes a la sombra y en ocasiones intolerantes a la sombra pero establecidas en espacios abiertos dejados por los árboles muertos, aumenta la riqueza de especies y algunos índices de diversidad (Margalef, Shannon, Brillouin, Simpson y McIntosh).
La estructura de la diversidad–abundancia sobre todo en las parcelas con matarrasa no se ha recuperado después de la remoción parcial o total del área basal. Las hipótesis nulas de los cuatro modelos de diversidad–abundancia para los tres periodos de mediciones corresponden sólo al 35% del total, mientras que esta proporción se dobla para el resto de los tratamientos de remoción en área basal (cuadro 2).
La productividad promedio tiende en general a aumentar con el incremento en la remoción en el área basal y la tendencia es consistente para las tres fechas de monitoreo (cuadro 3). Las tasas de aumento para el primer periodo son más notorias y menos importantes para el periodo de 1993 a 2004. Es decir, el efecto de los tratamientos en la productividad no es tan importante durante la época de sequía que se presentó en los años de 1990 en el norte de México (Návar, 2008).
La diversidad–productividad
Al nivel de los tratamientos de remoción de área basal, la diversidad arbórea y la productividad se relacionan unimodalmente. Los modelos tuvieron valores de coeficientes de determinación, r2, desde 0.60 hasta 0.85; con valores promedio (intervalo de confianza) de 0.74 (0.04). Los índices de diversidad que se relacionaron de una mejor manera, ordenados descendentemente fueron: Menhinick (0.82), McIntosh (0.78), Shannon (0.76), Brillouin (0.74), Margalef (0.73), Simpson (0.73); Berger–Parker (0.72) y S o riqueza de especies (0.62). Es decir, la diversidad es baja en sitios de baja productividad, la diversidad aumenta hasta alcanzar un máximo en sitios de mediana productividad y disminuye en los sitios de alta productividad. El modelo unimodal fue consistente para la mayoría de los índices, pero debido al bajo número de datos los parámetros no fueron estadísticamente significativos; sin embargo la tendencia fue consistente para todos los índices para todos los tratamientos, para los años en los que se estimó la productividad. Un ejemplo de las relaciones matemáticas se presenta en la figura 2, donde se puede observar que todos los coeficientes c poseen valores negativos, consistentes con los modelos unimodales. Esto sucede en estas parcelas porque se encuentran los sitios de matarrasa que presentan la menor diversidad pero la más alta productividad porque se encuentran en las etapas primarias del crecimiento, 30 años después de haber realizado la matarrasa. Mittelbach et al. (2001) demostraron que el modelo unimodal es el que se reporta más ampliamente en la mayoría de los estudios de diversidad–productividad. Desafortunadamente esta relación se ha descrito poco para comunidades arbóreas por la lenta respuesta a los cambios ambientales.

Al nivel de cada subparcela, la diversidad no estuvo estadísticamente relacionada con la productividad por ninguno de los modelos descritos (unimodal, monotónico o en forma de U; P > 0.05), con la excepción de los índices de Shannon–Weiner y Brillouin, que mostraron tendencias monotónicas con la productividad (P < 0.05). Es decir, que a medida que la productividad aumenta también aumenta la diversidad arbórea. Mittelbach et al. (2001) en su reporte sobre el resumen de los trabajos de la diversidad–productividad encontraron que el modelo monotónico es el segundo reportado más frecuentemente en varias comunidades. Hector et al. (1999) notaron que los modelos monotónicos describieron mejor la diversidad–productividad para comunidades de pastizales europeos.
La mezcla de encinos aumenta la productividad, como se puede observar en los modelos de incremento y rendimiento (cuadro 4). La tendencia positiva y lineal de los modelos que describe la diversidad y la productividad explican que a medida que aumenta la productividad lo hace la diversidad y viceversa. Esto parece estar más relacionada con los cambios en la densidad que con el aumento de las especies. Este efecto es notorio en sitios con matarrasa los cuales incrementan la densidad en promedio hasta 1800 individuos ha–1 durante 1982 para reducir este valor a 1300 individuos ha–1 durante 1993 y aumenta nuevamente a 1400 individuos ha–1 en 2004. La reducción en abundancia o densidad es notoria y es causada por el efecto de la competencia intraespecífica de la especie Pinus cooperi que domina con casi el 97% la abundancia total. La aparición de especies secundarias (P. ayacahuite, Quercus sideroxylla, P. teocote, Juniperus spp, Alnus spp, Arbutus spp y P. leiophylla) hacen que la abundancia aumente de 1993 a 2004, mientras que la densidad de P. cooperi continúa disminuyendo hasta ocupar por debajo del 95% de la densidad total.
La contribución del efecto de la mezcla de pinos–encinos en la varianza total de los modelos de incremento y rendimiento fue estadísticamente mayor que el efecto del índice de sitio (cuadro 4). Es decir, el incremento en volumen está más funcionalmente relacionado con la mezcla de pinos y encinos que con un índice de productividad como convencionalmente se ha descrito con anterioridad (Clutter et al., 1983; Husch, 2003).
La productividad aumenta con el índice de mezcla de pinos y encinos, lo cual se puede observar en los valores del coeficiente b4. Para las funciones de potencia y lineales estos valores son de 0.029 y de 38.14 y se desvían estadísticamente del 0. La diferenciación y la asincronía en el uso de los recursos disponibles son dos de los mecanismos que usan los bosques diversos para aumentar la productividad del sitio (Ishii et al., 2000, 2002). Los encinos son tolerantes a la sombra y se desarrollan bien debajo de la cobertura de los pinos, encontrándose bosques con dos pisos, que explotan de por sí la luz del sol de manera diferente debido a su posición vertical en el ecosistema. Esta especie desarrolla sistemas radiculares que explotan sitios más profundos de los suelos en contraste con las raíces de los pinos. Además, Merlín–Bermúdez y Návar (2005) modelaron ritmos diferentes de crecimientos en pinos y encinos.
La estructura vertical se encuentra desarrollando desde un típica J invertida en la primeras etapas después de la aplicación de los tratamientos hasta una curva ligeramente sesgada hacia la derecha, con parámetros desde a = 1.89 y a = 2.19 para los periodos de medición de 1982 y de 2004, respectivamente. La dispersión en la distribución está aumentando también desde b = 11.63 para 1982 hasta b = 14.44 para el 2004. Aunque los parámetros de la distribución cambiaron en tiempo, el estadístico promedio permaneció constante entre periodos. Usando los parámetros de la distribución Weibull para alturas en el periodo de 2004, se pueden proyectar las estructuras y sus probabilidades (cuadro 5).
En general, las especies Arbutus spp y Alnus spp ocuparon el estrato menor, con menos de 10 m en altura total, seguidos por Quercus sideroxylla en los estratos bajo y medio y finalmente los pinos en todos los estratos, en donde existen claros en los bosques pero ocupando el estrato superior en sitios densos. Por ahora, los pinos adaptados a condiciones de sombra ocupan los estratos bajos (P. ayacahuite y P. teocote) y la especie Pinus cooperi ocupa el estrato dominante. Esta última especie además se encuentra en estratos bajos pero en los claros del bosque.
Las estructuras diamétricas también son dinámicas espacio–temporalmente aunque en grado menor que las estructuras en alturas. Aquí los parámeros diamétricos de las poblaciones se encuentran muy similares. Los encinos tuvieron un diámetro (desviación estándar) y área basal promedio de 17.0 cm (11.5 cm) y 11.9 m2 ha–1 (7.7 m2 ha–1) mientras que los pinos tuvieron 17.7 cm (10.1 cm) y 16.1 m2 ha–1 (7.7 m2 ha–1), respectivamente. Esta similitud en diámetro promedio y en área basal ocasiona también una semejanza en las distribuciones diamétricas que parece que son independientes estadísticamente la una de la otra (Návar, 2004). En términos de crecimiento parecería que poseen ritmos similares de crecimiento diamétrico, lo que fue refutado en trabajos de investigación por Merlín–Bermúdez y Návar (2005) y que se expresa en términos ecológicos como la ausencia de competencia entre estos dos géneros.
La productividad se encuentra también estadísticamente relacionada con los pará metros de forma (alfa) y escala (beta) de la distribución Weibull (P < 0.05), es decir con la estructura vertical y horizontal del bosque. El modelo resultó se estadísticamente significativo y fue el siguiente:
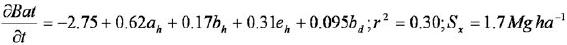
donde: a, b y e son los parámetros de forma, escala y posición de la distribución Weibull, h y d son la altura y diámetro y 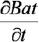 = incremento anual en biomasa o productividad en biomasa aérea total. En sitios altamente productivos, la densidad de los árboles se caracteriza por poseer un rango de alturas principalmente entre 5 y 15 m y la estructura horizontal se encuentra totalmente sesgada, dando la forma de la J invertida, con una amplia dispersión en los diámetros. En los sitios menos productivos se incrementa el rango de alturas desde dos hasta 25 m y la distribución diamétrica se encuentra simétrica o ligeramente sesgada hacia la izquierda. Observaciones similares han sido señaladas por Hiura (2001) para bosques naturales japoneses y por Ishii et al. (2000, 2002, 2004) para bosques naturales de Oregon, USA.
= incremento anual en biomasa o productividad en biomasa aérea total. En sitios altamente productivos, la densidad de los árboles se caracteriza por poseer un rango de alturas principalmente entre 5 y 15 m y la estructura horizontal se encuentra totalmente sesgada, dando la forma de la J invertida, con una amplia dispersión en los diámetros. En los sitios menos productivos se incrementa el rango de alturas desde dos hasta 25 m y la distribución diamétrica se encuentra simétrica o ligeramente sesgada hacia la izquierda. Observaciones similares han sido señaladas por Hiura (2001) para bosques naturales japoneses y por Ishii et al. (2000, 2002, 2004) para bosques naturales de Oregon, USA.
CONCLUSIONES
Este reporte enfatiza la importancia de la estructura y la diversidad en la productividad arbórea aérea de los bosques templados mixtos de la Sierra Madre Occidental de Durango, México. A través de la parametrización de la diversidad, la estructura horizontal y vertical y la productividad se lograron establecer relaciones estadísticamente significativas entre estos componentes que definen la función de la comunidad forestal. Aunque se requiere de estudios más exhaustivos para entender estas variaciones temporales a mayores escalas de tiempo, se pueden establecer conclusiones relevantes para la silvicultura y el manejo forestal de estas comunidades arbóreas. Las prescripciones silvícolas deben de centrarse en manejar las masas forestales con objetivos de maximizar la diversidad (aunque sea preliminarmente en la mezcla de pinos y encinos), de mantener las estructuras diamétricas en forma de J invertida y de tener una estructura de alturas entre los cinco y los 15 m. Esto hará que la productividad sea superior a los 3 Mg ha–1 año–1, bajo condiciones climáticas normales.
LITERATURA
Berger W.H. & Parker F.L., 1970. "Diversity of planktonic Foraminifera in deep sea sediments". Science, 168: 1345–1347. [ Links ]
Caspersen J.P. & Pacala S.W., 2001. "Successional diversity and forest ecosystem function". Ecological Research, 16(5): 895–903. [ Links ]
Clutter, J.L., Forston, J.C., Pienaar, L.V., Brister, G.H. & Bailey, R.L., 1983. Timber management: A quantitative approach. Wiley, New York. 333 p. [ Links ]
Clark, D.A., Brown, S. Kicklighter, D.W., Tomlison, J.Q. & Ni, J.,2001. "Measuring net primary production in forests; concepts and field methods". Ecological Applications, 11(2): 356–370. [ Links ]
Clifford, H.T. & Stephenson W., 1975. An introduction to numerical classification. Academic Press, London. 350 pp. [ Links ]
Fisher R.A., Corbet A.S. & Williams C.B., 1943. "The relation between the number of species and the number of individuals in a random sample of an animal population". J. Anim. Ecol. 12: 42–58. [ Links ]
Franco J.L., de la Cruz A.G., Rocha R.A., Navarrete S.N., Flores M.G., Kato M., Sánchez C.S., Abarca A.L. y Bedia S.C., 1989. Manual de Ecología. Editorial Trillas. México, pp. 93–96. [ Links ]
Haan, C.T., 2002. Statistical Methods in Hydrology. Iowa State Press. 2nd Edition. 378 pp. [ Links ]
Hector A, Schmidt, B., Beierkuhnlein, C., Caldeira, M.C., Diemer, M., Dimitrakopoulos, P.O., Finn, J.A., Freitas, H., Giller, P.S., Good, J., Harris, R., Hogberg, P., Huss–Uanell, K., Joshi, J., Jumpponen, A., Korner, C., Leadley, P.W., Loreau, M., Minns, A., Mulder, C.P.H., O'Donovan, G., Otway, S.J., Pereira, J.S., Prinz, A., Read, D.J., Scherer–Lorenzen, M., Schulze, E.D., Siamantziouras, A.S.D. Spehn, E.M., Terry, A.C., Troumbis, A.Y., Woodward, F.J., Yachi, S. & Lawton, J.H., 1999. "Plant diversity and productivity experiments in European grasslands". Science, 286: 1123–1127. [ Links ]
Hiura, T., 2001. "Stochasticity of species assemblage of canopy trees and understory plants in temperate secondary forest created by major disturbances". Ecological Research, 16: 887–893. [ Links ]
Hooper D.U. & Vitousek, P.M., 1997. "The effects of plant composition and diversity on ecosystem processes". Science, 277: 1302–1305. [ Links ]
Husch, B., T.W. Beers, & J.A. Kershaw, Jr., 2003. Forest Mensuration. Fourth Edition. Krieger Publishing Co., Malabar, Florida 443 pp. [ Links ]
Ishii, H., Reynolds, J.H., Ford, E.D. & Shaw, D.C. 2000. "Height growth and vertical development of an old–growth Pseudotsuga–Tsuga forest in southwestern Washington State, USA". Can. J. For. Res., 30:17–24. [ Links ]
Ishii, H., Ford, E.D., and Dinnie, D.E., 2002. "The role of epicormic shoot production in maintaining foliage in old Pseudotsuga menziesii (Douglasfir) trees II. Basal reiteration from older branch axes". Can. J. Bot., 80: 916–926. [ Links ]
Ishii, H.T., Tanabe S.I. & Hiura, T., 2004. "Exploring the relationships among canopy structure, stand productivity, and biodiversity of temperate forest ecosystems". Forest Science, 50: 342–355. [ Links ]
Magurran, A.E. 1989. Diversidad ecológica y su medición. Ed. Vedrá. Barcelona. 200 pp. [ Links ]
McArthur R.H., 1957. "On the relative abundance of bird species". Proc. Nat. Acad. Sci., 43: 293–295. [ Links ]
McIntosh R.P., 1981. "Succesion and ecological theory". In: D.C. West, H.H. Shugart, and D.B. Botkin, editors. Forest succession: concepts and application. Springer–Verlag, New York, New York, USA, pp. 10–23. [ Links ]
Merlin–Bermúdez, E. & Návar, J., 2005. "Desarrollo de un modelo de rendimiento e incremento para Quercus sideroxylla en bosques mixtos de Durango, México". Agrofaz, 5(2): 875–882. [ Links ]
Mittelbach, G.G., Steiner, C.F., Scheiner, S.M., Gross, K.L., Reynolds, H.L., Waide, R.B., Willig, M.R. & Dodson, S.I., 2001. "What is the observed relationship between species richness and productivity?" Ecology, 82(9): 2381–2396. [ Links ]
Návar, J., 2004. "Preliminary testing of the ecological interactions between pines and oaks growing in mixed, unevenaged coniferous forests of Durango, Mexico". Floresta, 34(3): 1–10. [ Links ]
––––––––––, 2008. "Reconstrucción de las sequías en los últimos 10 mil años en el norte de México". Agrofaz, 8: 41–53. [ Links ]
––––––––––, 2009. " Alometric equations for tree species and carbon stocks for forests of northwestern Mexico". Forest Ecology and Management, 257: 427–434. doi: 10.1016/j.foreco.2008.09.028. [ Links ]
Pielou, E.C., 1975. Ecological Diversity, Wiley, New York. 263 pp. [ Links ]
Pielou, E.C., 1997. Biodiversity versus old–style diversity measuring biodiversity for conservation. In: Measuring and monitoring biodiversity in tropical and temperate forests. Proceedings of a IUFRO Symposium held at Chiang Mai, Thailand August 27th– September 2nd, 1994, pp. 5–17. [ Links ]
Preston, F.W., 1948. "The commonness and rarity of species". Ecology, 29: 254–283. [ Links ]
Schumacher, F.X., 1939. "New growth curve and its application to timber–yield studies". Journal of Forestry, 37: 819–820. [ Links ]
Simpson E.H., 1949. "Mesurement of diversity". Nature, 163: 688–690. [ Links ]
Stevens, M.H.H. & Carson, W.P., 1999a. "Plant density determines species richness along an experimental fertility gradient". Ecology, 80: 455–465. [ Links ]
Stevens, M.H.H. & Carson, W.P., 1999b. "The significance of assemblage–level thinning for species richness". Journal of Ecology, 87: 490–502. [ Links ]
Tilman, D., Knops, J., Wedin, D., Reich, P., Ritchie, M. & Seimann, E., 1997. "The influence of functional diversity and composition on ecosystem processes". Science, 277: 1300–1302. [ Links ]
Vilá, M., Vayreda, .J, Comas, L., Ibáñez, J.J., Mata, T., Obón, B., 2007. "Species richness and wood production: a positive association in Mediterranean forests". Ecology Letters, 10(3): 241–250. [ Links ]
Whittaker, R.H., 1972. "Evolution and measurement of species diversity". Taxon, 21: 213–251. [ Links ]














